Координационная химия, 2021, T. 47, № 11, стр. 707-716
Связывание золота(III) из растворов кластером [Ag6{S2CN(CH2)6}6]: получение, термическое поведение и самоорганизация супрамолекулярной структуры двойного комплекса [Au{S2CN(CH2)6}2]2[AgCl2]Cl · 2CHCl3 (роль вторичных взаимодействий Au⋅⋅⋅Cl, Ag⋅⋅⋅S, Cl⋅⋅⋅Cl)
Е. В. Корнеева 1, Е. В. Новикова 1, О. В. Лосева 1, А. И. Смоленцев 2, 3, А. В. Иванов 1, *
1 Институт геологии и природопользования ДВО РАН
Благовещенск, Россия
2 Институт неорганической химии им. А.В. Николаева СО РАН
Новосибирск, Россия
3 Новосибирский государственный университет
Новосибирск, Россия
* E-mail: alexander.v.ivanov@chemist.com
Поступила в редакцию 04.02.2021
После доработки 15.03.2021
Принята к публикации 22.03.2021
Аннотация
Установлена способность цикло-гексаметилендитиокарбамата серебра(I) к концентрированию золота(III) из растворов, характеризующихся высоким уровнем солености (5.15 M NaCl), в твердую фазу. В качестве индивидуальной формы связывания анионов [AuCl4]– препаративно выделен двойной Au(III)−Ag(I) сольватированный хлороформом комплекс [Au{S2CN(CH2)6}2]2[AgCl2]Cl · 2CHCl3 (I). Состав ионных структурных единиц соединения I указывает на то, что связывание золота(III) из раствора в твердую фазу сопровождается полным перераспределением лигандов HmDtc между координационными сферами Ag(I) и Au(III). Комплекс I, охарактеризованный методами ИК-спектроскопии, СТА и РСА (CIF file CCDC № 2051654), обнаруживает супрамолекулярную структуру, включающую две противоположно заряженные псевдополимерные подсистемы. Комплексные катионы [Au{S2CN(CH2)6}2]+ и анионы [AgCl2]– (в соотношении 2 : 1) за счет вторичных взаимодействий Ag⋅⋅⋅S (3.2613 Å) и Au⋅⋅⋅Cl (3.2765 Å) формируют сложно организованную катион-анионную псевдополимерную ленту ({[Au(HmDtc)2]⋅⋅⋅[AgCl2]⋅⋅⋅[Au(HmDtc)2]}+)n, состоящую из двух рядов катионов и ряда анионов. Внешнесферные хлорид-ионы объединяют сольватные молекулы хлороформа двумя эквивалентными водородными связями Cl⋅⋅⋅H–C, образуя анион-молекулярные триады [Cl3CH⋅⋅⋅Cl⋅⋅⋅HCCl3]–, участвующие в построении супрамолекулярной ленты за счет вторичных взаимодействий Cl⋅⋅⋅Cl (3.4058 Å) между неэквивалентными атомами хлора ближайших сольватных молекул. Исследование термического поведения I позволило установить характер протекания термолиза и условия количественной регенерации связанного золота.
Дитиокарбаматные (Dtc) комплексы серебра(I) являются удобными прекурсорами как при получении пленок и нанопорошков акантита (α-Ag2S) [1–4], так и наночастиц Януса Ag2S/Ag0 (включающих комбинацию металла и его сульфида) [5, 6], которые представляют практический интерес для микроэлектроники. Поскольку Ag2S характеризуется низким уровнем токсичности и высокой устойчивостью в биологических средах, его использование перспективно также в медицине при создании биосовместимых нанозондов [7, 8]. При этом важно отметить, что в сравнении с другими металлами для серебра и его соединений низкий уровень токсичности в отношении клеток млекопитающих уникально сочетается с высокой токсичностью для микроорганизмов [9]. Кроме того, ранее мы обнаружили способность диалкилдитиокарбаматов серебра(I) к связыванию золота(III) из растворов в твердую фазу c образованием псевдополимерных гетерометаллических Au(III)–Ag(I) соединений ионного типа co сложноорганизованными супрамолекулярными структурами [10, 11]. Соединения такого рода могут представлять интерес как прекурсоры наночастиц и тонких пленок золота, имеющих потенциал практического использования в различных областях [12–15], а также наночастиц Януса типа Ag2S/Au0 [16].
В продолжение этих исследований в настоящей работе изучено взаимодействие шестиядерного цикло-гексаметилендитиокарбаматного (HmDtc) кластера серебра(I), строение которого установлено ранее [17], с AuCl3 в 5.15 M растворе NaCl. В качестве формы связывания золота(III) из продуктов реакции препаративно выделен сольватированный хлороформом хлорид-дихлороаргентат(I) бис(N,N-цикло-гексаметилендитиокарбамато-S,S') золота(III) состава [Au{S2CN(CH2)6}2]2[AgCl2]Cl · · 2CHCl3 (I). Структурная организация, термическое поведение и спектральные характеристики соединения I изучены методами РСА, синхронного термического анализа (СТА) и ИК-спектроскопии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
N,N-цикло-гексаметилендитиокарбамат натрия, Na{S2CN(CH2)6} · 2H2O получали взаимодействием гексаметиленимина (Aldrich) с сероуглеродом (Mer-ck) в щелочной среде [18]. Исходный комплекс серебра(I) состава [Ag6{S2CN(CH2)6}6] получали по методике [17].
Синтез комплекса I проводили взаимодействием свежеосажденного [Ag6{S2CN(CH2)6}6] с AuCl3 в 5.15 M растворе NaCl (что близко к условиям насыщения при 20°С). Принимая во внимание установленный состав и строение комплекса I, гетерогенную реакцию связывания золота(III) из раствора в твердую фазу с образованием промежуточного вещества Iа можно представить следующим образом:
К 100 мг (0.059 ммоль) свежеосажденного [Ag6{S2CN(CH2)6}6] приливали 10 мл раствора Na[AuCl4], содержащего 34.9 мг (0.177 ммоль) золота(III), и перемешивали в течение 1 ч при 60°С. В первые минуты взаимодействия осадка с раствором его зеленовато-желтый цвет быстро изменялся на красно-оранжевый и далее на насыщенный желто-оранжевый, при одновременном обесцвечивании раствора золота(III). Степень связывания золота из раствора в твердую фазу составила 99.89%, что указывает на образование в твердой фазе новых соединений. (Остаточное содержание золота в растворе после экстракции определяли на атомно-абсорбционном спектрометре 1 класса фирмы “Hitachi”, модель 180−50.) Полученный осадок Ia отделяли фильтрованием, промывали водой и высушивали на фильтре. Монокристаллы I, пригодные для РСА, получали растворением осадка в смеси ацетон–хлороформ (1 : 1) с последующим медленным испарением растворителей при комнатной температуре. Выход желто-оранжевых призматических кристаллов I 79.4%.
ИК-спектры I (KBr; ν, см–1): 2926 с, 2885 с, 2844 ср, 1542 о.с, 1459 ср, 1438 с, 1365 сл, 1358 сл, 1346 сл, 1290 сл, 1276 ср, 1206 ср, 1162 с, 1094 сл, 1058 сл, 1007 сл, 993 сл, 978 сл, 959 сл, 902 сл, 879 сл, 847 сл, 829 о.сл, 825 о.сл, 810 сл, 750 с, 743 с, 657 ср, 625 ср, 563 сл, 459 сл; и Ia (KBr; ν, см–1): 2920 с, 2849 ср, 1542 с, 1492 ср, 1473 сл, 1441 сл, 1421 с, 1362 ср, 1344 сл, 1270 с, 1242 сл, 1194 ср, 1160 с, 1092 ср, 1056 сл, 1045 сл, 1004 сл, 994 сл, 973 ср, 938 ср, 904 сл, 877 сл, 846 сл, 823 сл, 745 сл, 623 сл, 568 сл, 461 сл.
ИК-спектры полученных веществ, запрессованных в таблетках с KBr, регистрировали при комнатной температуре на интерференционном ИК-спектрометре ФСМ–1201 с Фурье-преобразованием в диапазоне 400–4000 см–1 (программное обеспечение FSpec, версия 4.0.0.2 для Windows, ООО Мониторинг, Россия).
РСА выполнен с призматического монокристалла I на дифрактометре Bruker-Nonius X8 Apex CCD (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор) при 150(2) K. Сбор данных проведен по стандартной методике: φ- и ω-сканирование узких фреймов. Поглощение учтено эмпирически с использованием программы SADABS [19]. Структура определена прямым методом и уточнена методом наименьших квадратов (по F 2) в полноматричном анизотропном приближении неводородных атомов с использованием программы SHELXL-2018/3 [20]. Положения атомов водорода в лигандах HmDtc и сольватных молекулах CHCl3 рассчитаны геометрически и включены в уточнение в модели “наездника”. Основные кристаллографические данные и результаты уточнения структуры I приведены в табл. 1, длины связей и углы − в табл. 2, геометрические параметры водородных связей C–H⋅⋅⋅Cl и вторичных взаимодействий Cl⋅⋅⋅Cl − в табл. 3.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структуры I
| Параметр | Значение |
|---|---|
| Брутто-формула | C30H50N4S8Cl9AgAu2 |
| М | 1544.07 |
| Сингония | Моноклинная |
| Пр. гр. | P2/c |
| a, Å | 20.0396(6) |
| b, Å | 6.06430(10) |
| c, Å | 20.4313(6) |
| β, град | 92.8030(10) |
| V, Å3 | 2479.97(11) |
| Z | 2 |
| ρ(выч.), г/см3 | 2.068 |
| μ, мм–1 | 7.143 |
| F(000) | 1488 |
| Размер кристалла, мм3 | 0.12 × 0.10 × 0.02 |
| Область сбора данных по θ, град | 2.00–27.60 |
| Интервалы индексов отражений | –26 ≤ h ≤ 25,
–7 ≤ k ≤ 6, –25 ≤ l ≤ 26 |
| Измерено отражений | 15977 |
| Независимых отражений (Rint) | 5702 (0.0388) |
| Отражений с I > 2σ(I) | 4629 |
| Переменных уточнения | 245 |
| GOOF | 0.954 |
| R-факторы по F 2 > 2σ(F 2) | R1 = 0.0277, wR2 = 0.0514 |
| R-факторы по всем отражениям | R1 = 0.0423, wR2 = 0.0545 |
| Остаточная электронная плотность (min/max), e/Å3 | –0.709/1.263 |
Таблица 2.
Основные длины связей (d), валентные (ω) и торсионные (φ) углы в структуре I*
| Катион | |||
|---|---|---|---|
| Связь | d, Å | Связь | d, Å |
| Au(1)–S(1) | 2.3465(10) | N(2)–C(9) | 1.474(4) |
| Au(1)–S(2) | 2.3333(10) | N(2)–C(14) | 1.482(4) |
| Au(1)–S(3) | 2.3333(10) | C(2)–C(3) | 1.530(5) |
| Au(1)–S(4) | 2.3442(10) | C(3)–C(4) | 1.522(6) |
| Au(1)···Cl(1) | 3.2765(9) | C(4)–C(5) | 1.530(5) |
| S(1)–C(1) | 1.738(4) | C(5)–C(6) | 1.536(5) |
| S(2)–C(1) | 1.739(4) | C(6)–C(7) | 1.507(5) |
| S(3)–C(8) | 1.737(4) | C(9)–C(10) | 1.523(5) |
| S(4)–C(8) | 1.727(4) | C(10)–C(11) | 1.518(5) |
| N(1)–C(1) | 1.294(5) | C(11)–C(12) | 1.521(5) |
| N(1)–C(2) | 1.472(4) | C(12)–C(13) | 1.536(5) |
| N(1)–C(7) | 1.490(5) | C(13)–C(14) | 1.512(6) |
| N(2)–C(8) | 1.306(5) | ||
| Угол | ω, град | Угол | ω, град |
| S(1)Au(1)S(2) | 75.25(3) | Au(1)S(1)C(1) | 86.76(13) |
| S(1)Au(1)S(3) | 104.58(3) | Au(1)S(2)C(1) | 87.04(13) |
| S(1)Au(1)S(4) | 177.53(3) | Au(1)S(3)C(8) | 86.83(13) |
| S(2)Au(1)S(3) | 179.61(3) | Au(1)S(4)C(8) | 86.70(13) |
| S(2)Au(1)S(4) | 104.85(3) | S(1)C(1)S(2) | 110.6(2) |
| S(3)Au(1)S(4) | 75.31(3) | S(3)C(8)S(4) | 111.1(2) |
| Угол | φ, град | Угол | φ, град |
| Au(1)S(1)S(2)C(1) | –173.5(2) | Au(1)S(3)S(4)C(8) | –177.8(2) |
| S(1)Au(1)C(1)S(2) | –174.1(2) | S(3)Au(1)C(8)S(4) | –178.1(2) |
| S(1)C(1)N(1)C(2) | 0.2(5) | S(3)C(8)N(2)C(9) | 0.6(4) |
| S(1)C(1)N(1)C(7) | 176.0(3) | S(3)C(8)N(2)C(14) | 179.7(2) |
| S(2)C(1)N(1)C(2) | –178.2(3) | S(4)C(8)N(2)C(9) | –178.3(2) |
| S(2)C(1)N(1)C(7) | –2.3(5) | S(4)C(8)N(2)C(14) | 0.7(5) |
| C(4)C(3)C(2)N(1) | –77.2(4) | C(11)C(10)C(9)N(2) | 73.0(4) |
| C(5)C(6)C(7)N(1) | –50.6(5) | C(12)C(13)C(14)N(2) | 42.9(4) |
| C(4)C(5)C(6)C(7) | 87.8(4) | C(11)C(12)C(13)C(14) | –86.9(4) |
| C(3)C(4)C(5)C(6) | –68.1(4) | C(10)C(11)C(12)C(13) | 67.2(4) |
| Анион | |||
| Связь | d, Å | Связь | d, Å |
| Ag(1)–Cl(1) | 2.3497(11) | Ag(1)···S(2)b | 3.2613(10) |
| Угол | ω, град | Угол | ω, град |
| Cl(1)–Ag(1)–Cl(1)a | 179.38(5) | Cl(1)–Ag(1)···S(2)c | 101.53(3) |
| Cl(1)–Ag(1)···S(2)b | 78.98(3) | S(2)b···Ag(1)···S(2)c | 73.07(2) |
Таблица 3.
Геометрические параметры водородной связи C–H∙∙∙Cl и Cl∙∙∙Cl взаимодействия в комплексе I
| Контакт D–X∙∙∙A | Расстояние, Å | Угол D–X∙∙∙A, град |
||
|---|---|---|---|---|
| D–X | X∙∙∙A | D∙∙∙A | ||
| C(15)–H(15)∙∙∙Cl(5) | 1.00 | 2.34 | 3.341(4) | 176 |
| C(15)–Cl(4)∙∙∙Cl(3)a | 1.765(4) | 3.4058(15) | 5.158(4) | 171.7(1) |
| C(15)a–Cl(3)a∙∙∙Cl(4) | 4.433(4) | 114.2(1) | ||
Координаты атомов, длины связей и углы депонированы в Кембриджском банке структурных данных (CCDC № 2051654 (I); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk).
Термическое поведение I изучали методом СТА, включающим параллельную регистрацию кривых термогравиметрии (ТГ) и дифференциальной сканирующей калориметрии (ДСК). Исследование проводили на приборе STA 449C Jupiter (NETZSCH) в корундовых тиглях под крышкой с отверстием, обеспечивающим давление паров при термическом разложении образца в 1 атм. Скорость нагрева составляла 5°С/мин до 1100°С в атмосфере аргона. Масса навесок 2.528–7.840 мг. Точность измерения температуры ±0.6°С, изменения массы ±1 × 10–4 мг. При съемке кривых ТГ и ДСК использовали файл коррекции, а также калибровки по температуре и чувствительности для заданной температурной программы и скорости нагрева. Независимое определение температуры плавления проводили на приборе ПТП(М) (ОАО Химлаборприбор).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Cильное взаимодействие колебаний связей C–H, C–C и C–N в лигандах HmDtc определяет сложную ИК-спектральную картину комплекса I и вещества Ia. Поэтому при анализе их спектров дополнительно привлекали ИК-спектральные данные для исходного кластера [Ag6{S2CN(CH2)6}6] [17], дигидрата цикло-гексаметилендитиокарбамата натрия, Na{S2CN(CH2)6} · 2H2O [21], гексаметиленимина, C6H12NH [22], циклогептана, C7H14 [23] и хлороформа СНCl311. В ИК-спектрах I/Ia наблюдаются полосы поглощения при 2926/2920 и 2844/2849 см–1, обусловленные валентными колебаниями νas(СН2) и νs(СН2) соответственно; деформационным (ножничным) колебаниям δs групп –СН2– отвечает среднеинтенсивная полоса поглощения при 1459/1473 см–1; валентным колебаниям связей N–CH2 соответствует высокоинтенсивная полоса при 1162/1160 см–1. Близкие положения соответственных полос поглощения в ИК-спектрах дигидрата НmDtc натрия, комплекса I и вещества Iа указывают на сохранение основных структурных особенностей периферийного циклического фрагмента –N(CH2)6 при комплексообразовании. Наиболее заметные различия характерны для валентных колебаний групп –С(S)S–, непосредственно связанных с комплексообразователем, и для частично двойной связи N–C(S)S. Так, при связывании лигандов HmDtc комплексообразователем, относительная интенсивность полос при 1058/1056 и 978/973 см–1, обусловленных колебаниями νas(СS2) и νs(СS2) соответственно, существенно понижается, что может быть связано с возрастанием вклада ковалентной составляющей в обсуждаемые связи (понижение их полярности) за счет смещения электронной плотности с металла на атомы серы. Тогда как наиболее интенсивные полосы поглощения в ИК-спектрах I и Ia, обусловленные валентными колебаниями связей N–C в дитиокарбаматных группах, значительно смещены в высокочастотную область (1542 и 1542 см–1), в сравнении с исходным кластером [Ag6{S2CN(CH2)6}6] (1494 см–1 [17]) и Na{S2CN(CH2)6} · · 2H2O (1485 см–1 [21]). Таким образом, все обсуждаемые полосы поглощения лежат между диапазонами частот колебаний ординарных, ν(C–N) (1350–1250 см–1) и двойных связей ν(C=N) (1690–1640 см–1), что указывает на существенный вклад двоесвязанности в формально ординарные связи N–C(S)S [25]. Однако, согласно полученным данным, для комплекса I ожидаются значительно более короткие связи N–C(S)S, чем в исходном комплексе серебра(I) – 1.335 Å [17].
Присутствие сольватных молекул хлороформа в структуре I отражается поглощениями в двух областях ИК-спектра (∼3000 и ∼800–600 см–1): а) полоса при 2885 см–1, отвечающая валентным колебаниям ν(С–Н) (следует отметить, что обычно относительно слабая полоса поглощения метиновой группы в спектре I обнаруживает высокую интенсивность, что обусловлено значительной полярностью связи С–Н и наличием дипольного момента у молекулы CHCl3); б) две (1 : 1) близко лежащие высокоинтенсивные полосы νas(C–Cl) при 750 и 743 см–1 и среднеинтенсивная полоса νs(C–Cl) при 657 см–1.
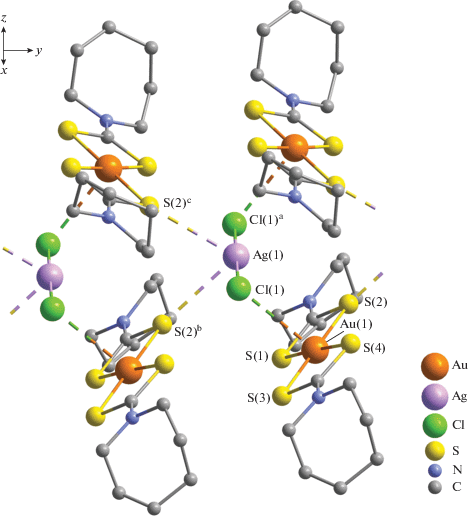
Для установления структурной организации сольватированного гетероядерного Au(III)–Ag(I) комплекса I был использован прямой метод РСА. Элементарная ячейка исследуемого соединения включает две формульные единицы [Au{S2CN(CH2)6}2]2[AgCl2]Cl · 2CHCl3 (рис. 1). Таким образом, структурными единицами комплекса являются нецентросимметричные катионы [Au{S2CN(CH2)6}2]+ (рис. 2а); анионы [AgCl2]– (рис. 2б), геометрия которых практически линейна (sp-гибридное состояние атома серебра); внешнесферные анионы Cl– и сольватные молекулы CHCl3, включающие по три неэквивалентных атома хлора: Cl(2), Cl(3), Cl(4).
Рис. 1.
Проекция структуры I на плоскость xz. В лигандах HmDtc атомы водорода не приведены. Пунктирными линиями показаны вторичные взаимодействия Au···Cl, Ag···S и водородные связи C–H···Cl.

Рис. 2.
Структура комплексного катиона [Au{S2CN(CH2)6}2]+ (а) и линейного аниона [AgCl2]– (б). Симметрические преобразования: a – x, y, 1/2 – z.

В комплексном катионе золота(III) координация двух неэквивалентных лигандов HmDtc, близкая к S,S'-изобидентатной (длина связей Au–S лежит в диапазоне 2.3333–2.3465 Å), приводит к формированию бициклической системы [CS2AuS2C], включающей два четырехчленных металлоцикла c общим атомом металла. Однако значения торсионных углов Au–S–S–C и S–Au–C–S (табл. 2) свидетельствуют, что в одном из обсуждаемых металлоциклов [AuS2C] атомы практически копланарны, тогда как для второго цикла характерно некоторое тетраэдрическое искажение, вследствие которого диагональный угол S(1)–Au–S(4) несколько отклоняется от 180°. Геометрия хромофора [AuS4] близка к плоско-тетрагональной, что указывает на внутриорбитальное dsp2-гибридное состояние атома золота. Как и ожидалось из данных ИК-спектроскопии, связи N–C(S)S в комплексе I (1.294 и 1.306 Å) значительно короче, чем в исходном кластере серебра(I) [17]. При этом структурные фрагменты S2C–NC2 в лигандах HmDtc практически плоские, о чем свидетельствуют значения соответствующих торсионных углов, близкие к 0° или 180° (табл. 2). Специфической особенностью катиона [Au{S2CN(CH2)6}2]+ (рис. 2а) является пространственная локализация семичленных циклических фрагментов –N(CH2)6 по одну сторону от средней плоскости центрального бициклического фрагмента (цис-ориентация). Несмотря на существующие различия в геометрических характеристиках семичленных гетероциклических фрагментов –N(CH2)6 неэквивалентных лигандов HmDtc (см. значения соответственных торсионных углов в табл. 2), оба они могут быть аппроксимированы конформациями “скошенное кресло” [26–28].
Соединение I характеризуется сложной супрамолекулярной структурой, включающей две псевдополимерные подсистемы, формирование которых осуществляется за счет вторичных взаимодействий (Au⋅⋅⋅S, Au⋅⋅⋅Cl, Cl⋅⋅⋅Cl) [29] и водородных связей C–H⋅⋅⋅Cl. В катион-анионной подсистеме ({[Au(HmDtc)2]2[AgCl2]}+)n (рис. 3) каждый дихлороаргентат(I)-ион взаимодействует с четырьмя ближайшими катионами золота(III), образуя две пары эквивалентных вторичных связей Ag(1)⋅⋅⋅S(2)b/c (3.2613 Å) и Au(1)⋅⋅⋅Cl(1), Au(1)a⋅⋅⋅Cl(1)a (3.2765 Å); сумма ван-дер-ваальсовых радиусов соответствующих пар атомов (3.52 и 3.41 Å [30]) заметно превышает длину приведенных вторичных связей. В свою очередь, каждый катион [Au{S2CN(CH2)6}2]+ связан вторичными взаимодействиями с двумя анионами [AgCl2]–, формируя таким образом супрамолекулярную ленту, направленную вдоль оси y и включающую два ряда комплексных катионов золота(III) и ряд анионов серебра(I).
Рис. 3.
Фрагмент катион-анионной псевдополимерной ленты ({[Au(HmDtc)2]2[AgCl2]}+)n, ориентированной вдоль оси y. Пунктирными линиями показаны вторичные связи Au···Cl и Ag···S. Симметрические преобразования: a –x, y, 1/2 – z; bx, y – 1, z; c –x, y – 1, 1/2 – z.
В образовании второй псевдополимерной подсистемы принимают участие внешнесферный ион Cl– и сольватные молекулы хлороформа. Обе молекулы CHCl3 сольватируют хлорид-ион с образованием эквивалентных водородных связей C(15)–H(15)⋅⋅⋅Cl(5) и C(15)b–H(15)b⋅⋅⋅Cl(5), результатом чего является построение анион-молекулярной триады [Cl3C–H⋅⋅⋅Cl⋅⋅⋅H–CCl3]– (рис. 4, табл. 3). Между соседними триадами, в свою очередь, реализуются межмолекулярные парные вторичные взаимодействия22 Cl⋅⋅⋅Cl, в которые вовлекаются атомы Cl(3) и Cl(4) каждой из молекул CHCl3 (рис. 5, табл. 3); расстояние Cl(4)⋅⋅⋅Cl(3)a, Cl(4)b⋅⋅⋅Cl(3)c составляет 3.4058 Å, что на 0.1 Å меньше удвоенного значения ван-дер-ваальсова радиуса атома хлора (3.50 Å [30]). Совокупность обсуждаемых взаимодействий приводит к формированию второй, анион-молекулярной, псевдополимерной ленты состава ([Cl3C–H⋅⋅⋅Cl⋅⋅⋅H–CCl3]–)n. Таким образом, супрамолекулярная структура соединения I включает две противоположно заряженные псевдополимерные подсистемы.
Рис. 4.
Триада состава [Cl3C–H⋅⋅⋅Cl⋅⋅⋅H–CCl3]–, образованная внешнесферным анионом Cl– и сольватными молекулами CHCl3. Эллипсоиды 50%-ной вероятности. Симметрические преобразования: b 1 – x, y, 1/2 – z.
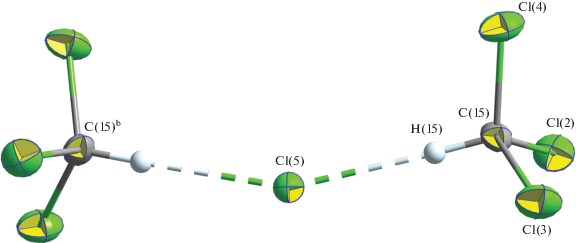
Рис. 5.
Фрагмент анион-молекулярной псевдополимерной ленты ([Cl3C–H⋅⋅⋅Cl⋅⋅⋅H–CCl3]–)n, сформированной сольватированным анионом Cl–; пунктиром показано Cl···Cl взаимодействие и водородная связь между молекулами CHCl3 и внешнесферным анионом Cl–. Эллипсоиды 50%-ной вероятности. Симметрические преобразования: ax, y – 1, z; b 1 – x, y, 1/2 – z; c 1 – x, y – 1, 1/2 – z.

В литературе [31–33] рассматривается два основных типа вторичных межгалогенных взаимодействий, различающихся геометрией соответствующего структурного фрагмента. Первый характеризуется примерным равенством углов C1–X⋅⋅⋅X и C2–X⋅⋅⋅X (θ1 ≈ θ2) в структурном фрагменте C1–X⋅⋅⋅X–C2, который может принимать как цис-, так и транс-конфигурацию. Для второго типа угол θ1 ≈ 180°, тогда как угол θ2 ≈ 90°. В нашем случае структурный фрагмент C(15)–Cl(4)∙∙∙Cl(3)a–C(15)a принимает конфигурацию, близкую к L-образной: углы θ1 = 171.7° и θ2 = 114.2°, что соотносится со вторым типом взаимодействий Cl∙∙∙Cl. Следует также отметить существование межгалогенных взаимодействий, в которых участвуют пары разнородных атомов галогенов (гетеровзаимодействие) [34, 35].
Исследование термического поведения комплекса I проводили методом СТА в атмосфере аргона с одновременной регистрацией кривых ТГ и ДСК (рис. 6). Соединение термически устойчиво до ~89°С. Кривая ТГ отображает многоступенчатую потерю массы, которая свидетельствует о многостадийном процессе термодеструкции (рис. 6а). Первая ступень (~89–144°С) потери массы в 15.45% соответствует полной десольватации комплекса I (расч. 15.46%). Точка перегиба при 118°С разделяет обсуждаемую ступень на два неравных участка: более пологий и крутопадающий, указывая на скачок в возрастании скорости потери массы, что может быть связано с плавлением образца. В обсуждаемом температурном интервале кривая ДСК (рис. 6б) включает два эндоэффекта с экстремумами при 109.2°С и 129.7°С. Первый отнесен к плавлению образца (экстраполированная Тпл = 98.0°С), второй обусловлен высвобождением сольватных молекул CHCl3 (экстраполированная температура процесса 122.3°С).
Рис. 6.
Кривые ТГ (а) и ДСК (б) комплекса I. Укрупненный план дна тигля после завершения термолиза (в).

Участок кривой ТГ в интервале ~144–172°С характеризуется стабилизацией массы образца с последующим выходом на крутопадающую ступень термолиза несольватированной формы комплекса (~172–311°С). Самому началу новой стадии потери массы на кривой ДСК соответствует эндоэффект при 194.2°С, который отнесен к плавлению несольватированной формы комплекса I (экстраполированная Tпл = 190.0°С; при независимом определении в капилляре плавление установлено в диапазоне 190.0–192.0°С). На обсуждаемом участке кривой ТГ, имеющем точку перегиба при 236.0°С, суммарная потеря массы составляет 42.86%, указывая на сложный характер протекания термолиза исследуемого соединения: одновременно по катионной и анионной частям, что cопровождается восстановлением золота до элементного состояния и выделением AgCl (расч. значение 47.45%). Соответствующий фрагмент кривой ДСК фиксирует два эндоэффекта при 216.5 и 263.1°С, обусловленные последовательными термическими превращениями вещества (экстраполированные температуры процессов 207.8 и 261.8°С).
Финальный участок кривой ТГ (~311–1000°С) отражает плавную потерю массы (9.31%) за счет десорбции летучих продуктов термолиза (7.01%) и восстановление элементного серебра из AgCl (2.30%). По завершении термолиза при 1100°С остаточная масса, составляющая 32.36%, хорошо согласуется с расчетным значением для восстановленных металлов – золота и серебра (32.50%). При вскрытии тигля на дне обнаружены мелкие шарики светло-желтого цвета, представляющие собой золото-серебряный сплав (рис. 6в). В высокотемпературной области кривой ДСК регистрируется эндоэффект с экстремумом при 1043.9°С, обусловленный плавлением восстановленных металлов (экстраполированная Tпл = 1040.2°С). Последнее значение ложится в диапазоне между температурами плавления золота и серебра (1064.18 и 961.78°С соответственно [36]). При этом анализ диаграммы состояния двойной металлической системы Au–Ag [37] позволяет сделать более определенный вывод, что вышеприведенная экстраполированная Tпл соответствует сплаву с атомным отношением компонентов Au : Ag = 2 : 1.
Таким образом, для шестиядерного цикло-гексаметилендитиокарбамата серебра(I) установлена эффективная способность к связыванию золота(III) в твердую фазу из растворов с высоким уровнем солености (5.15 M раствор NaCl). Из ацетон-хлороформного (1 : 1) раствора продуктов гетерогенной реакции в качестве формы связывания [AuCl4]– окристаллизован двойной Au(III)–Ag(I) сольватированный комплекс состава [Au{S2CN(CH2)6}2]2[AgCl2]Cl · 2CHCl3 (I). По данным РСА, полученное соединение характеризуется сложной супрамолекулярной структурой, включающей две противоположно заряженные псевдополимерные подсистемы ({[Au(HmDtc)2]2[AgCl2]}+)n и ([Cl3C–H⋅⋅⋅Cl⋅⋅⋅H–CCl3]–)n, в формировании которых определяющую роль играют вторичные взаимодействия (Ag⋅⋅⋅S, Au⋅⋅⋅Cl и Cl⋅⋅⋅Cl), а также водородные связи C–H⋅⋅⋅Cl. Исследование термического поведения I позволило установить характер протекания его термолиза и условия количественной регенерации металлов.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Hussain S.T., Bakar S.A., Saima B.B., Muhammad B. // Appl. Surf. Sci. 2012. V. 258. P. 9610.
Ehsan M.A., Khaledi H., Tahir A.A. et al. // Thin Solid Films. 2013. V. 536. P. 124.
Mothes R., Petzold H., Jakob A. et al. // Inorg. Chim. Acta. 2015. V. 429. P. 227.
Mothes R., Jakob A., Waechtler T. et al. // Eur. J. Inorg. Chem. 2015. № 10. P. 1726.
Jiang F., Tian Q., Tang M. et al. // CrystEngComm. 2011. V. 13. № 24. P. 7189.
Liu W., Zhang J., Peng Z. et al. // Coll. Surf. A. 2018. V. 544. P. 111.
Li C., Zhang Y., Wang M. et al. // Biomaterials. 2014. V. 35. № 1. P. 393.
Zhang Y., Hong G., Zhang Y. et al. // ACS Nano. 2012. V. 6. № 5. P. 3695.
Zhao G.J., Stevens S.E. // Biometals. 1998. V. 11. № 1. P. 27.
Корнеева Е.В., Лосева О.В., Смоленцев А.И., Иванов А.В. // Журн. общ. xимии. 2018. Т. 88. № 8. С. 1361 (Korneeva E.V., Loseva O.V., Smolentsev A.I., Ivanov A.V. // Russ. J. Gen. Chem. 2018. V. 88. № 8. P. 1680). https://doi.org/10.1134/S1070363218080200
Корнеева Е.В., Смоленцев А.И., Анцуткин О.Н., Иванов А.В. // Изв. АН. Сер. хим. 2019. № 1. С. 40 (Korneeva E.V., Smolentsev A.I., Antzutkin O.N., Ivanov A.V. // Russ. Chem. Bull. Int. Ed. 2019. V. 68. № 1. P. 40). https://doi.org/10.1007/s11172-019-2413-7
Teske C.L., Hansen A.-L., Weihrich R. et al. // Chem. Eur. J. 2019. V. 25. № 27. P. 6763.
Berillo D. // J. Clean. Prod. 2020. V. 247. 119089.
Pohanka M. // Mini-Rev. Med. Chem. 2021. V. 21. № 9. P. 1085.
Mäkelä M., Hatanpää T., Mizohata K. et al. // Chem. Mater. 2017. V. 29. № 14. P. 6130.
Yang J., Ying J.Y. // Chem. Commun. 2009. № 22. P. 3187.
Корнеева Е.В., Иванов А.В., Герасименко А.В. и др. // Журн. общ. xимии. 2019. Т. 89. № 8. С. 1260 (Korneeva E.V., Ivanov A.V., Gerasimenko A.V. et al. // Russ. J. Gen. Chem. 2019. V. 89. № 8. P. 1642). https://doi.org/10.1134/S1070363219080152
Бырько В.М. Дитиокарбаматы. М.: Наука, 1984. 341 с.
APEX2 (Version 1.08), SAINT (Version 7.03), SADABS (Version 2.11). Madison (WI, USA): Bruker. AXS Inc., 2004.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. № 1. P. 3.
Лосева О.В., Родина Т.А., Иванов А.В. и др. // Коорд. химия. 2018. Т. 44. № 5. С. 303 (Loseva O.V., Rodina T.A., Ivanov A.V. et al. // Russ. J. Coord. Chem. 2018. V. 44. № 10. P. 604). https://doi.org/10.1134/S107032841810007X
John Wiley & Sons, Inc. SpectraBase; SpectraBase Compound ID=5Zceg8XzL6u https://spectrabase.com/compound/5Zceg8XzL6u (дата обращения 21.12.2020).
John Wiley & Sons, Inc. SpectraBase; SpectraBase Compound ID=DiJQuAXLpJE https://spectrabase.com/compound/DiJQuAXLpJE (дата обращения 21.12.2020).
Тарасевич Б.Н. Основы ИК спектроскопии с преобразованием Фурье. Подготовка проб в ИК спектроскопии. M.: МГУ, 2012. 22 с.
Fabretti A.C., Forghieri F., Giusti A. et al. // Spectrochim. Acta. A. 1984. V. 40. № 4. P. 343.
Bocian D.F., Pickett H.M., Rounds T.C., Strauss H.L. // J. Am. Chem. Soc. 1975. V. 97. № 4. P. 687.
Entrena A., Campos J., Gómez J.A. et al. // J. Org. Chem. 1997. V. 62. № 2. P. 337.
Boessenkool I.K., Boeyens J.C.A. // J. Cryst. Mol. Struct. 1980. V. 10. № 1–2. P. 11.
Alcock N.W. // Adv. Inorg. Chem. Radiochem. 1972. V. 15. № 1. P. 1.
Bondi A. // J. Phys. Chem. 1964. V. 68. № 3. P. 441.
Reddy C.M., Kirchner M.T., Gundakaram R.C. et al. // Chem. Eur. J. 2006. V. 12. № 8. P. 2222.
Awwadi F.F., Willett R.D., Peterson K.A., Twamley B. // Chem. Eur. J. 2006. V. 12. № 35. P. 8952.
Hathwar V.R., Roopan S.M., Subashini R. et al. // J. Chem. Sci. 2010. V. 122. № 5. P. 677.
Usoltsev A.N., Korobeynikov N.A., Novikov A.S. et al. // Inorg. Chim. Acta. 2020. V. 513. 119932.
Podsiadło M., Katrusiak A. // J. Phys. Chem. B. 2008. V. 112. № 17. P. 5355.
Лидин Р.А., Андреева Л.Л., Молочко В.А. Константы неорганических веществ: справочник. М.: Дрофа, 2008. 180 с.
Диаграммы состояния двойных металлических систем: справочник / Под ред. Лякишева Н.П. М.: Машиностроение, 1996. 992 с.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия


