Координационная химия, 2021, T. 47, № 11, стр. 698-706
Образование кластера с металлоостовом ${\mathbf{M}}_{{\mathbf{4}}}^{{{\mathbf{II}}}}{\mathbf{M}}_{{\mathbf{2}}}^{{{\mathbf{III}}}}$ при окислении аддукта цимантрената марганца(II) кислородом воздуха в тетрагидрофуране
М. А. Уварова 1, С. Е. Нефедов 1, *
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: snef@igic.ras.ru
Поступила в редакцию 13.02.2021
После доработки 23.03.2021
Принята к публикации 29.03.2021
Аннотация
При взаимодействии водного ацетата марганца(II) c цимантрен-карбоновой кислотой в инертной атмосфере получен комплекс [Mn(Тhf)2(OH2)4][OOCC5H4Mn(CO)3]2 (I), крайне неустойчивый к влиянию кислорода воздуха и температуре аддукта, в котором анионы оказываются внешнесферными. Окисление маточного раствора после выделения монокристаллов I приводит к образованию комплекса Mn6(µ4-O)2[µ,η2-OOCC5H4Mn(CO)3]2[µ-OOCC5H4Mn(CO)3]8(OH2)4 · 5C6H6 · ТГФ · · 3H2O (II). По данным РСА, металлостов II – шестиядерный кластер, содержащий смешановалентные атомы металла ${\text{Mn}}_{4}^{{{\text{II}}}}{\text{Mn}}_{2}^{{{\text{III}}}}$. Помимо РСА, полученные неустойчивые комплексы охарактеризованы данными элементного анализа и ИК-спектроскопии (порошки).
Органические перекиси, образующиеся при взаимодействии некоторых растворителей (тетрагидрофуран, эфиры и др.) с кислородом воздуха на свету могут быть, подобно пероксиду водорода, удобными окислителями для комплексов металлов, приводя к оксо-, гидроксомостиковым полиядерным соединениям и кластерам [1, 2].
Так, например, для пивалатов кобальта(II) было обнаружено окисление кислородом воздуха комплекса ${\text{Со}}_{3}^{{{\text{II}}}}$(μ-OOCtBu)6(NEt3)2 с образованием кластера [${\text{Со}}_{6}^{{{\text{III}}}}$(µ4-O)2(µ3-O)2(µ-OOCtBu)9(OH)2- (HOOCtBu)](HNEt3) в растворе дибензилового эфира или раствора фиолетового продукта термической реакции ацетата кобальта(II) с пивалиновой кислотой в ТГФ, приводящее к возникновению кластеров [${\text{Со}}_{6}^{{{\text{III}}}}$(μ4-O)2(μ3-OH)2(OH)2(μ-OOCtBu)9]+- (OOCtBu)–(HOOCtBu) и ${\text{Со}}_{{14}}^{{{\text{III}}}}$(μ5-O)2(μ3-O)2(μ3-OH)12- (OH)4(μ-OOCtBu)8(OOCtBu)10 ⋅ 2[OC(=O)C3H6]- [OC(H)(OH)C3H6] [3, 4]. При этом в кристаллической ячейке последнего присутствуют по две сольватные молекулы бутиролактона и 2-гидрокситетрагидрофурана, которые являются продуктами разложения 2-гидропероксотетрагидрофурана, образующегося в результате сопряженной реакции кислорода воздуха с ТГФ в присутствии атомов Co(II).
Похожие полиядерные карбоксилаты, оксо-, гидроксокарбоксилаты марганца хорошо известны (в Кембриджском банке структурных данных на ноябрь 2020 года известно около 7000 структурно охарактеризованных соединений карбоксилатов марганца [5]). Безусловный интерес к таким комплексам связан с использованием их во многих фундаментальных областях современной химии, включая молекулярные магнетики (получение полиядерных комплексов и кластеров с высокоспиновыми атомами металла [6–15]), катализ [16–19], бионеорганическая химия (моделирование активной части природных ферментов [20–26]) и др.
Ранее мы показали, что реакция водного ацетата марганца(II) с цимантрен-карбоновой кислотой в метаноле приводит к образованию комплекса Mn[OOCC5H4Mn(CO)3]2[O(H)Me]4 [27]. В настоящей работе сообщается о строении продуктов аналогичной реакции, но в ТГФ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали Mn2(OOCMe)4(OH2)4 (ACROS), цимантрен-карбоновую кислоту синтезировали согласно методикe, приведенной в [28].
Синтез комплекса [Mn(Thf)2(OH2)4][OOCC5H4- Mn(CO)3]2 (I) и кластера Mn6(µ4-O)2[µ,η2-OOCC5H4Mn(CO)3]2[µ-OOCC5H4Mn(CO)3]8(OH2)4 · · 5C6H6 · ТГФ · 3H2O (II). К 0.2 г (0.8 ммоль) Mn(CH3COO)2 ⋅ 4H2O добавляли раствор 0.4 г (1.6 ммоль) HOOCC5H4Mn(CO)3 в 10 мл ТГФ и кипятили в инертной атмосфере (аргон) в течение 2 ч. Полученный гомогенный раствор концентрировали до ~4 мл и оставляли остывать в масляной бане до комнатной температуры. Образовавшиеся через сутки крайне неустойчивые при комнатной температуре бесцветные кристаллы комплекса I отделяли от маточного раствора декантацией, промывали последовательно холодным бензолом (10 мл), гексаном (10 мл) и сушили в токе аргона. Через 10–15 мин в аргоне кристаллы разлагались, превращаясь в порошок. На воздухе маточный раствор быстро менял окраску (через ~30 мин). К полученному коричневому раствору добавляли 5 мл бензола и оставляли на ночь под тягой в колбе с открытыми пробками. Образовавшиеся коричневые кристаллы кластера II отделяли от раствора декантацией, промывали последовательно холодным бензолом (10 мл), гексаном (10 мл) и сушили в токе аргона. Монокристаллы II также оказались неустойчивыми при комнатной температуре.
Выход I 0.09 г (15%).
| Найдено (порошок), %: | С 38.12; | Н 2.87. |
| Для C26H32O16Mn3 вычислено, %: |
С 40.80; | Н 4.21. |
| Для C26H32O16Mn3 – ТГФ C22H24Mn3O15 вычислено, %: |
С 38.11; | Н 3.49. |
| Для C26H32O16Mn3 – 2ТГФ C18H16O14Mn3 вычислено, %: |
С 34.8;1 | Н 2.59. |
Поскольку соединение I неустойчиво, а элементный анализ сделан для порошка, расcчитанные и экспериментальные данные плохо сходятся. Однако расчет показывает, что, по-видимому, при разложении комплекса улетает часть координированного ТГФ (это отражено в результатах элементного анализа).
ИК-спектр(порошок) 2016 с, 1911 с, 1682 сл, 1567 ср, 1480 с, 1388 с, 1363 с, 1200 ср, 1015 ср, 924 сл, 837 сл, 796 ср, 663 с, 627 с, 535 с, 489 ср, 465 ср, 440 сл, 414 сл, 405 сл.
Выход II 0.25 г (38%).
| Найдено (порошок), %: | С 36.18; | Н 2.04. |
| Для C90H48O56Mn16 вычислено, %: | С 37.22; | H 1.66. |
| Для C90H54O59Mn16 (C90H48Mn16O56 · 3H2O) вычислено, %: |
С 36.54; | H 1.84. |
ИК-спектр (порошок): 2018 с, 1919 с, 1539 ср, 1481 с, 1391 с, 1361 с, 1260 сл, 1199 сл, 1029 ср, 926 сл, 838 сл, 790 ср, 665 с, 628 с, 538 с, 489 ср, 471 ср, 453 ср, 433 сл, 418 сл.
Из-за крайней неустойчивости соединений I и II получить удовлетворительные данные химического анализа не удалось.
ИК-спектры соединений регистрировали на ИК спектрофотометре с Фурье преобразованием “Perkin-Elmer Spectrum 65” методом нарушенного полного внутреннего отражения (НПВО) в интервале частот 400–4000 см–1.
Монокристаллы комплексов для проведения РСА извлекали непосредственно из маточного раствора и быстро переносили в ток испаряющегося жидкого азота.
РСА I, II выполнен по стандартной методике на автоматическом дифрактометре Bruker SMART Apex II, оборудованном CCD-детектором (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор, ω-сканирование). Уточнение структур проводили с использованием комплекса программ SHELXTL PLUS (PC версия) [29–32]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для всех неводородных атомов. Положения атомов водорода координированных молекул воды в I выявлены из разностного Фурье-ряда и уточнены изотропно, остальные атомы водорода в I и II определены геометрически и уточнены в модели “наездника”.
Кристаллографические данные и детали уточнения структур I, II приведены в табл. 1, длины связей и валентные углы – в табл. 2, 3 соответственно.
Таблица 1.
Кристаллографические параметры и детали уточнения структур комплексов I, II
| Параметр | Значение | |
|---|---|---|
| I | II | |
| Брутто-формула | C26H32O16Mn3 | C90H48O56Mn16 · 5C6H6 · C4H8O · 3H2O |
| М | 765.34 | 3421.01 |
| Цвет | Бесцветный | Коричневый |
| T, K | 150(2) | 150(2) |
| Сингония | Триклинная | Триклинная |
| Пр. гр. | P1 | P1 |
| a, Å | 7.912(3) | 14.098(4) |
| b, Å | 8.033(4) | 15.235(4) |
| c, Å | 12.932(5) | 34.435(9) |
| α, град | 74.638(6) | 89.949(4) |
| β, град | 88.430(7) | 87.331(4) |
| γ, град | 79.108(7) | 89.906(4) |
| V, Å3 | 778.0(6) | 7388(3) |
| Z | 1 | 2 |
| ρ(выч.), мг/м3 | 1.633 | 1.538 |
| µ, мм–1 | 1.272 | 1.401 |
| F(000) | 391 | 3432 |
| Размеры кристалла, мм | 0.24 × 0.22 × 0.20 | 0.16 × 0.18 × 0.20 |
| Oбласть сканирования по θ, град | 2.62–27.99 | 1.44–27.57 |
| Интервалы индексов отражений | –7 ≤ h ≤ 10, –10 ≤ k ≤ 10, –17 ≤ l ≤ 13 |
–18 ≤ h ≤ 18, –19 ≤ k ≤ 19, –43 ≤ l ≤ 43 |
| Число отражений | 5164 | 32 047 |
| Число независимых отражений (Rint) | 3540 (0.0389) | 22 374 (0.0747) |
| GOOF | 0.979 | 1.079 |
| R (I > 2σ(I)) | R1 = 0.0530, wR2 = 0.1288 |
R1 = 0.0957, wR2 = 0.2471 |
| R (по всем рефлексам) | R1 = 0.0948, wR2 = 0.1559 |
R1 = 0.1301, wR2 = 0.2739 |
| Остаточная электронная плотность (max/min), e Å–3 | 1.452/–0.615 | 2.220/–1.070 |
Таблица 2.
Основные длины связей (Å) и валентные углы (град) в комплексe I*
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| Mn(1)–O(2) | 2.066(3) | Mn(1)–O(2)#1 | 2.066(3) |
| Mn(1)–O(3)#1 | 2.089(3) | Mn(1)–O(3) | 2.089(3) |
| Mn(1)–O(1)#1 | 2.130(4) | Mn(1)–O(1) | 2.130(4) |
| Угол | ω, град | Угол | ω, град |
| O(2)Mn(1)O(2)#1 | 180.0 | O(2)Mn(1)O(3)#1 | 93.76(13) |
| O(2)#1Mn(1)O(3)#1 | 86.24(13) | O(2)Mn(1)O(3) | 86.24(13) |
| O(2)#1Mn(1)O(3) | 93.76(13) | O(3)#1Mn(1)O(3) | 180.0 |
| O(2)Mn(1)O(1)#1 | 88.96(14) | O(2)#1Mn(1)O(1)#1 | 91.04(14) |
| O(3)#1Mn(1)O(1)#1 | 91.56(13) | O(3)Mn(1)O(1)#1 | 88.44(13) |
| O(2)Mn(1)O(1) | 91.04(14) | O(2)#1Mn(1)O(1) | 88.96(14) |
| O(3)#1Mn(1)O(1) | 88.44(13) | O(3)Mn(1)O(1) | 91.56(13) |
| O(1)#1Mn(1)O(1) | 180.0 | C(4)O(1)Mn(1) | 122.6(3) |
| C(1)O(1)Mn(1) | 128.2(3) |
Таблица 3.
Основные длины связей (Å) и валентные углы (град) в комплексе II
| Связь | d, Å | Связь | d, Å |
| Mn(1)–O(5) | 2.113(7) | Mn(1)–O(4) | 2.136(7) |
| Mn(1)–O(6) | 2.144(7) | Mn(1)–O(1) | 2.180(6) |
| Mn(1)–O(7) | 2.215(8) | Mn(1)–O(3) | 2.339(7) |
| Mn(1)–Mn(2) | 3.177(2) | Mn(2)–O(2) | 1.873(6) |
| Mn(2)–O(1) | 1.896(6) | Mn(2)–O(9) | 1.954(7) |
| Mn(2)–O(8) | 1.972(7) | Mn(2)–O(3) | 2.228(7) |
| Mn(2)–O(13) | 2.235(7) | Mn(2)–Mn(3) | 2.8220(17) |
| Mn(2)–Mn(4) | 3.162(2) | Mn(3)–O(1) | 1.869(6) |
| Mn(3)–O(2) | 1.910(6) | Mn(3)–O(11) | 1.957(7) |
| Mn(3)–O(12) | 1.978(7) | Mn(3)–O(10) | 2.220(7) |
| Mn(3)–O(22) | 2.235(7) | Mn(3)–Mn(6) | 3.160(2) |
| Mn(3)–Mn(5) | 3.161(2) | Mn(6)–O(26) | 2.110(7) |
| Mn(6)–O(24) | 2.113(7) | Mn(6)–O(23) | 2.168(7) |
| Mn(6)–O(1) | 2.209(6) | Mn(6)–O(25) | 2.226(8) |
| Mn(6)–O(22) | 2.271(7) | Mn(5)–O(19) | 2.075(7) |
| Mn(5)–O(18) | 2.158(7) | Mn(5)–O(2) | 2.192(6) |
| Mn(5)–O(20) | 2.197(7) | Mn(5)–O(21) | 2.201(7) |
| Mn(5)–O(10) | 2.278(7) | Mn(4)–O(14) | 2.120(8) |
| Mn(4)–O(16) | 2.125(7) | Mn(4)–O(15) | 2.131(7) |
| Mn(4)–O(2) | 2.177(7) | Mn(4)–O(17) | 2.230(8) |
| Mn(4)–O(13) | 2.362(7) | ||
| Угол | ω, град | Угол | ω, град |
| O(5)Mn(1)O(4) | 90.9(3) | O(5)Mn(1)O(6) | 99.5(3) |
| O(4)Mn(1)O(6) | 162.4(3) | O(5)Mn(1)O(1) | 91.6(3) |
| O(4)Mn(1)O(1) | 93.0(3) | O(6)Mn(1)O(1) | 100.9(3) |
| O(5)Mn(1)O(7) | 90.1(3) | O(4)Mn(1)O(7) | 83.7(3) |
| O(6)Mn(1)O(7) | 82.1(3) | O(1)Mn(1)O(7) | 176.2(3) |
| O(5)Mn(1)O(3) | 166.0(3) | O(4)Mn(1)O(3) | 82.3(3) |
| O(6)Mn(1)O(3) | 90.3(3) | O(1)Mn(1)O(3) | 76.6(2) |
| O(7)Mn(1)O(3) | 101.2(3) | O(2)Mn(2)O(1) | 83.4(2) |
| O(2)Mn(2)O(9) | 95.1(3) | O(1)Mn(2)O(9) | 172.7(3) |
| O(2)Mn(2)O(8) | 173.7(3) | O(1)Mn(2)O(8) | 95.0(3) |
| O(9)Mn(2)O(8) | 87.3(2) | O(2)Mn(2)O(3) | 96.0(3) |
| O(1)Mn(2)O(3) | 85.2(3) | O(9)Mn(2)O(3) | 87.8(3) |
| O(8)Mn(2)O(3) | 89.9(3) | O(2)Mn(2)O(13) | 86.6(3) |
| O(1)Mn(2)O(13) | 97.4(3) | O(9)Mn(2)O(13) | 89.6(3) |
| O(8)Mn(2)O(13) | 87.6(3) | O(3)Mn(2)O(13) | 176.5(2) |
| O(1)Mn(3)O(11) | 171.6(3) | O(2)Mn(3)O(11) | 95.9(3) |
| O(1)Mn(3)O(12) | 93.8(3) | O(2)Mn(3)O(12) | 171.8(3) |
| O(11)Mn(3)O(12) | 88.3(3) | O(1)Mn(3)O(10) | 98.8(3) |
| O(2)Mn(3)O(10) | 85.3(3) | O(11)Mn(3)O(10) | 89.4(3) |
| O(12)Mn(3)O(10) | 87.6(3) | O(1)Mn(3)O(22) | 85.8(3) |
| O(2)Mn(3)O(22) | 96.8(3) | O(11)Mn(3)O(22) | 86.1(3) |
| O(12)Mn(3)O(22) | 90.5(3) | O(10)Mn(3)O(22) | 175.2(2) |
| Угол | ω, град | Угол | ω, град |
| O(1)Mn(3)O(2) | 83.1(2) | O(26)Mn(6)O(24) | 167.5(3) |
| O(26)Mn(6)O(23) | 98.1(3) | O(24)Mn(6)O(23) | 84.3(3) |
| O(26)Mn(6)O(1) | 101.0(3) | O(24)Mn(6)O(1) | 91.2(3) |
| O(23)Mn(6)O(1) | 89.7(3) | O(26)Mn(6)O(25) | 85.6(3) |
| O(24)Mn(6)O(25) | 82.0(3) | O(23)Mn(6)O(25) | 93.7(3) |
| O(1)Mn(6)O(25) | 172.1(3) | O(26)Mn(6)O(22) | 98.1(3) |
| O(24)Mn(6)O(22) | 82.0(3) | O(23)Mn(6)O(22) | 161.0(3) |
| O(1)Mn(6)O(22) | 77.6(2) | O(25)Mn(6)O(22) | 97.3(3) |
| O(19)Mn(5)O(18) | 170.6(3) | O(19)Mn(5)O(2) | 98.0(3) |
| O(18)Mn(5)O(2) | 91.3(3) | O(19)Mn(5)O(20) | 86.7(3) |
| O(18)Mn(5)O(20) | 83.9(3) | O(2)Mn(5)O(20) | 174.0(3) |
| O(19)Mn(5)O(21) | 97.1(3) | O(18)Mn(5)O(21) | 84.1(3) |
| O(2)Mn(5)O(21) | 90.4(3) | O(20)Mn(5)O(21) | 92.6(3) |
| O(19)Mn(5)O(10) | 97.4(3) | O(18)Mn(5)O(10) | 83.3(3) |
| O(2)Mn(5)O(10) | 77.9(2) | O(20)Mn(5)O(10) | 98.0(3) |
| O(21)Mn(5)O(10) | 162.5(3) | O(14)Mn(4)O(15) | 164.6(3) |
| O(14)Mn(4)O(13) | 93.5(3) | O(16)Mn(4)O(15) | 90.8(3) |
| O(14)Mn(4)O(2) | 100.1(3) | O(16)Mn(4)O(2) | 93.9(3) |
| O(15)Mn(4)O(2) | 92.7(3) | O(14)Mn(4)O(17) | 84.5(3) |
| O(16)Mn(4)O(17) | 90.3(3) | O(15)Mn(4)O(17) | 82.1(3) |
| O(2)Mn(4)O(17) | 173.4(3) | O(2)Mn(4)O(13) | 77.0(2) |
| O(16)Mn(4)O(13) | 167.4(3) | O(15)Mn(4)O(13) | 81.1(3) |
| O(17)Mn(4)O(13) | 98.0(3) |
Структурные данные депонированы в Кембриджском банке структурных данных (CCDC № 2059074 (I), 2059075 (II); http://www.ccdc.cam.ac. uk/).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Обнаружено, что, в отличие от реакции водного ацетата марганца(II) с цимантрен-карбоновой кислотой в метаноле, взаимодействие в донорном полярном ТГФ приводит к образованию крайне неустойчивого бесцветного комплекса [Mn(OH2)4- (Тhf)2][OOCC5H4Mn(CO)3]2 (I, выход 15%). По данным РСА, в центросимметричном моноядерном комплексе I (табл. 1, 2 , рис. 1) атом металла имеет искаженное октаэдрическое окружение четырех атомов кислорода экваториально-расположенных молекул воды (Mn(1)–O 2.066(3)–2.089(3) Å) и двух атомов кислорода координированных в аксиальной позиции молекул ТГФ (Mn(1)–O 2.130(4) Å). Атомы кислорода двух внешнесферных цимантренат-анионов образуют короткие связи с атомами водорода молекул воды, формируя 2D-полимер (рис. 2) (О(4)…О(2)(O(2A) 2.658 Å (2.714 Å); О(5)…О(3)(O(3A) 2.671 Å (2.714 Å)). Отметим, что в полимере все циклопентадиенильные фрагменты параллельны.
Рис. 2.
Фрагмент упаковки молекул комплекса I в кристалле. Цвета атомов: марганец – фиолетовый, кислород – красный, углерод – серый.

Ранее было обнаружено, что аналогичная реакция в ТГФ при нагревании до 50°C, добавлении гексана и выдерживании полученного раствора в холодильнике при 5°C образуются кристаллы гетерокарбоксилатного 1D-полимера {Mn2[µ-OOCC5H4Mn(CO)3]2(µ-OOCMe)(µ-OOCC5H4Mn(CO)3)(Тhf)2}n (А) [33]. Можно предположить, что в реакционной смеси в полярном ТГФ при температурах, когда не происходит очевидного удаления одного из реагентов, присутствуют следующие возможные основные равновесия: Mn(OOCMe)2(OH2)4 + HOOCC5H4Mn(CO)3 ↔ ↔ (I) + 2HOOCMe ↔ (A) + HOOCMe + 4H2O + + HOOCC5H4Mn(CO)3 ↔ Mn[OOCC5H4Mn(CO)3]2-(Thf)4 (B) + 2HOOCMe + 4H2O.
Не исключено, что образование монокристаллов одного из имеющихся в растворе комплексов определяется условиями кристаллизации, причем предполагаемый аддукт В в монокристаллическом виде выделить пока не удалось.
Заметим, что похожие равновесия присутствуют в реакционном растворе при взаимодействии водного ацетата марганца с бензойной кислотой в горячем толуоле в ходе формирования полимера {Mn5(OOCMe)6(OOCPh)4}n [34], а также Zn(OOCMe)2(OH2)2 с цимантрен-карбоновой кислотой в ацетонитриле при 50°C, когда был получен 1D-полимер {Zn[OOCС5Н4Mn(CO)3]- (µ-OOCMe)(ОН2)}n [35].
Бесцветный маточный раствор этой реакции в присутствии кислорода воздуха быстро становится коричневым, и из него после добавления бензола кристаллизуется шестиядерный кластер Mn6(µ4-O)2- (µ,η2-OOCC5H4Mn(CO)3)2(µ-OOCC5H4Mn(CO)3)8- (OH2)4 · 5C6H6 · ТГФ · 3H2O (II, выход 35%).
Согласно РСА, в II (табл. 3, рис. 3, 4) шесть атомов марганца соединены двумя тетрадентатно-мостиковыми атомами кислорода (O(1)–Mn(1) 2.180(6), O(1)–Mn(2) 1.896(6), O(1)–Mn(3) 1.869(6), O(1)–Mn(6) 2.209(6) Å; O(2)–Mn(2) 1.873(6), O(2)–Mn(3) 1.910(6), O(2)–Mn(4) 2.177(7), O(2)–Mn(5) 2.192(6) Å). Распределение длин связей М–О позволяет предположить, что атомы Mn(2) и Mn(3) имеют степень окисления +3 (более сильные кислоты Льюиса), остальные атомы металла +2. Такое предположение подтверждается заметным различием длин связей металл–атом кислорода мостикового аниона (MnII(1)–O 2.113(7)–2.339(7); MnIII(2)–O 1.954(7)–2.235(7); MnIII(3)–O 1.957(7)–2.235(7); MnII(4)–O 2.120(8)–2.362(7); MnII(5)–O 2.158(7)–2.278(7); MnII(6)–O 2.110(7)–2.271(7) Å) и, соответственно, расстояний M…M (MnIII(2)…MnIII(3) 2.8220(17), MnIII(2),(3)…MnII 3.160(2)–3.502(3); MnII…MnII 3.781(3)–4.709(3) Å).
Рис. 3.
Общий вид кластера II с сольватными молекулами бензола и ТГФ (разупорядоченные молекулы воды не показаны). Для ясности фрагменты Mn(CO)3 не показаны. Цвета атомов: марганец – фиолетовый, кислород – красный, углерод – серый.
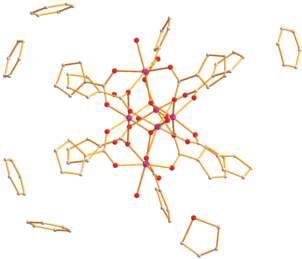
В итоге каждый атом MnIII имеет искаженное октаэдрическое окружение атомов кислорода мостиковых анионов, а для атомов MnII оно дополнено атомами кислорода координированных молекул воды (Mn–O 2.215(8)–2.230(8) Å) (табл. 3, рис. 4).
Необходимо отметить, что три выявленных сольватных молекулы воды связаны водородными связями между собой, с атомами кислородов координированной H2O и мостикового аниона, а остальные сольватные молекулы не имеют заметных контактов с атомами кластера II.
Шестиядерные карбоксилаты смешановалентного ${\text{Mn}}_{4}^{{{\text{II}}}}{{{\text{L}}}_{4}}$(µ4-O)2${\text{Mn}}_{2}^{{{\text{III}}}}$(OOCR)10 (L = координированный атомами марганец(II) двухэлектронный донор) хорошо известны [36], причем они были получены самыми разными способами: реакциями солей марганца(II) (хлориды, карбонаты) с солями натрия или калия карбоновых кислот, лигандным обменом анионов в ацетате марганца на анионы кислоты с последующим окислением кислородом воздуха в полярных растворителях (Н2О, МеCN, ТГФ), перекисью водорода или соединениями марганца в высоких степенях окисления (MnO4–) [37–52].
Таким образом, в ходе проведенных исследований обнаружено, что в отличие от реакции водного ацетата марганца(II) с цимантрен-карбоновой кислотой в метаноле, когда образуется устойчивый по отношению к кислороду воздуха аддукт Mn[OOCC5H4Mn(CO)3]2[O(H)Me]4 с четырьмя координированными молекулами спирта, аналогичная реакция в ТГФ дает моноядерный комплекс [Mn(OH2)4(Тhf)2][OOCC5H4Mn(CO)3]2, в котором анионы оказываются внешнесферными, причем последний легко окисляется в ТГФ на воздухе, приводя к шестиядерному кластеру, содержащему атомы марганца в разных степенях окисления. Отметим, что при этом атомы металла, входящие в металлоорганическую часть молекулы, не окисляются.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Карножицкий В. Органические перекиси / Пер. с франц. М.: ИЛ, 1961. С. 77.
Хавкинс Э.Дж.Э. Органические перекиси, их получение и реакции / Пер. с англ. М.; Л.: Химия, 1964. С. 269.
Нефедов С.Е., Уварова М.А., Голубничая М.А. и др. // Коорд. химия. Т. 40. № 6. С. 338 (Nefedov S.E., Uvarova M.A., Golubichnaya M.A. et al. // Russ. J. Coord. Chem. 2014. V. 40. P. 358). https://doi.org/10.7868/S0132344X14060048
Нефедов С.Е., Денисова Т.О. // Журн. неорган. химии. Т. 51. № 9. С. 1496 (Nefedov S.E., Denisova T.O. // Russ. J. Inorg. Chem. 2006. V. 51. P. 1404). https://doi.org/10.1134/S0036023606090063
CSD. Version 5.42 (November 2020).
Friedman J.R., Sarachik M.P. // Annu. Rev. Cond. Mat. 2010. № 1. P. 109. https://doi.org/10.1146/annurev-conmatphys-070909-104053
Kittilstved K.R., Liu W.K., Gamelin D.R. // Nat. Mater. 2006. V. 5. P. 291. https://doi.org/10.1038/nmat1616
Wernsdorfer W., Aliaga-Alcalde N., Hendrickson D.N., Christou G. // Nature. 2002. V. 416. P. 406. https://doi.org/10.1038/416406a
Martin J.D., Hess R.F. // Chem. Commun. 1996. V. 288. P. 2419. https://doi.org/10.1039/CC9960002419
Liu S., Bremer M.T., Lovaasen J. et al. // Inorg. Chem. 2008. V. 47. P. 1568 https://doi.org/10.1021/ic7020879
Geier S., Mason J.A., Bloch E. et al. // Chem. Sci. 2013. P. 2054. https://doi.org/10.1039/C3SC00032J
Aromí G., Brechin E.K. // Structure and Bonding: Single-Molecule Magnetsand Related Phenomena, Springer-Verlag / Ed. Winpenny R. Berlin; Heidelberg, 2006. V. 122. P. 1.
Inglis R., White F., Piligkos S. et al. // Chem. Commun. 2011. V. 47. P. 3090. https://doi.org/10.1039/c0cc05750a
Abasi P., Quinn K., Alexandropoulos D.I. et al. // J. Am. Chem. Soc. 2017. V. 139. P. 15644. https://doi.org/10.1021/jacs.7b10130
Mishra A., Wernsdorfer W., Abboud K.A., Christou G. // Inorg. Chem. 2006. V. 45. P. 10197. https://doi.org/10.1021/ic061334d
de Boer J.W., Brinksma J., Browne W.R. et al. // J. Am. Chem. Soc. 2005. V. 127. P. 7990. https://doi.org/10.1021/ja050990u
Talsi E.P., Bryakov K.P. // Coord. Chem. Rev. 2012. V. 256. № 13–14. P. 1418. https://doi.org/10.1016/j.ccr.2012.04.005
Castaman S.T., Nakagaki Sh., Ribeiro R.R. et al. // J. Mol. Catal. A. 2009. V. 300. № 1–2. P. 89. https://doi.org/10.1016/j.molcata.2008.10.037
Waiba S., Maji B. // ChemCatChem. 2020. V. 12. P. 1891. https://doi.org/10.1002/cctc.201902180
Lippard S.J., Berg J.M. Principles of Bioinorganic Chemistry. Mill Valley (CA): Univ. Science Books, 1994. P. 199.
Kanady J.S., Tsui E.Y., Day M.W., Agapie T. // Science. 2011. V. 333. P. 733. https://doi.org/10.1126/science.1206036
Larson V.A., Battistella B., Ray K. et al. // Nat. Rev. Chem. 2020. V. 4. P. 404. https://doi.org/10.1038/s41570-020-0197-9
Tsui E.Y., Kanady J.S., Agapie T. // Inorg. Chem. 2013. V. 52. № 24. P. 13833. https://doi.org/10.1021/ic402236f
Lee H.B., Marchiori D.A., Chatterjee R. et al. // J. Am. Chem. Soc. 2020. V. 142. № 8. P. 3753. https://doi.org/10.1021/jacs.9b1037
Reed Ch.J., Agapie T. // J. Am. Chem. Soc. 2018. V. 140. №3 4. P. 10900. https://doi.org/10.1021/jacs.8b06426
Beal N.J., O’Malley P.J. // J. Am. Chem. Soc. 2016. V. 138. № 13. P. 4358. https://doi.org/10.1021/jacs.6b02600
Уварова М.А., Нефедов С.Е. // Журн. неорган. химии. Т. 60. № 9. С. 1181 (Uvarova M.A., Nefedov S.E. // Russ. J. Inorg. Chem. 2015. 60. P. 1074). https://doi.org/10.1134/S003602361509020X
Несмеянов А.Н., Анисимов К.Н., Колобова Н.Е., Макаров Ю.В. // Изв. АН СССР. Сер. хим. 1968. P. 683 (Nesmeyanov A.N., Anisimov K.N., Kolobova N.E., Makarov Y.V. // Bull. Acad. Sciences USSR. Div. Chem. Science. 1968. P. 672).
SMART (control) and SAINT (integration) Software. Version 5.0. Madison (WI, USA): Bruker AXS Inc., 1997.
SAINT. Area-Detector Integration Sofware. Madison (WI, USA): Bruker AXS Inc., 2012.
Sheldrick G.M. SADABS. Program for Scaling and Correction of Area Detector Data. Göttingen (Germany): Univ. of Göttingen, 1997.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3. https://doi.org/10.1107/S2053229614024218
Уварова М.А., Нефедов С.Е. // Журн. неорган. химии. Т. 60. № 11. С. 1473 (Uvarova M.A., Nefedov S.E. // Russ. J. Inorg. Chem. 2015. V. 60. № 11. Р. 1348). https://doi.org/10.1134/S0036023615110212
Liu Sh., Bremer M.T., Lovaasen J. et al. // Inorg. Chem. 2008. V. 47. P. 1568. https://doi.org/10.1021/ic7020879
Уварова М.А., Агешина А.А., Гринева А.А. и др. // Журн. неорган. химии. 2015. Т. 60. № 5. С. 633 (Uvarova M.A., Ageshina A.A., Grineva A.A. et al. // Russ. J. Inorg. Chem. 2015. V. 60. № 11. Р. 566). https://doi.org/10.7868/S0044457X15050189
Baca S.G. // Advances in Chemistry Research / Ed. Taylor J.C. New York: Nova Science Publishers, 2018. V. 43. P. 81.
Wemple M.W., Tsai H.-L., Wang S. et al. // Inorg. Chem. 1996. V. 35 P. 6437. https://doi.org/10.1021/ic9603013
Malaestean I.L., Ellern A., Leusen J. et al. // CrystEngComm. 2014. V. 1. P. 6523. https://doi.org/10.1039/C4CE00504J
Kornowicz A., Komorski S., Wrobel Z. et al. // Dalton Trans. 2014. V. 43. P. 3048. https://doi.org/10.1039/C3DT53211A
Halcrow M.A., Streib W.E., Folting K., Christou G. // Acta Crystallogr. C. 1995. V. 51. P. 1263. https://doi.org/10.1107/S0108270194013764
Kushch L.A., Shilov G.V., Morgunov R.B., Yagubskii E.B. // Mendeleev Commun. 2009. V. 19. P. 170. https://doi.org/10.1016/j.mencom.2009.05.021
Batsanov A.S., Struchkov Yu.T., Timco G.A. et al. // Russ. J. Coord. Chem. 1994. V. 20. P. 604.
Malaestean I.L., Kravtsov V.Ch., Speldrich M. et al. // Inorg. Chem. 2010. V. 49. P. 7764. https://doi.org/10.1021/ic100541m
Schake A.R., Vincent J.B., Li Qiaoying et al. // Inorg. Chem. 1989. V. 28. P. 1915.
Karsten P., Strähle J. // Acta Crystallogr. C. 1998. V. 54. P. 1403. https://doi.org/10.1107/S0108270198005861
Kohler K., Roesky H.W., Noltemeyer M. et al. // Chem. Ber. 1993. V. 126. P. 921. https://doi.org/10.1002/cber.19931260411
Stamatatos T.C., Foguet-Albiol D., Perlepes S.P. et al. // Polyhedron. 2006. V. 25. P. 1737. https://doi.org/10.1016/j.poly.2005.11.019
Kiskin M.A., Sidorov A.A., Fomina I.G. et al. // Inorg. Chem. Commun. 2005. V. 8. P. 524. https://doi.org/10.1016/j.inoche.2005.03.005
Kar P., Haldar R., Gomez-Garcia C.J., Ghosh A. // Inorg. Chem. 2012. V. 51. P. 4265. https://doi.org/10.1021/ic2027362
Gerbier P., Ruiz-Molina D., Gomez J. et al. // Polyhedron. 2003. V. 22. P. 1951. https://doi.org/10.1016/S0277-5387(03)00158-X
Darii M., Filippova I., Hauser J. et al. // Crystals. 2018. V. 8(2). 100. https://doi.org/10.3390/cryst8020100
Ovcharenko V., Fursova E., Romanenko G., Ikorskii V. // Inorg. Chem. 2004. V. 43. P. 3332. https://doi.org/10.1021/ic049859y
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия




