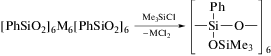Координационная химия, 2021, T. 47, № 6, стр. 344-355
Металлосилоксаны c ацетилацетонатными лигандами
Н. В. Сергиенко 1, *, Е. С. Транкина 1, Н. В. Польщикова 1, А. А. Корлюков 1
1 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
Москва, Россия
* E-mail: natotenija@rambler.ru
Поступила в редакцию 24.11.2020
После доработки 14.01.2021
Принята к публикации 18.01.2021
Аннотация
Изучено взаимодействие нейтральных каркасных металлофенилсилоксанов состава [PhSiO2]6M6[PhSiO2]6 (M = Cu или Ni) сэндвичевого типа с щелочным ацетилацетонатом K(Acac), а также щелочного каркасного металлосилоксана [PhSiO2]12Cu4Na4 глобулярного типа с нейтральным комплексом Co(Acac)2. Образующиеся в ходе реакции гексаядерные Cu6- (I) и Ni6-фенилсилоксаны (II) и октаядерный (Cu4,Co4)-фенилсилоксан (III) исследованы методом РСА (CIF files № 1974285 (I), 1974286 (II), 1974287 (III)). Показано, что во всех случаях сохраняется тип структуры (сэндвичевой или глобулярной) исходного металлосилоксана. Однако в случае Ni-силоксана координация с двумя Acac-лигандами приводит к заметному сдвигу силоксановых циклов друг относительно друга и трансформации обычного сэндвича, характерного для нейтрального Ni-фенилсилоксана к скошенному. Наличие четырех Acac-лигандов в глобулярном (Cu4,Co4)-фенилсилоксане привело к увеличению расстояния между двумя линейными Cu–Cu фрагментами молекулы, что обусловило структуру типа “двояковыпуклой линзы”.
Соединения, состоящие из переходных металлов и макроциклических силоксанолятных лигандов, обладают уникальной способностью образовывать структуры различной формы, что позволяет их ставить в один ряд с такими классами, как полиоксометаллаты [1, 2] или металлокарбоксилаты [3]. Среди металлосилоксанов особое место занимают комплексы, полученные при взаимодействии галогенидов переходных металлов (Cu, Co, Ni, Cr) и олигомерных продуктов щелочного гидролиза органотриэтоксисиланов общей формулы (M[RSiO2])n в среде полярных органических растворителей, обладающих электронодонорной способностью [4, 5]. Такие металлосилоксаны можно разделить на два основных структурных типа: сэндвичевую и глобулярную (или седла). Данная классификация в основном касается количества и природы силоксанолятных лигандов. Сэндвичевые металлосилоксаны известны для таких переходных металлов, как медь, никель, кобальт и хром, тогда как глобулярные известны только для меди. Для обоих типов структуры существуют способы управлять формой металлосилоксанового каркаса, основанные на изменении природы переходного металла и его лигандного окружения [6–8]. Для некоторых сэндвичевых и глобулярных металлосилоксанов исследованы магнитохимические [9–12] и каталитические [13, 14] свойства и показано, что они во многом определяются структурой каркаса.
Сэндвичевые металлосилоксаны состоят из четного числа переходных металлов: 4, 6, 8, 10 (исключение – пентаникельсилоксан [12] и пентамедьсилоксан [15]) и двух макроциклических силоксановых лигандов, дополнительно в каркас могут входить атомы натрия или калия. Согласно литературным данным, форма металлосилоксанового сэндвичевого каркаса близка к цилиндрической. Возможна и иная форма металлосилоксанового каркаса, для которой характерно нарушение цилиндрической симметрии таким образом, что угол между прямой, соединяющей центроиды двух силоксанолятных лигандов, и перпендикуляром, опущенным из центроида одного из силоксанолятных лигандов к средней плоскости другого, меньше 90°. Форма этого типа напоминает скошенный цилиндр (скошенный сэндвич). Внутри каркаса этого типа локализованы атомы кислорода, соответствующие гидроксильным или O2– группам. Структура типа скошенного сэндвича была получена только для нескольких соединений: окта- и тетраядерных никельсилоксанов [16, 17], тетраядерного кадмийсилоксана [18], а также биядерного хромсилоксана [19]. Другой тип деформации обнаружен при переметаллировании каркасных медьсилоксанов типа [RSiO2]6Na4Cu4[RSiO2]6. Замена атомов натрия на атомы щелочноземельных металлов с большим ионным радиусом (например, на стронций или барий [6]) приводит к получению металлосилоксановых каркасов с формой сплющенного цилиндра. Следует отметить, что искажение возрастает с увеличением ионного радиуса металла. Еще один тип искажения цилиндрической структуры металлосилоксаного фрагмента наблюдается в случае, когда ряд атомов металла кроме связи с силоксанолятным лигандом дополнительно координирован бипиридилом и гидроксильной группой [20]. Добавление бипиридина в ходе получения комплекса, по-видимому, оказывает непосредственное влияние на структуру образовавшегося продукта. В результате происходит своего рода “сплющивание” металлосилоксаного каркаса, более существенное, чем в случае внедрения щелочноземельных металлов, так что наблюдается разрыв единого металлооксидного пояса (названного в статье [11] “квантовым кольцом”) на два почти линейных медьсодержащих фрагмента (например, в медьсилоксане с метил-2-амино-2-оксо-N,N'-этанимидоатным лигандом [21]). При этом терминальные атомы меди этих фрагментов участвуют в слабых координационных взаимодействиях с атомами кислорода соседнего медьсодержащего фрагмента.
Структура глобулярного типа включает один двенадцатизвенный лиганд сложной формы, четыре атома меди и четыре атома щелочных металлов. Изменение формы каркаса металлосилоксана данного типа происходит при варьировании природы щелочного металла или его замене на какой-либо переходный металл. Мы показали, что замена атома натрия на атомы лития приводит к сокращению межатомного расстояния между противолежащими атомами меди и атомами кислорода двух линейных взаимно перпендикулярных металлосодержащих фрагмента. Таким образом, металлосилоксановый фрагмент приобретает форму двояковогнутой линзы. Замена натрия на калий, наоборот, приводит к форме двояковыпуклой линзы [7].
Все ранее изученные реакции металлообмена находятся в рамках традиционных представлений химии металлосилоксанов – замещение атома щелочного металла в группировке SiOM обменной реакцией с соответствующим галогенидом металла MHal2.
Цель настоящей работы – изучение возможностей металлообмена с участием ацетилацетонатов металлов и изучение влияния хелатных органических лигандов на строение каркасных металлосилоксанов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез проводили на воздухе. Бутанол, ТГФ, диоксан, толуол, пиридин, этанол абс. и хлороформ очищали по стандартным методикам [22]. Ацетилацетонаты калия и кобальта получали из коммерческих источников (ACRUS), использовали без дополнительной очистки. Медьфенилсилоксан, никельфенилсилоксан и медьнатрийфенилсилоксан получали по методикам [23, 24].
Реакция [PhSiO2]6Cu6[PhSiO2]6 с K(Аcac). 3.75 г (19.27 ммоль) К(Асас) ⋅ 3Н2О растворяли в 50 мл абсолютированного этанола и добавляли 3.88 г (1.62 ммоль) каркасного медьфенилсилоксана [PhSiO2]6Cu6[PhSiO2]6. Через неделю выпадал кристаллический осадок сине-фиолетового цвета с вкраплениями бирюзовых кристаллов соединения I. Кристаллы соединения I, пригодные для РСА, отделяли от осадка механически. Оставшийся осадок отфильтровывали, промывали этанолом от остатков ацетилацетоната калия и хлороформом от ацетилацетоната меди и сушили на воздухе до постоянного веса. Перекристаллизацией осадка из бутанола получено 2.50 г сине-фиолетового кристаллического медькалийфенилсилоксана (70.5%).
| Найдено, %: | Si 14.28; | Cu 12.30; | K 8.78 (соотношение Si : Cu : K = 3.0 : 1.15 : 1.30). |
| Для {[PhSiO2]6}2Cu4K4 | |||
| вычислено, %: | Si 16.34; | Cu 12.38; | K 7.61 (соотношение Si : Cu : K = 3 : 1 : 1). |
Реакция [PhSiO2]6Ni6[PhSiO2]6 с К(Асас). 2.43г K(Аcаc) ⋅ Н2О (15.76 ммоль) растворяли в 60 мл абсолютированного этилового спирта и к полученному раствору добавляли 3.21 г (1.31 ммоль) никельфенилсилоксана [PhSiO2]6Ni6[PhSiO2]6. Смесь перемешивали сутки, затем приливали 30 мл толуола. Через 8 сут реакционную массу отфильтровывали от смешанного ацетилацетоната никеля и калия. Из частично упаренного фильтрата выделили желто-зеленые кристаллы, перекристаллизацией которых из бутанола получили желтые кристаллы соединения II. Выход 0.65 г (16.6%). Найдено, %: Si 11.28; Ni 11.9; K 2.6 (соотношение Si : Ni : K = 12.0 : 6.06 : 1.99).
При упаривании досуха оставшегося маточного раствора (этанол–толуол (2 : 1)) получили 3.02 г (81.2%) полимерного металлосилоксана желтого цвета. Найдено, %: Si 11.90; Ni 2.35; K 14.45 (соотношение Si : Ni : K = 12.0 : 1.13 : 10.50).
Реакция [PhSiO2]12Cu4Na4 с Co(Аcac)2 · 2C2H5OH. К суспензии 1.08 г (0.5 ммоль) [PhSiO2]12Cu4Na4 в 20 мл ТГФ добавляли раствор 0.7 г (2 ммоль) Co(Аcac)2 ⋅ 2C2H5OH в 20 мл ТГФ. Смесь перемешивали 2 ч при комнатной температуре и затем кипятили 1 ч с обратным холодильником. Осадок розового цвета отфильтровывали, промывали хлороформом, а фильтрат упаривали. Получили 0.8 г (75%) сине-сиреневой смолы. Найдено, %: Si 11.13; Сu 8.4; Co 4.25; Na 1.25 (соотношение Si : Cu : Co : Na = 12.0 : 4.0 : 2.17 : 1.64). Из раствора смолы в смеси диоксан–пиридин (соотношение 4 : 1) выделено незначительное количество кристаллов соединения III.
Триметилсилилирование металлоорганосилоксанов проводили по известной методике [25].
РСА. Кристаллы соединения I выделены из раствора в этаноле, соединения II выращены перекристаллизацией из бутанола, а соединения III – из смеси диоксан–пиридин (4 : 1). Структуры расшифрованы прямым методом и уточнены МНК в анизотропном полноматричном приближении по $F_{{hkl}}^{2}.$ В структуре I один из атомов калия (K(1)), большая часть фенильных заместителей при атомах кремния, а также координационных молекул этанола разупорядочены. Для уточнения этих фрагментов использованы ограничения, накладываемые на их геометрию, в частности длины связей (инструкции DFIX и AFIX 66). При этом некоторые молекулы этанола разупорядочены вокруг кристаллографического центра инверсии. Уточнение последних представляло определенные сложности и поэтому для обеспечения стабильности МНК их геометрия была задана как жесткий фрагмент с половинной заселенностью (геометрия и изотропные факторы смещения зафиксированы). В структуре III также было выявлено разупорядочение части фенильных заместителей и координационных молекул пиридина (уточнение проведено аналогично структуре I). Кроме этого, один из атомов кобальта (Co(4)) и его координационного окружения также разупорядочены в соотношении 2 : 3. Атомы водорода рассчитаны исходя из геометрических соображений и включены в уточнение с фиксированными расстояниями C–H и O–H и с наложением ограничений на их эквивалентные параметры смещений. Для ряда координированных молекул этанола и бутанола позиции атомов водорода гидроксильных групп ни выявить, ни рассчитать не удалось. По-видимому, наличие разупорядочения большого числа молекулярных фрагментов было причиной слабой интенсивности дифракционной картины при углах 2θ° > 40° и не позволило достичь низких величин параметров расходимости для соединений I и II.
Все расчеты проведены с использованием программ SHELXL [26] и OLEX2 [27]. Основные кристаллографические данные и параметры уточнения структур I–III представлены в табл. 1.
Таблица 1.
Основные кристаллографические данные и параметры уточнения структур I, II и III
| Параметр | Значение | ||
|---|---|---|---|
| I | II | III | |
| Брутто-формула | C139.32H147.62O36.32Si12K2Cu6 | C125.34H187.34O44.67Si12K4Ni6 | C107.49H103.28N3O32Si1Сo4Cu42 |
| Дифрактометр | Bruker Smart 1000 | Bruker Smart 1000 | Bruker APEX II |
| Излучение (λ, Å) | MoKα (0.71073) | ||
| М | 3199.67 | 3222.26 | 2776.99 |
| T, K | 100 | 120 | 100 |
| Пр. гр. | P1 | P21/n | P21/c |
| Z | 1 | 2 | 4 |
| a, Å | 14.6266(11) | 17.1989(8) | 28.547(2) |
| b, Å | 14.8467(12) | 16.8936(8) | 16.1174(12) |
| c, Å | 17.3370(12) | 27.5106(13) | 29.771(2) |
| α, град | 93.146(2) | 90 | 90 |
| β, град | 97.1640(10) | 97.4130(10) | 103.698(2) |
| γ, град | 96.785(2) | 90 | 90 |
| V, Å3 | 3700.0(5) | 7926.4(6) | 135t308.1(17) |
| ρ(выч.), г см–3 | 1.436 | 1.350 | 1.386 |
| μ, см–1 | 10.75 | 9.21 | 12.89 |
| F(000) | 1654 | 3385 | 5671 |
| 2θmax, град | 52.04 | 52.04 | 52.04 |
| Число измеренных отражений | 16 621 | 46 169 | 118 263 |
| Число независимых отражений | 14 187 | 15 540 | 26 220 |
| Число отражений с I > 2σ(I) | 10271 | 8239 | 12 650 |
| Количество уточняемых параметров | 853 | 549 | 1179 |
| R1 (I > 2σ(I)) | 0.0525 | 0.1044 | 0.0929 |
| wR2 | 0.1589 | 0.3333 | 0.2753 |
| GOOF | 1.039 | 0.949 | 1.060 |
| Остаточная электронная плотность (max/min), e Å–3 | 1.436/–0.939 | 1.76/–2.09 | 1.237/–2.129 |
Координаты атомов и другие параметры соединений I–III депонированы в Кембриджском банке структурных данных (№ 1974285–1974287 соответственно; deposit@ccdc.cam.ac.uk или https:// www.ccdc.cam.ac.uk).
Спектры ЯМР 1Н регистрировали на спектрометре “Bruker Avance TM 400 МГц” (Германия) с рабочей частотой для 1Н 400.13 МГц. Использовали растворы в CDCl3, ацетоне-d6, хим. сдвиги измеряли относительно ТМС, спектры снимали при Т = 298 К.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Известно, что при взаимодействии каркасных металлосилоксанов с ацетилацетоном глубина протекания реакции определяется сравнительной устойчивостью ацетилацетонатных комплексов и металлосилоксанов [28]. Так, в случае медьфенилсилоксана [PhSiO2]6Cu6[PhSiO2]6 (МФС) расщепление идет практически с количественным выходом гексафенилгексагидроксициклогексасилоксана [PhSiO(OH)]6 (“гексол”), а в случае аналогичного марганецсилоксана только в присутствии большого избытка ацетилацетона удается выделить незначительное количество силоксанола. При этом имеет место обратная реакция – при взаимодействии гексола с ацетилацетонатом марганца образуется известный каркасный марганецфенилсилоксан. Мы предположили, что в системах металлосилоксан–ацетилацетонат металла возможен обмен между силоксанолятными и ацетилацетонатными лигандами, причем направление лигандного обмена будет определяться соотношением констант устойчивости исходных и образующихся металлокомплексов. Благоприятные условия для лигандного обмена возникают в случае, если для металла, входящего в состав металлоорганосилоксана, более устойчивым является его ацетилацетонатный комплекс. Устойчивость ацетилацетонатных комплексов М(Асас)2 варьируется в широких пределах (показатели lgK1 для Cu, Ni и Co(II) составляет 11.85, 9.70 и 7.81 соответственно, для калия lgβ 2.1) [29].
Предполагалось, что в ходе реакции каркасных металлофенилсилоксанов с ацетилацетонатами натрия или калия будет происходить полное замещение атомов переходного металла в составе металлосилоксана на атомы щелочного металла ацетилацетонатного комплекса, что приведет к образованию фенилсиланолятов натрия и калия по схеме:
Исходя из этого основными объектами исследования были выбраны системы медь- и никельфенилсилоксаны сэндвичевой структуры – ацетилацетонат калия, а также (медь, натрий)фенилсилоксан седловидной структуры – ацетилацетонат кобальта(II).
Для системы медьфенилсилоксан–ацетилацетонат калия было установлено, что при соотношении МФС : K(Асас) = 1 : 12 основным продуктом реакции является уже известный медькалийфенилсилоксан сэндвичевой структуры [PhSiO2]6K4Cu4[PhSiO2]6 [28], т.е. в действительности реакция проходит по следующей схеме:
Наряду с этим соединением в незначительном количестве были обнаружены кристаллы бирюзового цвета. Исследование их методом РСА показало, что соединение отвечает формуле {[PhSiO2]6}2Cu6K2(Аcac)2 (соединение I).
Структуру соединения I (рис. 1) можно описать как сэндвичевый комплекс, однако в нем отсутствует замкнутый металлоксидный пояс. Вместо этого в I присутствуют два металлоксидных фрагмента, содержащих три атома меди каждый. В каждом из этих фрагментов концевые атомы меди связаны с ацетилацетонатным лигандом. Межатомное расстояние Cu…Cu в данных фрагментах составляет в среднем 2.93 Å. Внутри комплекса локализованы два атома кислорода, которые отвечают координированным молекулам воды, на что указывает сокращенное расстояние O(7)…O(7) (–x, –y, –z) (1.874(4) Å). Атомы водорода данных молекул воды не были выявлены. Основные длины связей соединения I приведены в табл. 2.
Рис. 1.
Вид “сбоку” (а) и “сверху” (б) металлосилоксаного фрагмента комплекса I. Атомы водорода и фенильные группы при атомах кремния не показаны. Операция симметрии: (A) 2 – x, 2 – y, –z.
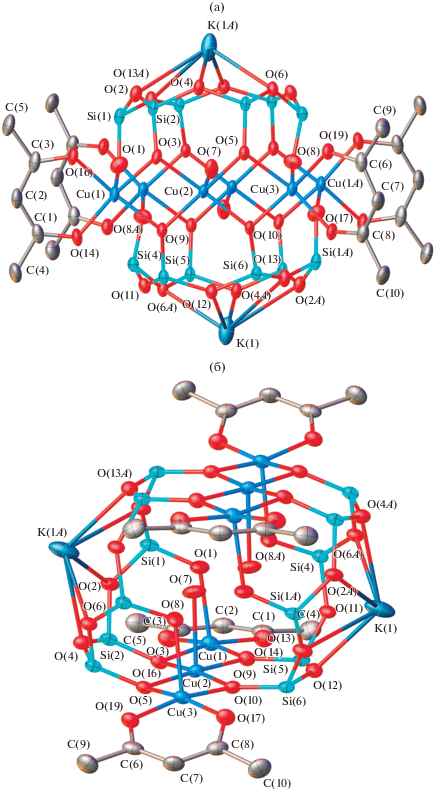
Таблица 2.
Основные длины связей в структуре I
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| Cu(1)–O(1) | 2.282(3) | Cu(2)–O(9) | 1.946(3) |
| Cu(1)–O(3) | 1.991(3) | Cu(2)–O(10) | 1.933(3) |
| Cu(1)–O(9) | 1.960(3) | Cu(3)–O(5) | 1.987(3) |
| Cu(1)–O(14) | 1.912(3) | Cu(3)–O(8) | 2.307(3) |
| Cu(1)–O(16) | 1.907(3) | Cu(3)–O(10) | 1.953(3) |
| Cu(2)–O(3) | 1.936(3) | Cu(3)–O(17) | 1.915(3) |
| Cu(2)–O(5) | 1.959(3) | Cu(3)–O(19) | 1.915(3) |
| Cu(2)–O(7) | 2.388(6) | K–O (средн.) | 2.960(10) |
При взаимодействии никельфенилсилоксана с ацетилацетонатом калия в тех же соотношениях основным продуктом реакции (81%) является полимер с соотношением Si : Ni : K = 12 : 1.1 : 10.5. Для изучения структуры полимера, полученного при взаимодействии никельфенилсилоксана с ацетилацетонатом калия, использовали метод деструктивного триметилсилилирования в сочетании со спектроскопией ЯМР 1Н.
Известно, что при взаимодействии триметилхлорсилана с металлоорганосилоксанами в присутствии пиридина происходит расщепление связей Si–O–M и образование соответствующих триметилсилильных производных с сохранением скелета силоксановых фрагментов металлоорганосилоксана [25]. Для металлосилоксана сэндвичевой структуры эта реакция описывается следующей сх-емой:
На рис. 2 представлен спектр ЯМР 1Н продукта, полученного при триметилсилилировании полимера. Для сравнения на рис. 3 приведен спектр модельного гексафенилгекса(триметилсилокси)циклогексасилоксана, образующегося при триметилсилилировании исходного никельфенилсилоксана сэндвичевой структуры.
Рис. 2.
ЯМР 1Н спектр продукта триметилсилилирования полимера, полученного при взаимодействии никельфенилсилоксана сэндвичевой структуры с ацетилацетонатом калия.
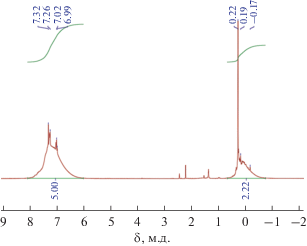
Рис. 3.
ЯМР 1Н спектр гексафенил(гексатриметилсилокси)циклогексасилоксана, полученного при триметилсилилировании никельфенилсилоксана сэндвичевой структуры.
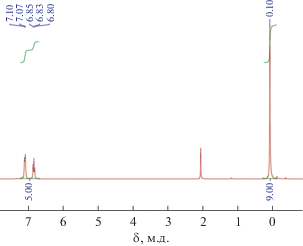
В случае полимера в спектре ЯМР 1Н видны широкие сигналы в областях протонов метильных групп при кремнии и протонов фенильного заместителя; т.е. при образовании полимера происходит существенная перестройка силоксанового каркаса.
Наряду с полимером был выделен кристаллический продукт (выход 16.6%) с соотношением Si : : Ni : K = 12 : 6.06 : 1.99. Данные РСА свидетельствуют о том, что в кристаллической массе присутствует соединение II, содержащее хелатные лиганды и четыре атома калия.
Металлосилоксановый каркас соединения II (рис. 4) занимает кристаллографический центр инверсии и в целом отвечает структуре “скошенного сэндвича”, подобно ранее изученным никель- и кадмийсилоксанам. Внутри металлосилоксанового каркаса локализованы два атома кислорода, соответствующие гидроксильным группам. Два атома калия (K(1) и K(1A)) координированы силоксанолятными атомами кислорода, тогда как остальные два (K(3) и K(3A)) связаны с атомами кислорода силоксановых циклов.
Рис. 4.
Вид “сбоку” (а) и “сверху” (б) металлосилоксаного фрагмента комплекса II. Атомы водорода и фенильные группы при атомах кремния не показаны. Операция симметрии: (A) 2 – x, 2 – y, –z.
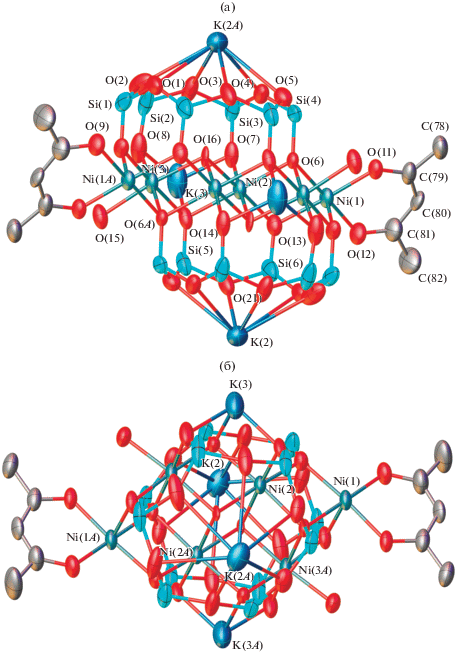
Координационный полиэдр большинства атомов никеля отвечает искаженному октаэдру. Атомы Ni(2) и Ni(2A) координированы только силоксанолятными лигандами [PhSiO2]6 и внутрикаркасными гидроксил-анионами. В свою очередь, атомы Ni(3) и Ni(3A) образуют с вышеупомянутыми фрагментами только пять связей, шестая связь в октаэдре образована за счет координации с молекулами бутанола. Ацетилацетонатные лиганды связаны с атомами Ni(1) и Ni(1A), остальные связи образованы за счет координации с молекулами бутанола и силоксанолятными лигандами [PhSiO2]6. Внутрикаркасная гидроксильная группа (O(16)) связана с тремя атомами никеля, при этом длины связей Ni(3)–O(16), Ni(2)–O(16) и Ni(2A)–O(16) варьируются в интервале 2.09–2.15 Å, что близко к значениям для ранее описанных никельсилоксанов этого типа.
Межатомные расстояния Ni…Ni в II варьируются в довольно широком интервале (3.075–3.145 Å). При этом расстояния Ni(1)…Ni(2) и Ni…Ni(3A) с участием атома Ni(1), связанного с ацетилацетонатным лигандов заметно короче (3.075 Å), чем в случае атомов никеля, не связанных с ними. Основные длины связей и валентные углы соединения II приведены в табл. 3.
Таблица 3.
Основные длины связей и валентные углы в структуре II
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| Ni(1)–O(6) | 2.127(4) | Ni(2)–O(16) | 2.100(4) |
| Ni(1)–O(11) | 2.020(4) | Ni(2)–O(16A) | 2.145(4) |
| Ni(1)–O(12) | 2.010(5) | Ni(3)–O(15) | 2.111(5) |
| Ni(1)–O(10) | 2.093(4) | Ni(3)–O(6A) | 2.136(4) |
| Ni(1)–O(13) | 2.057(4) | Ni(3)–O(9A) | 2.041(4) |
| Ni(1)–O(9A) | 2.037(4) | Ni(3)–O(16) | 2.093(3) |
| Ni(2)–O(6) | 2.145(4) | Ni(3)–O(8) | 2.092(5) |
| Ni(2)–O(7) | 2.078(4) | Ni(3)–O(9) | 2.032(4) |
| Ni(2)–O(13) | 2.038(5) | Ni(3)–O(14) | 2.098(4) |
| Ni(2)–O(14) | 2.133(4) | K-O) (средн.) | 2.773(8) |
| Угол | ω, град | Угол | ω, град |
| O(11)Ni(1)O(12) | 89.9(2) | O(11)Ni(1)O(13) | 175.7(2) |
| Ni(2)O(16)Ni(3) | 97.3(2) | O(12)Ni(1)O(6) | 179.5(2) |
| Ni(2)O(16)Ni(2A) | 98.98(14) | O(15)Ni(3)O(16A) | 170.5(2) |
Достаточно необычный результат получен при взаимодействии ацетилацетоната кобальта с медьнатрийфенилсилоксаном глобулярной структуры. Анализ образовавшегося при этом полимера показал, что он содержит все три металла (соотношение Si : Cu : Co : Na = 12 : 4 : 2.17 : 1.64). Как и в случае никельсилоксана, в ходе реакции происходит перестройка силоксанового скелета молекулы, о чем свидетельствует вид спектра ЯМР 1Н продукта триметилсилилирования полимера (рис. 5). Для сравнения приведен спектр додекафенил(додекатриметилсилокси)циклододекасилоксана, полученного триметилсилилированием исходного медьнатрийфенилсилоксана глобулярной структуры (рис. 6). Однако из раствора этого полимера в смеси диоксан–пиридин (4 : 1) было выделено в незначительном количестве соединение III, отвечающее, по данным РСА, формуле [PhSiO2]12Cu4Co4(Аcac)4 (рис. 7). В данном случае имеет место замещение натрия группировкой –Со(Асас).
Рис. 5.
ЯМР 1Н спектр продукта триметилсилилирования полимера, полученного при взаимодействии медьнатрийфенилсилоксана глобулярной структуры с ацетилацетонатом кобальта.
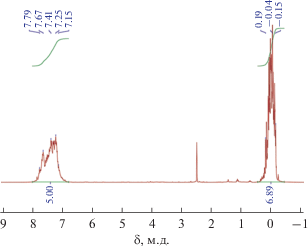
Рис. 6.
ЯМР 1Н спектр додекафенил(додекатриметилсилокси)циклододекасилоксана, полученного триметилсилилированием исходного медьнатрийфенилсилоксана глобулярной структуры.
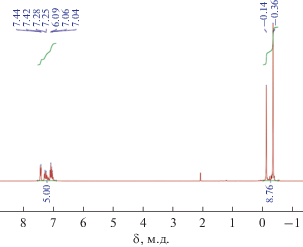
Рис. 7.
Вид “сверху” (а) и “сбоку” (б) металлосилоксаного фрагмента комплекса III. Атомы водорода, часть координационных молекул пиридина и фенильные группы при атомах кремния не показаны. Один из фрагментов Co(Acac) разупорядочен, соответствующие позиции, имеющие обозначение (Y), показаны пунктиром.
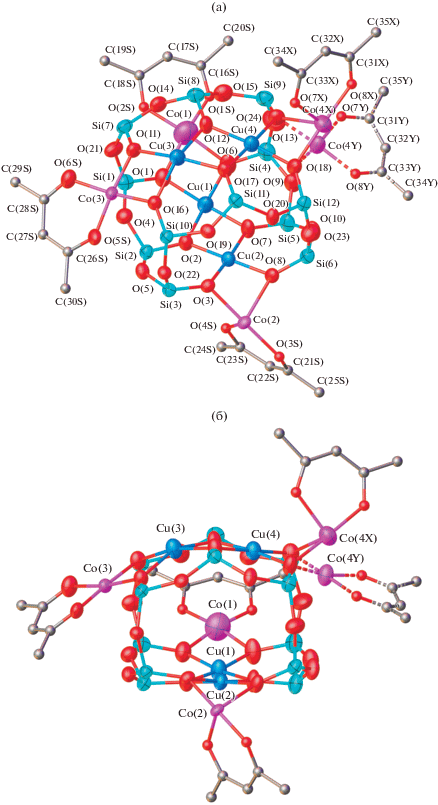
Структура соединения III содержит четыре атома меди и четыре атома кобальта, связанных с четырьмя ацетилацетонатными лигандами (рис. 7). Таким образом, данное соединение является первым примером металлосилоксанов со структурой типа “седла”, содержащих восемь атомов переходного металла различной природы. Следует отметить, что единственным примером металлосилоксанов, содержащих переходные металлы разных типов, являются сэндвичевые комплексы двухвалентных железа и никеля [30, 31]. Ранее было показано [32], что в случае октаядерных металлосилоксанов со связью Cu–Hal образуются два типа структур, имеющие форму “двояковыпуклой” и “двояковогнутой” линз (расстояния между атомами меди и противолежащими им атомами кислорода, соответственно, больше 3.5 Å и меньше 2.8 Å). В кристалле наблюдается их суперпозиция. В случае структуры III, несмотря на наличие разупорядочения атома кобальта (Co(4)), можно утверждать, что образования двух типов структур не происходит и образовавшийся металлосилоксан имеет форму только “двояковыпуклой линзы” (межатомные расстояния Cu(1)…O(12) и Cu(2)…O(17) равны 4.957(5) и 5.080(5) Å).
Межатомные расстояния Cu(1)…Cu(2) и Cu(3)…Cu(4) составляют 2.9585(11) и 3.0029(13) Å. Расстояния между медью и кобальтом меняются в достаточно широких пределах 2.84–2.98 Å. Это свидетельствует о том, что между переходными металлами возможно наличие обменного взаимодействия с участием мостиковых атомов кислорода силоксанолятных лигандов. Основные длины связей и валентные углы соединения III приведены в табл. 4.
Таблица 4.
Основные длины связей и валентные углы в структуре III
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| Co(1)–O(1) | 2.035(5) | Cu(1)–O(6) | 1.943(5) |
| Co(1)–O(6) | 2.035(5) | Cu(3)–O(11) | 2.031(4) |
| Co(1)–O(1S) | 1.823(5) | Cu(3)–O(12) | 1.987(5) |
| Co(1)–O(2S) | 1.935(6) | Cu(3)–O(16) | 2.004(4) |
| Co(2)–O(3) | 2.016(4) | Cu(3)–O(17) | 2.018(4) |
| Co(2)–O(8) | 2.199(4) | Cu(4)–O(12) | 1.946(4) |
| Co(2)–O(3S) | 1.922(4) | Cu(4)–O(13) | 1.950(4) |
| Co(2)–O(4S) | 1.952(5) | Cu(4)–O(17) | 1.970(4) |
| Co(3)–O(11) | 1.952(4) | Cu(4)–O(18) | 1.905(5) |
| Co(3)–O(16) | 1.943(4) | Co(4Y)–O(13) | 1.919(5) |
| Co(3)–O(5S) | 1.902(5) | Co(4Y)–O(18) | 1.991(5) |
| Co(3)–O(6S) | 1.917(5) | Co(4Y)–O(7Y) | 1.943(6) |
| Co(4X)–O(18) | 2.011(5) | Co(4Y)–O(8Y) | 1.860(5) |
| Co(4X)–O(8X) | 1.906(7) | Cu(1)–O(7) | 1.971(4) |
| Co(4X)–O(7X) | 2.067(8) | Cu(2)–O(2) | 1.955(4) |
| Co(4X)–N(4) | 2.014(8) | Cu(2)–O(3) | 1.939(4) |
| Cu(1)–O(1) | 1.971(5) | Cu(2)–O(7) | 1.937(4) |
| Cu(1)–O(2) | 1.960(4) | Cu(2)–O(8) | 1.938(4) |
| Угол | ω, град | Угол | ω, град |
| CoOCu (средн.) | 93.2(2) | CuOCu (средн.) | 98.7(2) |
Таким образом установлено, что при взаимодействии ацетилацетоната калия с каркасными медь- и никельфенилсилоксанами происходит замещение переходного металла калием. Структура образующихся соединений определяется природой переходного металла. В случае медьнатрийфенилсилоксана седловидной структуры возможно замещение атомов натрия на кобальт с ацетилацетонатным лигандом.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Талисманов С.С., Еременко И.Л. // Успехи химии. 2003. Т. 72. С. 627 (Talismanov S.S., Eremenko I.L. // Russ. Chem. Rev. 2003. V. 72. P. 555). https://doi.org/10.1070/RC2003v072n07ABEH000810
Katsoulis D.E. // Chem. Rev. 1998. V. 98. P. 359. https://doi.org/10.1021/cr960398a
Кискин М.А., Еременко И.Л. // Успехи химии. 2006. Т. 75. С. 627 (Kiskin M.A., Eremenko I.L. // Russ. Chem. Rev. 2006. V. 75. P. 559). https://doi.org/10.1070/RC2006v075n07ABEH003636
Levitsky M.M., Bilyachenko A.N. // Coord. Chem. Rev. 2016. V. 306. Pt 1. P. 35. https://doi.org/10.1016/j.ccr.2015.07.007
Левицкий М.М., Завин Б.Г., Биляченко А.Н. // Успехи химии. 2007. Т. 76. С. 907 (Levitsky M.M., Zavin B.G., Bilyachenko A.N. // Russ. Chem. Rev. 2007. V. 76. P. 847). https://doi.org/10.1070/RC2007v076n09ABEH003691
Сергиенко Н.В., Черкун Н.В., Корлюков А.А. и др. // Изв. АН. Сер. хим. 2013. № 9. С. 1999 (Sergienko N.V., Cherkun N.V., Korlyukov A.A. et al. // Russ. Chem. Bull. 2013. V. 62. № 9. P. 1999). https://doi.org/10.1007/s11172-013-0290-z
Сергиенко Н.В., Корлюков А.А, Мякушев В.Д. и др. // Изв. АН. Сер. хим. 2009. № 11. С. 2190 (Sergienko N.V., Korlyukov A.A., Myakushev V.D. et al. // Russ. Chem. Bull. 2009. № 11. P. 2258). https://doi.org/10.1007/s11172-009-0315-9
Korlyukov A.A., Vologzhanina A.V., Buzin M.I. et al. // Cryst. Growth Des. 2016. V. 16. P. 1968. https://doi.org/10.1021/acs.cgd.5b01554
Cornia A., Fabretti A.C., Gatteschi D. et al. // Inorg. Chem. 1995. V. 34. № 21. P. 5383. https://doi.org/10.1021/ic00125a045
Левицкий М.М., Бучаченко А.Л. // Изв. АН. Сер. хим. 1997. № 8. С. 1432 (Levitskii M.M., Buchachenko A.L. // Russ. Chem. Bull. 1997. V. 46. № 8. P. 1367).
Pashchenko V., Lang M., Wolf B. et al. // Comptes Rendus Chimie. 2007. № 10. P. 89. https://doi.org/10.1016/j.crci.2006.06.012
Bilyachenko A.N., Yalymov A.I., Levitsky M.M. et al. // Dalton Trans. 2016. V. 45. P. 13663. https://doi.org/10.1039/C6DT00113K
Bilyachenko A.N., Yalymov A.I., Shul’pina L.S. et al. // Molecules. 2016. V. 21. № 5. P. 665. https://doi.org/10.3390/molecules21050665
Bilyachenko A.N., Dronova. M.S., Yalymov A.I. et al. // Chem. Eur. J. 2015. V. 21. № 24. P. 8758. https://doi.org/10.1002/chem.201500791
Kononevich Yu.N., Anisimov A.A., Korlyukov A.A. et al. // Mendeleev Commun. 2017. V. 27. № 4. P. 332. https://doi.org/10.1016/j.mencom.2017.07.002
Игонин В.A., Линдеман С.В., Потехин K.A. и др. // Металлоорган. химия. 1991. Т. 4. № 4. С. 790.
Levitskii M.M., Shchegolikhina O.I.; Zhdanov A.A. et al. // J. Organomet. Chem. 1991. V. 401. № 1–2. P. 199.
Sergienko N.V., Korlyukov A.A., Arkhipov D.E. et al. // Mendeleev Commun. 2016. V. 26. № 4. P. 344. https://doi.org/10.1016/j.mencom.2016.07.026
Биляченко А.Н., Корлюков А.А., Левицкий М.М. и др. // Изв. АН. Сер. хим. 2008. № 10. С. 2162. (Bilyachenko A.N., Korlyukov A.A., Levitskii M.M. et al. // Russ. Chem. Bull . 2008. V. 57. № 10. P. 2204). https://doi.org/10.1007/s11172-008-0302-6
Pashchenko V., Brendel B., Wolf B. et al. // Eur. J. Inorg. Chem. 2005. V. 22. P. 4617. https://doi.org/10.1002/ejic.200500538
Mortalò C., Caneschi A., Cornia A. et al. // J. Cluster Sci. 2007. V. 18. № 1. P. 217. https://doi.org/10.1007/s10876-006-0099-0
Armarego W.L.F., Chai C.L.L. Purification of Laboratory Chemicals, 5th ed., Butterworth-Heinemann, 2003. 609 p.
Жданов А.А., Щеголихина О.И., Молодцова Ю.А. // Изв. АН. Сер. хим. 1993. № 5. С. 957.
Жданов А.А., Сергиенко Н.В., Транкина Е.С. // Росс. хим. журн. 2001. Т. 45. № 4. С. 44.
Благодатских И.В., Щеголихина О.И., Позднякова Ю.А. и др. // Изв. АН. Сер. хим. 1994. № 6. С. 1057 (Blagodatskikh I.V., Shchegolikhina O.I., Pozdnjakova Yu.A. et al. // Russ. Chem. Bull. 1994. V. 43. № 6. P. 994).
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3. https://doi.org/10.1107/S2053229614024218
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. V. 42. P. 339. https://doi.org/10.1107/S0021889808042726
Сергиенко Н.В., Черкун Н.В., Мякушев В.Д. и др. // Изв. АН. Сер. хим. 2010. № 7. С. 1340 (Sergienko N.V., Cherkun N.V., Myakushev V.D. et al. // Russ. Chem. Bull. V. 59. № 7. P. 1369). https://doi.org/10.1007/s11172-010-0248-3
Пешкова В.М., Мельчакова Н.В. β-Дикетоны. М.: Наука, 1986. 200 с.
Molodtsova Y.A., Pozdniakova Y.A., Lyssenko K.A. et al. // J. Organomet. Chem. 1998. V. 571. P. 31.
Cornia A., Fabretti A.C., Gavioli G. et al. // J. Cluster Sci.1998. V. 9. № 3. P. 295.
Сергиенко Н.В., Транкина Е.С., Павлов В.А. и др. // Изв. АН. Сер. хим. 2004. № 2. С. 337. (Sergienko N.V., Trankina E.S., Pavlov V.I. et al. // Russ. Chem. Bull. 2004. V. 53. № 2. P. 351.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия