Координационная химия, 2021, T. 47, № 6, стр. 373-380
Синтез и строение комплексов Zn(II) с анионами циклобутан-1,1-дикарбоновой кислоты и катионами кальция и бария
Е. Н. Зорина-Тихонова 1, *, А. С. Чистяков 1, М. А. Кискин 1, А. В. Вологжанина 2, А. А. Сидоров 1, И. Л. Еременко 1, 2
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
2 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
Москва, Россия
* E-mail: ezorinatikhonova@gmail.com
Поступила в редакцию 15.01.2021
После доработки 20.01.2021
Принята к публикации 21.01.2021
Аннотация
Получены новые соединения цинка(II) с анионами циклобутан-1,1-дикарбоновой кислоты (H2Сbdc) и катионами кальция [CaZn(Сbdc)2(H2O)3]n (I) и бария [BaZn(Сbdc)2(H2O)2]n (II). По данным РСА (CIF files CCDC № 2055176 (I), 2055177 (II)), соединения I и II представляют собой координационные полимеры, в которых атомы цинка связаны между собой мостиковыми и хелатно-мостиковыми дианионами кислоты в 2D-архитектуры с топологией плоско-квадратной сетки. Атомы щелочноземельных металлов не влияют на размерность упаковки соединений.
Дизайн и синтез координационных полимеров цинка является на сегодняшний день актуальной темой научных исследований [1]. Состав и строение таких соединений определяет их физико-химические свойства и возможность практического использования для сорбции и разделения газов, органических и неорганических субстратов [2–5], гетерогенного катализа [6, 7], при разработке люминесцентных материалов и сенсоров на их основе [8–10]. Строение полимеров цинка может быть изменено постсинтетически, например при воздействии на кристаллы УФ-излучения, в результате чего наблюдается протекание твердофазной реакции [2 + 2]-циклоприсоединения [11–13]. Синтез гетерометаллических координационных полимеров, сочетающих в своем составе атомы цинка с атомами других переходных металлов или s-элементов, расширяет структурное разнообразие полимеров и позволяет направленно синтезировать соединения с заданными свойствами, например люминесцентными [14, 15] или магнитными [16, 17]. В качестве способа получения гетерометаллических полимеров может быть использован как классический метод синтеза из простых солей, так и постадийный синтез из низкомолекулярных исходных комплексов [15, 18–20]. Анионы дикарбоновых кислот различной природы широко используются в качестве лигандов для построения координационных полимеров различной размерности [1, 20, 21]. Природа используемых дикарбоновых кислот – основополагающий фактор, определяющий строение полимера. Например, для анионов терефталевой кислоты, как правило, характерен мостиковый тип координации, что способствует образованию каркасных полимеров [1, 22, 23]. Использование же более конформационно подвижных лигандов, в частности анионов малоновой кислоты и ее замещенных аналогов, открывает дополнительные возможности координации и увеличивает структурное разнообразие получаемых полимеров [21, 24, 25]. Для малонатных гетерометаллических систем M–M', где М – атом 3d-металла, M' – щелочного или щелочноземельного элемента, в целом типичным является формирование координационных полимеров, в которых атомы 3d-металла формируют бисхелатный дианионный фрагмент {M(R1R2Мal)2(H2O)x}2– (x = 0–2), а катионы непереходных металлов связывают такие фрагменты между собой за счет координации атомов кислорода карбоксильных групп и молекул воды [18, 21]. Увеличение радиуса катиона s-элемента, как правило, способствует увеличению размерности упаковки полимера [21].
В настоящей работе описаны синтез и строение двух координационных 2D-полимеров цинка с ди-анионами циклобутан-1,1-дикарбоновой кислоты и катионами кальция [CaZn(Сbdc)2(H2O)3]n (I) и бария [BaZn(Сbdc)2(H2O)2]n (II), в которых анионы кислоты проявляют исключительно мостиковую функцию по отношению к атомам цинка. Показано, что для соединений I и II изменение радиуса катиона щелочноземельного элемента не влияет на размерность упаковки полимера.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез всех соединений проводили на воздухе с использованием дистиллированной воды, Zn-SO4 ⋅ 7H2O (Реахим, “ч.”), Ca(OH)2 (Реахим, “ч.”), Ba(OH)2 ⋅ H2O (Sigma Aldrich, 98%), циклобутан-1,1-дикарбоновой кислоты (H2Сbdc, Sigma Aldrich, 99%).
Инфракрасные спектры полученных соединений регистрировали на спектрофотометре Perkin Elmer Spectrum 65, оснащенном приставкой Quest ATR Accessory (Specac), методом нарушенного полного внутреннего отражения (НПВО) в диапазоне 400–4000 см–1. Элементный анализ выполняли на автоматическом C, H, N, S-анализаторе E-uroEA-3000 (EuroVector).
Синтез [CaZn(Сbdc)2(H2O)3]n (I). Навески Ca(OH)2 (0.026 г, 0.35 ммоль) и H2Сbdc (0.050 г, 0.35 ммоль) растворяли в 30 мл воды, добавляли раствор ZnSO4 ⋅ 7H2O (0.049 г, 0.17 ммоль) в 10 мл воды. Реакционную смесь перемешивали в течение часа, фильтровали. Полученный бесцветный раствор выдерживали на воздухе при комнатной температуре. Образовавшиеся через неделю бесцветные кристаллы I, пригодные для РСА, выделяли, промывали холодным ацетонитрилом (Т = = –5°С), сушили на воздухе при Т = 20°С. Выход I 0.036 г (48% в расчете на исходное количество цинка).
ИК-спектр (НПВО; ν, см–1): 3530 ср, 3450 ср, 3414 ср, 3383 ср, 3226 сл, 2999 сл, 2967 сл, 2945 сл, 2872 сл, 2324 сл, 2280 сл, 2162 сл, 2030 сл, 1672 сл, 1634 ср, 1591 с, 1463 ср, 1402 ср, 1342 с, 1264 ср, 1236 ср, 1160 ср, 1123 ср, 1077 сл, 1067 сл, 1012 ср, 955 сл, 928 сл, 909 ср, 858 ср, 799 сл, 764 ср, 709 ср, 656 ср, 642 ср, 592 с, 551 с, 520 с, 494 с, 447 с, 427 ср, 419 ср.
Синтез [BaZn(Сbdc)2(H2O)2]n (II) выполняли по методике, аналогичной для получения I. Количества реагентов: Ba(OH)2 ⋅ H2O (0.132 г, 0.70 ммоль), H2Сbdc (0.101 г, 0.70 ммоль), ZnSO4 ⋅ 7H2O (0.100 г, 0.35 ммоль). Выход II 0.042 г (23% в расчете на исходное количество цинка).
ИК-спектр (НПВО; ν, см–1): 3478 сл, 3883 сл, 2989 сл, 2941 сл, 2899 сл, 2869 сл, 2324 сл, 2284 сл, 2163 сл, 2036 сл, 1979 сл, 1649 ср, 1574 с, 1468 сл, 1394 ср, 1319 с, 1254 ср, 1224 ср, 1156 ср, 1126 ср, 1079 ср, 950 сл, 923 сл, 899 ср, 860 сл, 795 ср, 776 сл, 757 ср, 690 ср, 638 ср, 575 с, 516 с, 469 с, 430 с, 414 ср.
РСА. Монокристаллы I и II взяты из реакционной смеси. Экспериментальный набор отражений получен на дифрактометре Bruker APEX II, оснащенном двухкоординатным CCD детектором (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор). Поглощение учтено эмпирически по программе SADABS [26]. Структуры решены по программе SHELXT [27]. Все неводородные атомы локализованы в разностных синтезах электронной плотности и уточнены в анизотропном приближении по $F_{{hkl}}^{{\text{2}}}$ с помощью программ SHELXL-14 [28] и OLEX2 [29]. Атомы водорода найдены геометрически и уточнены в изотропном приближении в модели жесткого тела, с Uизо(H) = 1.5Uэкв(Xi) для молекул воды, или 1.2Uэкв(Xi) для остальных атомов, где Uэкв(X) – эквивалентный тепловой параметр атома, с которыми связан атом водорода. Кристаллографические характеристики и детали дифракционного эксперимента приведены в табл. 1, основные геометрические характеристики координационных связей – в табл. 2.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур I и II
| Параметр | Значение | |
|---|---|---|
| I | II | |
| М | 443.73 | 522.96 |
| T, K | 150 | 120 |
| Сингония | Ромбическая | |
| Пр. гр. | Pca21 | C2221 |
| Z | 4 | 16 |
| a, Å | 12.497(2) | 17.5620(17) |
| b, Å | 6.9353(13) | 18.8077(17) |
| c, Å | 19.238(4) | 19.8175(19) |
| V, Å3 | 1667.3(6) | 6545.7(11) |
| ρ(выч.), г см–3 | 1.768 | 2.123 |
| μ, см–1 | 1.837 | 3.907 |
| F(000) | 888 | 4064 |
| 2θmax, град | 30.738 | 30.623 |
| Число измеренных отражений | 21 450 | 36 476 |
| Число независимых отражений | 5099 | 9969 |
| Число отражений с I > 2σ(I) | 4371 | 9410 |
| Количество уточняемых параметров | 230 | 439 |
| R1, wR2 (I > 2σ(I)) | 0.0525, 0.1286 | 0.0374, 0.0837 |
| R1, wR2 (по всем данным) | 0.0636, 0.1360 | 0.0403, 0.0852 |
| GOОF | 1.037 | 1.050 |
| Остаточная электронная плотность (min/max), e Å–3 |
–0.852/2.657 | –1.364/3.407 |
| Flack | 0.47(2) | 0.030(7) |
Таблица 2.
Основные геометрические характеристики соединений I и II
| Параметр | I | II |
|---|---|---|
| M = Ca | M = Ba | |
| Связь | d, Å | |
| Zn–O(Сbdc2–) | 1.985(4)–1.997(4) | 1.958(4)–1.985(4) |
| M–O(Сbdc2–) | 2.280(5)–2.403(4) | 2.670(5)–3.047(4) |
| M–O(H2O-κO) | 2.334(5)–2.418(5) | 2.735(5)–2.707(5) |
| Угол | ω, град | |
| OZnO | Zn(1): 95.76(17)–120.94(18) | Zn(1): 91.99(18)–126.1(3) Zn(2): 104.32(19)–118.93(18) Zn(3): 93.3(2)–131.66(18) |
| OMO (хелатный) | 71.66(14) | 67.24(12)–72.03(13) |
| Симметрия окружения атомов M | SQ(P) | |
| M(1) | CaO7: С2v, одношапочная тригональная призма (0.369) | BaO8: D4d, квадратная антипризма (1.125) |
| M(2) | BaO9: C4v, одношапочный куб (3.896) | |
| M(3) | BaO8: D4d, квадратная антипризма (2.973) | |
Координаты атомов, величины тепловых параметров и список всех отражений для исследованных структур депонированы в Кембриджском банке структурных данных (CCDC № 2055176 (I), 2055177 (II)) и могут быть получены по запросу на deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/ structures).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
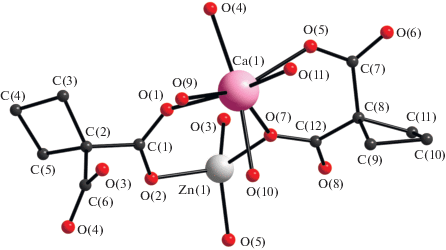
В результате взаимодействия сульфата цинка с циклобутан-1,1-дикарбоновой кислотой и гидроксидом кальция в соотношении 1 : 2 : 2 образуется соединение полимерного строения [CaZn(Сbdc)2- (H2O)3]n (I). Комплекс кристаллизуется в ромбической сингонии, пространственная группа Pca21. Независимая часть ячейки содержит по одному катиону цинка и кальция, два аниона и три молекулы воды. В соединении I атом цинка находится в искаженном тетраэдрическом окружении (хромофор ZnO4), сформированном атомами кислорода четырех разных дианионов циклобутан-1,1-дикарбоновой кислоты (рис. 1а). Дианионы связывают атомы цинка в 2D-полимерную сеть с топологией плоско-квадратной сетки sql.
Рис. 1.
Сетка из атомов цинка в соединении I (а); фрагмент слоя соединения I (б) (атомы водорода и углеводородные заместители дианионов не показаны).
Атомы кальция находятся в шестичленном хелатном цикле, сформированном анионом циклобутан-1,1-дикарбоновой кислоты (2.390(4)–2.403(4) Å) (рис. 1б). Координационное окружение кальция достраивается атомами кислорода до семи (полиэдр – одношапочная тригональная призма, хромофор CaO7, по расчетам программы Shape 2.1, см. табл. 2 [30]) за счет взаимодействия с атомами кислорода двух других дианионов (2.280(5)–2.305(5) Å) и трех атомов кислорода монодентатно-координированных молекул воды (рис. 2).
В соединении I один из двух независимых анионов кислоты (O1/O2/C1–C6/O3/O4) проявляет µ4-тип координации, а второй дианион образует хелатный цикл с атомом кальция {Ca(Сpdc)(H2O)3} и проявляет κ2,µ3-тип координации.
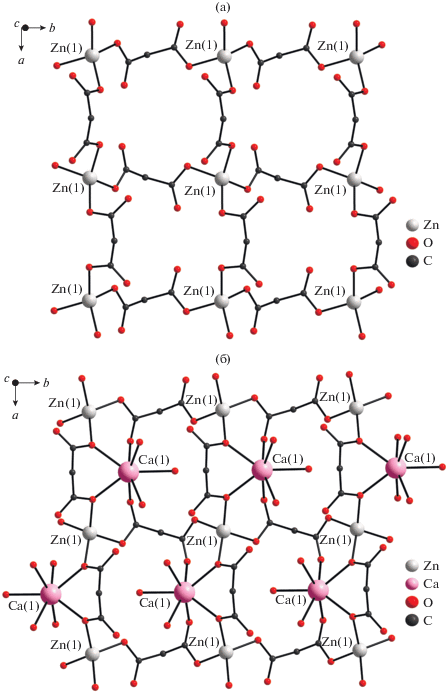
При замене сульфата кальция на сульфат бария в условиях синтеза, аналогичных получению I, образуется соединение полимерного строения [BaZn(Сbdc)2(H2O)2]n (II) (рис. 3). В данном соединении независимая часть ячейки содержит три структурно-неэквивалентных атома цинка, три катиона бария, четыре аниона и четыре молекулы воды, координированных щелочноземельным катионом. Два из трех независимых катионов цинка и два из трех катионов бария находятся на винтовой оси второго порядка. Каждый атом цинка находится в искаженном тетраэдрическом окружении (хромофор ZnO4) четырех атомов кислорода четырех разных мостиковых дианионов (табл. 2, рис. 3а). Как и в случае соединения I, анионы в сочетании с атомами цинка формируют слоистую структуру с топологией плоско-квадратной сетки sql. Структуры координационных полимеров отличаются за счет склонности бария к реализации более высоких координационных чисел, чем у кальция.
Рис. 3.
Сетка из атомов цинка (а); фрагмент слоя соединения II (б) (углеводородные заместители дианионов в (б) и атомы водорода не показаны).
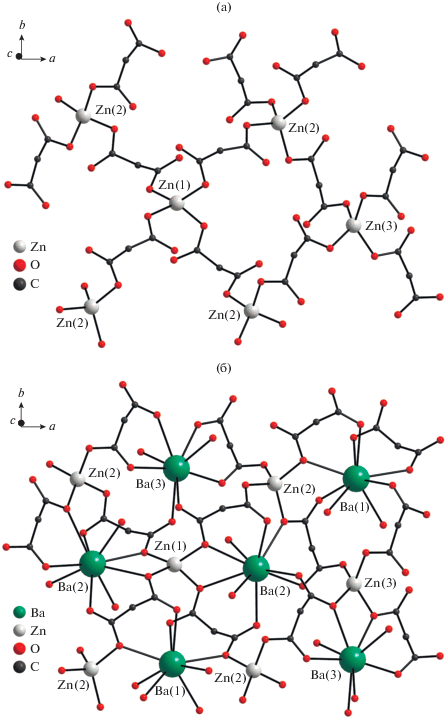
В полимере II присутствуют три структурно-неэквивалентных атома бария. Для Ba(1) и Ba(3) полиэдры соответствуют искаженной квадратной антипризме (хромофор BaO8), для Ba(2) – искаженному одношапочному кубу (хромофор BaO9) (по расчетам программы Shape 2.1, см. табл. 2 [31–33]). Анионы циклопропан-1,1-дикарбоновой кислоты образуют с атомами Ba(1) и Ba(3) бисхелатный фрагмент {Ba(Сpdc)2(H2O)2}2–, а с атомами Ba(2) трисхелатный фрагмент (рис. 3б). В данном соединении все анионы циклопропан-1,1-дикарбоновой кислоты проявляют κ2,µ4-тип координации.
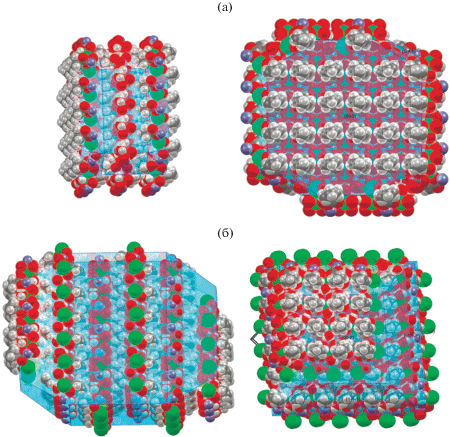
В ранее описанном комплексе цинка-бария с анионами диметилмалоновой кислоты [18] атомы бария связывали фрагменты {Zn(Me2Мal)2(H2O)2}2– в каркасный полимер. В соединении II, как и в случае комплекса I, атомы щелочноземельного элемента не влияют на размерность упаковки соединения, а достраивают слоистую структуру соединения. При этом параллельно расположенные слои перпендикулярны оси с элементарной ячейки и, следовательно, как минимум две из граней монокристалла образованы гидрофобными алкильными группами. На рис. 4 изображена предполагаемая форма кристаллов I и II, рассчитанная методом BFDH (Bravais, Friedel, Donnay, and Harker) Mercury 2020.2.0 [34], как описано в [35]. Она совпадает с реально наблюдаемой формой (пластинки в случае I и призмы в случае II). Это означает, что комплекс I может быть использован для создания материалов с супергидрофобной поверхностью [36].
Рис. 4.
Рассчитанная форма кристаллов соединений I (а) и II (б). Поверхности кристаллов изображены голубым, атомы в представлении ван-дер-ваальсовых сфер (углерод, водород, кислород и катионы цинка и щелочноземельного металла соответственно показаны серым, белым, красным, синим и зеленым). Слева – вид параллельно кристаллографической оси с, справа – перпендикулярно ей.
Таким образом получено два координационных полимера цинка с дианионами циклобутан-1,1-дикарбоновой кислоты и катионами кальция [CaZn(Сbdc)2(H2O)3]n (I) или бария [BaZn(Сbdc)2-(H2O)2]n (II). В данных соединениях анионы в сочетании с атомами цинка формируют слоистую структуру. В структурах полимеров анионы дикарбоновой кислоты образуют шестичленные хелатные циклы с атомами щелочноземельных элементов, тогда как с атомами цинка анионы связываются исключительно как мостиковые лиганды. Состав и строение изученных комплексов отличается в результате различных координационных чисел s‑металлов (CaO7, BaO8/9) и их связывания с анионами дикарбоновой кислоты, но это не влияет на размерность структур и их топологию – плоско-квадратная сетка sql.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Erxleben A. // Coord. Chem. Rev. 2003. V. 246. № 1–2. P. 203.
Lysova A.A., Samsonenko D.G., Kovalenko K.A. et al. // Angew. Chem. Int. Ed. 2020. V. 59. № 46. P. 20561.
Lysova A.A., Samsonenko D.G., Dorovatovskii P.V. et al. // J. Am. Chem. Soc. 2019. V. 141(43). P. 17260.
Adil K., Belmabkhout Y., Pillai R.S. et al. // Chem. Soc. Rev. 2017. V. 46. P. 3402.
Yu J., Xie L.-H., Li J.-R. et al. // Chem. Rev. 2017. V. 117. P. 9674.
Ghorbanloo M., Safarifard V., Morsalis A. // New J. Chem. 2017. V. 41. P. 3957.
Li Z.-H., Xue L.-P., Qin Q.-P. // J. Solid State Chem. 2019. V. 274. P. 81.
Rachuri Y., Parmar B., Bisht K.K. et al. // Cryst. Growth Des. 2017. V. 17. № 3. P. 1363.
Liu J.-Q., Wu J., Li F.-M. et al. // RSC Adv. 2016. V. 6. P. 31161.
Arisi M. // Cryst. Growth Des. 2017. V. 17. № 10. P. 5499.
Zorina-Tikhonova E.N., Chistyakov A.S., Kiskin M.A. et al. // IUCrJ. 2018. V. 5. № 3. P. 293.
Volodin A.D., Korlyukov A.A., Zorina-Tikhonova E.N. et al. // Chem. Commun. 2018. V. 54. P. 13861.
Ushakov I.E., Goloveshkin A.S., Zorina-Tikhonova E.N. et al. // Mend. Commun. 2019. V. 29. P. 643.
Feng X., Ma L.-F., Liu L. et al. // Cryst. Growth Des. 2013. V. 13. P. 4469.
Sapianik A.A., Zorina-Tikhonova E.N., Kiskin M.A. et al. // Inorg. Chem. 2017. V. 56. № 3. P. 1599.
Portolés-Gil N., Gómez-Coca S., Vallcorba O. et al. // RSC Adv. 2020. V. 10. 45090.
Mielcarek A., Bieńko A., Saramak P. et al. // Dalton Trans. 2019. V. 48. P. 17780.
Ryumin M.A., Dobrokhotova Zh.V., Emelina A.L. et al. // Polyhedron. 2015. V. 87. P. 28.
Rubtsova I.K., Melnikov S.N., Shmelev M.A. et al. // Chem. Commun. 2020. V. 30. № 6. P. 722.
Сапьяник А.А., Федин В.П. // Коорд. химия. 2020. Т. 46. № 7. С. 387 (Sapianik A.A., Fedin V.P. // Russ. J. Coord. Chem. 2020. V. 46. № 7. P. 443). https://doi.org/10.1134/S1070328420060093
Бажина Е.С., Гоголева Н.В., Зорина-Тихонова Е.Н. и др. // Журн. структур. химии. 2019. Т. 60 № 6. С. 893 (Bazhina E.S., Gogoleva N.V., Zorina-Tikhonova E.N. et al. // J. Struct. Chem. 2019. V. 60. № 6. P. 855).
Liu D., Ge Y., Li N.-Y. et al. // RSC Adv. 2015. V. 5. P. 45467.
Tranchemontagne D.J., Hunt J.R., Yaghi O.M. // Tetrahedron. 2008. V. 64. P. 8553.
Delgado F.S., Ruiz-Pérez C., Sanchiz J. // CrystEngComm. 2006. V. 8. P. 507.
Зорина-Тихонова Е.Н., Матюхина А.К., Александров Г.Г. // Журн. неорган. химии. 2021. Т. 66. № 2. С. 178 (Zorina-Tikhonova E.N., Matyukhina A.K., Aleksandrov G.G. // Russ. J. Inorg. Chem. 2021. V. 66. № 2. P. 178). https://doi.org/10.1134/S0036023621020212
Sheldrick G.M. SADABS. Program for Empirical X-ray Absorption Correction. Bruker-Nonius, 1990–2004.
Sheldrick G.M. // Acta Crystalogr. A. 2015. V. 71. № 1. P. 3.
Sheldrick G.M. // Acta Crystalogr. 2015. C. V. 71. № 1. P. 3.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. A-ppl. Cryst. 2009. V. 42. № 2. P. 339.
Casanova D., Alemany P., Bofill J. M., Alvarez S. // Chem. Eur. J. 2003. V. 9. P. 1281.
Casanova D., Llunell M., Alemany P., Alvarez S. // Chem. Eur. J. 2005. V. 11. P. 1479.
Ruiz-Martínez A., Casanova D., Alvarez S. // Chem. Eur. J. 2008. V. 14. P. 1291.
Ruiz-Martínez A., Casanova D., Alvarez S. // Dalton Trans. 2008. V. 19. P. 2583.
Macrae C.F., Sovago I., Cottrel S.J. et al. // J. Appl. Cryst. 2020. V. 53. P. 226.
Vologzhanina A.V. // Crystals. 2019. V. 9. № 9. P. 478.
Rao K.P., Higuchi M., Sumida K. // Angew. Chem. Int. Ed. 2014. V. 53. № 31. P. 8225.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия