Координационная химия, 2021, T. 47, № 7, стр. 391-423
Комплексы металлов ароил(ацил)бензоилгидразонов ароматических альдегидов, кетонов: способы координации и свойства
А. С. Бурлов 1, *, В. Г. Власенко 2, Б. В. Чальцев 1, Ю. В. Кощиенко 1, С. И. Левченков 3
1 НИИ физической и органической химии Южного федерального университета
Ростов-на-Дону, Россия
2 НИИ физики Южного федерального университета
Ростов-на-Дону, Россия
3 Южный федеральный университет
Ростов-на-Дону, Россия
* E-mail: anatoly.burlov@yandex.ru
Поступила в редакцию 21.01.2021
После доработки 05.03.2021
Принята к публикации 06.03.2021
Аннотация
В настоящем обзоре обобщены и систематизированы сведения, основанные на данных РСА за последние 20 лет, о способах координации ароил(ацил)гидразонов альдегидов и кетонов, содержащих хелатофорные группировки атомов, их фотолюминесцентных, магнитных свойствах и биологической активности. Рассмотрены также наиболее значимые ранние исследования комплексов металлов с ароил(ацил)гидразонными лигандами. Настоящий обзор будет полезен ученым-специалистам при целенаправленном синтезе новых комплексов металлов данного класса лиганда с целью получения практически важных материалов на их основе.
Большой научный интерес к гидразонам ароматических альдегидов, кетонов и их комплексам с металлами обусловлен широким спектром их биологической активности: антибактериальной [1–5], антимикробной [6–8], антивирусной [9–14], противоопухолевой [4, 15–18], цитотоксической [19], антигрибковой [20, 21]. Также они проявляют каталитическую активность [22–26]. Например, большое практическое значение имеют такие соединения ароилгидразонов в качестве эффективных и селективных каталитических систем при окислительной функционализации инертных алканов в более ценные органические продукты – каталитическое окисление циклогексана до циклогексанола и циклогексанона, используемых для производства нейлона [25, 27–32]. Имеются примеры использования этих соединений как эффективных противоизносных присадок в узлах трения [33–36].
Ароил(ацил)гидразоны ароматических альдегидов, являясь полидентатными органическими лигандами, в зависимости от условий синтеза и природы металла, образуют комплексы металлов различного состава и строения (моно-, би- или полиядерные). Большую группу из полиядерных комплексов составляют соединения, содержащие обменно-связанные парамагнитные ионы переходных металлов. Ключевой ролью для понимания магнитных свойств в таких обменных кластерах является выявление взаимосвязи обменных параметров с особенностями строения подобных комплексов, что имеет большое значение для понимания магнитных взаимодействий и магнитоструктурных корреляций в молекулярных системах [37–46]. Комплексы цинка и редкоземельных элементов бензоилгидразонов 2-гидрокси- или 2-(N-тозиламино)бензальдегидов проявляют фото- и электролюминесцентные свойства. На их основе получены эффективные светоизлучающие устройства [47–50].
В литературе основное внимание уделено изучению ароилгидразонов на основе 2-гидроксибензальдегида и его аналогов. Примеров синтеза и изучения физико-химических свойств ароилгидразонов на основе 2-(N-тозиламино)бензальдегида, их комплексов металлов, аддуктов с гетероциклическим основаниями значительно меньше [48–57].
В настоящем обзоре обобщены и систематизированы сведения, основанные на данных РСА за последние 20 лет, о способах координации ароил(ацил)гидразонов альдегидов и кетонов, содержащих хелатофорные группировки атомов, их фотолюминесцентных, магнитных свойствах и биологической активности.
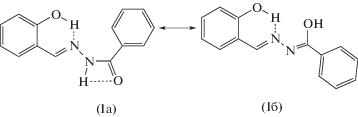
Ароил(ацил)гидразоны альдегидов и кетонов, содержащие хелатофорные группировки (–OH, ‒SH, –NH-Ts, –COOH) представляют обширный класс соединений, вызывающих постоянный научный интерес. Как было показано в [37, 48–50], ароил(ацил)гидразоны 2-гидроксибензальдегида и его аналогов могут существовать, как минимум, в двух таутомерных формах: гидразонной (кето-форме) Ia, либо в α-оксиазинной (енольной форме) Iб (схема 1 ).
Схема 1 .
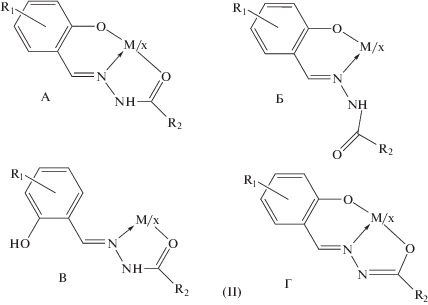
Ароил(ацил)гидразоны салицилового альдегида и его замещенных соединений в свободном состоянии, согласно данным спектроскопии ИК, ЯМР 1Н, квантово-химических расчетов и РСА существуют в гидразонной (кето) таутомерной форме Ia. Как, например, показано в [58], молекула бензоилгидразона салицилового альдегида имеет плоскую структуру с сильной внутримолекулярной водородной связью между азометиновым атомом азота и атом водорода гидроксильной группы. Возможность существования в таких системах различных таутомерных форм обуслoвливает возможность (в зависимости от условий синтеза, природы металла-комплексообразователя) получения на их основе комплексных соединений металлов с различными способами координации указанных лигандных систем [59–63]. Согласно [59–63], возможно существование четырех основных типов координации ароил(ацил)гидразонов салицилового альдегида в комплексах металлов (IIА–IIГ) (схема 2 ).
Схема 2 .
Бензоилгидразоны 2-гидроксибензальдегида, 2-гидрокси-1-нафтальдегида, о-оксиацетофенона, о-оксипропиофенона, о-оксибензофенона с ацетатами меди(II), никеля(II), марганца(II), железа(II) и ацетилацетонатом ванадила(II) в нейтральной или слабощелочной средах образуют комплексы, содержащие енольную II(Г) форму, либо кето-форму бензоилгидразона типа II(А) [58, 64].
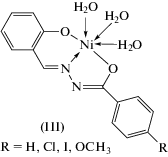
Комплексы металлов могут иметь как моноядерное, так и биядерное строение. Состав, строение и способ координации в комплексах никеля(II) ароилгидразонами салицилового альдегида могут существенно меняться от условий синтеза [65, 66]. Бензоил-, п-хлорбензоил-, п-иодбензоил-, п-метоксибензоилгидразоны салицилового альдегида с избытком ацетата никеля(II) образуют парамагнитные моноядерные комплексы III (схема 3 ) с координацией лигандов в енольной таутомерной форме типа II(Г) (схема 2 ).
Схема 3 .
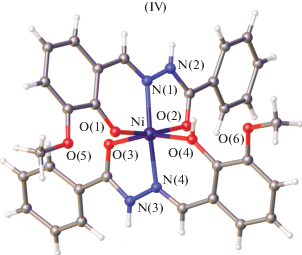
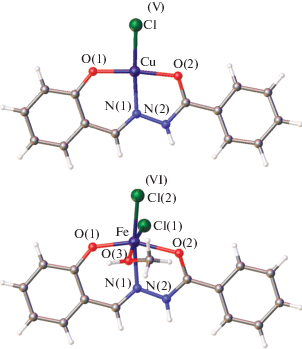
В то же время в ряде работ [60–65, 67] получены октаэдрические комплексы никеля(II) IV, в которых лиганд координирует к атому никеля в гидразонной (кето-) форме (рис. 1).
Тридентатно-координированная гидразонная форма ацилгидразона салицилового альдегида реализуется в комплексах с хлоридом и бромидом меди(II) и хлоридом железа(II) типа V и VI (рис. 2) [65, 66, 68–73]. Моноядерные структуры комплексов меди(II) и железа(II) V, VI установлены методом РСА [73].
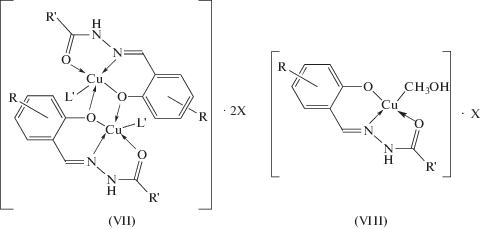
Ацилгидразоны и ароилгидразоны салицилового альдегида с нитратом и перхлоратом меди(II) приводят к образованию биядерного VII или моноядерного VIII комплексов [74–77] с координацией лигандов в гидразонной (кето-) форме (cхема 4, 5).
R = H, 5-NO2, 5-OCH3, 5-CH3, 5-Cl, 5-Br; R'= CH3; X = NO3, ${\text{ClO}}_{4}^{ - }$; L' = H2O, CH3OH, C2H5OH
Схема 4 .
R: Ph, PhCH3, p-Tol, t-But
Схема 5 .
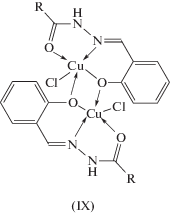
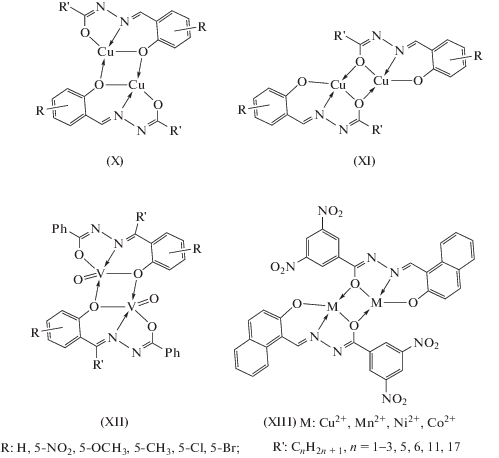
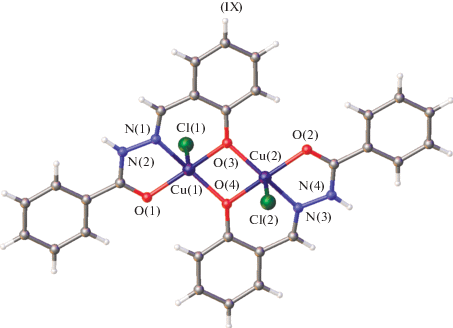
Особенностью димерных комплексов данного типа является то, что мостиковую функцию способен выполнять феноксильный атом кислорода альдегидного фрагмента, как в комплексах IX (схема 5 , рис. 3 [78]), так и гидразонного атома кислорода лиганда X, XI, XII, XIII (схема 6 ). В литературе известны оба возможных способа образования димеров. Димерные структуры с мостиковыми феноксильными атомами кислорода получены для комплексов меди(II), урана(II), железа(III), хрома(III), кобальта(III), марганца(III), ванадия(II) [79–87], например типа X или c гидразонным атомом кислорода типа XI, XIII (схема 6 ). Во всех данных случаях вывод о координации в димерных комплексах сделан на основе данных ИК-спектроскопии.
Схема 6 .
Для всех димерных комплексов данного типа характерно обменное взаимодействие антиферромагнитного типа между парамагнитными ионами металлов, установленное методом температурной магнетохимии. Для биядерных комплексов меди(II) арилгидразонов салицилового альдегида димеризация мономерных объектов через феноксильные атомы кислорода носит, как это показано в [38, 88, 89], направленный характер, обусловленный особенностями строения лигандных систем.
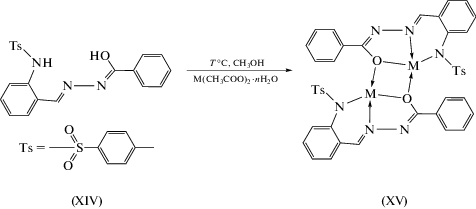
В меньшей степени, чем гидразоны салицилового альдегида и его замещенные, изучены гидразоны на основе 2-(N-тозиламино)бензальдегида XIV [90] (схема 7 ).
Схема 7 .
Особенность таких лигандных систем состоит в том, что в их биядерных комплексах исключается возможность димеризации через атом азота альдегидного фрагмента. В [91, 92] синтезированы комплексы металлов бензоилгидразонов 2-(N-тозиламино)бензальдегида типа XV (схема 7 ). Координация лигандов в дважды депротонированной енольной форме в комплексах XV подтверждена данными ИК-спектроскопии и температурной магнетохимии, показавшей наличие сильного обменного взаимодействия антиферромагнитного типа. Димеризация в таких комплексах осуществляется единственным способом – через атомы кислорода гидразонных фрагментов [91–93].
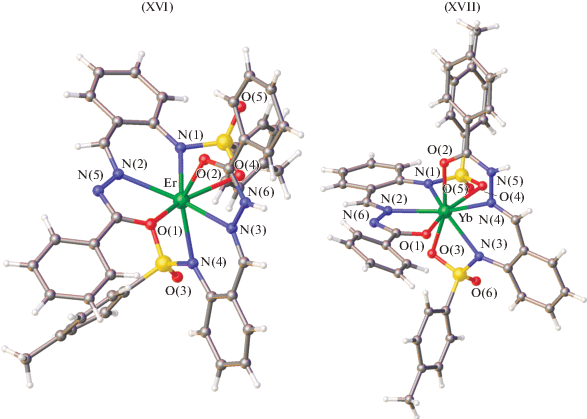
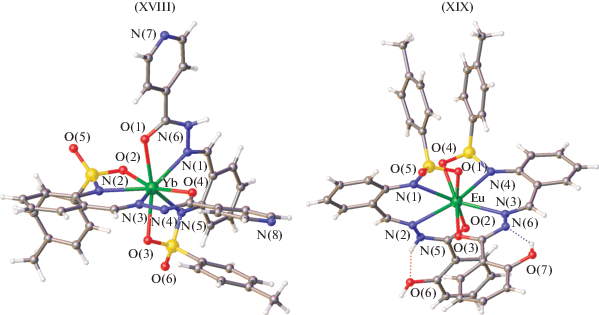
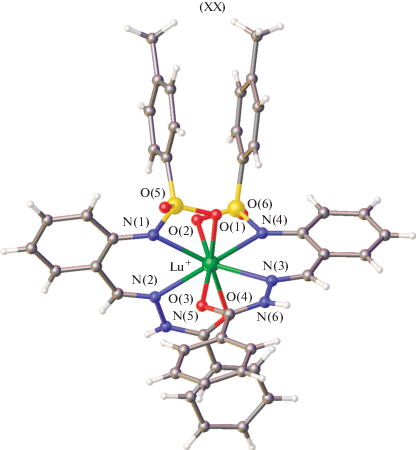
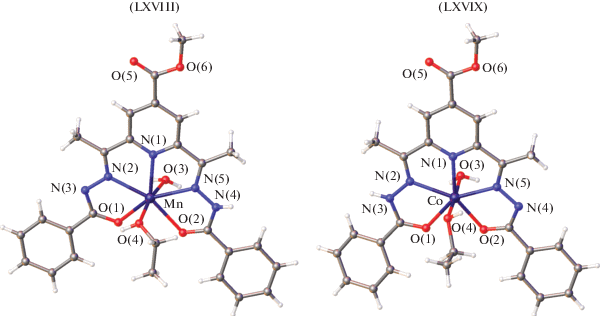
Большой научный интерес представляют комплексы лантанидов с бензоилгидразонами 2-(N-тозиламино)бензальдегида [48–50]. Получены и структурно охарактеризованы методом РСА комплексы эрбия(III) XVI, иттербия(III) XVII, XVIII, европия(III) XIX и лютеция(III) XX [49, 50] этого лиганда (рис. 4–6).
В комплексах XVI–XIX, согласно данным РСА, один монодепротонированый лиганд координируется в гидразонной (кето-) форме, а другой дважды депротонированный лиганд – в енольной. В комплексе XX два монодепротонированных лиганда координируются к металлу в кетонной форме. Данные комплексы демонстрируют эффективную люминесценцию с высокими квантовыми выходами в ИК-области. Красная граница спектра возбуждения достигает 450 нм, дает возможность для возбуждения комплексов синим светом, что важно для биовизуализации. Комплекс иттербия показал рекордно высокую эффективность в качестве эмиссионного материала в OLED-устройстве 385 мкВт/Вт.
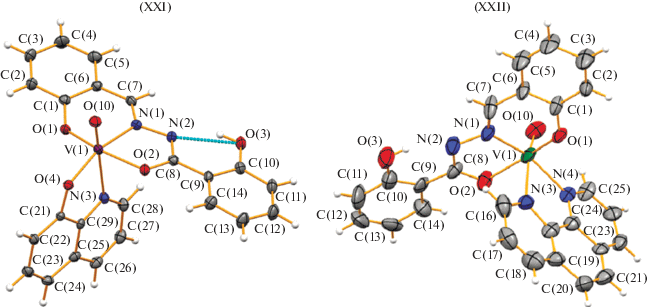
В [23] описана серия аддуктов комплексов металлов бензоил- или салицилоилгидразонов салицилового альдегида, его замещенных с пиридином, 2- или 3- или 4-пиколинами, 1,10-фенантролином, 8-гидроксихинолином. В аддуктах комплексов ванадия(II) с молекулами 8-гидроксихинолинами XXI или 1,10-фенантролином XXII (рис. 7) дважды депротинированный лиганд салицилгидразон салицилового альдегида [23] координируется к ванадию в енольной форме, образуя вместе с дополнительными молекулами искаженное октаэдрическое окружение иона металла. Гидроксигруппа бензоилгидразонного фрагмента в координации с металлом не участвует. Комплексы XXI, XXII изучены как катализаторы окисления спиртов в кетоны.
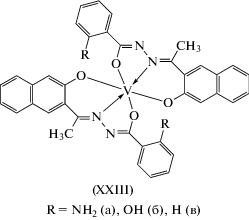
Гексакоординированные моноядерные комплексы ванадия(IV) типа XXIII получены и структурно охарактеризованы в [94] (схема 8 ).
Схема 8 .
В этих комплексах реализуется енольная форма лиганда. Комплексы XXIIIa–XXIIIв (схема 8 ) in vitro проявляют миметическую активность в отношении инсулина и противоопухолевую активность.
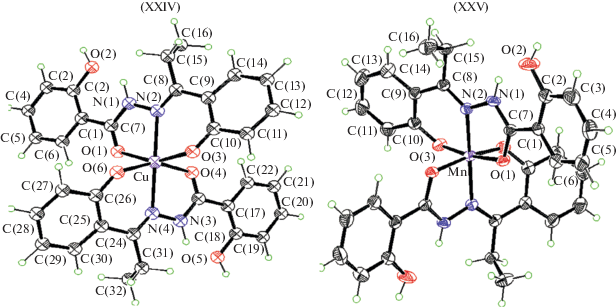
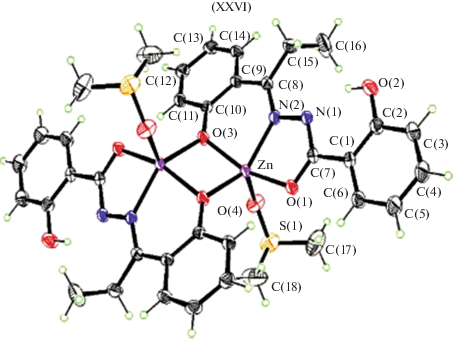
Салицилоилгидразон 2-гидроксипропиофенона в моноядерных комплексах меди(II) XXIV и марганца(II) XXV (рис. 8) координирует, согласно данным РСА, в кето-форме, а в биядерном комплексе цинка XXVI (рис. 9) – в енольной [95]. Комплексы XXIV–XXVI были изучены в качестве ингибиторов коррозии.
Молекулярные структуры комплексов меди(II) XXIV и марганца(II) XXV близки и демонстрируют искаженную октаэдрическую геометрию вокруг иона металла. Ион металла в обоих комплексах координирован двумя моноанионными лигандами через карбонильный атом кислорода O, азометиновый атом азота N и фенолятный атом кислорода O каждого лиганда.
Молекулярная структура XXVI представляет собой феноксимостиковый центросимметричный димер, имеющий 5-координатную искаженную квадратную пирамиду, в которой металл связывается через азометиновый атом азота N, карбонильный атом кислорода O и два мостиковых фенолятных атома кислорода O лигандов, а сульфоксидный атом кислорода O молекулы ДМСО занимает апикальное положение. Гидроксигруппа салицилоил гидразонного фрагмента не координирует к металлу.
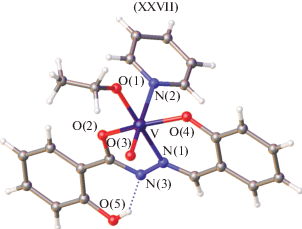
2-Гидроксибензоилгидразон салицилового альдегида (H2L) с ацетилацетонатом ванадила в среде этанола дает оксоэтоксованадиевый комплекс [VO(OEt)L], который вступает в реакцию с основаниями Льюиса (L'), образуя комплексы типа [VO(OEt)L')], где L' = пиридин, 2-пиколин, 3-пиколин, 4-пиколин, 2-аминопиридин, имидазол, 4-метилимидазол (XXVII) (рис. 10). Комплексы XXVII, структурно охарактеризованные методом РСА, имеют искаженное октаэдрическое координационное окружение O4N2 вокруг акцепторного центра V(V) за счет связи с фенольным атомом кислорода O, енольного атома кислорода O гидразонного фрагмента и иминного атома азота N тридентатного лиганда и атома кислорода O этоксигруппы депротонированной молекулы этанола. Две аксиальные позиции заняты оксоатомом O ванадила и атомом азота N вторичного лиганда L' [96].
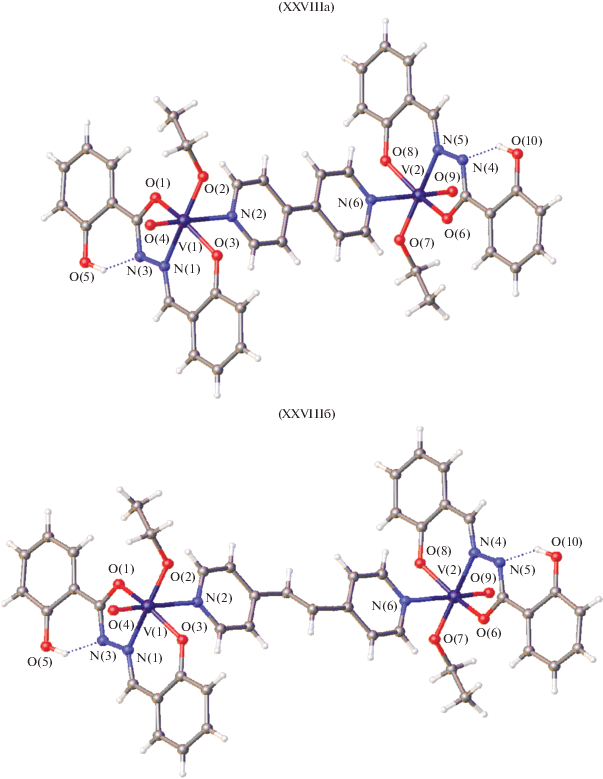
В случае, когда L' = 4,4'-бипиридин, 1,2-бис(4-пиридил)этилен образуются димерные молекулы [VO(OEt)L]2(L') за счет координации к ванадию атома азота 4,4'-бипиридина XXVIIIа и 1,2-бис(4-пиридил)этилена XXVIIIб [96] (рис. 11). Группа OH салицилоил гидразонного фрагмента не участвует в координации с металлом, но образуют водородные связи с депротонированным атомом азота гидразонного фрагмента.
Также получены и структурно охарактеризованы аналогичные продукты биядерных комплексов оксомолибдена(VI) [97–99].
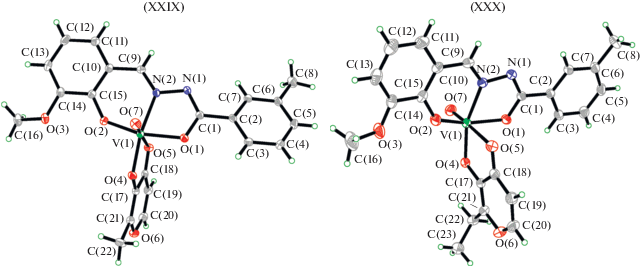
Два новых комплексa оксованадия(V), [VOLL1] (XXIX) и [VOLL2] (XXX), где L – дианионная форма гидразонового лиганда N'-(2-гидрокси-3-метоксибензилиден)-3-метилбензоилгидразида (H2L). Лиганды L1 и L2, представляющие собой депротонированную форму 3-гидрокси-2-метил-4H-пиран-4-она (HL1) и 3-гидрокси-2-этил-4H-пиран-4-он (HL2) соответственно, были получены и охарактеризованы методом РСА [100] (рис. 12). Атомы ванадия(V) в комплексах находятся в октаэдрической координации, при этом гидразонный лиганд координируется в енольной форме с атомами металла через фенолятный атом кислорода О, иминный атом азота N и енолятный атом кислорода О бензоилгидразонного фрагмента, а с пироновыми лигандами через атомы кислорода О карбонила и гидроксила. Оба комплекса обладают высокой антибактериальной и противогрибковой активностью против Staphylococcus aureus, Escherichia coli и Candida albicans по сравнению со свободным гидразоном.
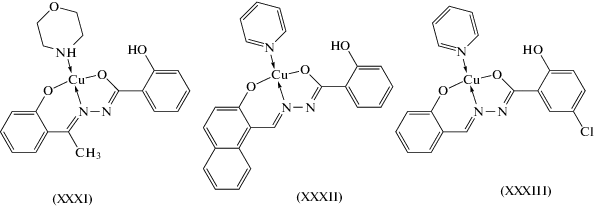
В енольной формекоординируют к иону меди(II)салицилоилгидразоны2-гидроксибензальдегида и2-гидроксинафтальдегидав аддуктах с морфолиномXXXI [101] ипиридином XXXII, XXXIII [102, 103] (схема 9 ).
Схема 9 .
Ион Cu(II) в комплексе XXXI координирован атомом кислорода O енольной формы гидразонного фрагмента лиганда, азометиновым атомом азота N, фенолатным атомом O дважды депротонированного тридентатного лиганда и атомом азота молекулы морфолина, формируя искаженную транс-CuN2O2 плоско-квадратную геометрию. Аналогичное координационное окружение ионов Cu(II) формируется в комплексах XXXII и XXXIII [102, 103].
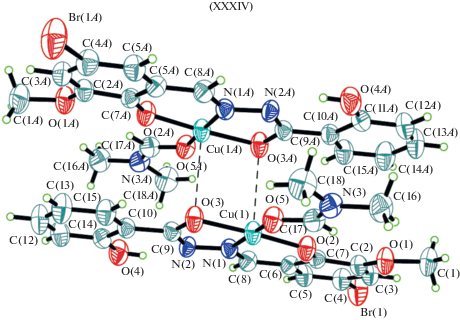
В димерном медном аддукте с ДМФА XXXIV 2‑гидроксибензоилгидразон 2-гидрокси-3-метокси-5-бромбензальдегид координирует в енольной форме с образованием искаженной квадратно-пирамидальной координационной геометрии. Образование димерной молекулы осуществляется за счет аксиальных атомов кислорода гидразонных фрагментов лигандов [104] (рис. 13).
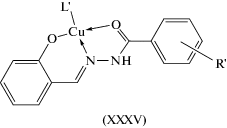
В [18] произведена оценка на цитотоксичность в отношении клеточной линии аденокарциномы человека салицилиденбензоилгидразонов и их комплексов меди(II) XXXV. В некоторых случаях цитотоксичность комплексов меди(II) XXXV превосходит цисплатин более чем в 2 раза. В этих комплексах лиганд, по мнению авторов [21], координирует к атому меди в кето-форме (схема 10 ).
M = Cu2+; R = H; 2-CH3; 3-OCH3; 5-OCH3; 5-Cl; 5-NO2; 5-CH3; R' = H, 2-CH3; 3-CH3; 4-CH3; 4-F; 4-Cl; 4-Br; 4-NO2; 2-OH; 4-OH; 4-CH3; 4-Cl; 4-NO2; L' = Cl, NO3
Схема 10 .
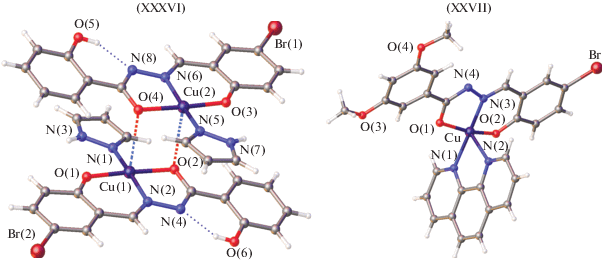
В [105, 106] получены и структурно охарактеризованы аддукты комплексов меди(II): биядерного на основе 5-бромсалицилбензоилгидразона с имидазолом XXXVI и 5-бромсалицилаль-3,5-диметоксибензоилгидразона с 1,10-фенантролином XXXVII (рис. 14).
В комплексах XXXVI, XXXVII медь координируется лигандом в енольной форме и дополнительно координируются атомами азота молекулы имидазола или 1,10-фенантролина. Комплекс XXXVI имеет искаженную плоско-квадратную геометрию, тогда как комплекс XXXVII – искаженную квадратно-пирамидальную геометрию, в которой N,N-донорные атомы 1,10-фенантролина являются аксиально-экваториальными. В качестве мостика в димерной структуре XXXVI выступают атомы кислорода гидразонного фрагмента. В обеих структурах ONO-донорный гидразоновый лиганд занимает базальную плоскость из фенолятного атома кислорода O, иминнного атома азота N и депротонированных атомов кислорода O амидного фрагмента.
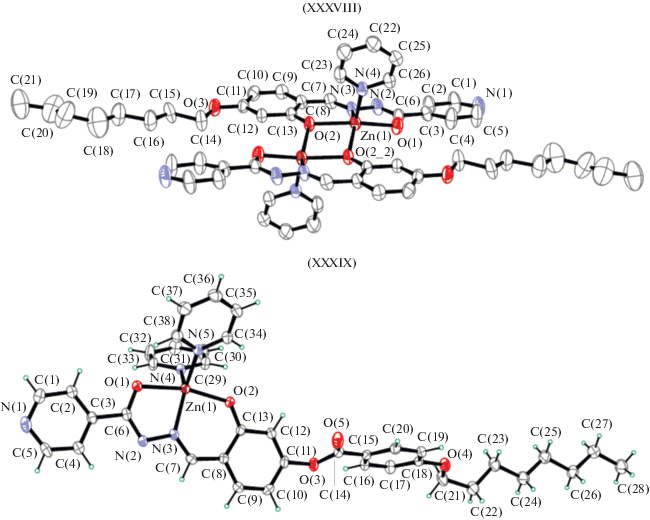
Рентгеноструктурно охарактеризованы комплексы (моно- и биядерные) пиридиноилгидразона, 2‑гидрокси-4-октилоксибензальдегида и 4-формил-3-гидроксифенил-4-октилоксибензола XXXVIII и XXXIX (рис. 15), обладающие фотолюминесцентными свойствами [107] с высокими квантовыми выходами фотолюминесценции.
Геометрия координационного узла в комплексах XXXVIII и XXXIX является квадратно-пирамидальной или тригонально-бипирамидальной с пентакоординированным цинком(II) координированным гидразонным O,N,O-лигандом в енольной форме и одним или двумя пиридинами. Лиганды имеют вытянутую форму и почти плоскую конформацию. В димерном комплексе XXXVIII в качестве мостиков выступают атомы кислорода фенольных фрагментов салициловых альдегидов.
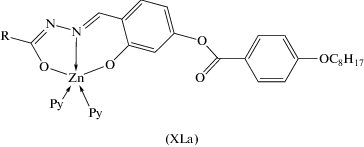
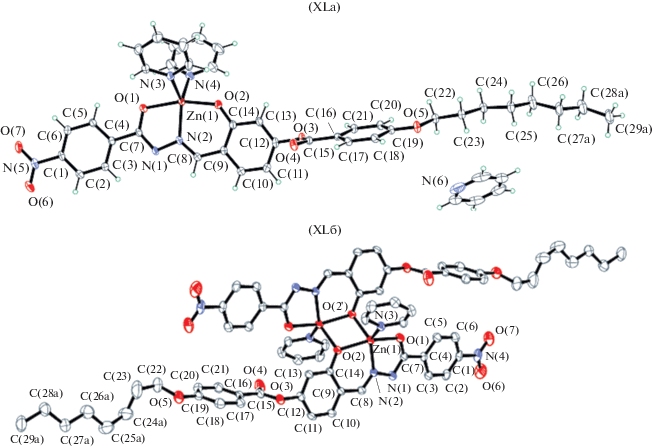
Фотолюминесцентными свойствами обладает ряд моно- и биядерных комплексов цинка XLa и XLб (схема 11 , рис. 16), структуры которых установлены методом РСА [108], в которых тридентатные лиганды координируют с ионом цинка через два атома кислорода и один атом азота. Координационная сфера иона цинка дополнена одним (XLб) или двумя (XLа) молекулами пиридина. Биядерный комплекс XLб образуется через мостиковые фенолятные атомы кислорода альдегидного фрагмента.
R = –C6H4–4-F, –C6H4–4-СN, –C6H4–4-NO2, 4-бензотиазол
Схема 11 .
Отметим, что в комплексах XLа, XLб лиганды координируют к атомам цинка в енольной таутомерной форме.
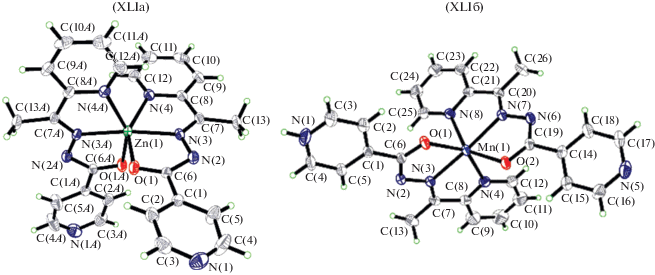
Получены два моноядерных соединения цинка(II) и марганца(II) [ZnL2] (XLIa) и [MnL(HL)]ClO4 (XLIб) (рис. 17), где L – моноанионная форма N'‑(1-(пиридин-2)-ил)этилиден)изоникотиногидразид (HL), которые были получены и охарактеризованы методом РСА [109]. Соединение XLIa содержит нейтральную комплексную молекулу [ZnL2], XLIб – [MnL(HL)]+ комплексный катион и один перхлорат-анион. Атомы металлов в комплексах находятся в октаэдрической координации. Гидразоновые лиганды координируются с атомами металла через пиридиновый атом азота N, иминный атом азота N и енолятные атомы кислорода O. Показана высокая антимикробная активность этих соединений в отношении Staphylococcus aureus, Escherichia coli и Candida albicans [109, 110].
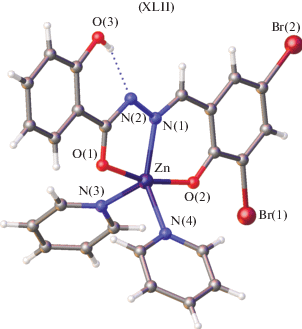
В комплексе цинка с 2-гидроксибензоилгидразоном 2-гидрокси-3,5-дибромбензальдегида лиганд также координирует к металлу в енольной форме, образуя дипиридиновый аддукт XLII (рис. 18), где координационный центр имеет искаженную тригонально-бипирамидальную геометрию [111].
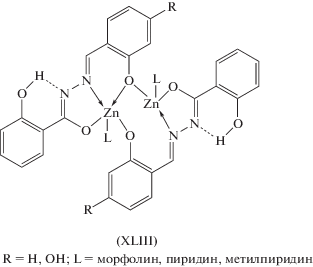
Как показано в [112–114], при взаимодействии 2-гидроксибензоилгидразона 2-гидроксибензальдегида с ацетатом цинка получены биядерные комплексы типа XLIII (схема 12 ) с координацией лиганда в енольной форме и димеризацией через атомы кислорода альдегидного фрагмента. В качестве аксиального лиганда присутствуют молекулы морфолин, пиридина или метилпиридина.
Схема 12 .
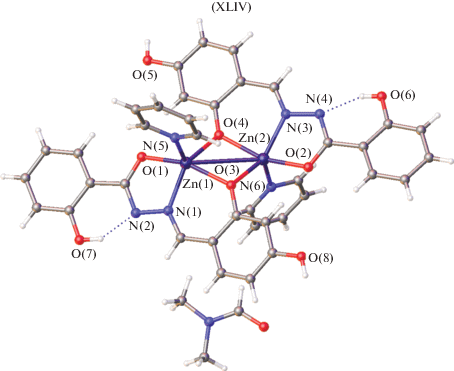
В димерном комплексе XLIV (рис. 19) полученном из 2-гидроксибензоилгидразона 2,4-дигидроксибензальдегида и Zn(OAc)2 · 2H2O лиганд координирует в енольной форме, где в качестве мостиков выступают атомы кислорода альдегидных фрагментов с дополнительной координацией двух молекул пиридина и двух молекул ДМФА. Все атомы Zn(II) координированы тремя атомами кислорода O и двумя атомами азота N с формированием искаженной тетрагонально-пирамидальной геометрии из-за разных расстояний Zn–O и Zn–N. Три атома кислорода О и один атом азота N от L лигандов расположены в базисной плоскости искаженной квадратной пирамиды, а апикальное положение занимает атом азота N, принадлежащий молекуле пиридина [115].
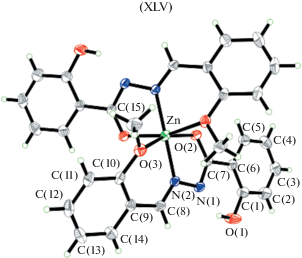
В [116] приведены данные РСА для мономерного комплекса цинка XLV (рис. 20), полученного взаимодействием 2-гидроксибензоилгидразона 2-метоксибензальдегида с Zn(OAc)2 ⋅ 2H2O, где лиганд координирует к атому цинка в енольной форме. Ион цинка(II), лежащий в центре симметрии, имеет октаэдрическое окружение и координирован четырьмя атомами кислорода O и двумя атомами азота N от двух анионных 2- гидрокси-N-(2-метоксибензилиден) бензоилгидразидных лигандов.
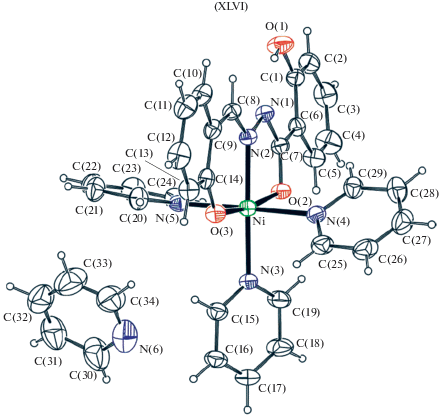
Структурно охарактеризован [117] никелевый аддукт XLVI (рис. 21) с тремя молекулами пиридина и лигандом в енольной форме. Ион никеля(II) окружают один атом азота N и два атома кислорода O основания Шиффа и три атома азота N от трех молекул пиридина. Эта координация NiN4O2 образует искаженную октаэдрическую геометрию.
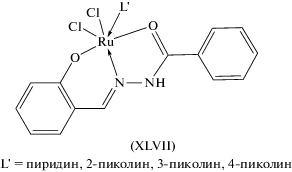
Бензоилгидразон салицилового альдегида с хлоридом рутения(III) в присутствии пиридина, 2-пиколина, 3-пиколина, 4-пиколина образует октаэдрические комплексы XLVII (схема 13 ), в которых, по данным ИК-спектров, реализуется кетонная форма лиганда [118].
Схема 13 .
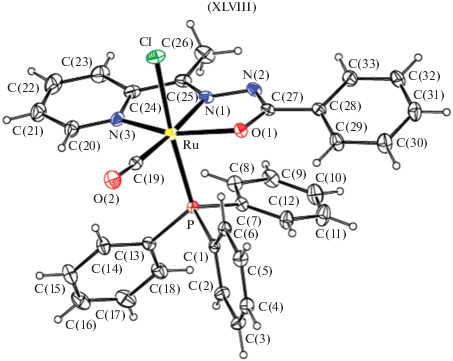
Октаэдрические комплексы рутения(II) замещенных 2-ацетилпиридин бензоилгидразона XLVIII (рис. 22), обладающие каталитической активностью в реакциях восстановления альдегидов до спиртов были структурно охарактеризованы в [119]. В комплексе рутения(II) лиганд координирует в енольной форме. N,N,O-бензоилгидразоновый лиганд координирует с ионом рутения(II) через пиридиновый и азометиновый атомы азота N и депротонированный амидный атом кислорода O атомов с образованием двух пятичленных конденсированных хелатных колец.
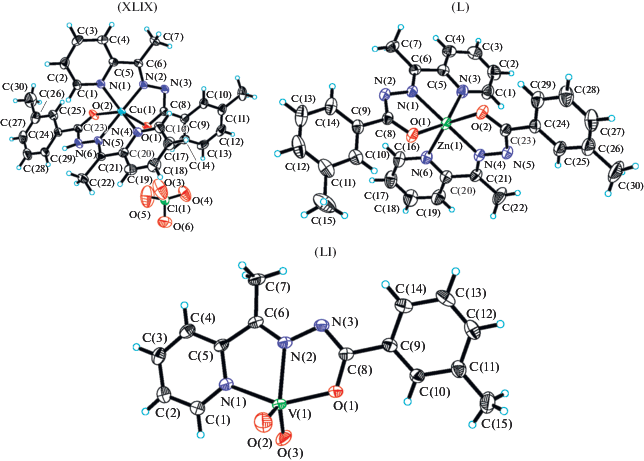
Три комплекса меди(II), цинка(II) и ванадия(V), [CuL(HL)]ClO4 (XLIX), [ZnL2] (L) и [VO2L] (LI) (рис. 23), где L – анионная форма 3-метил-N'-(1-(пиридин-2-ил)этилиден)бензогидразида (HL) были синтезированы и охарактеризована методом РСА. Все комплексы обладают высокой активностью против различных бактериальных штаммов B. subtilis, S. aureus и E. coli [120].
Координационная геометрия вокруг иона меди(II) в XLIX (рис. 23) является искаженно октаэдрической с одним нейтральным и одним анионным тридентатным гидразоновым лигандом. Гидразоновые лиганды координируются с ионом меди(II) через пиридиновые атомы азота N, иминные атомы азота N, карбонильный и енолятный атомы кислорода O(2) и O(1) соответственно.
Координационная геометрия вокруг иона цинка(II) в L (рис. 23) является также искаженно октаэдрической с тридентатными анионными гидразоновыми лигандами в енольной форме. Гидразоновые лиганды координируются с ионом цинка через пиридиновые атомы азота N, иминные атомы азота N и енолятные атомы кислорода O.
Координационная геометрия вокруг иона ванадия(V) в LI может быть описана как тригональная бипирамида с иминным атомом азота N тридентатного гидразонового лиганда и двумя оксо-атомами O в енольной форме.
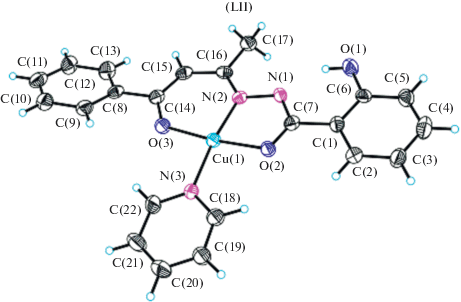
В енольной форме N-(4-оксо-4-фенилбутан-2-илиден)бензоилгидразон бензальдегида образует с хлоридом меди(II) пиридиновый аддукт LII (рис. 24) [121]. Центральный атом Cu(II) имеет искаженную плоско-квадратную координационную геометрию, которая образована двумя атомами кислорода O, одним атомом азота N от молекулы лиганда и одним атомом азота N от молекулы пиридина.
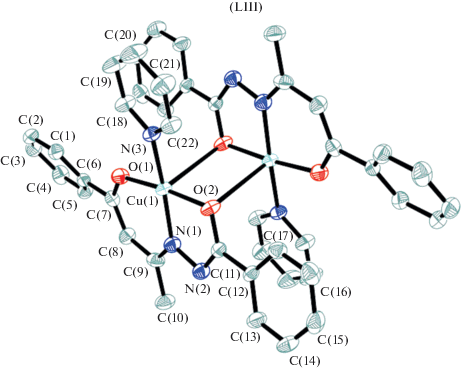
Получена и структурно охарактеризована биядерная структура LIII [122] (рис. 25), в которой лиганд координирует к иону меди(II) в енольной форме с дополнительной координацией молекулы пиридина. Ион меди(II) имеет N2O2 квадратно-пирамидальное окружение, где в аксиальных положениях находятся мостиковые атомы кислорода лиганда.
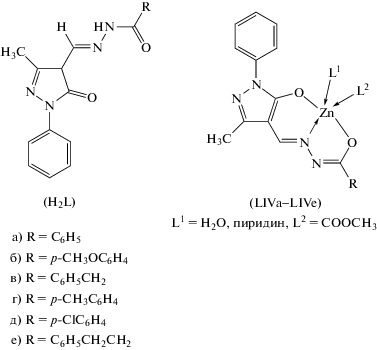
Фотолюменисцирующие комплексы цинка LIVа–LIVе ароил(ацил)гидразонов 3-метил-4-формилпиразол-5-она (H2L) с квантовыми выходами от 10 до 64% (схема 14 ) описаны и структурно охарактеризованы в [47].
Схема 14 .
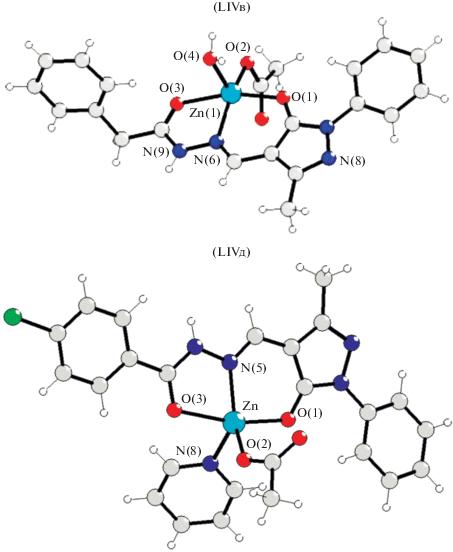
Координационная сфера иона цинка(II) образована одним атомом азота N и атомами кислорода О пиразольного фрагмента лиганда и карбоксильной группы гидразона О (в кето-форме), а также атомами кислорода координированного монодентатно ацетат-аниона и воды (LIVв) или атома азота пиридиновой молекулы (LIVд) (рис. 26). Координационный полиэдр в этих комплексах LIVв и LIVд имеет геометрию тетрагональной пирамиды.
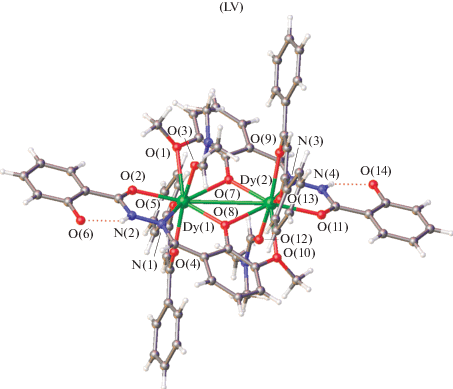
Для изучения регулирования динамики магнетизма в молекулярных магнетиках с помощью “гостевых” молекул растворителя в [123] синтезирован и структурно охарактеризован биядерный комплекс диспрозия(III) 2-гидроксибензоилгидразона с 2-гидрокси-3-метоксибензальдегидом [Dy2(L)2(DBM)2(DMF)2] ⋅ 2DMF (LV), где H2L – 2-гидрокси-N'-(2-гидрокси-3-метоксибензилиден) бензогидразид, HDBM – дибензоилметан (рис. 27), и изучены его магнитные свойства в широком температурном интервале вплоть до 2 К. Лиганд в димерной молекуле координирует к диспрозию(III) в кето-форме.
Структура комплекса LV представляет собой нейтральный димер, в котором два иона металла Dy(III) координируют два лиганда дианионного основания Шиффа (L2–), два бидентатных моноанионных лиганда DBM– и два осевых лиганда растворителя ДМФA. Ионы диспрозия(III) соединены двумя феноксильными группами двух лигандов.
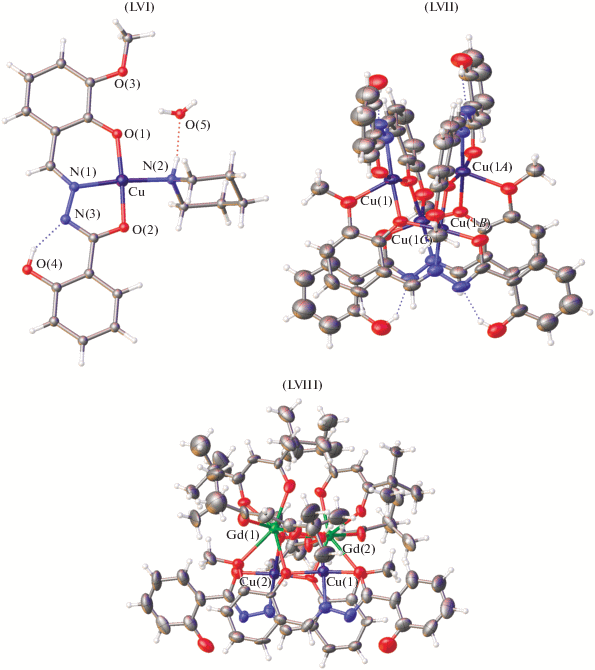
Получены [124] биметаллические моноядерные LVI и четырехъядерные комплексы меди(II) LVII и гадолиния(III) LVIII (рис. 28) 2-гидрокси-N'-[(2-гидрокси-3-метоксифенил)метилиден]бензогидразидом (LH3), где лиганды координируют с ионами металлов в енольной форме. Кубановый гетерометаллический комплекс LVIII состоит из двух пар Cu-Gd, связанных дигидроксо-Gd-Gd мостиком, в котором ионы Cu(II) и Gd(III) соединены несимметричным феноксо-гидроксомостиком.
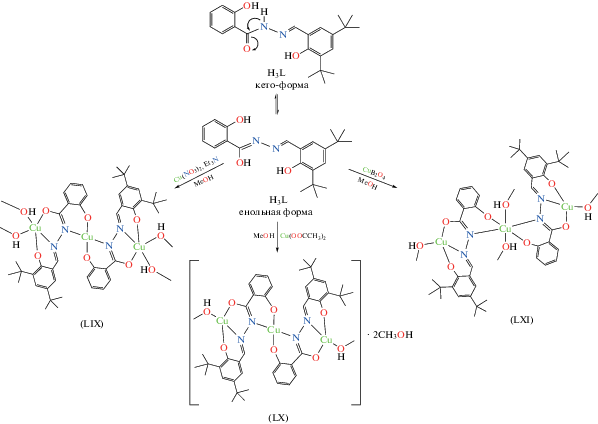
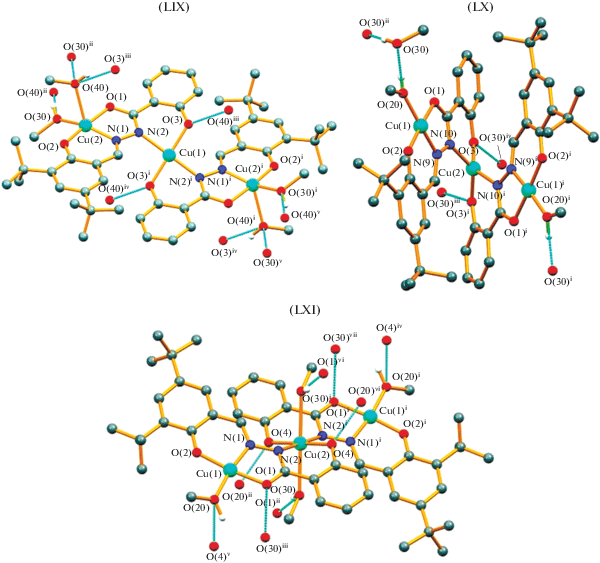
В [125] получены трехядерные изомерные комплексы Cu(II) [Cu3(L)2(MeOH)4] (LIX), [Cu3(L)2-(MeOH)2] 2MeOH (LX) и [Cu3(L)2(MeOH)4] (LXI) (рис. 29). При взаимодействии основания Шиффа (3,5-ди-трет-бутил-2-гидроксибензилиден)-2-гидроксибензогидразида (H3L) с нитратом, ацетатом или метаборатом меди(II) (cхема 15). В этих соединениях лиганд L проявляет дианионный (HL2–) в LIX или трианионный (L3–) в LX и LXI пентадентатные способы хелатирования в енольной форме. Измерения магнитной восприимчивости при различной температуре (2–300 K) показали, что во всех трех комплексах наблюдается сильное антиферромагнитное взаимодействие между ионами меди(II).
Схема 15 .
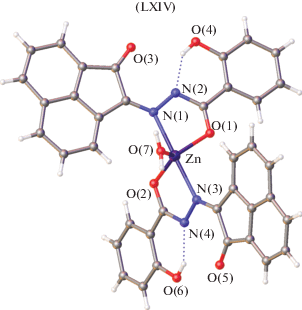
В некоторых случаях енольная и кето-формы лигандов одновременно координируются с ионом металла. В [126] получены комплексы Fe(III) и Co(III) [Fe(L1)(HL1)] (LXII) и [Co(L2)(HL2)] (LXIII) на основе (3,5-ди-трет-бутил-2-гидроксибензилиден)-2-гидроксибензогидразида (H2L1) и (3,5-ди-трет-бутил-2,3-дигидроксибензилиден)-2-гидроксибензогидразида (H2L2) (рис. 30). Структурные исследования показали присутствие как кето-, так и енольных таутомерных форм лиганда в LXII и LXIII. Оба катиона металла в этих соединениях имеют октаэдрическую геометрию, включающую два неэквивалентных тридентатных лиганда и приводящую к координационным узлам N2O4.
На основе 2-гидрокси-N'-(1-оксоаценафтилен-2(1H)илиден) бензогидразидного лиганда (H2L) получен моноядерный комплекс цинка(II), [Zn- (HL)2H2O] (LXIV) [127] (рис. 31). Лиганд хелатирует с металлическим центром двумя атомами азота иминогруппы и двумя атомом кислорода енольной группы. Комплекс имеет искаженную тригонально-бипирамидальную геометрию вокруг иона цинка(II) с атомами кислорода, лежащими в экваториальной плоскости, и атомами азота иминогруппами в осевом направлении и дополнительным атомом кислорода воды.
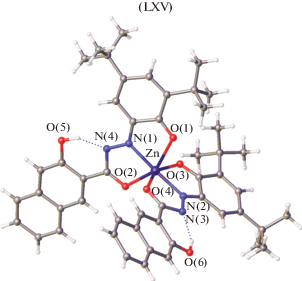
В [128] cинтезированы новые комплексы Zn(II), Cd(II), Ni(II) и Со(II) с 3-гидроксинафтоилгидразона-3,5-ди-трет-бутилбензохиноном-1,2. Структура комплекса цинка LXV определена методом РСА (рис. 32). К атому Zn в комплексе тридентатно координированы два органических лиганда, представляющие собой монодепротонированный 3-гидроксинафтоилгидразон 3,5-ди-трет-бутилбензохинон-1,2 в енольной форме. Координационный полиэдр атома цинка в комплексе LXV – искаженный октаэдр, образованный двумя атомами азота и четырьмя атомами кислорода.
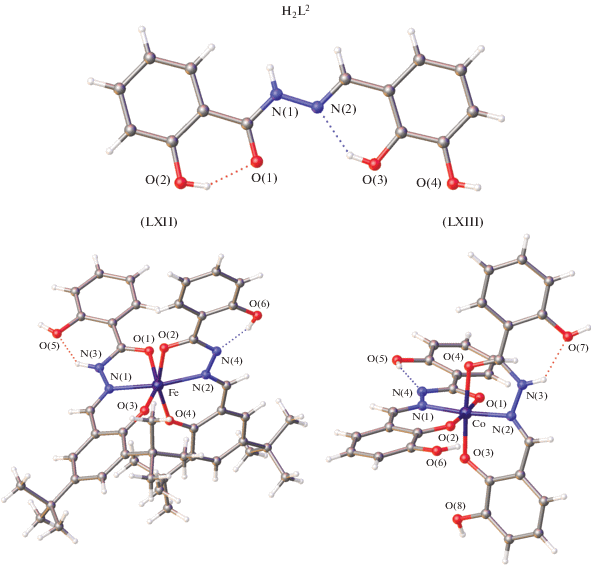
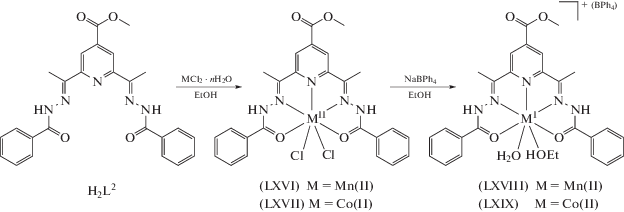
В [129] получены комплексы Mn(II) и Co(II) функционализированного донорного лиганда N3O2H2L2, где H2L2 – 2,6-диацетил-4-карбоксиметилпиридин-бис(бензоилгидразон) изучено их строение (схема 16 , рис. 33).
Схема 16 .
Показано, что лиганд H2L2 координирует в кето-форме с образованием комплексов [M(H2L2)- (Cl2)] (M = Mn(II) (LXVI), Co(II) (LXVII)), тогда как в комплексах [М(HL2)(H2O)(EtOH)]BPh4] (M = Mn(II) (LXVIII), Co(II) (LXIX)) одновременно присутствуют кето- и енольная формы лиганда. Структура комплексов LXVIII и LXIX определена РСА. Они оказались изоструктурными с искаженными пентагонально-бипирамидальными координированными ионами марганца(II) и кобальта(II), с дополнительными координациями молекул H2O и EtOH в аксиальных положениях.
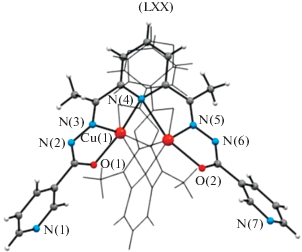
В то же время в ряде работ [130–132] описаны комплексы меди(II) и никеля(II) с бис-гидразонами диацетилпиридина (H2L), в которых, вместо обычной для подобных систем пентадентатной координации к одному иону, два органических лиганда координируются с двумя ионами металла в качестве гексадентатных мостиков. При этом мостиковую функцию выполняет пиридиновый атом азота, что является необычным. Структура комплекса LXX с бис-изоникотиноилгидразоном диацетилпиридина состава Cu2L2 [132] приведена на рис. 34.
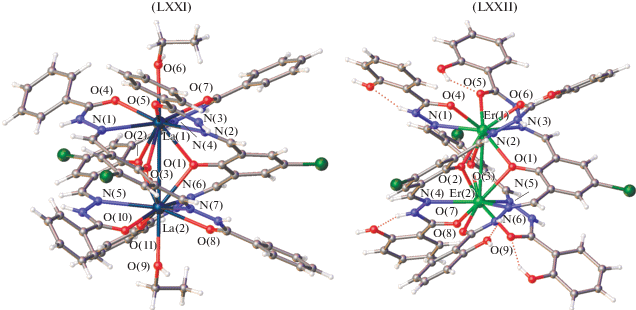
В литературе имеется значительное количество структурных данных по комплексам переходных и редкоземельных металлов с так называемыми лигандами робсоновского типа – бис-азометинам и бис-гидразонам 2,6-диформил-4-R-фенолов, строение которых предполагает образование биядерных комплексов [133]. В [134] синтезированы два основания Шиффа (H3L1 и H5L2), полученные из 2,6-диформил-4-хлорфенола и гидразидов, и их комплексы с некоторыми лантанидами (Y, La, Nd, Sm, Dy и Er) (рис. 35). Рентгеноструктурный анализ монокристаллов двух комплексов [La2(H2L1)3(C2H5OH)2](Cl)(NO3)2((CH3)2-CO)2(H2O)2 (LXXI) и [Er2(H4L2)3](SCN)3(H2O) (LXXII) выявил, что лиганды координируются к ионам лантанидов(III) в кето-форме. Ионы металлов соединены внутримолекулярными мостиками тремя фенольными атомами кислорода, образуя биядерные комплексы. Ионы лантана(III) в LXXI десятикоординированы и связывают три иминных атома азота, три нейтральных атома кислорода гидразона, три фенолятных атома кислорода трех молекул лиганда и один нейтральный атом кислорода этанола. Ионы эрбия(III) в LXXII девятикоординированы и связаны с тремя атомами кислорода карбонильных групп, тремя атомами азота азометиновых групп и тремя фенолятными атомами кислорода.
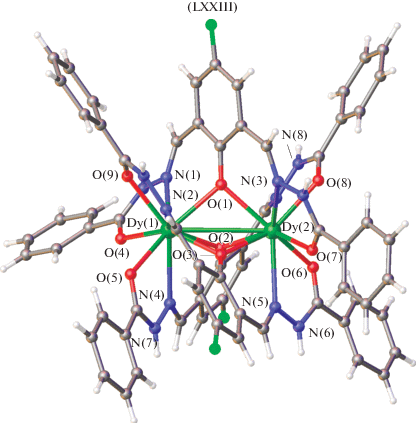
Сходный способ координации имеет место в комплексах Dy(III) LXXIII, LXXIV с бис-ароилгидразонами 2,6-диформил-4-R-фенолов (H3L) состава [Dy2(H2L)3] · 3NO3 (для LXXIII выбран H3L1: R1 = F, R2 = H; для LXXIV – H3L2: R1 = OMe, R2 = Me). Эти комплексы представляют собой рацемическую смесь право- и левосторонних геликатов (рис. 36) и демонстрируют магнитные свойства, характерные для молекулярных магнетиков [135].
Биядерные комплексы переходных металлов 1-го ряда с робсоновскими лигандами хорошо исследованы в качестве удобных моделей для изучения факторов, влияющих на характер и силу магнитного обменного взаимодействия между парамагнитными центрами [136].
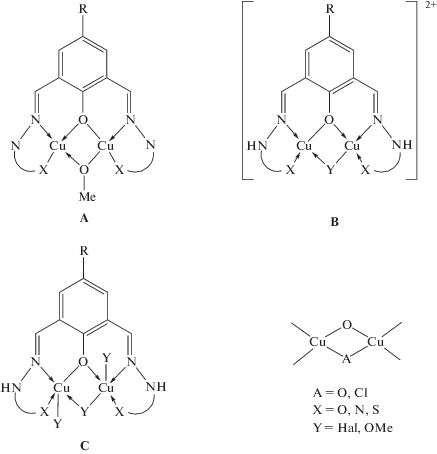
Структура бис-гидразона, выступающего в качестве гексадентатно-мостикового лиганда, предполагает наличие в комплексной молекуле “экзогенного” мостикового фрагмента, в качестве которого выступают метоксил-(гидроксил-) либо галогенид-ионы (схема 17 ) [137].
Схема 17 .
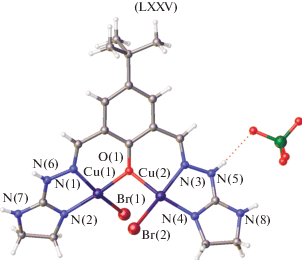
Вместе с тем в [138] описана структура комплекса меди(II) с бис-имидазолинилгидразоном 2,6-диформил-4-трет-бутилфенола LXXV, в котором два иона металла связаны только феноксидным мостиком (рис. 37).
В биядерных комплексах данного типа робсоновский лиганд может находиться как в енольной (α-оксиазинной), так и в кетонной (гидразонной) форме, что обусловлено, прежде всего, природой соли металла, используемой при синтезе. Так, с ацетатом Cu(II) бис-гидразоны образуют комплексы, содержащие трижды депротонированную (α-оксиазинную) форму лиганда, а с галогенидами, нитратом и перхлоратом – монодепротонированную (гидразонную) [137].
При этом с ацетатом, нитратом и перхлоратом Cu(II) образуются комплексы, содержащие либо гидроксильный, либо алкоксильный экзогенный мостик и имеющие практически плоское строение обменного фрагмента, что приводит к сильному антиферромагнитному взаимодействию между парамагнитными центрами. При взаимодействии с галогенидами комплекс, как правило, содержит галогенидный мостиковый лиганд, что приводит к существенному искажению структуры комплекса и, как следствие, к ослаблению антиферромагнитного обменного взаимодействия [136].
Таким образом, проведенный анализ научной литературы свидетельствует. что в комплексах металлов ароил(ацил)гидразонов: 2-гидрокси-, 2‑(N-тозиламино)бензальдегидов, кетонов, 2,6-диформилфенолов, тиофенолов существует многообразие способов координации лигандов к металлам, как в кето- (гидразонной) или енольной, так и одновременно в обоих формах в зависимости от природы лигандов, вида атомов металлов, условий синтеза. Так, при использовании ацетатов металлов при синтезе комплексов ароил(ацил)гидразонов обычно образуют соединения, содержащие лиганды в енольной форме, тогда как с галогенидами, нитратами или перхлоратами металлов в образующихся комплексах лиганды координируют в монодепротонированной (кетонной) форме. Показано, что гидроксигруппа салицилоилгидразонного фрагмента, в подавляющем большинстве случаев, не участвует в координации к металлу. Приведены сведения о практически значимых свойствах комплексов ароил(ацил)гидразонов: биологической активности, фото- и электролюминесценции, каталитической активности и магнитных характеристиках.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Rollas S., Küçükgüzel S.G. // Molecules. 2007. V. 12. № 8. P. 1910. https://doi.org/10.3390/12081910
Wang O., Pan Y., Wang J. et al. // African J. Biotech. 2011. V. 10. № 78. 18013. https://doi.org/10.5897/AJB10.2501
Xia L.X., Xia Y.F., Huang L.R. et al. // Eur. J. Med. Chem. 2015. V. 97. P. 83. https://doi.org/10.1016/j.ejmech.2015.04.042
Нуркенов О.А., Сатпаева Ж.Б., Щепеткин И.А. и др. // Журн. общ. химии. 2017. Т. 87. № 10. С. 1639 (Nurkenov O.A., Satpaeva Z.B., Schepetkin I.A. et al. // Russ. J. Gen. Chem. 2017. V. 87. P. 2299). https://doi.org/10.1134/S1070363217100097
Raju V.V., Balasubramanian P.K., Chinnusamy V. // Asian J. Chem. 2010. V. 22. № 9. P. 7318.
Ferraz K.S.O., Silva N.F., Silva J.G. et al. // Eur. J. Org. Chem. 2012. V. 53. P. 98. https://doi.org/10.1016/j.ejmech.2012.03.040
Singh V.P., Singh S., Katiyar A. // J. Enz. Inhib. Med. Chem. 2009. V. 24. № 2. P. 577. https://doi.org/10.1080/14756360802318662
Küçük H. B., Mataraci E., Çelik B.Ö. // Turkish J. Chem. 2015 V. 1. № 1. P. 1. https://doi.org/10.3906/kim-1502-122
Lisina S.V., Brel’ A.K., Mazanova L.S. et al. // Pharm. Chem. J. 2008. V. 42. № 10. P. 574. https://doi.org/10.1007/s11094-009-0184-4
El-Gammal O.A., Rakha T.H., Metwally H.M. et al. // Spectrochim. Acta Mol. Biomol. Spectrosc. 2014. V. 127. P. 144. https://doi.org/10.1016/j.saa.2014.02.008
Badiger D.S., Hunoor R.S., Patil B.R. et al. // J. Mol. Struct. 2012. V. 1019. P. 159. https://doi.org/10.1016/j.molstruc.2012.02.062
Singh V.P., Singh S., Singh D.P. // J. Enzym. Inhib. 2012. V. 27. P. 319. https://doi.org/10.3109/14756366.2011.588228
Abd El-Hady M.N., Zaky R.R., Ibrahim K.M. et al. // J. Mol. Struct. 2012. V. 1016. P. 169. https://doi.org/10.1016/j.molstruc.2012.02.006
Singh V.P., Gupta P. // J. Enzym. Inhib. 2008. V. 23. P. 797. https://doi.org/10.1080/14756360701733136
Mohan M., Gupta N.S., Gupta M.P. et al. // Inorg. Chim. Acta. 1988. V. 152. № 1. P. 25. https://doi.org/10.1016/s0020-1693(00)90726-6
Kaplanek R., Havlík M., Dolenský B. et al. // Bioorg. Med. Chem. 2015. V. 23. P. 1651. https://doi.org/10.1016/j.bmc.2015.01.029
Hunoor R.S., Patil B.R., Badiger D.S. et al. // Appl. Organomet. Chem. 2015. V. 29. P. 101. https://doi.org/10.1002/aoc.3252
Bakale R.P., Pathan A.H., Naik G.N. et al. // Appl. Organomet. Chem. 2014. V. 28. P. 720. https://doi.org/10.1002/aoc.3190
Tan S.J., Sk M.A., Lee P.P.F. et al. // Canad. J. Chem. 2012. V. 90. № 9. P. 762. https://doi.org/10.1139/v2012-053
Backes G.L., Neuman D.M., Jursic B.S. // Bioorg. Med. Chem. 2014. V. 22. № 17. P. 4629. https://doi.org/10.1016/j.bmc.2014.07.022
Ainscough E.W., Brodie A.M., Denny W.A. et al. // J. Inorg. Biochem. 1999. V. 77. № 3–4. P. 125. https://doi.org/10.1016/s0162-0134(99)00131-2
Rao S.N., Munshi K.N., Rao N.N. // J. Mol. Catal. A: Chem. 2000. V. 156. № 1−2. P. 205. https://doi.org/10.1016/s1381-1169(99)00413-6
Sutradhar M., Martins L.M.D.R.S., Guedes da Silva M.F.C. et al. // Appl. Catal. A. 2015. V. 493. P. 50. https://doi.org/10.1016/j.apcata.2015.01.005
Clark J., Macquarrie D. Handbook of Green Chemistry and Technology. Oxford: Backwell, 2002.
Shilov A.E., Shul’pin G.B. Activation and Catalytic Reactions of Saturated Hydrocarbons in the Presence of Metal Complexes. Dordrecht (The Netherlands): Kluwer Academic Publishers, 2000.
Pombeiro A.J.L. // Advances in Organometallic Chemistry and Catalysis / Ed. Pombeiro A.J.L., Hoboken (NJ): Wiley, 2013. Ch. 2. P. 15.
Gruenwald K.R., Kirillov A.M., Haukka M. et al. // Dalton Trans. 2009. P. 2109. https://doi.org/10.1039/b813160k
Kirillova M.V., Kirillov A.M., Martins A.N.C. et al. // Inorg. Chem. 2012. V. 51. P. 5224. https://doi.org/10.1021/ic300123d
Schuchardt U., Cardoso D., Sercheli R. et al. // Appl. Catal. A. 2001. V. 211. P. 1. https://doi.org/10.1016/S0926-860X(01)00472-0
Shul’pin G.B., Kozlov Y.N., Shul’pina L.S. et al. // Ap-pl. Organomet. Chem. 2010. V. 24. P. 464. https://doi.org/10.1002/aoc.1641
Martins L.M.D.R.S., Pombeiro A.J.L. // Advances in Organometallic Chemistry and Catalysis / Ed. Pombeiro A.J.L. Weinheim (Germany): Wiley-VCH, 2013. Ch. 22. P. 285.
Martins L.M.D.R.S., Pombeiro A.J.L. // Coord. Chem. Rev. 2014. V. 265. P. 74. https://doi.org/10.1016/j.ccr.2014.01.013
Jaiswal V., Gupta S.R., Rastogi R.B. et al. // J. Mater. Chem. A. 2015 V. 3. № 9. P. 5092. https://doi.org/10.1039/c4ta05663a
Rastogi R.B., Maurya J.L., Jaiswal V. // Tribol. Trans. 2013 V. 56. P. 592. https://doi.org/10.1080/10402004.2012.748115
Wan Y., Liu W.M., Xue Q. // Lubr. Sci. 1995. V. 7. P. 187. https://doi.org/10.1002/ls.3010070208
Rastogi R.B., Maurya J.L., Jaiswal V. // Wear. 2013. V. 297. P. 849. https://doi.org/10.1016/j.wear.2012.10.003
Коган В.А., Луков В.В. // Коорд. хим. 1997. Т. 23. № 1. С. 13 (Kogan V.A., Lukov V.V. // Russ. J. Coord. Chem. 1997. V. 23. № 1. P. 18).
Попов Л.Д., Туполова Ю.П., Левченков С.И. и др. // Коорд. химия. 2007. Т. 33. № 3. С. 216 (Popov L.D., Tupolova Y.P., Levchenkov S.I. et al. // Russ. J. Coord. Chem. 2007. V. 33. P. 208). https://doi.org/10.1134/S1070328407030098
Tupolova, Y.P., Popov, L.D., Lukov, V.V. et al. // Anorg. Allg. Chem. 2009. V. 635. № 3. P. 530. https://doi.org/10.1002/zaac.200801299
Луков В.В., Щербаков И.Н., Левченков С.И. и др. // Коорд. химия. 2019. Т. 45. № 3. С. 131 (Lukov V.V., Shcherbakov I.N., Levchenkov S.I. et al. // Russ. J. Coord. Chem. 2019. V. 45. P. 163). https://doi.org/10.1134/s0132344x1903006x
Zhang K., Guo F.S., Wang Y.Y. // Inorg. Chem. Commun. 2017. V. 76. P. 95. https://doi.org/10.1016/j.inoche.2017.01.005
Le Guennic B., Petit S., Chastanet G. et al. // Inorg. Chem. 2008. V. 47. P. 572. https://doi.org/10.1021/ic701758x
Gautier-Luneau I., Phanon D., Duboc C. et al. // Dalton Trans. 2005. P. 3795. https://doi.org/10.1039/b506934c
Rigamonti L., Cinti A., Forni A. et al. // Eur. J. Inorg. Chem. 2008. P. 3633. https://doi.org/10.1002/ejic.200800372
Anwar M.U., Thompson L.K., Dawe L.N. // Dalton Trans. 2011. V. 40. P. 1437. https://doi.org/10.1039/c0dt01606c
Köhn R.D., Laudo L.T., Pan Z. et al. // Dalton Trans. 2009. P. 4556. https://doi.org/10.1039/b819268e
Гусев А.Н., Брага Е.В., Крюкова М.А. и др. // Коорд. химия. 2020. Т. 46. № 4. С. 232 (Gusev A.N., Braga E.V., Kryukova M.A. et al. // Russ. J. Coord. Chem. 2020. V. 46. P. 251). https://doi.org/10.1134/S107032842004003X
Utochnikova V.V., Kovalenko A.D., Burlov A.S. et al. // Dalton Trans. 2015. V. 44. № 28. P. 12660. https://doi.org/10.1039/c5dt01161b
Kovalenko A.D., Bushmarinov I.S., Burlov A.S. et al. // Dalton Trans. 2018. V. 47. P. 4524. https://doi.org/10.1039/c7dt04387b
Kovalenko A.D., Rublev P.O., Tcelykh L.O. et al. // Chem. Mater. 2019. V. 31. P.759. https://doi.org/10.1021/acs.chemmater.8b03675
Попов Л.Д., Ткачев В.В., Туполова Ю.П. и др. // Журн. неорган. химии. 2017. Т. 62. № 7. С. 912 (Popov L.D.,Tkachev V.V., Tupolova Y.P. et al. // Russ. J. Inorg. Chem. 2017. V. 62. № 7. P. 893). https://doi.org/10.1134/S003602361707018X
Левченков С.И., Попов Л.Д., Щербаков И.Н. и др. // Журн. общ. химии. 2016. Т. 86. № 5. С. 802 (Levchenkov S.I., Popov L.D., Scherbakov I.N. et al. // Russ. J. Gen. Chem. 2016. V. 86. № 5. P. 1064). https://doi.org/10.1134/S1070363216050133
Попов Л.Д., Туполова Ю.П., Левченков С.И. и др. // Журн. общ. химии. 2015. Т. 85. № 8. С. 1347 (Popov L.D., Tupolova Yu.P., Levchenkov S.I. et al. // Russ. J. Gen. Chem. 2015. V. 85. № 8. P. 1902). https://doi.org/10.1134/S1070363215080186
Попов Л.Д., Морозов А.Н., Распопова Е.А. и др. // Журн. общ. химии. 2015. Т. 85. № 1. С. 135 (Popov L.D., Morozov A.N., Raspopova E.A. et al. // Russ. J. Gen. Chem. 2015. V. 85. № 1. P. 126). https://doi.org/10.1134/S1070363215010223
Попов Л.Д., Левченков С.И., Щербаков И.Н. и др. // Коорд. химия. 2013. Т. 39. № 5. С. 259 (Popov L.D., Levchenkov S.I., Shcherbakov I.N. et al. // Russ. J. Coord. Chem. 2013. V. 39. № 5. P. 367). https://doi.org/10.1134/S107032841304009X
Попов Л.Д., Распопова Е.А., Морозов А.Н. и др. // Коорд. химия. 2014. Т. 40. № 11. С. 668 (Popov L.D., Raspopova E.A., Morozov A.N. et al. // Russ. J. Coord. Chem. 2014. V. 40. № 11. P. 806). https://doi.org/10.1134/S1070328414110050
Попов Л.Д., Щербаков И.Н., Левченков С.И. и др. // Коорд. химия. 2011. Т. 37. № 7. С. 483 (Popov L.D., Shcherbakov I.N., Levchenkov S.I. et al. // Russ. J. Coord. Chem. 2011. V. 37. P. 483). https://doi.org/10.1134/S1070328411060078
Коган B.A., Зеленцов B.B., Гэрбэлэу H.B. и др. // Журн. неорган. химии. 1986. Т. 31. № 11. С. 2831.
Nagano R., Kiroshita H., Hirakawa A. // Chem. Pharm. Bull. 1964. V. 12. P. 1198. https://doi.org/10.1248/cpb.12.1198
Aggarwal R.C. Bahadur A. // Indian J. Chem. 1969. V. 7. № 10. P. 1038.
El Sayed L., Iskander M.F. // J. Inorg. Nuc. Chem. 1971. V. 33. P. 435. https://doi.org/10.1016/0022-1902(71)80386-x
Iskander M.F., Zayan S.E., Khalifa M.A., El-Sayed L. // J. Inorg. Nucl. Chem. 1974. V. 36. № 3. P. 551. https://doi.org/10.1016/0022-1902(74)80112-0
Narang K.K., Aggarwal A. // Trans. Met. Chem. 1977. V. 2. № 1. P. 29. https://doi.org/10.1007/bf01402673
Гогошвили П.В. Каркарашвили М.В. Каландарашвили Д.З. // Журн. неорган. химии. 1969. Т. 14. № 6. С. 1516.
Rastogi D.K., Pachauri P.C., Rana V.B. et al. // Acta Chim. Acad. Sci. Hungar. 1977. V. 95. № 2–3. P. 223.
Iskander M.F., El-Sayed L., Saddeck S. et al. // Trans. Met. Chem. 1980. V. 5. № 1. P. 168. https://doi.org/10.1007/bf01396903
Zou L.F., Yang X.Y., Wang D.X. et al. // Asian J. Chem. 2012. V. 24. P. 2909.
Biradar N.S., Mahale V.B., Havinale B.R. // Curr. Sci. 1976. V. 45. № 1. P. 6. https://www.jstor.org/stable/ 24215120.
Jahagirdar J.A., Patil B.G., Havinale B.R. // Indian J. Chem. A. 1991. V. 30. № 5. P. 471. http://nopr.niscair.res.in/handle/123456789/41894.
Syamal A. Gurta B.K. // Rev. Roum. Chim. 1982. V. 45. № 8. P. 927.
Issa R.M., El-Shazly M.F., Iskander M.F. et al. // Anorg. Allg. Chem. 1967. V. 354. № 1–2. P. 90. https://doi.org/10.1002/zaac.19673540118
Aruffo A.A., Murphy T.B., Johnson D.K. et al. // Inorg. Chim. Acta. 1982. V. 67. № 4. P. L25. https://doi.org/10.1016/S0020-1693(00)85021-5
Aruffo A.A., Murphy T.B., Johnson D.K. et al. // Acta Crystallogr. C. 1984. V. 40. № 7. P. 1164. https://doi.org/10.1107/s0108270184007198
Левченков С.И., Щербаков И.Н., Луков В.В., Коган В.А. // Коорд. химия. 1997. Т. 23. № 4. С. 293 (Levchenkov S.I., Shcherbakov I.N., Lukov V.V., Kogan V.A. // Russ. J. Coord. Chem. 1997. V. 23. № 4. P. 271).
Левченков С.И., Луков В.В., Коган В.А. // Коорд. химия. 1997. Т. 23. № 5. С. 380 (Levchenkov S.I., Lukov V.V., Kogan V.A. // Russ. J. Coord. Chem. 1997. V. 23. № 5. P. 349).
Луков В.В., Левченков С.И., Щербаков И.Н., Коган В.А. // Коорд. химия. 1997. Т. 23. № 7. С. 544 (Lukov V.V., Levchenkov S.I., Shcherbakov I.N., Kogan V.A. // Russ. J. Coord. Chem. 1997. V. 23. № 7. P. 507).
Biradar N.S., Havinale B.R. // Inorg. Chim. Acta. 1976. V. 17. P. 157. https://doi.org/10.1016/s0020-1693(00)81975-1
Koh L.L., Kon O.L., Loh K.W. et al. // J. Inorg. Biochem. 1998. V. 72. P. 155. https://doi.org/10.1016/s0162-0134(98)10075-2
Syamal A., Kale K.S. // Indian J. Chem. A. 1978. V. 16. № 1. P. 46.
Rastogi D.K., Dua S.K., Sahni S.K. // J. Inorg. Nucl. Chem. 1980. V. 42. № 3. P. 323. https://doi.org/10.1016/0022-1902(80)80002-9
Rastogi D.K., Sahni S.K., Rana V.B. et al. // J. Inorg. Nucl. Chem. 1979. V. 41. № 1. P. 21. https://doi.org/10.1016/0022-1902(79)80386-3
Rastogi D.K., Sahni S.K., Rana V.B. et al. // J. Coord. Chem. 1978. V. 8. № 2. P. 97. https://doi.org/10.1080/00958977808073078
Туполова Ю.П., Луков В.В., Коган В.А. и др. // Коорд. химия. 2007. Т. 33. № 4. С. 310 (Tupolova Yu.P., Lukov V.V., Kogan V.A. et al. // Russ. J. Coord. Chem. 2007. V. 33. № 4. P. 301).https://doi.org/10.1134/s1070328407040112
Луков В.В., Кныш А.А. Любченко и др. // Коорд. химия. 2002. Т. 28. № 12. С. 934 (Lukov V.V., Knysh A.A., Lyubchenko S.N. et al. // Russ. J. Coord. Chem. 2002. V. 28. № 12. P. 874). https://doi.org/10.1023/A:1021642530810
Луков В.В., Туполова Ю.П., Коган В.А. и др. // Коорд. химия. 2003. V. 29. № 5. P. 359 (Lukov V.V., Tupolova Yu.P., Kogan V.A. et al. // Russ. J. Coord. Chem. 2003. V. 29. № 5. P. 335). https://doi.org/10.1023/a:1023675801876
Repich H.H., Orysyk S.I., Orysyk V.V. et al. // J. Mol. Struct. 2017. V. 1146. P. 222. https://doi.org/10.1016/j.molstruc.2017.05.140
Alagesan M., Bhuvanesh N.S.P., Dharmaraj N. // Eur. J. Med. Chem. 2014. V. 78. P. 281. https://doi.org/10.1016/j.ejmech.2014.03.043
Попов Л.Д., Туполова Ю.П., Левченков С.И. и др. // Коорд. химия. 2007. Т. 33. № 3. С. 216 (Popov L.D., Tupolova Y.P., Levchenkov S.I. et al. // Russ. J. Coord. Chem. 2007. V. 33. № 3. P. 208). https://doi.org/10.1134/s1070328407030098
Попов Л.Д., Левченков С.И., Щербаков И.Н. и др. // Журн. общ. химии. 2010. Т. 80. № 3. С. 471 (Po-pov L.D., Levchenkov S.I., Shcherbakov I.N. et al. // Russ. J. Gen. Chem. 2010. V. 80. № 3. P. 493) https://doi.org/10.1134/S1070363210030217
Бурлов А.С., Гарновский А.Д., Алексеенко В.А. и др. // Коорд. химия. 1992. Т. 18. № 8. С. 859.
Левченков С.И., Луков В.В., Коган В.А., Анимимова Б.А. // Коорд. химия. 1997. Т. 23. № 3. С. 178 (Levchenkov S.I., Lukov V.V., Kogan V.A., Anisimova B.A. // Russ. J. Coord. Chem. 1997. V. 23. № 3. P. 163).
Луков В.В., Коган В.А., Епифанцев А.П. и др. // Журн. неорган. химии. 1990. Т. 35. № 5. С. 1336.
Луков В.В., Коган В.А., Богатырева Е.В. и др. // Журн. неорган. химии. 1989. Т. 34. № 10. С. 2554.
Dash S. P., Pasayat S., Bhakat S. et al. // Inorg. Chem. 2013. V. 52. № 24. P. 14096. https://doi.org/10.1021/ic401866x
Mishra M., Tiwari K., Singh A. K. et al. // Polyhedron. 2014. V. 77. P. 57. https://doi.org/10.1016/j.poly.2014.04.003
Sutradhar M., Mukherjee G., Drew M.G.B. et al. // Inorg. Chem. 2006. V. 45. № 13. P. 5150. https://doi.org/10.1021/ic051120g
Dinda R., Ghosh S., Falvello L.R. et al. // Polyhedron. 2006. V. 25. № 12. P. 2375. https://doi.org/10.1016/j.poly.2006.02.002
Rao S.N., Munshi K.N., Rao N.N. // J. Mol. Catal. A: Chem. 1999. V. 145. № 1–2. P. 203. https://doi.org/10.1016/s1381-1169(99)00023-0
Rao S.N., Munshi K.N., Rao N.N. et al. // Polyhedron. 1999. V. 18. № 19. P. 2491. https://doi.org/10.1016/s0277-5387(99)00139-4
Ming La, Pan-Pan Wang, Ling-Wei Xue // Inorg. Nano-Met. Chem. 2020. V. 50. P. 151. https://doi.org/10.1080/24701556.2019.1694038
Song-Zhu Lin, Ruo-Kun Jia, Yan-Lin Yuan et al. // Acta Crystallogr. E. 2009. V. 65. Pt. 11. P. m1422. https://doi.org/10.1107/S1600536809042810
Li P., Li D., Shi X. // Acta Crystallogr. E. 2009. V. 65. Pt. 7. P. m738. https://doi.org/10.1107/S1600536809020546
Dong Yan Xu, Ying Liu, Ming Li Liu et al. // Acta Crystallogr. E. 2006. V. 62. № 4. P. m671. https://doi.org/10.1107/S1600536806006696
Zhao S., Li L., Liu X. et al. // Acta Crystallogr. E. 2012. V. 68. № 9. P. m1216. https://doi.org/10.1107/S1600536812036100
Sutradhar M., Rajeshwari, Barman T.R. et al. // J. Inorg. Biochem. 2017. V. 175. P. 267. https://doi.org/10.1016/j.jinorgbio.2017.07.034
Liu H., Lu Z., Niu D. // Coord. Chem. 2008. V. 61. № 24. P. 4040. https://doi.org/10.1080/00958970802213476
Borbone F., Caruso U., Concilio S. et al. // Eur. J. Inorg. Chem. 2016. V. 2016. № 6. P. 818. https://doi.org/10.1002/ejic.201501132
Borbone M.A.F., Caruso U., Causà M. et al. // Eur. J. Inorg. Chem. 2014. V. 2014. № 34. P. 5916. https://doi.org/10.1002/ejic.201402717
Xue L.W., Zhang H.J., Wang P.P. // Acta Chim. Slovenica. 2019. V. 66. № 1. P. 190. https://doi.org/10.17344/acsi.2018.4773
Ling-Wei Xue, Hui-Jie Zhang, Pan-Pan Wang // Acta Chim. Slovenica. 2019. V. 66. P. 190.
Wu Y., Shi H.M., Jia B. et al. // Acta Crystallogr. E. 2006. V. 62. № 3 P. m648–m649. https://doi.org/10.1107/S160053680600657X
Xiao-Hua Chen, Qiong-Jie Wu, Zhi-Yu Liang et al. // Acta Crystallogr. C. 2009. V. 65. P. m190. https://doi.org/10.1107/S0108270109011263
Jin-Shang Huang, Ming-Tian Li // Acta Crystallogr. E. 2007. V. 63. P. m2170. https://doi.org/10.1107/S1600536807024944
Zhong-Qiu Hu, Shao-Min Shi, Hong-Wu He et al. // Wuji Huaxue Xuebao (Chin.) (Chin. J. Inorg. Chem.) 2007. V. 23. P. 323.
Huang J.S., Li M.T. // Acta Crystallogr. E. 2007. V. 63. № 8. P. m2170. https://doi.org/10.1107/S1600536807024944
Yu Z.X., Qi J.S., Liang K.Z. et al. // Acta Crystallogr. E. 2006. V. 62. № 12. P. m3284. https://doi.org/10.1107/S1600536806046745
Hu Z.Q., Li W.H., Ding Y. et al. // Acta Crystallogr. E. 2005. V. 61. № 12. P. m2526. https://doi.org/10.1107/S1600536805035701
Kara N.K., Singha M.K., Lalb R.A. // Arabian J. Chem. 2017. V. 10. № 1. P. S76.
Suganthy P.K., Prabhu R.N., Sridevi V.S. // Polyhedron. 2015. V. 88. P. 57. https://doi.org/10.1016/j.poly.2014.12.016
Li-Hang Wang, Xiao-Yang Qiu et al. // J. Coord. Chem. 2019. V. 72. № 5–7. P. 962. https://doi.org/10.1080/00958972.2019.1590561
Zhang S.P., Wei Y., Shao S.C. // Acta Crystallogr. E. 2010. V. 66. № 12. m1635. https://doi.org/10.1107/S1600536810047719
Hatefi M., Sheikhshoaie I., Moghadam M. et al. // Acta Crystallogr. E. 2010. V. 66. № 7. P. m726. https://doi.org/10.1107/S1600536810019902
Zhang K., Guo F.S., Wang Y.Y. // Inorg. Chem. Commun. 2017. V. 76. P. 95. https://doi.org/10.1016/j.inoche.2017.01.005
Costes J.P, Duhayon C., Vendier L. // Inorg. Chem. 2014. V. 53. № 4. P. 2181. https://doi.org/10.1021/ic4027283
Sutradhar M., Martins L.M.D.R.S., Guedes da Silva M.F.C. et al. // Eur. J. Inorg. Chem. 2015. P. 3959. https://doi.org/10.1002/ejic.201500440
Sutradhar M., Alegria E.C.B.A., Mahmudov K.T. et al. // RSC Adv. 2016. V. 6. P. 8079. https://doi.org/10.1039/c5ra25774c
Kumar M., Roy S., Md. Faizi S.H., Kumar S. et al. // J. Mol. Struct. 2017. V. 1128. P. 195. https://doi.org/10.1016/j.molstruc.2016.08.004
Бурлов А.С., Зайченко С.Б., Попов Л.Д. и др. // Журн. общ. химии. 2019. Т. 89. № 4. С. 597 (Burlov A.S., Zaichenko S.B., Popov L.D. et al. // Russ. J. Gen. Chem. 2019. V. 89. № 4. P. 727). https://doi.org/10.1134/S1070363219040157
Schleife F., Rodenstein A., Kirmse R. et al. // Inorg. Chim. Acta. 2011. V. 374. № 1. P. 521. https://doi.org/10.1016/j.ica.2011.02.064
Paolucci G., Stelluto S., Sitran S. et al. // Inorg. Chim. Acta. 1992. V. 193. № 1. P. 57. https://doi.org/10.1016/S0020-1693(00)83797-4
Koziol A.E., Palenik R.C., Palenik G.J., Wester D.W. // Inorg. Chim. Acta. 2006. V. 359. № 8. P. 259. https://doi.org/10.1016/j.ica.2006.01.042
Данилеску О., Булхак И., Шова С. и др. // Коорд. химия. 2020. Т. 46. № 12. С. 758 (Danilescu O., Bulhac I., Shova S. et al. // Russ. J. Coord. Chem. 2020. V. 46. № 12. P. 838). https://doi.org/10.1134/S1070328420090018
Robson R. // Austr. J. Chem. 1970. V. 23. № 11. P. 2217. https://doi.org/10.1071/CH9702217c
Tamboura F.B., Diouf O., Barry A.H. et al. // Polyhedron. 2012. V. 43. № 1. P. 97. https://doi.org/10.1016/j.poly.2012.06.025
Beloborodov S.S., Levchenkov S.I., Popov L.D. et al. // Mendeleev Commun. 2014. V. 24. N 4. P. 219. https://doi.org/10.1016/j.mencom.2014.06.010
Попов Л.Д., Морозов А.Н., Щербаков И.Н. и др. // Успехи химии. 2009. Т. 78. № 7. С. 697 (Popov L.D., Morozov A.N., Shcherbakov I.N. et al. // Russ. Chem. Rev. 2009. V. 78. № 7. P. 643). https://doi.org/10.1070/RC2009v078n07ABEH003890
Lukov V.V., Tsaturyan A.A., Tupolova Yu.P. et al. // Mendeleev Comm. 2019. V. 29. № 1. P. 43. https://doi.org/10.1016/j.mencom.2019.01.013
Левченков С.И., Попов Л.Д., Щербаков И.Н. и др. // Коорд. химия. 2013. Т. 39. № 7. С. 393 (Levchenkov S.I., Popov L.D., Shcherbakov I.N. et al. // Russ. J. Coord. Chem. 2013. V. 39. № 7. P. 493). https://doi.org/10.1134/S107032841307004X
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия