Координационная химия, 2021, T. 47, № 9, стр. 568-573
Синтез и строение комплексов висмута [(2-MeO)(5-Cl)C6H3]3Bi, [(2-MeO)(5-Cl)C6H3]3Bi[OC(O)CF2Br]2 и [(2-MeO)(5-Br)C6H3]3Bi[OC(O)C6HF4-2,3,4,5]2
В. В. Шарутин 1, О. К. Шарутина 1, А. Н. Ефремов 1, *
1 Национальный исследовательский Южно-Уральский государственный университет
Челябинск, Россия
* E-mail: efremov_an94@mail.ru
Поступила в редакцию 22.01.2021
После доработки 02.02.2021
Принята к публикации 08.02.2021
Аннотация
В кристалле [(2-MeO)(5-Cl)C6H3]3Bi (I), полученном из треххлористого висмута и 2-метокси-5-хлорфениллития в эфире, атомы висмута имеют тригональное окружение лигандов. С учетом координации атомов кислорода MeO-групп на атом металла (внутримолекулярные расстояния Bi∙∙∙OМе 3.014(6), 3.088(6) и 3.168(6) Å) координационное число центрального атома составляет 6 (3 + 3). Действие гидропероксида третичного бутила на смесь I и бромдифторуксусной кислоты или [(2‑MeO)(5-Вr)C6H3]3Bi и 2,3,4,5-тетрафторбензойной кислоты в эфире приводит к синтезу тригонально-бипирамидальных дикарбоксилатов триарилвисмута [(2-MeO)(5-Cl)C6H3]3Bi[OC(O)CF2Br]2 (II), [(2-MeO)(5-Br)C6H3]3Bi[OC(O)C6HF4-2,3,4,5]2 (III), соответственно, с карбоксильными лигандами в апикальных позициях. В кристаллах II и III имеет место дополнительная координация атома металла с атомами кислорода О=С- и МеО-групп (3.05(16), 3.30(16) и 3.153(5)−3.117(5) Å для II и 3.004(7), 3.230(7) и 3.159(7)−3.199(7) Å для III). Структуры комплексов I–III изучены методом РСА (CIF files CCDC № 2044006 (I), 2044005 (II), 2048153 (III)).
До недавнего времени наиболее изученными арильными соединениями висмута были фенильные и в меньшей степени п-толильные производные. Наличие вакантных d-орбиталей у атомов висмута позволяет образовывать дополнительные координационные связи с лигандами, содержащими пространственно доступные атомы с неподеленными электронными парами, что приводит к увеличению координационного числа (КЧ) металла и часто влияет на реакционную способность соединений. Так, известны арильные производные висмута, имеющие в фенильных заместителях такие потенциальные координирующие центры, как атомы азота [1–10], кислорода [10–13], фосфора [14, 15], бора [16] и серы [10, 17, 18]. Известно, что дикарбоксилаты триарилвисмута способны оказывать антилейшманиозное действие [19–22], обладают высокой фотохимической ативностью [23], поэтому синтез и исследование свойств дикарбоксилатов триарилвисмута с потенциальными координирующими центрами в арильных лигандах является актуальной зада-чей.
В настоящей работе впервые получен комплекс [(2-MeO)(5-Cl)C6H3]3Bi (I), изучена его реакция с бромдифторуксусной кислотой в присутствии трет-бутилгидропероксида, приводящая к образованию [(2-MeO)(5-Cl)C6H3]3Bi[OC(O)CF2Br]2 (II). Аналогично получен комплекс [(2-MeO)(5-Br)- C6H3]3Bi[OC(O)C6HF4-2,3,4,5]2 (III), который после перекристаллизации из бензола охарактеризован в виде сольвата с бензолом (III · 1/2PhH). Установлены особенности строения полученных соединений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали пара-хлоранизол, бромдифторуксусную и 2,3,4,5-тетрафторбензойную кислоты (Alfa Aesar). Трис(2-метокси-5-бромфенил)висмут получали по методике для комплекса I. Перед проведением синтеза растворители бензол и октан квалификации “х. ч.” просушивали над хлоридом кальция, диэтиловый эфир – над натрием.
Синтез трис(2-метокси-5-хлорфенил)висмута (I). К смеси 5.05 г (16.0 ммоль) трихлорида висмута и 100 мл эфира прибавляли раствор 5-хлор-2-метоксифениллития в 150 мл эфира, полученного металлированием 7.00 г пара-хлоранизола фениллитием, перемешивали и выдерживали 18 ч при 20°С. К реакционной смеси прибавляли 2 мл воды, эфирный раствор фильтровали и концентрировали. Выход бесцветных кристаллов I 7.08 г (70%). Тпл = 189°С.
ИК-спектр (ν, см–1): 2955, 2934, 2901, 1564, 1455, 1431, 1377, 1288, 1280, 1259, 1231, 1177, 1138, 1097, 1041, 883, 804, 797, 665, 638, 538, 434.
Синтез бис(бромдифторацетата) трис(2-метокси-5-хлорфенил)висмута (II). К смеси 0.10 г (0.16 ммоль) комплекса I и 0.055 г (0.32 ммоль) бромдифторуксусной кислоты в 20 мл эфира прибавляли 0.02 г 70%-ного водного раствора трет-бутилгидропероксида. После испарения растворителя (12 ч) образовались бесцветные кристаллы II, которые выделяли из реакционной смеси, промывали 1 мл диэтилового эфира и высушивали на воздухе. Выход II составил 77%. Тпл = 105°С.
ИК-спектр (ν, см−1): 3088, 3005, 2945, 2843, 1714, 1689, 1583, 1558, 1473, 1440, 1386, 1352, 1280, 1267, 1249, 1166, 1149, 1139, 1105, 1033, 1004, 933, 871, 815, 705, 669, 640, 601, 542, 530, 426.
Синтез бис(2,3,4,5-тетрафторбензоата) трис(2-метокси-5-бромфенил)висмута (III) выполняли аналогично для комплекса II, но вместо комплекса I использовали [(2-MeO)(5-Вr)C6H3]3Bi, полученный по методике [13]. Выход III 88%. После перекристаллизации III из бензола получили бесцветные кристаллы III · 1/2PhH, пригодные для РСА. Тпл = 134°С.
ИК-спектр (ν, см−1): 3068, 3039, 3005, 2991, 2953, 2931, 2900, 2833, 1722, 1624, 1558, 1525, 1456, 1433, 1373, 1309, 1282, 1259, 1232, 1176, 1143, 1136, 1085, 1037, 1014, 914, 896, 883, 796, 765, 713, 694, 655, 613, 532, 516, 433.
ИК-спектры соединений I–III регистрировали на ИК-спектрометре Shimadzu IR Affinity-1S в области 4000–400 см–1 (таблетки KBr).
РСА проведен на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор) при 293 К. Сбор, редактирование данных, уточнение параметров элементарной ячейки, учет поглощения, определение и уточнение структур проведены по известным программам [24–26]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Положения атомов водорода определены геометрически по модели “наездника”. Кристаллографические данные и результаты уточнения структур приведены в табл. 1.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур I–III
| Параметр | I | II | III |
|---|---|---|---|
| М | 633.68 | 981.54 | 1192.27 |
| Сингония | Триклинная | Триклинная | Триклинная |
| Т, K | 293.15 | 293.15 | 293.15 |
| Пр. гр. | P1 | P1 | P1 |
| a, Å | 8.715(9) | 10.067(6) | 12.353(6) |
| b, Å | 9.055(9) | 11.968(7) | 13.785(9) |
| c, Å | 14.820(12) | 15.463(14) | 13.807(7) |
| α, град | 95.20(4) | 103.11(2) | 103.44(3) |
| β, град | 103.39(4) | 102.07(2) | 97.18(2) |
| γ, град | 92.05(6) | 109.886(17) | 114.41(3) |
| V, Å3 | 1131.1(18) | 1621(2) | 2016(2) |
| Z | 2 | 2 | 2 |
| ρ(выч/), г/см3 | 1.861 | 2.011 | 1.964 |
| μ, мм−1 | 8.166 | 8.214 | 7.428 |
| F(000) | 604.0 | 928.0 | 1134.0 |
| Размер кристалла, мм | 0.35 × 0.31 × 0.13 | 0.27 × 0.15 × 0.13 | 0.32 × 0.14 × 0.11 |
| 2θ, град | 5.68–55.82 | 6.06–54.56 | 6.116–56.026 |
| Интервалы индексов отражений | –11 ≤ h ≤ 11, –11 ≤ k ≤ 11, –19 ≤ l ≤ 19 |
–12 ≤ h ≤ 12, –15 ≤ k ≤ 15, –19 ≤ l ≤ 19 |
–16 ≤ h ≤ 16, –17 ≤ k ≤ 18, –18 ≤ l ≤ 18 |
| Всего отражений | 38 014 | 37 025 | 61 975 |
| Независимых отражений (Rint) | 5390 (0.0479) | 7188 (0.0410) | 9593 (0.0689) |
| Отражений с I > 2σ(I) | 4946 | 6383 | 7800 |
| Число уточняемых параметров | 256 | 382 | 557 |
| GOOF | 1.043 | 1.047 | 1.035 |
| R-факторы по F 2 > 2σ(F 2) |
R1 = 0.0278, wR2 = 0.0699 |
R1 = 0.0311, wR2 = 0.0773 |
R1 = 0.0453, wR2 = 0.1120 |
| R-факторы по всем отражениям | R1 = 0.0316, wR2 = 0.0715 |
R1 = 0.0380, wR2 = 0.0804 |
R1 = 0.0637, wR2 = 0.1215 |
| Остаточная электронная плотность (max/min), e/Å3 | 1.48/–1.85 | 0.98/–1.92 | 1.82/–1.47 |
Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2044006 (I), № 2044005 (II), № 2048153 (III); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam. ac.uk/structures).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Трис(2-метокси-5-хлорфенил)висмут (I) синтезировали из 2-метокси-5-хлорфениллития и треххлористого висмута в эфире:
(I)
$\begin{gathered} 3[({\text{2 - MeO}})({\text{5 - Cl}}){{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{3}}]{\text{Li}} + {\text{BiC}}{{{\text{l}}}_{3}} \to \\ \to {{[({\text{2 - MeO}})({\text{5 - Cl}}){{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{3}}]}_{3}}{\text{Bi}} + 3{\text{LiCl}}{\text{.}} \\ \end{gathered} $Бис(бромдифторацетат) трис(2-метокси-5-хлорфенил)висмута получили с выходом 77% из триарилвисмута и бромдифторуксусной кислоты в присутствии гидропероксида третичного бутила в растворе эфира:
(II)
$\begin{gathered} {\text{I}} + 2{\text{HOC(O)R}} + t{\text{ - BuOOH}} \to \\ \to {{\left[ {\left( {{\text{2 - MeO}}} \right)\left( {{\text{5 - Cl}}} \right){{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{3}}}}} \right]}_{3}}{\text{Bi}}{{\left[ {{\text{OC}}\left( {\text{O}} \right){\text{R}}} \right]}_{2}} + \\ + \,\,t{\text{ - BuOH}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $По аналогичной схеме из трис(2-метокси-5-бромфенил)висмута [13] синтезировали бис(2,3,4,5- тетрафторбензоат) трис(2-метокси-5-бромфенил)- висмута (III).
(III)
$\begin{gathered} {{\left[ {\left( {{\text{2 - MeO}}} \right)\left( {{\text{5 - Br}}} \right){{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{3}}} \right]}_{3}}{\text{Bi}} + 2{\text{HOC}}\left( {\text{O}} \right){{{\text{C}}}_{{\text{6}}}}{\text{H}}{{{\text{F}}}_{4}}{\text{ - }}2,3,4,5 + t{\text{ - BuOOH}} \to \\ \to {{\left[ {\left( {{\text{2 - MeO}}} \right)\left( {{\text{5 - Br}}} \right){{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{3}}} \right]}_{3}}{\text{Bi}}{{\left[ {{\text{OC}}\left( {\text{O}} \right){{{\text{C}}}_{{\text{6}}}}{\text{H}}{{{\text{F}}}_{{\text{4}}}}{\text{ - 2,3,4,5}}} \right]}_{2}} + t{\text{ - BuOH}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}. \\ \end{gathered} $В ИК-спектрах соединений I–III наблюдаются интенсивные полосы при 1230–1281 (О–C), 1458–1474 (Ar), 2934–2945 (H–CAlk), 2843–3088 см−1 (H–C). Присутствие интенсивных полос поглощения при 1690 (II) и 1558 см−1 (III) указывает на присутствие в комплексах II и III карбонильных групп.
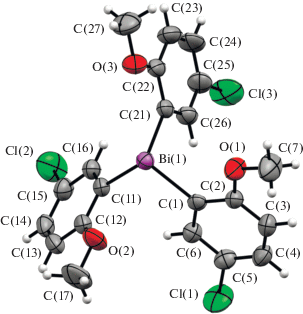
По данным РСА, молекула соединения I имеет конфигурацию тригональной пирамиды (рис. 1).
Длины связей Bi–C (2.253(5), 2.259(4) и 2.262(4) Å) по своему значению приближаются к сумме ковалентных радиусов указанных атомов (2.36 Å [27]). Атомы кислорода MeO-групп координированы на атом висмута (внутримолекулярные расстояния Bi∙∙∙OМе в I составляют 3.014(6), 3.088(6), 3.168(6) Å). Углы CBiC и внутримолекулярные расстояния Bi∙∙∙O равны 91.40(16)°, 92.60(15)°, 93.19(15)° и 3.014(6), 3.088(6), 3.168(6) Å соответственно, что сравнимо с аналогичными углами и расстояниями в трис(2-метокси-5-бромфенил)висмуте (90.6(4)°–93.9(5)° и 3.007(15)–3.136(19) Å) [13]). Наличие внутримолекулярных контактов в I обусловливает уменьшение валентных углов СBiС по сравнению с трифенилвисмутом (92.25°–94.37° [28]), в котором такие контакты отсутствуют.
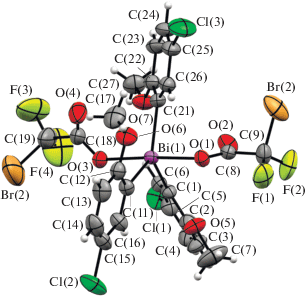
В II и III атом висмута имеет искаженную тригонально-бипирамидальную координацию с карбоксилатными лигандами в аксиальных положениях (рис. 2, 3). Атомы фтора соединения III, расположенные в орто-положении бензольного кольца карбоксилатного лиганда, разупорядочены по двум положениям. Уточненные соотношения вкладов положений в разупорядоченный фрагмент составляют 0.56/0.44. Сольватная молекула бензола в III разупорядочена по 4 положениям с заселенностью атомов углерода 0.25.
Рис. 3.
Общий вид молекулы III (разупорядоченные атомы фтора и сольватная молекула бензола не приведены).
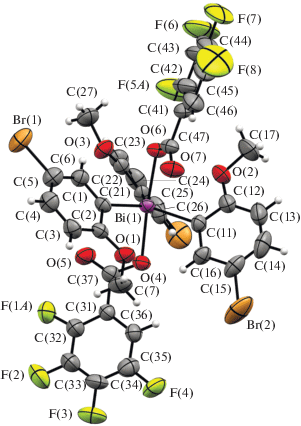
Суммы валентных углов в экваториальной плоскости составляют 360° для II и 359.8° для III, углы OBiC несколько отклоняются от теоретического значения (81.4(2)°–98.08(16)°). Аксиальные углы OBiO (175.53(12)° и 175.41(17)°) отличаются от идеального значения 180°. Длины связей Bi–C имеют близкие значения: 2.195(5)–2.204(4) Å в II и 2.199(6)–2.201(7) Å в III, а расстояния Bi–O (2.264(4), 2.315(3) Å в II и 2.252(5), 2.295(5) Å в III) соизмеримы с ковалентными длинами связей Bi–O (2.32 Å [27]). В дикарбоксилатах триарилвисмута II и III реализуется возможность внутримолекулярного взаимодействия атома Bi с потенциальными координирующими центрами лигандов, в качестве которых выступают атомы кислорода метокси-групп. Так, расстояния Bi∙∙∙OMe в II и III составляют 3.153(5)–3.117(5) и 3.122(7)–3.199(7) Å, что сравнимо с аналогичными величинами в I. В дикарбоксилатах триарилвисмута наблюдаются также внутримолекулярные взаимодействия атомов металла с карбонильными атомами кислорода, в которых расстояния Bi∙∙∙O=C равны 3.05(16), 3.30(16) Å (II) и 3.004(7), 3.230(7) Å (III), что значительно меньше суммы ван-дер-ваальсовых радиусов атомов Bi и O 3.9 Å [27]. Отметим, что в бис(бромдифторацетате), бис(трихлорацетате) и бис(трифторацетате) трис(2-метокси-5-бромфенил)висмута аналогичные контакты составляют 3.109−3.566, 3.146, 3.163 и 3.067, 3.146 Å [13, 28], поэтому можно говорить об увеличении КЧ центрального атома до 10 (5 + 5).
Известно, что карбоксилатные лиганды в молекулах структурно охарактеризованных дикарбоксилатов триарилвисмута, как правило, расположены таким образом, что внутримолекулярные контакты Bi∙∙∙O(=C) формируются внутри одного экваториального угла, значение которого может возрастать до 152.9° при понижении значений двух других экваториальных углов [29, 30]. Однако в соединениях II и III карбонильные атомы кислорода находятся напротив разных экваториальных углов (111.55(18)°, 124.34(18)°, 124.11(18)° и 114.3(2)°, 121.9(2)°, 123.6(3)°).
Таким образом, наличие в соединении I при атоме висмута 2-метокси-5-хлорфенильных лигандов, имеющих в своем составе атомы кислорода с неподеленными электронными парами, обусловливает дополнительные невалентные внутримолекулярные взаимодействия с участием атома висмута, которые проявляются и в дикарбоксилатах II и III. Введение электроноакцепторных групп в карбоксилатные лиганды не оказывает заметного влияния на длины связей Bi–C и величину аксиального угла в молекуле дикарбоксилата триарилвисмута. Основным отличием в строении молекул II и III по сравнению с другими дикарбоксилатами триарилвисмута является уменьшение внутримолекулярного взаимодействия Bi⋅⋅⋅O=C вследствие присутствия электроноакцепторных заместителей (CBrF2 и С6HF4) в радикалах R карбоксилатных лигандов и увеличение КЧ центрального атома до десяти (5 + 5).
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Усольцев А.Н., Адонин С.А., Новиков А.С. и др. // Журн. коорд. химии. 2020. Т. 46. № 1. С. 26 (Usoltsev A.N., Adonin S.A., Novikov A.S. et al. // Russ. J. Coord. Chem. 2020. V. 46. № 1. P. 23). https://doi.org/10.1134/S107032842001008X
Kindra D.R., Peterson J.K., Ziller J.W. et al. // Organometallics. 2015. V. 34. P. 395. https://doi.org/10.1021/om5010786
Casely I.J., Ziller J.W., Mincher B.J. et al. // Inorg. Chem. 2011. V. 50. P. 1513. https://doi.org/10.1021/ic102119y
Urbanova I., Jambor R., Ruzicka A. et al. // Dalton Trans. 2014. V. 43. P. 505. https://doi.org/10.1039/c3dt51733k
Solyntjes S., Neumann B., Stammler H.-G. et al. // Eur. J. Inorg. Chem. 2016. P. 3999. https://doi.org/10.1002/ejic.201600539
Soran A., Breunig H.J., Lippolis V. et al. // J. Organomet. Chem. 2010. V. 695. P. 850. https://doi.org/10.1016/j.jorganchem.2010.01.004
Schulz A., Villinger A. // Organometallics. 2011. V. 30. P. 284. https://doi.org/10.1021/om1009796
Breunig H.J., Nema M.G., Silvestru C. et al. // Z. Anorg. Allg. Chem. 2010. Bd. 636. S. 2378. https://doi.org/10.1002/zaac.201000233
Alcantara E., Sharma P., Perez D. et al. // Synth. React. Inorg. Met.-Org., Nano-Met. Chem. 2012. V. 42. P. 1139. https://doi.org/10.1080/15533174.2012.680162
Benjamin S.L., Karagiannidis L., Levason W. et al. // Organometallics. 2011. V. 30. P. 895. https://doi.org/10.1021/om1010148
Lichtenberg C., Pan F., Spaniol T.P. et al. // Angew. Chem., Int. Ed. 2012. V. 51. P. 13011. https://doi.org/10.1002/anie.201206782
Obata T., Matsumura M., Kawahata M. et al. // J. Organomet. Chem. 2016. V. 807. P. 17. https://doi.org/10.1016/j.jorganchem.2016.02.008
Шарутин В.В., Шарутина О.К., Ермакова В.А. и др. // Журн. неорган. химии. 2017. Т. 62. № 8. С. 1049 (Sharutin V.V., Sharutina O.K., Ermakova V.A. et al. // Russ. J. Inorg. Chem. 2017. V. 62. № 8. P. 1043). https://doi.org/10.1134/S0036023617080174
Chalmers B.A., Meigh C.B.E., Nejman P.S. et al. // Inorg. Chem. 2016. V. 55. P. 7117. https://doi.org/10.1021/acs.inorgchem.6b01079
Tschersich C., Hoof S., Frank N. et al. // Inorg. Chem. 2016. V. 55. P. 1837. https://doi.org/10.1021/acs.inorgchem.5b02740
Wade C.R., Saber M.R., Gabbai F.P. // Heteroat. Chem. 2011. V. 22. P. 500. https://doi.org/10.1002/hc.20713
Новикова Е.В., Иванов А.В., Егорова И.В. и др. // Журн. коорд. химии. 2019. Т. 45. № 10. С. 599 (Novikova E.V., Ivanov A.V., Egorova I.V. et al. // Russ. J. Coord. Chem. 2019. V. 45. № 10. P. 695). https://doi.org/10.1134/S1070328419100038
Chen J., Murafuji T., Tsunashima R. // Organometallics. 2011. V. 30. P. 4532. https://doi.org/10.1021/om200228x
Duffin R.N., Blair V.L., Kedzierski L. et al. // Dalton Trans. 2018. V. 47. P. 971. https://doi.org/10.1039/c7dt04171c
Duffin R.N., Blair V.L., Kedzierski L. et al. // J. Inorg. Biochem. 2018. V. 189. P. 151. https://doi.org/10.1016/j.jinorgbio.2018.08.015
Ong Y.C., Blair V.L., Kedzierski L. et al. // Dalton Trans. 2014. V. 43. P. 12904. https://doi.org/10.1039/c4dt00957f
Ong Y.C., Blair V.L., Kedzierski L. et al. // Dalton Trans. 2015. V. 44. P. 18215. https://doi.org/10.1039/c5dt03335g
Zhang X.-Y., Wu R.-X., Bi C.-F. et al. // Inorg. Chim. Acta. 2018. V. 483. P. 129. https://doi.org/10.1016/j.ica.2018.07.027
SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Madison (WI, USA): Bruker AXS Inc., 1998.
SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Madison (WI, USA): Bruker AXS Inc., 1998.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Ap-pl. Crystallogr. 2009. V. 42. P. 339. https://doi.org/10.1107/S0021889808042726
Бацанов С.С. // Журн. неорган. химии. 1991. Т. 36. № 12. С. 3015 (Batsanov S.S. // Russ. J. Inorg. Chem. 1991. V. 36. P. 1694).
Ермакова В.А., Шарутина О.К. // Вестник ЮУрГУ. Сер. Химия. 2018. Т. 10. № 2. С. 41. https://doi.org/10.14529/chem180205
Hassan A., Wang S. // Dalton Trans. 1997. № 12. P. 2009. https://doi.org/10.1039/A700477J
Шарутин В.В., Шарутина О.К., Ефремов А.Н. // Журн. неорган. химии. 2019. Т. 64. № 2. С. 159 (Sharutin V.V., Sharutina O.K., Efremov A.N. // Russ. J. Inorg. Chem. 2019. V. 64. № 2. P. 190).https://doi.org/10.1134/S0036023619020189
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия