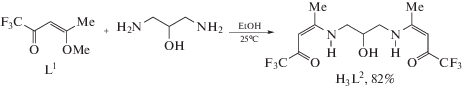Координационная химия, 2021, T. 47, № 9, стр. 574-580
Влияние трифторметильных групп на кристаллическую упаковку биядерного комплекса меди(II) на основе N2O3-пентадентатного гидрокси-бис(СF3-енаминокетона)
Ю. О. Эдилова 1, 2, Ю. С. Кудякова 1, П. А. Слепухин 1, 2, Я. В. Бургарт 1, В. И. Салоутин 1, Д. Н. Бажин 1, *
1 Институт органического синтеза им. И.Я. Постовского УрО РАН
Екатеринбург, Россия
2 Уральский федеральный университет им. первого Президента России Б.Н. Ельцина
Екатеринбург, Россия
* E-mail: dnbazhin@gmail.com
Поступила в редакцию 19.03.2021
После доработки 21.04.2021
Принята к публикации 24.04.2021
Аннотация
Взаимодействие 1,1,1-трифтор-4-метокси-3-пентен-2-она (L1) с 1,3-диаминопропан-2-олом приводит к получению N,N'-(2-гидроксипропан-1,3-диил)-бис(трифторацетилацетимина) (H3L2) с выходом 82%. Синтезированный N2O3-лиганд в реакции с ацетатом меди(II) в отсутствие дополнительных оснований дает биядерный комплекс состава [Cu2L2(OAc)] (I), структура которого установлена методом (CIF file CCDC № 2071133).
На протяжении нескольких десятилетий биядерные комплексы меди(II) остаются одними из привлекательных объектов исследований. Комплексы Cu(II) с мостиковыми μ-фенокси, μ-алкокси или μ-гидрокси группами, формирующими биядерный металлоостов, являются модельными системами для изучения спин-спиновых обменных взаимодействий между двумя неспаренными электронами [1–5]. С другой стороны, проявляемое цитотоксичное действие комплексов Cu(II) по отношению к раковым клеткам человека является основой для направленного дизайна лигандов, способных к селективному связыванию и дальнейшему расщеплению вредоносных ДНК, что снижает развитие опухолей [6]. Не менее важными являются исследования Cu2-комплексов в различных каталитических реакциях, что является с экономической и экологической точек зрения обоснованной альтернативой используемым катализаторам на основе металлов платиновой группы [7–9].
В качестве лигандов для построения биядерного остова с атомами меди(II) зачастую используют основания Шиффа [1, 10–16]. Енаминокетоны, содержащие дополнительные донорные атомы расширяют ряд полидентатных соединений, которые в зависимости от условий получения приводят к моно- и полиядерным комплексам меди(II) [17–23].
Введение фторсодержащих заместителей в структуру лигандов играет важную роль в самоорганизации молекул, в том числе при кристаллизации металлокомплексов [24–26]. Наравне с хорошо известными межмолекулярными взаимодействиями (водородные связи, π–π-стэкинг, С–Н…π) все больше внимания уделяется слабым контактам (таким как C–F…H, F…F или C–F…π), определяющим структуру и свойства кристаллов [26].
В настоящей работе на основе нового фторсодержащего функционализированного енаминокетона (H3L2) осуществлен синтез биядерного комплекса меди(II) [Cu2L2(OAc)] (I) в мягких условиях и исследованы особенности его кристаллической структуры.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все операции, связанные с синтезом лиганда H3L2 и комплекса I, выполняли на воздухе с использованием коммерчески доступных реактивов: Cu(OAc)2 · H2O (“ч. д. а.”, Вектон), 1,3-диаминопропан-2-ол (99%, Alfa Aesar), диэтиловый эфир (“ч.д.а”, Вектон), ацетонитрил (“ч. д. а.”, Вектон), метанол (“х. ч.”, Вектон). Трифторметилсодержащий алкоксиенон (L1) синтезирован по известной методике [27] из 2-метоксипропена, трифторуксусного ангидрида в присутствии пиридина в дихлорметане.
Спектры ЯМР 1H, 19F, 13C регистрировали на спектрометре Bruker DRX-500 (500 МГц) с Me4Si и C6F6 в качестве внутренних стандартов. ИК-спектры соединений регистрировали на ИК-Фурье спектрометре PerkinElmer Spectrum One в интервале 400–4000 см–1 с использованием приставки диффузного отражения для твердых веществ. Элементный анализ выполнен на автоматическом анализаторе PerkinElmer PE 2400 Series II.
Синтез N,N'-(2-гидроксипропан-1,3-диил)-бис(трифторацетилацетимина) (H3L2). К охлажденному до 0°С раствору 1,3-диаминопропан-2-ола (0.41 г, 4.5 ммоль) в 25 мл диэтилового эфира добавляли по каплям алкоксиенон L1(1.53 г, 9 ммоль). Реакционную массу перемешивали до выпадения белого осадка, который отфильтровывали и сушили на воздухе. Выход 1.35 г (82%). Белый порошок, Тпл = 142–144°С.
ИК-спектр (ν, см–1): 3304, 3135 (O–H), 2949, 2929 ν(C–H), 1616 (C=O), 1577 (C=C), 1441 νas(CH3), 1250, 1188, 1137 ν(C–F). Спектр ЯМР 1H (500 МГц; CD3CN; δ, м.д. (J, Гц)): 2.11 (c., 6H, 2 CH3), 3.39 (м., 2H, CH2), 3.52 (м., 2H, CH2), 3.96 (т.т., 1H, JHH = 7.7, 3.7, CHOH), 5.38 (c., 2H, 2 CH=), 11.20 (c., 2H, NH). Спектр ЯМР 19F (470 МГц; CD3CN; δ, м.д.): 87.29 (c., СF3). Спектр ЯМР 13C (125 МГц; CD3CN; δ, м.д., (J, Гц)): 19.95 (c., CH3), 47.96 (c., CH2NH), 69.40 (c., CHOH), 89.94 (c., CCH3), 119.0 (кв., 2JCF = 288, CF3), 172.38 (с., CHCO), 175.12 (кв., 3JCF = 32, C=O).
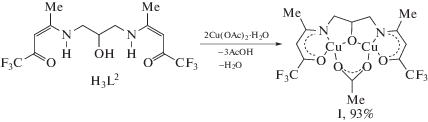
Синтез комплекса [Cu2L(OAc)] (I). К соединению H3L2 (128 мг, 0.35 ммоль) в 10 мл метанола добавляли Cu(OAc)2 · H2O (139 мг, 0.7 ммоль) и перемешивали при комнатной температуре 1 ч, после чего приливали 50 мл воды. Образовавшийся осадок отфильтровывали и сушили. Далее полученный комплекс растворяли в ацетонитриле, пропускали через слой Celite® 545. Медленное упаривание растворителя приводило к образованию голубых кристаллов комплекса I. Тпл = 303–304°С.
Выход 183 мг (93%). ИК-спектр (ν, см–1): 2952, 2841 ν(C–H), 1625 ν(C=O), 1568 (С=С), 1479, 1466 νas(CH3), 1248–1149 ν(C–F).
РСА. Кристаллографические данные для монокристалла комплекса I получены на автоматическом чырехкружном дифрактометре с CCD-детектором Xcalibur 3 по стандартной процедуре (МоKα-излучение, графитовый монохроматор, ω‑сканирование с шагом 1° при 295(2) К). Введена эмпирическая поправка на поглощение. Структура определена прямым статистическим методом и уточнена полноматричным МНК по F 2 в анизотропном приближении для всех неводородных атомов. Атомы водорода помещены в геометрически рассчитанные положения и уточнены в модели “наездника”. Все расчеты проведены в программной оболочке Olex [28] c использованием программного пакета SHELX [29].
Координаты атомов и другие параметры структуры I депонированы в Кембриджском банке структурных данных (CСDС № 2071133; deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/ data_request/cif).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Взаимодействием алкоксиенона L1 с диаминопропанолом в соотношении 2 : 1 в эфире при охлаждении впервые получен бис-CF3-енаминокетон H3L2, содержащий помимо двух способных к хелатированию N,O-енаминокетонных фрагментов дополнительную гидроксигруппу, формирующую два тридентатных NO2-фрагмента (cхема 1). Строение лиганда H3L2 подтверждено с помощью данных ЯМР и ИК-спектроскопии, а также элементного анализа. В спектре ЯМР 1Н соединения H3L2 в растворе CD3CN наблюдаются синглеты при 2.11, 5.36 и 11.20 м.д., относящиеся к енаминокетонному фрагменту, а именно метильному заместителю, метиновому протону и группе N–H соответственно. Мультиплеты диаминопропанольной части регистрируются при δН = 3.39, 3.52 и 3.96 м.д. В спектре ЯМР 19F наблюдается синглет трифторметильной группы при δF = 87.3 м.д., находящийся в диапазоне, характерном для трифторацетилсодержащих соединений [18–22]. Один набор сигналов углерода лиганда H3L2 также регистрируется в спектре ЯМР 13С. Таким образом, в растворе CD3CN оба енаминокетонных фрагмента соединения H3L2 существуют в наиболее выгодной Z,Z-форме, по-видимому, благодаря внутримолекулярным водородным связям.
Схема 1 .
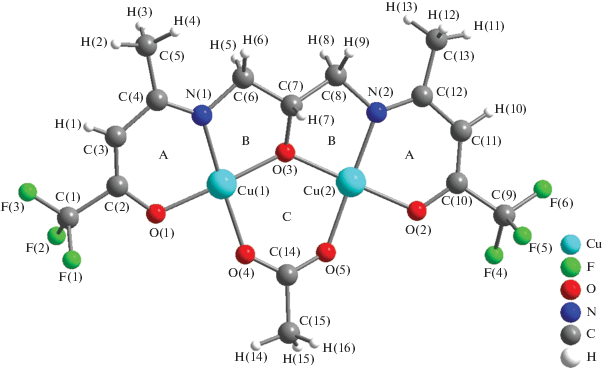
Ранее для нефторированного аналога H3L2 N,N'-(2-гидроксипропан-1,3-диил)-бис(ацетилацетимина) (H3L3) была получена “кубановая” структура [(Cu(HL3))4] в реакции с перхлоратом меди(II) в присутствии триэтиламина [30]. В аналогичных условиях попытки выделить продукты взаимодействия H3L2 с солями двухвалентной меди были безуспешными. Однако в отсутствие азотистого основания реакция гидрокси-бис(CF3-енаминокетона) H3L2 с ацетатом меди(II) приводила к образованию комплекса I с хорошим выходом (cхема 2). Таким образом, ацетат-анионы выступают в качестве мягкого основания для депротонирования лиганда H3L2. Медленное упаривание ацетонитрильного раствора соединения I дает кристаллы, пригодные для проведения РСА (рис. 1).
Схема 2 .
По данным РСА, нейтральный биядерный комплекс меди(II) I кристаллизуется в пространственной группе P21/c моноклинной системы (рис. 1, табл. 1). Плоско-квадратное координационное окружение двух атомов меди(II) образуется за счет участия енаминокетонных фрагментов, μ‑гидроксигруппы лиганда H3L2, а также за счет μ-мостикового ацетат аниона. При этом вокруг каждого атома меди формируются три различных металлоцикла: шестичленный и пятичленный с двумя разными гетероатомами (A и B, рис. 1); шестичленный с тремя атомами кислорода, включающий два атома металла (С, рис. 1). Плоскости двух хелатных енаминокетонных фрагментов характеризуются незначительным отклонением со значением двугранного угла 6.6(4)°. Расстояние между атомами меди в комплексе I составляет 3.481(1) Å, что сопоставимо с одним из значений (3.438(1) Å) для Cu…Cu в кластере [(Cu(HL3))4] на основе нефторированного аналога H3L3 [30].
Таблица 1.
Основные кристаллографические характеристики и параметры рентгеноструктурного эксперимента для комплекса I
| Параметр | Значение |
|---|---|
| Брутто-формула | C15H16N2O5F6Cu2 |
| M | 545.38 |
| Сингония | Моноклинная |
| Пр. гр. | P21/c |
| a, Å | 10.834(1) |
| b, Å | 11.519(1) |
| c, Å | 15.284(3) |
| α, град | 90.00 |
| β, град | 101.99(2) |
| γ, град | 90.00 |
| V, Å3 | 1865.8(5) |
| Z | 4 |
| ρ(выч.), г см–3 | 1.942 |
| μ, мм–1 | 2.3708 |
| Размер кристалла, мм | 0.39 × 0.19 × 0.08 |
| θmin–θmax, град | 3.76–26.21 |
| F(000) | 1088 |
| Rint | 0.0905 |
| Интервалы индексов отражений | –13 ≤ h ≤ 10, –14 ≤ k ≤ 14, –18 ≤ l ≤ 19 |
| Измерено отражений | 12 134 |
| Независимых отражений | 3803 |
| Число отражений с I > 2σ(I) | 2238 |
| GOOF | 1.000 |
| R-факторы по F 2 > 2σ(F 2) | R1 = 0.0600, wR2 = 0.1387 |
| R-факторы по всем отражениям | R1 = 0.1136, wR2 = 0.1802 |
| Остаточная электронная плотность (max/min), e/Å3 | 0.61/−0.68 |
Таблица 2.
Основные длины связей и валентные углы комплекса I
| Связь | d, Å | Угол | ω, град |
|---|---|---|---|
| Cu(1)–O(1) | 1.898(5) | O(1)Cu(1)N(1) | 94.70(20) |
| Cu(1)–N(1) | 1.939(6) | N(1)Cu(1)O(3) | 85.06(19) |
| Cu(1)–O(4) | 1.929(5) | O(1)Cu(1)O(4) | 85.67(20) |
| Cu(1)–O(3) | 1.918(4) | O(3)Cu(1)O(4) | 95.83(19) |
| Cu(2)–O(2) | 1.910(5) | O(2)Cu(2)N(2) | 93.98(22) |
| Cu(2)–N(2) | 1.931(5) | N(2)Cu(2)O(3) | 85.22(20) |
| Cu(2)–O(5) | 1.932(5) | O(2)Cu(2)O(5) | 86.08(20) |
| Cu(2)–O(3) | 1.912(5) | O(3)Cu(2)O(5) | 94.68(18) |
| Cu(1)O(3)Cu(2) | 130.67(22) |
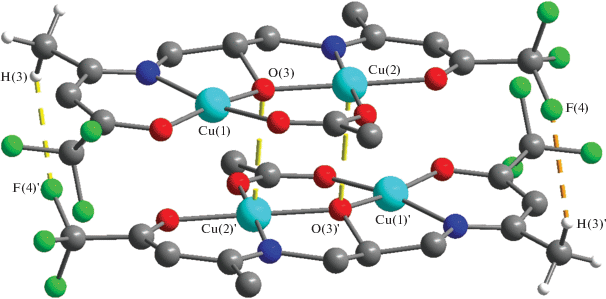
Введение трифторметильной группы в енаминокетонный фрагмент приводит к образованию внутримолекулярного короткого контакта между атомом фтора и метиновым атомом водорода, равного 2.49(7) Å. Молекулы комплекса I образуют псевдодимерные структуры с межплоскостным расстоянием в ~3.4 Å (плоскости, проходящие через атомы N(1)O(1)N(2)O(1) молекул). В псевдодимерах симметрично реализуются два межмолекулярных контакта F…H между CF3- и CН3-группами, равных 2.517(5) Å (рис. 2). Атомы кислорода O(3) и O(3)' мостиковых алкоксидных групп выходят из плоскости молекул на 0.267 Å, что приводит к сближениям Cu(2)–O(3)' и Cu(2)'–O(3), равным 3.108(6) Å с наименьшим межмолекулярным расстоянием между атомами меди Cu(2)–Cu(2)' в 3.778(1) Å (рис. 2).
Рис. 2.
Псевдодимер комплекса I. Атомы водорода частично не показаны. Межмолекулярный контакт F(4)…H(3)' и F(4)'…H(3) составляет 2.517(5) Å, расстояние Cu(2)…O(3)' и Cu(2)'…O(3) равны 3.108(6) Å, Сu(1)...Cu(1)' составляет 6.391(1) Å.
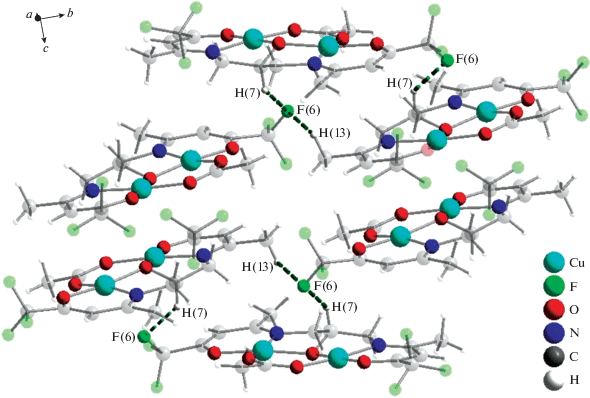
Псевдодимеры формируют стопки за счет контактов F…H между атомами фтора и атомами Н(7), H(13) алкоксидных и метильных групп комплекса I (рис. 3).
Рис. 3.
Межмолекулярные взаимодействия F…H в комплексе I. Расстояния F(6)…H(13) и F(6)…H(7) равны, соответственно, 2.968(6) и 2.726(5) Å.
В данной работе показано, что функционализированный фторсодержащий енаминокетон легко вступает в реакцию комплексообразования с ацетатом меди(II). В отличие от нефторированных аналогов для осуществления данного взаимодействия не требуется использование основных агентов, в том числе триэтиламина. При этом пентадентатный лиганд участвует в образовании биядерного комплекса меди(II), в качестве мостикового солиганда сохраняется один ацетат-анион. Установлено, что трифторметильные группы образуют короткие внутри- и межмолекулярные контакты F…H, формируя кристаллическую структуру комплекса, особенностью которой является образование псевдо-димеров.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Novoa N., Justaud F., Hamon P. et al. // Polyhedron. 2015. V. 86. P. 81.
Ямбулатов Д.С., Николаевский С.А., Луценко И.А. и др. // Коорд. химия. 2020. Т. 46. С. 698 (Yambulatov D.S., Nikolaevskii S.A., Lutsenko I.A. et al. // Russ. J. Coord. Chem. 2020. V. 46. P. 772). https://doi.org/10.1134/S1070328420110093
Popov L.D., Shcherbakov I.N., Vlasenko V.G. et al.// J. Struct. Chem. 2017. V. 58. P. 1685.
Bazhin D.N., Kudyakova Y.S., Slepukhin P.A. et al. // Mendeleev Commun. 2018. V. 26. P. 54. https://doi.org/10.1016/j.mencom.2018.03.032
Ovcharenko V.I., Fokin S.V., Romanenko G.V. et al. // Russ. Chem. Bull. 2011. V. 60. P. 2457.
Glaser T., Mollard G.F., Anselmetti D. // Inorg. Chim. Acta. 2016. V. 452. P. 62.
Presti E.L., Monzani E., Santagostini L. et al. // Inorg. Chim. Acta. 2018. V. 481. P. 47.
Sanyal R., Kundu P., Rychagova E. et al. // New J. Chem. 2016. V. 40. P. 6623.
Haack P., Limberg C. // Angew. Chem. Int. Ed. 2014. V. 53. P. 4282.
Thompson L.K., Mandal S.K., Tandon S.S. et al. // Inorg. Chem. 1996. V. 35. P. 3117.
Miyagawa Y., Tsatsuryan A., Haraguchi T. et al. // New J. Chem. 2020. V. 44. P. 16665. https://doi.org/10.1039/D0NJ02481C
Repich H.H., Orysyk S.I., Orysyk V.V. et al. // J. Mol. Struct. 2017. V. 1146. P. 222. https://doi.org/10.1016/j.molstruc.2017.05.140
Cheng F.-Y., Tsai C.-Y., Huang B.-H. et al. // Dalton Trans. 2019. V. 48. P. 4667. https://doi.org/10.1039/C9DT00471H
Gennarini F., Kochem A., Isaac J. et al. // Inorg. Chim. Acta. 2018. V. 481. P. 113. https://doi.org/10.1016/j.ica.2017.09.067
Daneshmand P., Pinon L., Schaper F. // Dalton Trans. 2018. V. 47. P. 10147. https://doi.org/10.1039/C8DT02140F
Vrdoljak V., Pavlović G., Maltar-Strmečki N. // New J. Chem. 2016. V. 40. P. 9263. https://doi.org/10.1039/C6NJ01036A
Chopin N., Chastanet G., Le Guennic B. et al. // Eur. J. Inorg. Chem. 2012. P. 5058.
Кудякова Ю.С., Горяева М.В., Бургарт Я.В. и др. // Изв. РАН. Сер. хим. 2009. Т. 58. С. 1207 (Kudyakova Y.S., Goryaeva M.V., Burgart Y.V. et al. // Russ. Chem. Bull. 2009. V. 58. P. 1241). https://doi.org/10.1007/s11172-009-0161-9
Кудякова Ю.С., Горяева М.В., Бургарт Я.В. и др. // Изв. РАН. Сер. хим. 2010. Т. 59. С. 1544 (Kudyakova Y.S., Goryaeva M.V., Burgart Y.V. et al. // Russ. Chem. Bull. 2010. V. 59. P. 1582). https://doi.org/10.1007/s11172-010-0281-2
Кудякова Ю.С., Горяева М.В., Бургарт Я.В. и др. // Изв. РАН. Сер. хим. 2010. Т. 59. С. 1707 (Kudyakova Y.S., Goryaeva M.V., Burgart Y.V. et al. // Russ. Chem. Bull. 2010. V. 59. P. 1753). https://doi.org/10.1007/s11172-010-0308-8
Kudyakova Y.S., Burgart Y.V., Goryaeva M.V., Saloutin V.I. // Mendeleev Commun. 2012. V. 22. P. 284. https://doi.org/10.1016/j.mencom.2012.09.020
Кудякова Ю.С., Горяева М.В., Бургарт Я.В., Салоутин В.И. // Журн. орган. химии. 2011. Т. 47. С. 339 (Kudyakova Y.S., Goryaeva M.V., Burgart Y.V., Saloutin V.I. // Russ. J. Org. Chem. 2011. V. 47. P. 331). https://doi.org/10.1134/S107042801103002X
Kudyakova Y.S., Bazhin D.N, Goryaeva M.V. et al. // Russ. Chem. Rev. 2014. V. 83. P. 120. https://doi.org/10.1070/RC2014v083n02ABEH004388
Suresh A., Ghosh S., Chopra D. // J. Mol. Struct. 2021. V. 1224. P. 129045.
Vasylyeva V., Shishkin O.V., Maleev A.V., Merz K. // Cryst. Growth Des. 2012. V. 12. P. 1032.
Berger R., Resnati G., Metrangolo P. et al. // Chem. Soc. Rev. 2011. V. 40. P. 3496.
Bonacorso H.G., Nogara P.A., Silva F.A. et al. // J. F-luor. Chem. 2016. V. 190. P. 31.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Ap-pl. Cryst. 2009. V. 42. P. 339.
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. P. 112.
Mukherjee A., Nethaji M., Chakravarty A.R. // Angew. Chem. Int. Ed. 2004. V. 43. P. 87.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия