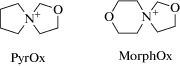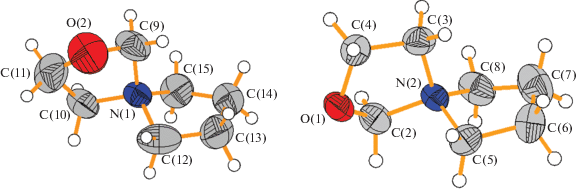Координационная химия, 2021, T. 47, № 9, стр. 581-588
Синтез, кристаллическое строение и термические свойства металлсодержащих ионных жидкостей со спирокатионами: (Spiro)2MCl4, (Spiro = 2,8-диоксо-5-азонияспиро[4.5]декан или 2-оксо-5-азонияспиро[4.4]нонан, M = Mn, Ni, Co)
М. А. Захаров 1, *, Э. А. Вятчанина 1, А. С. Иванов 1, М. А. Быков 1, Е. В. Карпова 1, К. А. Пасешниченко 1, Л. А. Асланов 1
1 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: max@struct.chem.msu.ru
Поступила в редакцию 12.01.2021
После доработки 25.03.2021
Принята к публикации 29.03.2021
Аннотация
Синтезированы металлсодержащие ионные жидкости со спирокатионами 2,8-диоксо-5-азонияспиро[4.5]декан (MorphOx) и 2-оксо-5-азонияспиро[4.4]нонан (PyrOx) и тетрахлоридометаллат-анионами ${\text{MCl}}_{4}^{{2 - }}$ (M = Mn, Ni, Co). Методом РСА определено их кристаллическое строение (CIF files CCDC № 2033482 (MorphOx2CoCl4), 2033483 (PyrOx2CoCl4), 2033484 (PyrOx2MnCl4) и 2033485 (PyrOx2NiCl4)). Соединения PyrOx2MCl4 являются изоструктурными. Методом дифференциальной сканирующей калориметрии определены температуры фазовых переходов полученных соединений.
Мировое потребление энергии с каждым годом растет. Отчасти эта потребность может быть удовлетворена за счет возобновляемых источников энергии. Прерывистый характер работы солнечных батарей и ветряных генераторов требует разработки накопителей энергии с большой емкостью, высокой плотностью энергии и низкой стоимостью. Такими накопителями являются проточные аккумуляторы, которые исследуются последнее время довольно интенсивно [1–3].
Одним из перспективных решений являются проточные аккумуляторы на основе ионных жидкостей (ИЖ). Ионные жидкости – это соединения, полностью состоящие из ионов, с температурой плавления ниже некоторой температуры, которую часто определяют равной 100°С, однако есть работы, где максимальная температура плавления ИЖ приравнивается 150 или 250°С [4–6]. В определении ИЖ указание максимальной температуры задает ненужное ограничение [7]. Одно из преимуществ ИЖ по сравнению с молекулярными растворителями в том, что растворимость в них полярных и ионных соединений [7] гораздо выше, что приводит к повышению плотности тока [3]. ИЖ имеют широкие электрохимические окна, благодаря нулевой упругости паров, отвечают требованиям пожаробезопасности. Последние тридцать лет ИЖ изучаются крайне интенсивно. Их используют в качестве растворителей [8, 9], катализаторов [8, 10], молекулярных магнитов [11–13], электролитов для аккумуляторов [14, 15] и многого другого. Для выявления закономерности изменения свойств от строения и состава необходимо знать кристаллическую структуру, но в случае жидкостей это сопровождается сильными осложнениями [16]. Неоспоримые преимущества для определения атомной структуры веществ дает метод рентгеноструктурного анализа (РСА), однако для ИЖ он часто бесполезен, так как они образуют аморфные (стекловидные) состояния.
Одним из направлений разработки ИЖ с высокой электрохимической устойчивостью, невысокой вязкостью и низкой молекулярной массой являются ИЖ со спирокатионами [17–21]. Введение атома кислорода в цепочку циклоалкана спирокатиона уменьшает температуру плавления и вязкость ИЖ [22, 23].
Металлсодержащие ионные жидкости всегда привлекали внимание ученых, о применении их в различных областях можно прочитать в работах [24–26]. Ранее мы опубликовали результаты исследования металлсодержащих ИЖ [27, 28].
В настоящей работе мы представляем синтез, кристаллическое строение и термические свойства новых ионных жидкостей со спирокатионами, содержащими один (2-оксо-5-азонияспиро[4.4]нонан (PyrOx)) или два атома кислорода (2,8-диоксо-5-азонияспиро[4.5]декан (MorphOx)), и галогенметаллатными анионами ${\text{MCl}}_{4}^{{2 - }}$ (M = Mn, Ni, Co), а именно тетрахлорокобальтат(II) 2,8-диоксо-5-азонияспиро[4.5]декана (MorphOx2CoCl4) (I), тетрахлорокобальтата(II) 2-оксо-5-азония-спиро[4.4]нонана (PyrOx2CoCl4) (II), тетрахлороникелата 2-оксо-5-азонияспиро[4.4]нонана (PyrO-x2NiCl4) (III), тетрахлороманганата(II) 2-оксо-5-азония-спиро[4.4]нонана (PyrOx2MnCl4) (IV).
Структура спирокатионов 2-оксо-5-азония-спиро[4.4]нонан (PyrOx) и 2,8-диоксо-5-азония-спиро[4.5]декан (MorphOx) представлена на сх-еме.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали следующие реагенты: CoCl2 · 6H2O, NiCl2 · 6H2O, MnCl2 · 6H2O (все “ч. д. а.”); P4O10 (“ч.”); ClCH2CH2OH, пирролидин, морфолин, параформ, диэтиловый эфир, CH2Cl2 (все “х. ч.”).
Синтез хлоридов PyrOxCl и MorphOxCl проводили согласно следующей схеме взаимодействия: (0.4 моль) амин + (0.4 моль) параформ + (0.4 моль) хлорэтанол = (150 мл Et2O) = Spiro+Cl– (амин = пирролидин/морфолин, Spiro+ = = Py-rOx/MorphOx).
К смеси параформа и хлорэтанола в диэтиловом эфире добавляли амин. Смесь перемешивали и кипятили с обратным холодильником в течение 3–4 ч. Далее смесь остужали до комнатной температуры при перемешивании. После охлаждения смесь разделялась на два слоя. Верхний слой декантировали, а нижний слой смешивали с водой, фильтровали, а примеси из фильтрата 3 раза экстрагировали хлористым метиленом. Водный раствор после этого упаривали досуха и сушили при 100°С в вакуумном шкафу. Выход 87.5% (PyrOxCl) и 89% (MorphOxCl). Тпл(PyrOxCl) = –24°C, Тпл(MorphOxCl) = 33°C.
ЯМР 1Н PyrOxCl (CD3CN; 293 K; δ, м.д.): 2.18 (м., 4H), 3.56 (м., 4H), 3.70 (т., J = 7.7 Гц, 2H), 4.28 (т., J = 7.7 Гц, 2H), 4.74 (с., 2H); ЯМР 1Н Mo-rphOxCl (CD3CN; 293 K; δ, м.д.): 3.54 (м., 2H), 3.80 (м., 4H), 3.94 (т., J = 7.5 Гц, 4H), 4.26 (т., J = 7.5 Гц, 2H), 5.00 (с., 2H).
| Найдено, %: | C 50.13; | H 7.78; | Cl 20.72; | N 7.76; | O 13.61. |
| Для C7H14NOCl | |||||
| вычислено, %: | C 51.38; | H 8.62; | Cl 21.66; | N 8.56; | O 9.78. |
| Найдено, %: | C 45.92; | H 7.04; | Cl 18.82; | N 7.19; | O 21.03. |
| Для C7H14NO2Cl | |||||
| вычислено, %: | C 46.80; | H 7.86; | Cl 19.74; | N 7.80; | O 17.80. |
Синтез металлсодержащих ионных жидкостей I–IV проводили согласно следующей общей схеме взаимодействия: 2Spiro+Cl– + MCl2 · 6H2O = = Spiro2MCl4 + 6H2O (Spiro = PyrOx/MorphOx; M = Mn, Co, Ni).
В стеклянный бюкс с крышкой помещали 2 г Spiro+Cl– (11.13 ммоль MorphOxCl или 12.22 ммоль PyrOxCl), затем добавляли эквимолярное количество кристаллогидрата MCl2 · 6H2O (M = Mn, Co, Ni). Смесь нагревали до 70–80°С при перемешивании в течение 2–3 ч на магнитной мешалке до полной гомогенизации. Полученное вязкое вещество помещали в эксикатор с P4O10 до выпадения кристаллов, в случае соединения IV кристаллы получали после перекристаллизации из ацетонитрила. Соединения MorphOx2CoCl4 (I) и PyrOx2CoCl4 (II) представляют собой темно-синие призматические кристаллы, устойчивые на воздухе. Выход I 94%, II – 95%.
| Найдено, %: | C 33.80; | H 5.40; | Cl 29.32; | N 5.97; | O 14.00; | Co 11.51. |
| Для (C7H14NO2)2Cl4Co (I) | ||||||
| вычислено, %: | C 34.38; | H 5.77; | Cl 28.99; | N 5.73; | O 13.08; | Co 12.05. |
| Найдено, %: | C 36.11; | H 5.72; | Cl 29.88; | N 5.71; | O 10.05; | Co 12.53. |
| Для (C7H14NO)2CoCl4 (II) | ||||||
| вычислено, %: | C 36.78; | H 6.17; | Cl 31.02; | N 6.13; | O 7.00; | Co 12.89. |
Соединение PyrOx2NiCl4 (III) представляет собой изумрудно-зеленые призматические кристаллы устойчивые на воздухе. Выход III 95%.
| Найдено, %: | C 36.34; | H 5.80; | Cl 31.22; | N 5.80; | Ni 12.23; | O 8.61; |
| Для (C7H14NO)2NiCl4 (III) | ||||||
| вычислено, %: | C 36.80; | H 6.18; | Cl 31.04; | N 6.13; | Ni 12.85; | O 7.00. |
Соединение PyrOx2MnCl4 (IV) представляет собой лимонно-желтые призматические кристаллы, устойчивые на воздухе. Выход IV 98%.
| Найдено, %: | C 36.70; | H 5.58; | Cl 31.89; | N 5.71; | O 8.50; | Mn 11.62. |
| Для (C7H14NO)2MnCl4 (IV) | ||||||
| вычислено, %: | C 37.11; | H 6.23; | Cl 31.30; | N 6.18; | O 7.06; | Mn 12.12. |
Образцы всех полученных металлсодержащих ИЖ исследовали методом дифференциальной сканирующей калориметрии (ДСК) на приборе Netzsch DSC-204 F1. Измерительную систему калибровали согласно стандарту ISO 11357-1 по параметрам фазовых переходов стандартных веществ (C6H12, Hg, бензойная кислота, Ga, KNO3, In, Sn, Bi, CsCl, чистота 99.99%). Систематическая ошибка температурной калибровки (определена по In) составляет 0.1°.
Образцы тестировали в стандартных алюминиевых ячейках (V = 56 мм3, d = 6 мм), завальцованных крышкой с отверстием (отношение площади дна ячейки к площади отверстия составляло ~40) в потоке (40 мл/мин) азота (“ос. ч.”) при скорости нагревания 5 K/мин. Экспериментальные данные обрабатывали с помощью пакета анализа NETZSCH Proteus Analysis согласно стандарту ISO/CD 11358.
РСА проведен для образцов I–IV с использованием монокристального рентгеновского дифрактометра StadiVari Pilatus 100 K. Кристаллические структуры расшифрованы прямыми методами (программа SHELX-97 [29]) и уточнены полноматричным методом наименьших квадратов. Все атомы, кроме атомов водорода, уточнены анизотропно (программа SHELXL в пакете программ SHELX-97 [29]). Атомы водорода заданы геометрически и не уточнялись. Для обработки данных использована программа WinGX [30]. Рисунки структур подготовлены с использованием программы Diamond 3.0 [31]. Кристаллографические данные и детали съемки даны в табл. 1.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения I–IV
| Параметр | Значение | |||
|---|---|---|---|---|
| I | II | III | IV | |
| Брутто-формула | (C7H14NO2)2Cl4Co | (C7H14NO)2Cl4Co | (C7H14NO)2Cl4Ni | (C7H14NO)2Cl4Mn |
| М | 489.13 | 457.13 | 456.89 | 453.13 |
| Излучение (λ, Å) | MoKα (0.71073) | CuKα (1.54186) | CuKα (1.54186) | CuKα (1.54186) |
| Сингония | Моноклинная | Моноклинная | Моноклинная | Моноклинная |
| Пр. гр. | P21/с | P21/с | P21/с | P21/с |
| a, Å | 9.4341(4) | 10.4116(3) | 10.2935(3) | 10.4721(3) |
| b, Å | 16.8689(5) | 14.0842(6) | 14.0071(4) | 14.2173(5) |
| c, Å | 13.2475(7) | 13.7810(5) | 13.7230(4) | 13.8639(4) |
| β, град | 95.803(4) | 90.022(3) | 90.412(2) | 89.984(2) |
| V, Å 3 | 2097.44(16) | 2020.83(13) | 1978.56(10) | 2064.13(11) |
| Z | 4 | 4 | 4 | 4 |
| ρ(выч.), г/см3 | 1.549 | 1.502 | 1.534 | 1.458 |
| Температура, K | 293(2) | 293(2) | 293(2) | 293(2) |
| μ, мм–1 | 1.348 | 11.597 | 6.459 | 10.036 |
| F(000) | 1012 | 948 | 952 | 940 |
| Область θ, град | 2/28.8 | 4.2/88.8 | 4.3/73.0 | 4.2/73.0 |
| Общее число рефлексов | 31 252 | 30 252 | 15 128 | 15 802 |
| Число независимых рефлексов (Rint) | 5350 (0.119) | 4614 (0.152) | 3846 (0.0367) | 3926 (0.059) |
| Число рефлексов с I > 2σ(I) | 2292 | 1585 | 3280 | 2510 |
| Число уточняемых параметров | 227 | 209 | 209 | 209 |
| GOOF по F 2 | 0.843 | 0.773 | 1.031 | 0.875 |
| R1 по I > 2σ(I) | 0.0582 | 0.0560 | 0.0262 | 0.0386 |
| wR2 (по всем данным) | 0.1412 | 0.1512 | 0.0691 | 0.1001 |
| Остаточная электронная плотность (min/max), e Å–3 | –0.675/0.597 | –0.499/0.403 | –0.387/0.251 | –0.243/0.421 |
Параметры кристаллических структур депонированы в Кембриджском банке структурных данных (CCDC № 2033482 (I), 2033483 (II), 2033484 (IV) и 2033485 (III)) и их можно получить у авторов.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
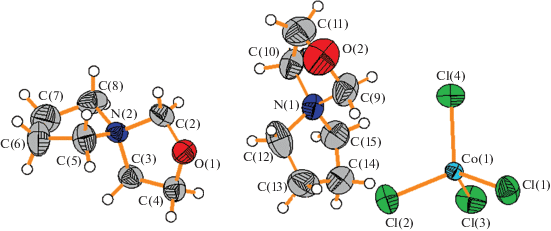
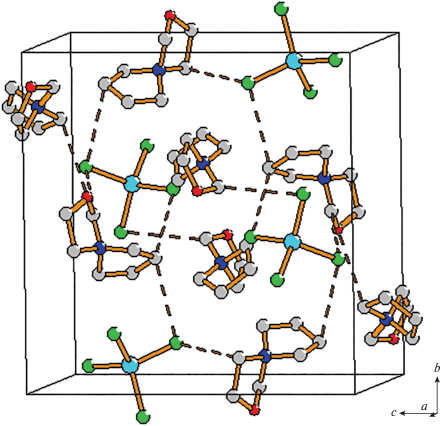
Независимая часть элементарной ячейки структуры I состоит из двух катионов MorhOx и одного аниона ${\text{CoCl}}_{4}^{{2 - }}$ (рис. 1). Катион состоит из двух циклов: морфолинового и оксазолидинового, объединенных общим атомом азота. Оба катиона имеют одинаковую конформацию, причем в катионе морфолиновый цикл имеет конформацию кресла, а оксазолидиновый цикл – конформацию полукресла. Каждый анион ${\text{CoCl}}_{4}^{{2 - }}$ окружен девятью катионами по вершинам искаженной трехшапочной тригональной призмы, четыре из них с атомом N(1) и пять – с атомом N(2). Катион с атомом азота N(1) окружен пятью анионами по вершинам искаженной тетрагональной пирамиды, а катион с атомом азота N(2) – четырьмя анионами по вершинам искаженного тетраэдра. При помощи слабых водородных связей (ВС) С···O (расстояние от 3.036(7) до 3.538(9) Å) катионы образуют трехмерный каркас, причем катионы N(2) связаны только с катионами N(1), а катионы N(1) связаны также с другими катионами N(1). Внутри каркасa из катионов располагаются анионы ${\text{CoCl}}_{4}^{{2 - }},$ контактирующие с катионами через слабые ВС С···Cl 3.542(5)–3.821(5) Å (рис. 2).
Рис. 1.
Фрагмент структуры I. Тепловые эллипсоиды с вероятностью 50%. Нумерация атомов водорода не приведена для ясности.
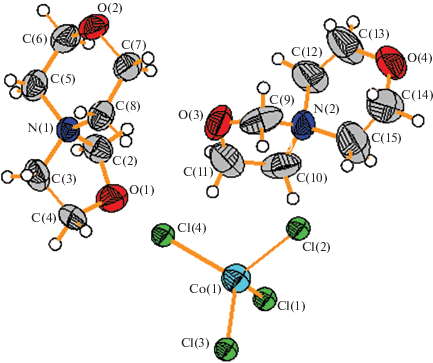
Рис. 2.
Водородные связи в структуре I. Атомы водорода не показаны для ясности. Штриховыми линиями обозначены водородные связи.
Соединения II–IV изоструктурны. Рассмотрим строение на примере структуры II. Независимая часть элементарной ячейки структуры II состоит из двух катионов PyrOx и одного аниона ${\text{CoCl}}_{4}^{{2 - }}$ (рис. 3). Катион состоит из двух циклов: пирролидинового и оксазолидинового, объединенных общим атомом азота. Конформации циклов в обоих независимых катионах приближены к конформации “конверт”, причем пирролидиновый цикл содержит атомы углерода в одной плоскости и атом азота, находящийся вне этой плоскости. На рис. 4а в катионе N(1) атомы углерода С(12)–С(13)–С(14)–С(15) лежат в одной плоскости, а атом N(1) отклоняется из этой плоскости: клапаном конверта является С(12)–N(1)–C(15), в катионе N(2) (рис. 4б) в одной плоскости лежат атомы С(5)–С(6)–С(7)–С(8), а клапаном конверта является С(5)–N(2)–C(8). Конформация оксазолидинового цикла содержит атомы N–C–C–O в одной плоскости, а атом углерода между атомами азота и кислорода относится к клапану конверта. В катионе N(1) атомы N(1)–C(10)–C(11)–O(2) лежат в плоскости, а атом С(9) находится в вершине клапана; в катионе N(2) в плоскости лежат атомы N(2)–C(3)–C(4)–O(1), а атом С(2) расположен в вершине клапана. Два катиона представляют собой конформационные диастереомеры, так как могут переходить друг в друга только при изменении конформации и не являются зеркальным отображением друг друга. Так, например, если в катионе N(1) оба клапана на двух циклах (С(9) в оксазолидиновом цикле и N(1) – в пирролидиновом) выгнуть в противоположную сторону, то он совпадет с катионом N(2). Такие же конформации катионов встречаются в структуре PyrOxBF4 [23].
Рис. 3.
Фрагмент структуры II. Подписи к атомам водорода не показаны для ясности. Вероятность тепловых эллипсоидов 50%.
Между катионами действуют слабые ВС С–Н···О, которые объединяют катионы в слои, перпендикулярные оси а. Причем катион N(1) соединен с двумя катионами N(2) через ВС С(12)···О(1) 3.26(1) Å и С(8)···О(2) 3.382(9) Å, а катион N(2) связан с двумя катионами N(1) через ВС С(12)···О(1) 3.26(1) Å и С(8)···О(2) 3.382(9) Å и одним катионом N(2) (симметрически связанным с ним центром инверсии) через две ВС С(5)···О(1) 3.301(8) Å.
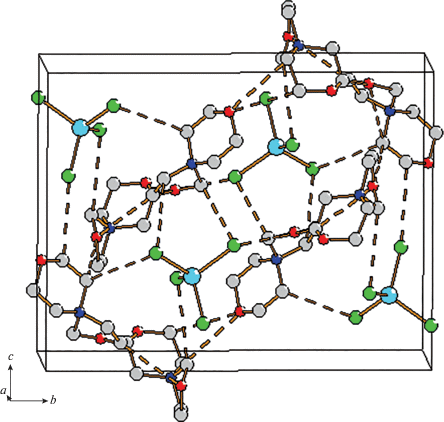
Каждый анион ${\text{CoCl}}_{4}^{{2 - }}$ окружен восемью кати-онами по вершинам искаженной тетрагональной ан-типризмы, четыре из них с атомом N(1) и четыре – с атомом N(2). Оба катиона окружены четырьмя анионами по вершинам искаженного тетраэдра каждый. При помощи ВС C–H···Cl (расстояния C···Cl варьируются от 3.434(8) до 3.688(9) Å) анионы сшивают слои катионов в трехмерный каркас (рис. 5).
Рис. 5.
Водородные связи в структуре II. Атомы водорода не показаны для ясности. Штриховыми линиями обозначены водородные связи.
Результаты ДСК всех полученных металлсодержащих ионных жидкостей представлены в табл. 2. Образец IV имеет в ряду представленных соединений самую низкую температуру плавления, немного выше комнатной температуры. Образец I имеет температуру плавления немного выше 100°С, тем не менее, данное соединение можно относить к ионным жидкостям в силу ионного строения и сходства с остальными образцами ионных жидкостей, представленных в данной работе. Для образца II обнаружено два фазовых эн-дотермических перехода, один из которых мо-жет соответствовать плавлению (75.2°С), а другой – переходу твердое–твердое (61.1°С). Для образца III зафиксирован экзотермический переход, что связано, по-видимому, с каким-то химическим превращением. Для установления природы переходов в образцах II и III необходимы дополнительные исследования.
Температуры плавления ИЖ II–IV меньше, чем температура плавления ИЖ I. Отсюда можно сделать предположение, что наличие дополнительного атома кислорода в катионе ИЖ приводит к повышению температуры плавления. Это можно объяснить тем, что атом кислорода образует дополнительные водородные связи. Так, в структуре I четыре атома кислорода катионов образуют семь уникальных водородных связей, в то время как в структуре II два атома кислорода образуют лишь четыре водородные связи. Такие экспериментальные факты уже ранее встречались [23]. В пользу такого предположения говорит и то, что, по нашим данным, температура плавления образца (MorphOx)2MnCl4 составляет 39.3°С, что выше температуры плавления образца IV.
Таким образом, в настоящей работе синтезированы четыре новые металлсодержащие ионные жидкости со спирокатионами 2,8-диоксо-5-азонияспиро[4.5]декан (MorphOx) и 2-оксо-5-азонияспиро[4.4]нонан (PyrOx) и тетрахлоридометаллат-анионами ${\text{MCl}}_{4}^{{2 - }}$ (M = Mn, Ni, Co). Определена их кристаллическая структура методом РСА, все соединения с катионом PyrOx изoструктурны. Методом ДСК определены температуры фазовых переходов полученных соединений. Температура плавления ИЖ при переходе от катиона PyrOx к катиону MorphOx растет, что можно предположительно объяснить увеличением количества атомов кислорода в катионе.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Soloveichik G.L. // Chem. Rev. 2015. V. 115. P. 11533.
Winsberg J., Hagemann T., Janoschka T. et al. // Angew. Chem. Int. Ed. 2016. V. 55. P. 2.
Noack J., Roznyatovskaya N., Herr T., Fischer P. // Angew. Chem. Int. Ed. 2015. V. 54. P. 9776.
Асланов Л.А., Захаров М.А., Абрамычева Н.Л. Ионные жидкости в ряду растворителей. М.: Изд-во Моск. ун-та, 2015. 272 с.
Злотин С.Г., Махова Н.Н. // Успехи химии. 2010. Т. 79. № 7. С. 603.
Marcus Y. Ionic Liquid Properties. From Molten Salts to RTILs. Springer, 2016. 244 p.
MacFarlane D.R., Kar M., Pringle J.M. Fundamentals of Ionic Liquids. From Chemistry to Applications. Wiley-VCH Verlag GmbH&Co., 2017. 248 p.
Vekariya R.L. // J. Mol. Liq. 2017. V. 227. P. 44.
Greaves T.L., Drummond C.J. // Chem. Rev. 2015. V. 115. P. 11379.
Dai C., Zhang J., Huang C., Lei Z. // Chem. Rev. 2017. V. 117. P. 6929.
Yoshida Y., Tanaka H., Saito G. et al. // Inorg. Chem. 2009. V. 48. P. 9989.
Yoshida Y., Saito G. // J. Mater. Chem. 2006. V. 16. P. 1254.
Hayashi S., Hamaguchi H.-O. // Chem. Lett. 2004. V. 33. P. 1590.
Hapiot P., Lagrost C. // Chem. Rev. 2008. V. 108. P. 2238.
Watanabe M., Thomas M.L., Zhang S. et al. // Chem. Rev. 2017. V. 117. P. 7190.
Hayes R., Warr G.G., Atkin R. // Chem. Rev. 2015. V. 115. P. 6357.
Ue M., Ida K., Mori S. // J. Electrochem. Soc. 1994. V. 141. P. 2989.
Clough M.T., Geyer K., Hunt P.A. et al. // Phys. Chem. Chem. Phys. 2016. V. 18. P. 3339.
Yu C., Iwama E., Ueda T. et al. // J. Phys. Chem. C. 2020. V. 124. P. 12230.
Nguyen H.V.T., Lee S., Kwak K., Lee K.-K. // Electrochim. Acta. 2019. V. 321. P. 134649.
Xu L., Gao J.-X., Chen X.-G. et al. // Dalton Trans. 2018. V. 47. P. 16995.
Devarajan T., Higashiya S., Dangler C. et al. // Electrochem. Commun. 2009. V. 11. P. 680.
Higashiya S., Filatov A. S., Wells C. C. et al. // J. Mol. Struct. 2010. V. 984. P. 300.
Estager J., Holbrey J. D., Swadzba-Kwasny M. // Chem. Soc. Rev. 2014. V. 43. P. 847.
Brown L.C., Hogg J.M., Swadzba-Kwasny M. // Top. Curr. Chem. 2017. V. 375. P. 1.
Meyer C., Werner S., Haumann M., Wasserscheid P. // Ionic Liquids Completely UnCOILed: Critical Expert Overviews. Wiley & Sons, 2015. P. 107.
Захаров М.А., Филатова Ю.В., Быков М.А. и др. // Коорд. химия. 2020. Т. 46. № 4. С. 249 (Zakharov M.A., Filatova Y.V., Bykov M.A. et al. // Russ. J. Coord. Chem. 2020. V. 46. № 4. P. 268. https://doi.org/10.1134/S1070328420040077
Zakharov M.A., Fetisov G.V., Veligzhanin A.A. et al. // Dalton Trans. 2015. V. 44. P. 18576.
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. P. 112.
Farrugia L.J. // J. Appl. Cryst. 1999. V. 32. P. 837.
Diamond. Crystal and Molecular Structure Visualization. Bonn: Crystal Impact, 2014.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия