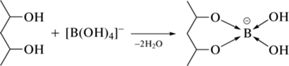Координационная химия, 2022, T. 48, № 10, стр. 625-631
Применение комплексообразующего импрегнированного поливинилового спирта для определения углеводов методом оптической микрометрии
И. С. Щемелев 1, *, М. А. Смирнова 1, А. В. Иванов 1, 2, Н. Б. Ферапонтов 1
1 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
2 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: shchemelev_93@mail.ru
Поступила в редакцию 19.04.2022
После доработки 21.04.2022
Принята к публикации 22.04.2022
- EDN: SQHSYP
- DOI: 10.31857/S0132344X22100061
Аннотация
Показана возможность определения концентрации водорастворимых углеводов методом оптической микрометрии с помощью гранул поливинилового спирта (ПВС), импрегнированного тетраборатом натрия. Изучено влияние кислотности на величину аналитического сигнала. Для определения концентрации глюкозы в присутствии сахарозы оптимальный диапазон pH составляет 8.5–10.0. Установлено, что для достижения равновесного объема чувствительной полимерной гранулы требуется около 30 мин, причем изменение объема является обратимым. Построен градуировочный график для определения концентрации глюкозы в диапазоне от 0 до 40 ммоль/дм3. Показано, что импрегнирование гранулы ПВС тетраборатом натрия приводит к снижению предела обнаружения до 6.9 ммоль/дм3 и повышению селективности, которую можно варьировать путем изменения pH раствора.
Одной из важных задач современной аналитической химии является разработка внелабораторных способов определения углеводов в пищевых продуктах, а также в целях клинической диагностики. К настоящему времени для решения этой задачи уже разработаны различные типы сенсоров и тест-систем, позволяющие быстро и надежно проводить определение концентрации глюкозы, сахарозы, фруктозы и других сахаров без сложной пробоподготовки. К ним относятся амперометрические [1–4], оптические [5–7], термометрические [8] и прочие аналитические системы, принцип действия которых в подавляющем большинстве основан на ферментном расщеплении углеводов с последующим аналитическим откликом на продукты данных реакций. С их помощью возможно определение концентраций углеводов на уровне ~1 ммоль/дм3 и ниже с относительным стандартным отклонением до 10%. Основным ограничением данного подхода является низкая устойчивость ферментов, что приводит к короткому сроку службы сенсоров, а также их высокая стоимость.
Другой подход к решению данной проблемы основан на применении сенсорных материалов на основе полимеров с ковалентно иммобилизованной на них фенилборной кислотой. В большинстве случаев подобные исследования проводили на фотонно-кристаллических [9–11] и голографических [12–14] сенсорах, принцип действия которых основан на изменении Брэгговской дифракции света в оптическом диапазоне длин волн. При нанесении аналита на фотонно-кристаллическую структуру или ее аналог (например, голографический сенсор) происходит изменение степени набухания чувствительного элемента, что приводит к изменению периода структуры фотонного кристалла и эффективного показателя преломления, вследствие чего происходит сдвиг максимума в спектре отражения [14–16]. Однако стоимость таких материалов для определения глюкозы повышается вследствие модификации полимеров дорогостоящими производными фенилборной кислоты.
Альтернативным способом определения концентрации растворенных веществ служит метод оптической микрометрии (ОМ), позволяющий напрямую определять степень набухания полимеров и служащий инструментом для физико-химического исследования процессов, приводящих к изменению данной величины при замене чистого растворителя на раствор пробы. Здесь в качестве чувствительного элемента используются сферические гранулы из гидрофильных полимеров, объем которых изменяется при изменении состава раствора, в котором они находятся. Измерение объема гранул осуществляется с помощью обработки фотографий, получаемых с помощью оптического микроскопа, снабженного цифровой видеокамерой. Благодаря возможностям специального пакета программ для получения аналитического сигнала, определение концентрации растворенного вещества методом ОМ возможно как по измерению объема гранул, выдержанных в растворе пробы до состояния равновесия [17, 18], так и по 3D-кинетическим поверхностям с помощью кинетических коэффициентов, получаемых при обработке экспериментальных данных кинетической гетерофазной моделью строения полимерных гелей и составляющих базу данных прибора [19–21]. К настоящему времени проведены исследования возможности определения концентрации растворенных углеводов данным методом [22–24]. Показано, что равновесная степень набухания полимера в растворах слабо отличалась от равновесной степени набухания в воде, а для установления равновесия требовалось от 2 до 5 ч. Все это делало невозможным анализ растворов, содержащих углеводы, по равновесным данным, поэтому были построены кинетические поверхности, обладающие характерным минимумом на начальном участке [23]. Тем не менее отсутствие селективности исследованных полимеров к растворимым в воде сахарам делало этот подход возможным только для анализа индивидуальных модельных растворов и существенно ограничивало его применение для анализа реальных объектов даже при определении суммарного содержания углеводов.
Для устранения данного недостатка возможно применение полимеров, импрегнированных или поверхностно модифицированных борной кислотой или ее солями благодаря комплексообразованию последних с 1,2- или 1,3-диолами. Подобный подход был успешно применен на фотонно-кристаллическом массиве с чувствительным слоем из поливинилового спирта [25], а также в варианте тонкослойной хроматографии на пластинках, покрытых SiO2 [26]. В настоящей работе данный подход был предложен для определения концентрации растворимых углеводов методом ОМ с целью повышения чувствительности и селективности.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали следующие реактивы: поливиниловый спирт (ПВС) марки 18/11, эпихлоргидрин, сахароза (ч. д. а.), D-глюкоза (ч.), NaOH, Na2B4O7 10-водный (ч. д. а.), NaCl (ч. д. а.), KCl (ч.), Na2HPO4 · 12H2O (ч.), KH2PO4 (ч.)
Для изучения степени набухания полимерных гранул использовали установку, состоящую из 48-луночного планшета для биохимических исследований или ячейки и оптического микроскопа, снабженного источником света и цифровой видеокамерой, подключенной к персональному компьютеру, снабженному пакетом программ для получения и обработки фотоизображений [27].
Методика приготовления фоновых растворов. В химический стакан емкостью 300 см3 помещали 4.0 г NaCl, 0.1 г KCl, 1.80 г Na2HPO4, 0.12 г KH2PO4 и 9.53 г Na2B4O7. Соли растворяли в воде при нагревании, затем охлаждали до комнатной температуры и доводили до требуемого значения pH добавлением концентрированных растворов HCl или NaOH, контролируя кислотность с помощью рН-метра. Затем количественно переносили в мерную колбу емкостью 500.0 см3, доводили до метки дистиллированной водой, перемешивали. Полученные растворы содержали 0.05 моль тетрабората натрия в 1 дм3. В дальнейшем эти растворы использовали для приготовления растворов, содержащих глюкозу и сахарозу.
Методика получения сферических гранул поливинилового спирта. Получение гранул ПВС-20 проводили в соответствии с методикой, разработанной на основе работ [28, 29]. Навеску ПВС заливали 100 см3 дистиллированной воды, нагревали до температуры 90–100°С, добиваясь полного растворения полимера и удаления пузырьков воздуха. Затем при непрерывном перемешивании приливали раствор гидроксида натрия (10 г в 20 см3 воды) в течение 30 мин. Полученный раствор охлаждали до температуры 30–40°С, приливали 20 см3 эпихлоргидрина, интенсивно перемешивали и переносили в вазелиновое масло, нагретое до 70°С и выдерживали при этой температуре при непрерывном перемешивании в течение 3 ч. Полученные гранулы отделяли от масла, затем промывали несколько раз ацетоном (для удаления остатков масла) и дистиллированной водой.
Методика изучения влияния кислотности на степень набухания гранул. Гранулы ПВС-20, очищенные от загрязняющих веществ, перемещали из воды в фоновые растворы с разным значением pH (от 7.5 до 10.5 с шагом по 0.5 ед.) и выдерживали в эксикаторе, на дне которого находится такой же фоновый раствор, с плотно закрытой крышкой, до состояния равновесия в течение 1 ч. Затем раствор сливали и заливали свежий (такая процедура необходима для поддержания постоянства концентраций компонентов фонового раствора в течение эксперимента).
Гранулы, приведенные таким образом в состояние равновесия с фоновыми растворами, помещали в ячейки планшета, заполненные этим же раствором, фотографировали с помощью цифровой камеры и определяли их объем – V0. Затем сливали фоновые растворы из ячеек и заменяли их на растворы углеводов с концентрацией 40 ммоль/дм3 (по 5 гранул на каждый раствор), приготовленные на соответствующих фоновых растворах. Планшеты с гранулами помещали в соответствующие эксикаторы, выдерживали в течение 1 ч до состояния равновесия и снова фотографировали. На основании данных фотографирования вычисляли значение V/V0. По полученным результатам строили зависимость относительного объема гранул от pH раствора для каждого исследуемого углевода.
Методика изучения кинетики набухания гранул в растворах углеводов. Изучение кинетики набухания гранул ПВС-20 проводили по методике, описанной в [19, 20]. Гранулу ПВС-20, приведенную в равновесие с фоновым раствором при определенном значении pH помещали в измерительную ячейку и фотографировали 5 раз. По полученным фотографиям определяли значение V0. Затем в ячейке меняли фоновый раствор на раствор углевода с определенной концентрацией и тотчас же начинали фотосъемку гранулы в ячейке с частотой 1 кадр/с. По истечении 5 мин частоту съемки меняли на 1 кадр в 10 с. Время эксперимента составляло ~1 ч. Последующую обработку фотоизображений проводили тем же самым способом, как и при определении V0. По полученным данным строили кинетические кривые в координатах V/V0–f(t) для растворов с разными концентрациями углеводов для оценки времени, необходимого для установления равновесия.
Гранулы ПВС-20, очищенные от загрязняющих веществ, перемещали из воды в фоновый раствор с оптимальным для этого углевода значением pH и выдерживали в эксикаторе, на дне которого находился такой же фоновый раствор, с плотно закрытой крышкой до состояния равновесия в течение 1 ч. Затем раствор сливали и заливали свежий (такая процедура необходима для поддержания постоянства концентраций компонентов фонового раствора в течение эксперимента).
Гранулы, приведенные таким образом в состояние равновесия с фоновым раствором, помещали в ячейки планшета, заполненные этим же раствором, фотографировали и определяли их объем – V0. Затем сливали фоновый раствор из ячеек и заменяли его на растворы углевода с концентрациями 2, 4, 6, 10 и 20 ммоль/дм3 (по 5 гранул на каждый раствор). Планшет с гранулами помещали в эксикатор, на дне которого находился фоновый раствор, выдерживали в течение 1 ч до состояния равновесия и снова фотографировали. На основании данных фотографирования вычисляли значение V/V0. По усредненным результатам полученных данных строили градуировочные графики, с помощью которых возможно определение концентрации углеводов в анализируемых растворах.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Взаимодействие поливинилового спирта с тетраборатом натрия. Известно [30, 31], что борная кислота и ее производные способны к обратимому взаимодействию с 1,2- и 1,3-диолами с образованием хелатных эфиров. Такое название они получили потому, что содержат в своем составе 5- или 6-членные циклы (хелаты) с атомом бора в качестве центрального атома и многоатомные спирты в качестве лигандов. В частности, при обработке поливинилового спирта избытком тетрабората натрия в слабощелочной среде протекает следующая реакция:
При взаимодействии обработанного таким образом ПВС со слабощелочным раствором, содержащим водорастворимый углевод, возможен следующий процесс:
В ходе него происходит образование дополнительных сшивок в полимерной сетке, что приводит к уменьшению степени набухания полимерного геля. При увеличении концентрации углеводов возможна дальнейшая десорбция борсодержащих групп с поверхности ПВС, что приводит к его полной регенерации [22].
На таком же принципе основан отклик и полимеров, ковалентно модифицированных фенилборной кислотой или ее производными. Основное отличие заключается в том, что при этом определяемые в растворе углеводы непосредственно связываются с функциональными группами полимера, т.е. происходит их хемосорбция [9]. Однако, как было отмечено ранее, стоимость фенилборной кислоты и ее производных достаточно высока, а модифицирование известных полимеров данным классом органических реагентов иногда протекает в несколько стадий, каждая из которых сопряжена с необходимостью удаления избытков участников реакций [32], что приводит к еще большему увеличению стоимости получаемых чувствительных элементов. Применение полиспиртов, импрегнированных борной кислотой или ее солями, являющимися более доступными и дешевыми реагентами, а также простота стадии импрегнирования делают возможным использование предлагаемой методики определения углеводов практически во всех лабораториях и передвижных станциях, занимающихся внелабораторным анализом.
Влияние кислотности на степень набухания ПВС-20 в растворах углеводов. Как и в любом случае при комплексообразовании с участием лиганда, представляющего собой слабую кислоту, существенное влияние на образование эфирных хелатов будет оказывать влияние кислотности раствора. Нами была получена зависимость равновесного объема гранул поливинилового спирта от pH фосфатного буферного раствора, содержащего глюкозу и сахарозу с концентрацией 40 ммоль/дм3 в присутствии 0.05 моль/дм3 Na2B4O7 (рис. 1). Из графика видно, что объем гранул, выдерживаемых в растворах глюкозы, уменьшается с увеличением значения pH от 7.5 до 8.5 и остается приблизительно постоянным в диапазоне от 8.5 до 10.0. Этот эффект может быть связан с увеличением доли депротонированных спиртовых групп глюкозы и, как следствие, более легким лигандообменным процессом. При значениях pH раствора больше 10.0 более благоприятным оказывается образование комплекса бора с ПВС вследствие увеличения доли депротонированных гидроксильных групп полимера, что приводит к обратному увеличению объема гранул. Следует отметить, что в диапазоне pH от 8.0 до 10.5 не наблюдается отклика на сахарозу. Это может быть связано со слабой способностью сахарозы к образованию комплексов с бором вследствие отсутствия в молекуле углевода цис-диольных фрагментов. Для дальнейшего изучения поведения гранул ПВС в растворах глюкозы было выбрано значение pH буферного раствора 8.5.
Рис. 1.
Зависимость относительного объема гранул ПВС-20 в растворах сахарозы (1) и глюкозы (2) от кислотности среды: фосфатный буферный раствор, Cуглеводов = 0.04 моль/дм3, ${{C}_{{{\text{N}}{{{\text{a}}}_{{\text{2}}}}{{{\text{B}}}_{{\text{4}}}}{{{\text{O}}}_{{\text{7}}}}}}}$ = 0.05 моль/дм3.

Кинетика набухания ПВС-20 в растворах глюкозы. При определении концентрации растворенных веществ с помощью чувствительных полимеров возникает необходимость их выдерживания в растворе пробы до состояния равновесия. Зачастую при этом возникает проигрыш в экспрессности проведения анализа, поскольку для ряда полимеров время достижения равновесной степени набухания составляет более 30 мин, а в ряде случаев и несколько часов. В связи с этим в аналитических целях предлагается использование данных о кинетике изменения объема полимерных гелей.
В настоящей работе была изучена кинетика набухания гранул ПВС-20 при их перемещении из фонового раствора в раствор, содержащий глюкозу. На рис. 2 представлены полученные кинетические кривые. Зависимости имеют вид убывающих кривых с выходом на равновесие, что подтверждает факт образования дополнительных поперечных сшивок в гранулах через атом бора. Таким образом, скорость сжатия гранул определяется скоростью десорбции бора с поверхности ПВС (с точки зрения квазигомогенной модели строения полимерных гелей). Это означает, что в рамках клаcсической кинетической гетерофазной модели строения полимерных гелей [20] кривые не могут быть описаны, поскольку последняя не учитывает хемосорбцию или хемодесорбцию растворенных в воде веществ. Отметим, что на кривой, соответствующей концентрации глюкозы 1 ммоль/дм3, это незаметно, поскольку данная концентрация находится ниже предела обнаружения глюкозы. Видно, что для достижения равновесной степени набухания гранул требуется около 30 мин, что существенно меньше по сравнению с немодифицированным ПВС. Вероятно, что замена ПВС на матрицу, которая образует менее устойчивые комплексы с бором позволят еще больше снизить этот показатель.
Рис. 2.
Кинетические кривые изменения объема гранул ПВС при их перемещении из фонового раствора в растворы глюкозы. Cглюкозы = 1 (1), 8 (2) и 40 ммоль/дм3 (3).

Одним из важных факторов использования гранул в качестве чувствительных элементов является обратимость их набухания при перенесении из растворителя в раствор и обратно. Кинетические кривые прямого и обратного экспериментов представлены на рис. 3, из которых видно, что система ПВС-20–тетраборат обратима. Это особенно важно для создания сенсорных устройств, основанных на взаимодействии ПВС–тетраборат, для многократного использования, что дает исследователю возможность проводить измерения в условиях повторяемости.
Рис. 3.
Кинетические кривые, полученные в ходе прямого (1) и обратного (2) экспериментов, Cглюкозы = 40 ммоль/дм3.

Еще одним полезным применением кинетики набухания полимерных гелей при анализе реальных объектов является возможность определения нескольких аналитов при совместном присутствии [18]. В этом случае кинетические кривые рассматриваются как многомерные данные, а применение математических алгоритмов, таких как множественная линейная регрессия, регрессия на главных компонентах и дробный метод наименьших квадратов, может позволить решать задачи подобного плана.
Градуировочный график для определения глюкозы и оценка предела ее обнаружения. Для количественного определения глюкозы и оценки предела ее обнаружения был построен градуировочный график (рис. 4а), представляющий собой зависимость равновесного относительного объема гранул ПВС от концентрации глюкозы в присутствии 0.05 моль/дм3 Na2B4O7 при значении pH 8.5 в диапазоне концентраций глюкозы от 0 до 40 ммоль/дм3. По ранее полученным данным [20] был построен график зависимости глубины минимума на кинетических кривых от концентрации глюкозы в водном растворе в диапазоне от 0 до 2 моль/дм3 (рис. 4б).
Рис. 4.
Зависимость относительного объема гранул ПВС-20 от концентрации глюкозы: фосфатный буферный раствор, pH 8.5, ${{C}_{{{\text{N}}{{{\text{a}}}_{{\text{2}}}}{{{\text{B}}}_{{\text{4}}}}{{{\text{O}}}_{{\text{7}}}}}}}$ = 0.05 моль/дм3 (a), водные растворы глюкозы (б).

Oба графика, представленных на рис. 4, видно, что в выбранных диапазонах концентраций они представляют собой линейную зависимость величины аналитического сигнала от концентраций. Установлено, что в присутствии тетрабората натрия в растворе предел обнаружения глюкозы составляет 6.9 ммоль/дм3, в то время как в его отсутствие – 0.2 моль/дм3. Иными словами, чувствительность определения глюкозы за счет применения реакции комплексообразования ПВС с бором в слабощелочной среде возрастает практически в 30 раз, что дает возможность проводить анализы в таком диапазоне концентраций, в котором активность воды фонового раствора и раствора пробы практически одинакова, вследствие чего полимер не будет реагировать на другие растворенные в воде вещества, а это означает высокую селективность к углеводам. Кроме того, немодифицированный ПВС откликается как на глюкозу, так и на сахарозу, причем чувствительность к сахарозе вдвое выше, чем к глюкозе, в то время как при использовании модифицированного тетраборатом ПВС возможно достижение селективности к одному углеводу путем варьирования pH раствора, что было показано ранее. Следовательно, использование реакции комплексообразования бора с ПВС с последующим обменом лигандов приводит к значительному повышению чувствительности полимера к углеводам, селективности и дает возможность проводить определение по равновесным данным в пищевых продуктах, содержащих глюкозу в соответственном диапазоне концентраций, таких как мед, фрукты, овощи, а также в витаминных комплексах и лекарственных сиропах для детей.
Таким образом, исследована возможность применения поливинилового спирта, импегнированного раствором тетрабората натрия, для определения концентрации растворимых в воде углеводов (глюкозы и сахарозы). Данный материал продемонстрировал высокую селективность при определении концентрации глюкозы в слабощелочной среде в присутствии сахарозы, а также чувствительность, достаточную для анализа пищевых продуктов, таких как мед, овощи, фрукты, кондитерские изделия и пр. Селективность достигается путем варьирования pH раствора в диапазоне от 8.5 до 10.0. В дальнейшем планируется изучение набухания гранул ПВС с образованными на его поверхности комплексными соединениями с бором в растворах других углеводов. Основным ограничением метода оптической микрометрии является широкий доверительный интервал для измеренного аналитического сигнала, что может быть связано с неоднородностью распределения сшивающего реагента внутри гранул одной партии или их неидеальной сферичности. Наиболее вероятной областью применения данного полимера будет создание фотонно-кристаллических и голографических сенсоров на его основе и разработка подходов к анализу пищевых продуктов с их использованием.
Автор заявляет, что у него нет конфликта интересов
Список литературы
Karpova E.V., Shcherbacheva E.V., Galushin A.A. et al. // Anal. Chem. 2019. V. 91. № 7. P. 3778.
Zhuang N., Ma J., Yang L. // Microchem. J. 2021. V. 164. Art. 106075.
Conzuelo F., Gamella M., Campuzano S. et al. // J. Agric. Food Chem. 2010. V. 58. № 12. P. 7141.
Antiochia R., Vinci G., Gorton L. // Food Chem. 2013. V. 40. № 4. P. 742.
Adeniyi O., Sicwetsha S., Mashazi Ph. // ACS Appl. Mater. Interfaces. 2020. V. 12. № 2. P. 1973.
Zhou C., Shi Ya., Ding X. et al. // Anal. Chem. 2013. V. 85. № 2. P. 1171.
Aksorn J., Teepoo S. // Talanta. 2020. V. 207. Art 120302.
Tao Yi., Luo F., Lin Yi. et al. // Talanta. 2021. V. 230. Art 122364.
Chen Ch., Dong Zh.-Q., Shen J.-H. et al. // ACS Omega. 2018. V. 3. P. 3211.
Lan Yu., Xue M., Qiu L., Meng Z. // Chem. Select. 2019. V. 4. № 21. P. 6547.
Yan Z., Xue M., He Q. et al. // Anal. Bioanal. Chem. 2016. V. 408. № 29. P. 8317.
Moghaddam G.K., Margerison H., Suzuki J. et al. // Sens. Actuators. B. 2018. V. 267. P. 1.
Крайский А.В., Постников В.А., Султанов Т.Т., Хамидулин А.В. // Квант. электроника. 2010. Т. 40. № 2. С. 178.
Postnikov V.A., Kraiskii A.V., Sergienko V.I. // Holography – Basic Principles and Contemporary Applications. London: IntechOpen, 2013. P. 111.
Chen C., Zhu Y., Bao H. et al. // Soft Matter. 2011. V. 7. P. 915.
Jiang H., Zhu Y., Chen C. et al. // New J. Chem. 2012. V. 36. № 4. P. 1051.
Ковалева С.С., Ферапонтов Н.Б. // Сорбц. хромат. процессы. 2007. Т. 7. № 7. С. 883.
Бабаян И.И., Токмачев М.Г., Иванов А.В., Ферапонтов Н.Б. // Журн. аналит. химии. 2019. Т. 74. № 8. С. 634 (Babayan I.I., Tokmachev M.G., Ivanov A.V., Ferapontov N.B. // J. Anal. Chem. 2019. V. 74. № 8. P. 834). https://doi.org/10.1134/S0044450219080036
Гагарин А.Н., Ферапонтов Н.Б., Токмачев М.Г. // Коллоидн. журн. 2017. Т. 79. № 6. С. 705 (Gagarin A.N., Ferapontov N.B., Tokmachev M.G. // Colloid J. 2017. V. 79. № 6. P. 740). https://doi.org/10.1134/S1061933X17060096
Токмачев М.Г., Ферапонтов Н.Б., Тробов Х.Т., Гавлина О.Т. // Учен. зап. физ. фак-та Моск. ун-та. 2018. № 5. 1850303.
Тиханова О.А., Гагарин А.Н., Токмачев М.Г. et al. // Сорбц. хромат. процесы. 2021. Т. 21. № 6. С. 860.
Ivanov A.V., Smirnova M.A., Tikhanova O.A. et al. // Theor. Found. Chem. Technol. 2021. V. 55. № 5. P. 1009.
Щемелев И.С., Ферапонтов Н.Б., Иванов А.В. // Н-ауч. вестн. СамГУ. 2021. № 3(127). С. 14.
Щемелев И.С., Староверова А.В., Иванов А.В., Ферапонтов Н.Б. // Сорбц. хромат. процессы. 2021. Т. 21. № 6. С. 841.
Cui Q., Muscatello M.M.V., Asher S.A. // Analyst. 2009. V. 134. № 5. P. 875.
Panahi H.A., Moniri E., Izadi A. et al. // J. Appl. Chem. Res. 2009. V. 9. P. 52.
Ферапонтов Н.Б., Ковалева С.С., Рубин Ф.Ф. // Журн. аналит. химии. 2007. Т. 62. № 10. С. 1028 (Ferapontov N.B., Kovaleva S.S., Rubin F.F. // J. Anal. Chem. 2007. V. 62. № 10. P. 924).https://doi.org/10.1134/S1061934807100048
Ямсков И.А., Буданов М.В., Даванков В.А. // Биоорган. химия. 1979. Т. 5. № 11. С. 1728.
Груздева А.Н., Горшков В.И., Гагарин А.Н., Ферапонтов Н.Б. // Журн. физ. химии. 2005. Т. 79. № 7. С. 1305 (Gruzdeva A.N., Gorshkov V.I., Gagarin A.N., Ferapontov N.B. // Russ. J. Phys. Chem. A. 2005. V. 79. № 7. P. 1150).
van Duin M., Peters J.A., Kieboom A.P.G., van Bekkum H. // Tetrahedron. 1984. V. 40. № 15. P. 2901.
van Duin M., Peters J.A., Kieboom A.P.G., van Bekkum H. // Tetrahedron. 1985. V. 41. № 16. P. 3411.
Wu Zh., Zhang Sh., Zhang X. et al. // J. Pharm. Sci. 2011. V. 100. № 6. P. 2278.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия