Координационная химия, 2022, T. 48, № 12, стр. 760-772
Синтез и строение комплексных солей с катионами 3-арилиден-1-пирролиния
Ю. К. Воронина 1, *, Е. Н. Зорина-Тихонова 1, Д. О. Блинов 1, О. В. Зверева 1, 2, Е. Ю. Пешкова 1, 3, А. В. Смолобочкин 4, И. Л. Еременко 1, 5
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
2 Национальный исследовательский университет “Высшая школа экономики”
Москва, Россия
3 Школа на Юго-Востоке им. Маршала В.И. Чуйкова
Москва, Россия
4 Институт органической и физической химии им. А.Е. Арбузова,
ФИЦ Казанский научный центр РАН
Казань, Россия
5 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
Москва, Россия
* E-mail: juliavoronina@mail.ru
Поступила в редакцию 13.05.2022
После доработки 27.05.2022
Принята к публикации 30.05.2022
- EDN: BXFLIU
- DOI: 10.31857/S0132344X22700074
Аннотация
При взаимодействии трифторацетатов 3-арилиден-1-пирролиния и хлорида цинка(II), нитрата меди(II), хлорида или диметилмалоната железа(III) получены комплексные соли (R-BpH)[MAnх], где R-BpH – протонированная форма 3-арилиден-1-пирролиния, выступающая в качестве катиона, An – хлорид, нитрат или диметилмалонат-анион. Все полученные соединения охарактеризованы методом ИК-спектрометрии, структура соединений установлена методом РСА (CCDC № 2169556–2169560). Показано, что все кристаллические структуры образованы за счет классических водородных связей типа N–H…O и O–H…O между комплексными анионами и протонированными органическими молекулами, а также π…π-взаимодействий между последними.
Одним из наиболее актуальных направлений в современной химии является получение новых координационных соединений с заданными свойствами, основанный на комбинировании органических и неорганических блоков, обладающих известными свойствами. Варьирование типов, соотношения и взаимной ориентации этих блоков в молекулах позволяет управлять свойствами конечных соединений [1–3]. В частности, при использовании этого подхода получены полифункциональные материалы, проявляющие одновременно магнитные и оптические свойства или оптические свойства и биологическую активность [1, 4, 5]. Ранее был изучен ряд галогенометаллатных комплексов хинолиния, изохинолиния и пиридиния [6–10]. Производные пирролина и пирролидина – пятичленные гетероциклические соединения, содержащие в своем составе нуклеофильный атом азота, – являются одними из наиболее часто встречающимися в природных (никотин, пролин) [11–16] и наиболее перспективных синтетических биологически активных соединениях [17–20]. Помимо этого, значительное количество различных реакционных центров делают эти соединения удобными прекурсорами для получения более сложных органических каркасов [20–25]. Координационные соединения эссенциальных металлов с производными пирролина представляют интерес не только как потенциально биологически активные соединения, но и как прекурсоры для дальнейшей постсинтетической модификации полученных комплексов.
Настоящая работа посвящена синтезу и изучению строения комплексных солей железа(III) (I, II), меди(II) (III) и цинка (IV, V) с катионами 3‑арилиден-1-пирролиния. Структурная формула производных 3-арилиден-1-пирролина, использованных в реакциях, представлена на схеме 1 .
R = Cl (для I и III), OH (для II и IV), OEt (для V)
Схема 1 .
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез соединений проводили на воздухе с использованием дистиллированной воды и следующих коммерчески доступных реагентов и растворителей: хлороформ (CHCl3, “х. ч.”, Химмед), FeCl3 · 6H2O (“х. ч.”, Реахим), Fe2(SO4)3 · 9H2O (“х.ч .”, Реахим), Ba(OH)2 · 8H2O (“х. ч.”, Реахим), Cu(NO3)2 · 3H2O (98%, Roth), ZnCl2 · xH2O (>99%, Alfa Aesar), диметилмалоновая кислота (H2Me2Mal, Fluorochem). Соединения (p-Cl-BpH)CF3CO2, (p‑OH-BpH)CF3CO2, (p-OEt-BpH)CF3CO2 и p-OH-Bp получали по ранее описанной методике [25].
Инфракрасные спектры полученных соединений регистрировали на спектрометре Perkin Elmer Spectrum 65, оснащенном приставкой Quest ATR Accessory (Specac), методом нарушенного полного внутреннего отражения (НПВО) в диапазоне 400–4000 см–1.
РСА монокристаллов изученных соединений проведен на автоматическом дифрактометре Bruker D8 Venture, оборудованном CCD-детектором (графитовый монохроматор, λMoKα = 0.71073 Å, ω- и φ-сканирование) при температуре 100 K. Проведен полуэмпирический учет поглощения с помощью программы SADABS [26]. Структуры расшифрованы прямым методом по программе SHELXT 2014/4 [27] и уточнены вначале в изотропном, затем в анизотропном приближении по программе SHELXL-2018/3 [28] с использованием OLEX2 [29]. Атомы водорода NH- и OH-групп всех соединений за исключением разупорядоченных фрагментов соединения II выявлены из разностных рядов электронной плотности, остальные помещены в геометрически рассчитанные положения и включены в уточнение по модели “наездника”. Кристаллографические параметры и детали уточнения структур приведены в табл. 1.
Таблица 1.
Кристаллографические данные и параметры уточнения структур I−V
| Параметр | Значение | ||||
|---|---|---|---|---|---|
| Формула соединения | Cl4Fe · 2(C11H11NCl) · · C2F3O2 (I) | C15H18O12Fe · · 3(C11H11NOH) · · 2(H2O) (II) |
N4O12Cu · · 4(C11H11CNCl) · · 2(NO3) (III) | Cl4Zn · · 2(C11H11NOH) (IV) | Cl3H2OZn · · C11H11NOC2H5 (V) |
| M | 695.98 | 1004.82 | 1206.23 | 555.60 | 392.00 |
| Сингония, пр. группа | Triclinic, $P\bar {1}$ | Monoclinic, C2/c | Triclinic, $P\bar {1}$ | Monoclinic, C2/c | Triclinic, $P\bar {1}$ |
| a, Å b, Å c, Å |
8.7822(3) 11.2645(4) 15.7304(6) |
19.932(4) 12.768(2) 40.083(8) |
8.0233(3) 10.4965(6) 15.9559(9) |
17.2976(9) 7.6362(4) 18.1929(9) |
5.2241(6) 10.6705(13) 15.5578(18) |
| α, град | 80.075(1) | 83.118(2) | 109.599(4) | ||
| β, град | 73.931(1) | 97.217(5) | 88.858(2) | 102.091(2) | 94.456(4) |
| γ, град | 73.043(1) | 69.875(2) | 96.240(3) | ||
| V, Å3 | 1423.22(9) | 10120(3) | 1252.29(11) | 2349.8(2) | 806.11(17) |
| Z | 2 | 8 | 1 | 4 | 2 |
| µ, мм−1 | 1.14 | 0.37 | 0.74 | 1.52 | 2.019 |
| Размеры кристалл, мм | 0.12 × 0.11 × 0.05 | 0.1 × 0.02 × 0.01 | 0.18 × 0.16 × 0.12 | 0.15 × 0.12 × 0.03 | 0.16 × 0.12 × 0.08 |
| Tmin, Tmax | 0.316, 0.381 | 0.290, 0.381 | 0.342, 0.381 | 0.317, 0.393 | 0.320, 0.381 |
| Число измеренных отражений | 13 522 | 32 155 | 10 076 | 16 235 | 8205 |
| Число независимых отражений | 6842 | 8905 | 4887 | 2829 | 4247 |
| Отражений с I > 2σ(I) | 6334 | 3807 | 4583 | 2458 | 3680 |
| Rint | 0.017 | 0.185 | 0.019 | 0.046 | 0.021 |
| R1/wR (F 2) (I > 2σ(I) | 0.0233/0.0560 | 0.0860/0.1797 | 0.0272/0.0708 | 0.0261/0.0593 | 0.0268/0.0599 |
| R1/wR (F 2) (по всем отражениям) | 0.0259/0.0574 | 0.1924/0.2288 | 0.0290/0.0719 | 0.0348/0.0659 | 0.0342/0.0628 |
| Число уточняемых параметров | 351 | 680 | 357 | 149 | 194 |
| Остаточная электронная плотность (max/min), e Å−3 | 0.40/−0.31 | 0.46/−0.57 | 0.33/−0.40 | 0.65/−0.32 | 0.44/−0.32 |
| Полиэдр центрального иона металла (SHAPE 2.1), CShM | Тетраэдр, 0.087 | Октаэдр, 0.398 | Квадрат, 0.017 | Тетраэдр, 0.164 | Тетраэдр, 0.522 |
Полный набор рентгеноструктурных параметров комплексов I–V депонирован в Кембриджском банке структурных данных (CCDC № 2169556–2169560) и доступны по адресу deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/ data_request/cif.
Геометрия полиэдров атомов металлов определена с использованием программы SHAPE 2.1 [30].
Синтез (p-Cl-ВpH)2[FeCl4](CF3COО) (I). Навеску FeCl3 · 6H2O (0.0152 г, 0.057 ммоль) растворяли в 10 мл CHCl3, после чего к раствору добавляли навеску (p-Cl-BpH)CF3COO (0.0339 г, 0.111 ммоль), раствор при этом изменял окраску с желтой на красную. Реакционную смесь перемешивали 60 мин при комнатной температуре (20°C), фильтровали и оставляли медленно испаряться на воздухе. Через 3 cут образовывались темно-красные кристаллы, пригодные для РСА. Выход 0.01 г (25% в расчете на исходное количество железа(III)).
ИК-спектр (НПВО; ν, см–1): 3268 ср, 1911 сл, 1628 сл, 1576 с, 1488 ср, 1444 ср, 1376 сл, 1304 с, 1234 сл, 1192 ср, 1162 с, 1085 с, 976 ср, 907 с, 882 ср, 829 ср, 727 с, 492 с.
Синтез (p-OH-ВpH)3[Fe(Me2Mal)3] · 2H2O (II). Навески Ba(OH)2 · 8H2O (0.0473 г, 0.15 ммоль) и H2Me2Mal (0.0396 г, 0.3 ммоль) растворяли в 15 мл H2O. К образовавшемуся бесцветному раствору добавляли навеску Fe2(SO4)3 · 9H2O (0.0281 г, 0.05 ммоль), вследствие чего раствор изменял окраску на бледно-желтую. Раствор перемешивали 45 мин при комнатной температуре (20°C), затем фильтровали. Далее, к маточнику при перемешивании добавляли навеску p-OH-Вp (0.052 г, 0.3 ммоль), цвет раствора изменялся на ярко-желтый. Раствор перемешивался в течение 30 мин, фильтровали и оставляли медленно испаряться на воздухе. Через 14 сут образовывались кристаллы, пригодные для РСА. Выход 0.038 г (44% в расчете на исходное количество железа (III)).
ИК-спектр (НПВО; ν, см–1): 3439 сл, 3051 ср, 2986 ср, 2875 ср, 2676 ср, 1568 с, 1507 с, 1458 с, 1392 с, 1348 с, 1287 с, 1246 с, 1200 с, 1162 с, 1112 с, 976 с, 886 с, 832 с, 759 с, 697 с, 590 с, 538 с, 500 с.
Синтез (p-Cl-BpH)4[Cu(NO3)4](NO3)2 (III). Навески Cu(NO3)2 · 3H2O (0.1 г, 0.413 ммоль) и (p-Cl-BpH)CF3CO2 (0.243 г, 0.826 ммоль) растворяли в 40 мл CHCl3 при нагревании (40°C) и перемешивали на протяжении 1 ч. Полученный раствор охлаждали до комнатной температуры и оставляли медленно испаряться. Примерно через 16 cут образовывались синие кристаллы, пригодные для РСА. Выход 0.085 г (17% в расчете на исходное количество меди(II)).
ИК-спектр (НПВО; ν, см–1): 3220 сл, 3142 ср, 3064 ср, 2979 ср, 2891 ср, 2841 ср, 2786 ср, 2647 ср, 2085 сл, 1891 сл, 1748 сл, 1660 сл, 1634 ср, 1612 ср, 1584 ср, 1562 сл, 1491 ср, 1464 ср, 1437 ср, 1423 ср, 1381 ср, 1306 с, 1286 с, 1197 ср, 1185 ср, 1169 с, 1121 ср, 1088 с, 1038 ср, 1008 ср, 953 ср, 814 с, 786 с, 726 ср, 710 ср, 699 ср, 683 ср, 581 ср, 526 ср, 500 с, 464 ср, 426 ср, 413 ср, 406 ср.
Синтез (p-OH-BpH)2[ZnCl4] (IV). Навески (p‑OH-BpH)CF3COO (0.0395 г, 0.144 ммоль) и ZnCl2 · xH2O (0.015 г, 0.072 ммоль) растворяли в 20 мл этанола. Реакционную смесь перемешивали при нагревании (60°C) в течение 1 ч. Через неделю образовывались кристаллы, пригодные для РСА. Выход 0.005 г (12% в расчете на исходное количество цинка).
Синтез (p-OEt-BpH)[Zn(H2O)Cl3] (V). Навеску (p-OEt-BpH)CF3COO (0.0437 г, 0.144 ммоль) растворяли в 20 мл CHCl3, после чего к раствору добавляли навеску ZnCl2 · xH2O (0.015 г, 0.072 ммоль). Реакционную смесь перемешивали на протяжении 1 ч. Образовавшийся желто-оранжевый раствор оставляли медленно испаряться. Оранжевые кристаллы, пригодные для РСА, образовывались через 11 недель. Выход 0.007 г (25% в расчете на исходное количество меди(II)).
ИК-спектр (НПВО; ν, см–1): 3226 сл, 3085 сл, 2986 сл, 2936 сл, 2888 сл, 1890 сл, 1772 сл, 1683 ср, 1574 с, 1512 ср, 1444 ср, 1383 сл, 1306 ср, 1258 ср, 1194 с., 1155 с, 1039 ср, 912 ср., 882 сл, 840 ср, 796 ср, 757 с, 725 ср, 666 ср, 618 ср, 586 ср, 534 ср, 490 с, 406 сл.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ.
Комплексные соли I, III–V были получены при взаимодействии трифторацетатов производных 3-арилиден-1-пирролиния и хлорида железа(III) (I), нитрата меди(II) (III), хлорида цинка (IV, V) при соотношении M : (R-BpH) CF3COO = = 1 : 2 в хлороформе (для I, III и V) или этаноле (для IV). В результате реакции образовались комплексные соли, в составе которых присутствует неорганический комплексный анион [FeCl4]– для I, [Cu(NO3)4]2– для III, [ZnCl4]2– для IV и [Cu(NO3)4]2– для V и органические катионы 3‑арилиден-1-пирролиния (схема 1 ). Замена анионов неорганической кислоты на анионы диметилмалоновой также привела к образованию комплексной соли II.
Строение полученных соединений определено методом рентгеноструктурного анализа. Катионная часть во всех случаях представлена протонированным 3-арилиден-1-пирролином. Анионная часть в комплексах I и III содержит помимо комплексного аниона еще и кислотный остаток. Причем, если в III это анион минеральной кислоты, то в I – трифторацетат, являющийся противоионом в исходной органической соли. В комплексах II, IV и V анионная часть представлена только комплексным анионом.
В комплексных солях железа(III) (I и II) состав и строение комплексного аниона определяется природой лиганда – в первом соединении железо имеет конфигурацию близкого к идеальному тетраэдра, построенного за счет координации четырех хлорид-ионов (рис. 1а). Минимальное расстояние Fe–Cl наблюдается до атома Cl(1), а максимальное – до атома Cl(4) (табл. 2), что связано со слабыми нековалентными взаимодействиями, в которые вовлечены эти атомы. Интересно отметить, что сильными водородными связями NH…O (табл. 3) в кристалле связаны только органический катион и анион трифторацетата, в результате чего образуется близкий к плоскому водородно-связанный синтон состава 2(p-Cl-BpH)+ : CF3C${\text{O}}_{2}^{ - }$. Анион [FeCl4]– при этом не только не лежит в этой плоскости, но и не образует никаких нековалентных взаимодействий, более значимых, чем CH…Cl. В результате упаковка молекул в кристалле образуется за счет π…π-взаимодействий между арилиденпирролиновыми фрагментами и слабых взаимодействий CH…O и CH…π и представляет собой чередование “анионного” слоя, образованного частицами ${\text{FeCl}}_{4}^{ - }$ и CF3COO– и “катионного”, образованного молекулами арилиденпирролина (рис. 1б).
Рис. 1.
Строение комплексной соли I в кристалле (а); фрагмент кристаллической упаковки соединения I (б). Здесь и на всех рисунках эллипсоиды приведены с вероятностью 50%.
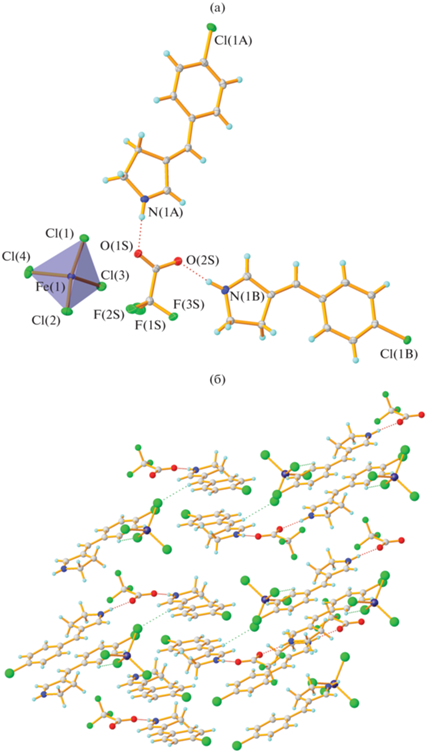
Таблица 2.
Избранные длины связей в комплексных анионах по данным РСА
| Связь | Длина, Å | Связь | Длина, Å |
|---|---|---|---|
| I | |||
| Fe(1)–C(l1) | 2.1786(4) | Fe(1)–Cl(3) | 2.1956(4) |
| Fe(1)–C(l2) | 2.1924(4) | Fe(1)–Cl(4) | 2.2071(4) |
| II | |||
| Fe(1)–O(1) | 1.961(4) | Fe(1)–O(7) | 2.003(5) |
| Fe(1)–O(3) | 1.963(5) | Fe(1)–O(9) | 2.002(5) |
| Fe(1)–O(5) | 1.991(5) | Fe(1)–O(11) | 2.009(5) |
| III | |||
| Cu(1)–O(4S) | 1.9649(12) | Cu(1)–O(7S) | 1.9650(13) |
| Cu(1)–O(4S) | 1.9649(12) | Cu(1)–O(7S) | 1.9651(13) |
| IV | |||
| Zn(1)–Cl(1) | 2.2797(5) | Zn(1)–Cl(2) | 2.2574(5) |
| Zn(1)–Cl(1) | 2.2797(5) | Zn(1)–Cl(2) | 2.2574(5) |
| V | |||
| Zn(1)–Cl(1) | 2.2304(5) | Zn(1)–Cl(2) | 2.2609(5) |
| Zn(1)–O(1) | 2.0218(14) | Zn(1)–Cl(3) | 2.2521(5) |
Таблица 3.
Геометрические параметры водородной связи в кристаллах соединений I−V
| D−H…A | Преобразование симметрии | Расстояние, Å | Угол D−H…A, град | ||
|---|---|---|---|---|---|
| D−H | H…A | D…A | |||
| I | |||||
| N(1A)–H(1A)…O(1S) | x, y, z | 0.85(2) | 1.83(2) | 2.6783(17) | 177(2) |
| N(1B)–H(1B)…O(2S) | x, y, z | 0.88(2) | 1.80(2) | 2.6744(16) | 174(2) |
| C(5A)–H(5AA)…O(1S) | 2 – x, 1 – y, 2 – z | 0.99 | 2.48 | 3.4685(18) | 175 |
| C(6A)–H(6A)…Cl(4) | x, 1 + y, z | 0.95 | 2.74 | 3.6649(14) | 166 |
| C(8B)–H(8B)…Cl(2) | 3 – x, 1 – y, 1 – z | 0.95 | 2.74 | 3.4875(15) | 136 |
| C(9A)–H(9A)…O(1S) | –1 + x, 1 + y, z | 0.95 | 2.49 | 3.4004(16) | 161 |
| II | |||||
| N(1A)–H(1A)…O(8) | 1 – x, –y, 1 – z | 0.88(8) | 1.84(8) | 2.686(10) | 160(8) |
| N(1B)–H(1B)…O(4) | x, 1 + y, z | 0.84(8) | 2.13(8) | 2.860(8) | 146(7) |
| O(13')–H(13')…O(5) | x, 1 + y, z | 0.84 | 1.98 | 2.818(15) | 172 |
| O(13')–H(13')…O(6) | x, 1 + y, z | 0.84 | 2.55 | 3.015(16) | 116 |
| O(13A)–H(13A)…O(9) | x, y, z | 1.06(7) | 2.56(6) | 3.198(7) | 118(4) |
| O(13A)–H(13A)…O(10) | x, y, z | 1.06(7) | 1.64(7) | 2.696(7) | 174(4) |
| O(13B)–H(13B)…O(12) | x, y, z | 0.76(6) | 1.87(6) | 2.609(6) | 165(7) |
| O(1S)–H(1SA)…O(2) | –1/2 + x, –1/2 + y, z | 0.87 | 1.82 | 2.691(7) | 177 |
| O(1S)–H(1SB)…O(10) | x, y, z | 0.87 | 1.94 | 2.791(7) | 164 |
| O(2S)–H(2SA)…O(7) | x, y, z | 0.87 | 2.52 | 2.980(7) | 114 |
| O(2S)–H(2SA)…O(8) | x, y, z | 0.87 | 2.09 | 2.945(9) | 167 |
| O(2S)–H(2SB)…O(1S) | x, y, z | 0.87 | 1.78 | 2.656(7) | 179 |
| N(1C')–H(1C')…O(2S) | x, y, z | 0.88 | 2.37 | 2.67(2) | 100 |
| N(1C')–H(1C')…O(13B) | x, y, z | 0.88 | 2.51 | 3.23(3) | 139 |
| C(2A)–H(2A)…O(6) | x, y, z | 0.95 | 2.27 | 3.124(10) | 148 |
| C(2B)–H(2B)…O(3) | x, 1 + y, z | 0.95 | 2.28 | 3.086(8) | 142 |
| C(5)–H(5A)…O(11) | x, y, z | 0.98 | 2.47 | 3.403(7) | 158 |
| C(5)–H(5B)…O(12) | 1 – x, y, 1/2 – z | 0.98 | 2.56 | 3.484(8) | 158 |
| C(6A)–H(6A)…O(6) | x, y, z | 0.95 | 2.45 | 3.322(10) | 153 |
| C(9)–H(9A)…O(1) | x, y, z | 0.98 | 2.42 | 3.352(9) | 159 |
| C(9B)–H(9BA)…O(4) | –1/2 + x, 1/2 + y, z | 0.95 | 2.43 | 3.329(9) | 157 |
| C(11')–H(11')…O(2S) | 1/2 + x, 1/2 + y, z | 0.95 | 2.37 | 3.299(18) | 165 |
| C(12')–H(12')…O(2) | x, y, z | 0.95 | 2.55 | 3.464(18) | 161 |
| C(14)–H(14A)…O(3) | x, y, z | 0.98 | 2.49 | 3.440(8) | 164 |
| C(5C')–H(5CD)…O(4) | –1/2 + x, 1/2 + y, z | 0.99 | 2.49 | 3.47(3) | 172 |
| C(2C')–H(2C')…O(7) | x, y, z | 1.14(12) | 2.30(12) | 3.05(2) | 121(8) |
| C2(C')–H(2C')…O(11) | x, y, z | 1.14(12) | 2.54(12) | 3.62(2) | 157(9) |
| III | |||||
| N(1A)–H(1A)…O(3S) | x, y, z | 0.83(2) | 1.96(2) | 2.7772(18) | 173.0(19) |
| N(1B)–H(1B)…O(2S) | x, y, z | 0.87(2) | 1.88(2) | 2.7443(18) | 174(2) |
| N(1B)–H(1B)…O(3S) | x, y, z | 0.87(2) | 2.52(2) | 3.0488(18) | 120.4(16) |
| C(4A)–H(4AA)…O(8S) | 1 – x, 2 – y, 1 – z | 0.99 | 2.53 | 3.240(2) | 128 |
| C(2A)–H(2A)…O(1S) | x, y, z | 0.95 | 2.51 | 3.105(2) | 121 |
| C(2B)–H(2B)…O(3S) | x, y, z | 0.95 | 2.47 | 3.040(2) | 118 |
| C(2B)–H(2B)…O(6S) | x, y, z | 0.95 | 2.38 | 3.288(2) | 160 |
| C(8B)–H(8B)…O(8S) | x, y, z | 0.95 | 2.57 | 3.270(2) | 131 |
| C(11B)–H(11B)…Cl(13) | –1 + x, –1 + y, –1 + z | 0.95 | 2.80 | 3.6548(17) | 151 |
| C(12A)–H(12A)…O(2S) | 1 – x, 1 – y, 2 – z | 0.95 | 2.55 | 3.318(2) | 138 |
| IV | |||||
| N(1)–H(1)…Cl(1) | 3/2 – x, 3/2 – y, 1 – z | 0.93(3) | 2.33(3) | 3.2120(16) | 158(3) |
| O(13)–H(13)…C(l2) | x, y, z | 0.76(3) | 2.43(3) | 3.1882(17) | 177(3) |
| C(2)–H(2)…O(13) | x, 1 – y, –1/2 + z | 0.95 | 2.27 | 3.206(2) | 169 |
| C(6)–H(6)…Cl(1) | x, 1 – y,–1/2 + z | 0.95 | 2.79 | 3.6951(19) | 160 |
| C(8)–H(8)…Cl(1) | x, 1 – y,–1/2 + z | 0.95 | 2.76 | 3.6588(18) | 158 |
| V | |||||
| N(1)–H(1)…Cl(3) | x, y, z | 0.81(2) | 2.50(2) | 3.2296(17) | 150(2) |
| N(1)–H(1)…Cl(3) | –1 – x, 1 – y, –z | 0.81(2) | 2.81(2) | 3.3534(16) | 126.4(19)' |
| O(1)–H(1A)…Cl(1) | –1 + x, y, z | 0.84(3) | 2.29(3) | 3.0794(17) | 157(3) |
| O(1)–H(1B)…Cl(2) | –1 + x, y, z | 0.82(3) | 2.39(3) | 3.1640(17) | 157(3) |
| C(5)–H(5B)…Cl(1) | –x, 1 – y, –z | 0.99 | 2.81 | 3.6780(19) | 146 |
| C(9)–H(9)…O(13) | 3 – x, 2 – y, 1 – z | 0.95 | 2.56 | 3.513(2) | 178 |
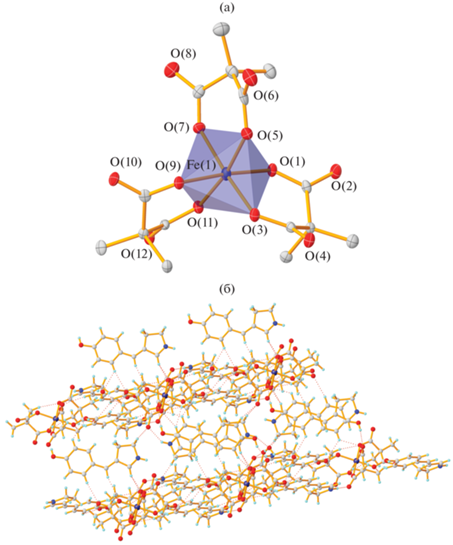
В соединении II строение аниона аналогично строению ранее полученных трисмалонатоферратов [31, 32]. На минимальном расстоянии от иона железа находится диметилмалонатный фрагмент, координированный по атомам О(1) и О(3), а на максимальном – по атомам О(9) и О(11) (рис. 2а, табл. 2). При этом именно эти два фрагмента участвуют в формировании водородных связей с сольватными молекулами воды, являющихся основным мотивом упаковки соответствующего кристалла (табл. 3). Катионная часть полученного соединения – три протонированные молекулы 3-арилиден-1-пирролина, содержащего гидроксильную группу в пара-положении. Таким образом, независимая часть элементарной ячейки представляет собой расположенные параллельно друг другу трис-диметилмалонатоферрат и стекинг-димер арилиденпирролина, третья молекула арилиденпирролина находится под этой плоскостью. За счет большого числа центров водородного связывания в системе этот фрагмент не только очень устойчив, но и формирует множество водородных связей (табл. 3), образуя слои, в которых чередуются цепочки трис-малонатных анионов и стекинг-димеров арилиденпирролина. Слои связаны между собой за счет третьего арилиденпирролинового фрагмента. Таким образом, получаются двойные слои, связанные между собой ван-дер-ваальсовыми взаимодействиями (рис. 2б).
Рис. 2.
Строение аниона трис-диметилмалоната железа в соединении II (a); фрагмент кристаллической упаковки соединения II (б).
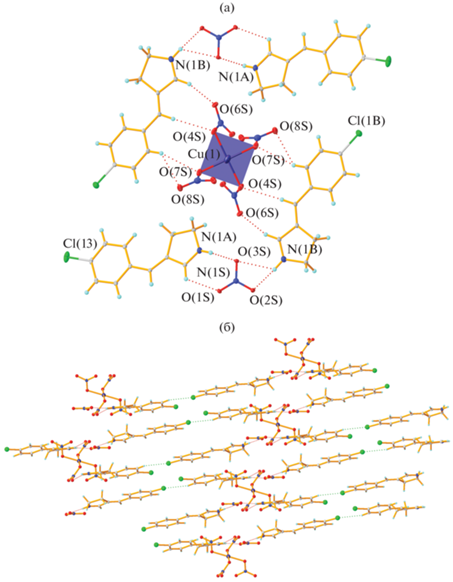
В соединении III анионная часть представлена нитрат- и тетранитрокупрат-анионами, а катионная – протонированным 3-арилиден-1-пирролином с атомом хлора в пара-положении. Атом меди находится в центре симметрии в плоско-квадратной конфигурации с практически равными расстояниями до атомов кислорода координированных нитрогрупп (табл. 2). Строение основного синтона аналогично описанному для соединения I, фрагмент из двух органических катионов и одного нитрат-аниона практически плоский, а независимая часть купрат-аниона выходит из плоскости (рис. 3а). Классические водородные связи NH…O образуются между нитратом и арилиденпирролинами, металлсодержащий анион связан с остальной частью кристалла более слабыми взаимодействиями CH…O (табл. 3). Упаковка молекул в кристалле представляет собой бесконечные плоские слои, связанные в трехмерную сетку объемными металлсодержащими анионами (рис. 3б).
Рис. 3.
Строение комплексной соли III и водородные связи между лигандами (a); фрагмент кристаллической упаковки соединения III (б).
В соединениях IV и V в качестве металлсодержащих анионов выступают хлориды цинка. Тетраэдральная конфигурация построена за счет четырех анионов хлора в соединении IV (рис. 4а) и трех анионов хлора и одной молекулы воды в соединении V (рис. 5а). Расстояния до атомов хлора в соединении IV несколько различаются, что, вероятно, обусловлено участием атомов хлора в сильных водородных связях различного типа (табл. 3). Наличие в молекуле 3-п-гидроксифенил-1-пирролина двух сильных доноров водородной связи приводит к тому, что с каждым комплексным анионом связано по четыре катиона, в результате чего образуются бесконечные зигзагообразные цепочки, связанные в трехмерную сетку взаимодействиями π…π, CH…O, CH…Cl (рис. 4б).
Рис. 4.
Строение комплексной соли IV в кристалле (а); фрагмент кристаллической упаковки соединения IV (б).
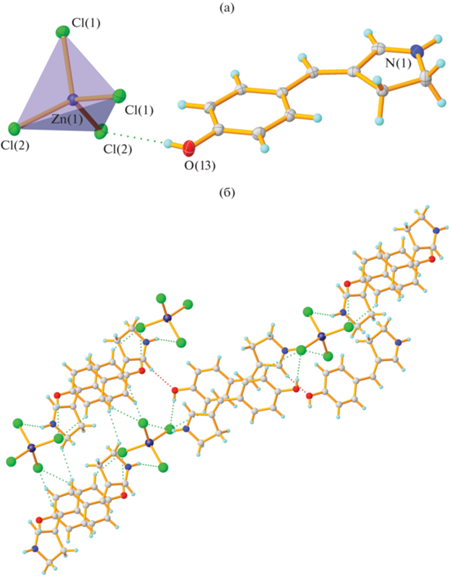
Рис. 5.
Строение комплексной соли V в кристалле (а); фрагмент бесконечной водородносвязанной цепочки в кристалле соединения V (б).
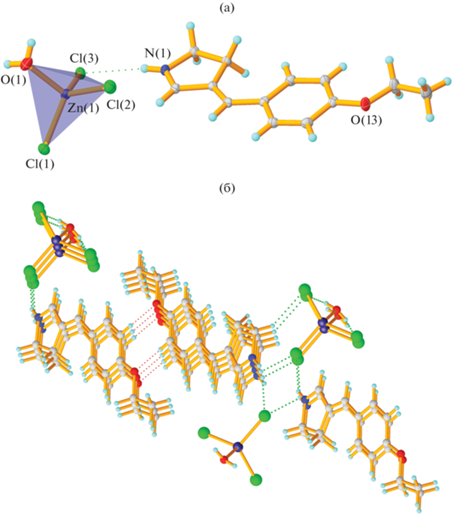
Искажение тетраэдрического атома цинка в V значительно сильнее, чем в IV (0.522 против 0.164 согласно данным программы Shape) (рис. 5а), что обусловливается тем фактом, что одно из координационных мест цинка вместо хлора занято молекулой воды. Таким образом, в кристалле этого соединения доноры водородной связи есть как в катионной, так и в анионной части. Катион и анион связаны за счет связей NH…Cl, образуя центросимметричные фрагменты, состоящие из двух катионов и двух анионов, связанные в бесконечную цепь за счет водородных связей OH…Cl между комплексными анионами (рис. 5б). В результате образуются бесконечные ленты, связанные стекинг-взаимодействиями между плоскими фрагментами арилиденпирролиния, сформированных по принципу “голова к хвосту”.
В результате анализа кристаллических упаковок можно сделать вывод, что основным мотивом формирования структуры изученных соединений является водородная связь между NH-группой катиона и акцепторным атомом аниона. Интересно отметить, что, сравнивая параметры водородных связей в соединениях, описанных в данной работе, и в органических трифторацетатах пирролиния, описанных ранее [25], можно сделать вывод о сохранении геометрии этих взаимодействий вне зависимости от природы аниона. Единственным исключением может стать соль с трис-диметилмалонатом железа(II), в которой несколько искажены углы NHO (табл. 3). Oднако этот факт легко объясняется более сложным по сравнению с остальными строением комплексного аниона и обилием других центров водородного связывания, что приводит к более сложной системе водородных связей в кристалле.
Таким образом, в данной работе описаны способы получения пяти новых комплексных солей производных 3-арилиден-1-пирролиния, охарактеризовано их строение и выявлены основные структурные мотивы образования кристаллов.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Karunananda M.K., Vázquez F.X., Alp E.E. et al. // Dalton Trans. 2014. V. 43. P. 13661.
Yeary L.W., Moon J.-W., Rawn C.J. et al. // J. Magn. Magn. 2011. V. 323. № 23. P. 3043.
Doungmene F., Aparicio P.A., Ntienoue J. et al. // Electrochim. Acta. 2014. V. 125. P. 674.
Reddy T.S., Privér S.H., Mirzadeh N. et al. // Inorg. Chem. 2020. V. 59. № 8. P. 5662.
Catto M., Aliano R., Carotti A. et al. // Eur. J. Med. Chem. 2010. V. 45. № 4. P. 1359.
Adonin S.A., Gorokh I.D., Samsonenko D.G. et al. // Polyhedron. 2019. V. 159. P. 318.
Gorokh I.D., Adonin S.A., Novikov A.S. et al. // Polyhedron. 2019. V. 166. P. 137.
Adonin S.A., Gorokh I.D. et al. // J. Struct. Chem. 2017. V. 58. № 4. P. 718.
Adonin S.A., Bondarenko M.A., Abramov P.A. et al. // Z. Anorg. Allg. Chem. 2019. V. 645. № 18–19. P. 1141.
Usol’tsev A.N., Shentseva I.A., Shayapov V. R. et al. // Russ. J. Inorg. Chem. 2021. V. 66. № 10. P. 1482.
Tyroller S., Zwickenpflug W., Richter E. // J. Agric. Food Chem. 2002. V. 50. № 17. P. 4909.
Pluotno A., Carmeli Sh. // Tetrahedron. 2005. V. 61. № 3. P. 575.
Laohakunjit N., Noomhorm A. // Flavour Fragr. J. 2004. V. 19. № 3. P. 251.
Dannhardt G., Kiefer W. // Arch. Pharm. 2001. V. 334. № 6. P. 183.
Klintworth R., de Koning Ch.B., Opatz T. et al. // J. Org. Chem. 2019. V. 84. № 17. P. 11025.
Guilard R., Kadish K., Smith K. et al. The Porphyrin Handbook. San Diego (CA): Academic Press, 2003. 284 p.
Micheletti G., Delpivo C., Baccolini Gr. // Green Chem. Lett. Rev. 2013. V. 6. № 2. P. 135.
Boga C., Cino S., Micheletti G. et al. // Org. Biomol. Chem. 2016. V. 14. № 29. P. 7061.
Haria M., Balfour J.A. // CNS Drugs. 1997. V. 7. № 2. P. 159.
Gazizov A.S., Smolobochkin A.V., Burilov A.R. et al. // Tetrahedron Lett. 2020. V. 61. № 39. P. 152371.
Smolobochkin A.V., Melyashova A.S., Gazizov A.S. et al. // Russ. J. Org. Chem. 2020. V. 56. P. 1115.
Melyashova A.S., Smolobochkin A.V., Gazizov A.S. et al. // Tetrahedron. 2019. V. 75. № 47. P. 130681.
Smolobochkin A.V., Gazizov A.S., Urgenishbay N.M. et al. // Russ. Chem. Bull. 2020. V. 69. № 2. P. 382.
Smolobochkin A.V., Melyashova A.S., Gazizov A.S. et al. // Russ. J. Gen. Chem. 2018. V. 88. P. 1934.
Smolobochkin A.V., Gazizov A.S., Melyashova A.S. et al. // RSC Advances. 2017. V. 7. № 80. P. 50955.
Krause L., Herbst-Irmer R., Sheldrick G.M. et al. // J. Appl. Crystallogr. 2015. V. 48. P. 3.
Sheldrick G.M. // Acta Crystallogr. A. 2015. V. 71. P. 3.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. A-ppl. Crystallogr. 2009. V. 42. P. 339.
Llunell M., Casanova D., Cirena J. et al. SHAPE. Version 2.1. Program for the Stereochemical Analysis of Molecular Fragments by Means of Continuous Shape Measures and Associated Tools. Barcelona (Spain): Universitat de Barcelona, 2013.
Clegg W. // Acta Crystallogr. C. 1985. V. 41. P. 1164.
Calogero S., Stievano L., Diamandescu L. et al. // Polyhedron. 1997. V. 16. № 23. P. 3953.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия