Координационная химия, 2022, T. 48, № 12, стр. 752-759
Бис-о-семихиноновые комплексы кобальта(III) c п-толилзамещенными формазановыми лигандами: синтез, строение и магнитные свойства
Н. А. Протасенко 1, *, Е. В. Баранов 1, И. А. Якушев 2, А. С. Богомяков 3, В. К. Черкасов 1
1 Институт металлоорганической химии им. Г.А. Разуваева РАН
Нижний Новгород, Россия
2 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
3 Международный томографический центр СО РАН
Новосибирск, Россия
* E-mail: nprotasenko@iomc.ras.ru
Поступила в редакцию 19.04.2022
После доработки 13.05.2022
Принята к публикации 17.05.2022
- EDN: BTSZLD
- DOI: 10.31857/S0132344X22600138
Аннотация
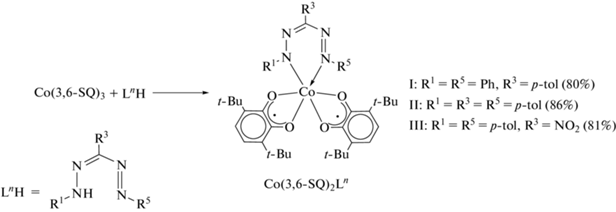
Синтезированы и охарактеризованы новые гетеролигандные бис-3,6-ди-трет-бутил-о-бензосемихиноновые комплексы кобальта(III) с п-толилзамещенными формазановыми лигандами Co(3,6-SQ)2Ln (L1H = 1,5-дифенил-3-п-толилформазан (I), L2H = 1,3,5-три-п-толилформазан (II), L3H = 3-нитро-1,5-ди-п-толилформазан (III)). Молекулярное строение соединений I, II и III в кристаллическом виде установлено методом РСА (CCDC № 2161722 (I), 2167094 (II), 2167095 (III)). По данным РСА, магнитных и спектральных измерений установлено, что соединения I–III представляют собой комплексы низкоспинового кобальта(III), связанного с двумя анион-радикальными о-семихиноновыми лигандами и одним анионом формазана. Магнитное поведение комплексов в интервале температур 2–300 К характеризуется наличием внутримолекулярных обменных взаимодействий антиферромагнитного характера между о-семихиноновыми лигандами. Показано, что замена фенильных заместителей на п-толильные в положениях 1,5 диамагнитного формазанатного лиганда приводит к значительному усилению обмена между радикальными центрами.
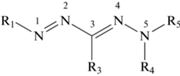
Формазанами называют соединения, содержащие азогидразонную систему связей, общей формулы:
Наиболее изучены 1,3,5-тризамещенные формазаны. Традиционно в химии формазанов заместители при атомах азота N(1) и N(5) принято обозначать как R1 и R5, а при атоме углерода в положении 3 – R3. Соединения класса формазанов благодаря простоте синтеза, наличию подвижной π-системы, конформационной гибкости и интересных окислительно-восстановительных свойств широко используются в качестве лигандов в координационной химии [1, 2]. Металлокомплексы формазанов в настоящее время интенсивно изучаются в связи с возможностью их использования в катализе [3, 4] и дизайне молекулярных магнетиков [5–7]. Кроме того, показано, что формазанатные комплексы на основе дифторида бора (BF2) обладают уникальными оптоэлектронными свойствами и оказались хорошими флуоресцентными агентами для визуализации клеток [8, 9], эммиторами электрохемилюминесценции [10, 11] и строительными блоками для многофункциональных полимеров [12, 13]. Формазановые лиганды также могут использоваться для создания на их основе гетеролигандных металлокомплексов. Координационные соединения такого типа, содержащие в своем составе лиганды различной природы, демонстрируют больше возможностей для управления их окислительно-восстановительными и оптическими свойствами путем варьирования иона металла комплексообразователя, заместителей в формазанатной цепи, а также природы дополнительных лигандов [14–19].
Интересы нашей научной группы лежат в области исследования гетеролигандных комплексов металлов, содержащих в своем составе радикальные редокс-активные лиганды на основе о-хинона и различные N-донорные лиганды [20–22]. Ранее нами были получены и охарактеризованы первые примеры комплексов кобальта, содержащих одновременно два типа редокс-активных лигандов: о-хиноновый и формазанатный [23, 24], а также исследовано влияние электроноакцепторных групп в положении 3 формазанатного лиганда на магнитное и электрохимическое поведение смешанолигандных о-семихинонформазанатных комплексов кобальта [25].
В настоящей работе представлены результаты синтеза, спектральных, магнитных и структурных исследований трех новых бис-о-семихиноновых комплексов кобальта(III) с п-толилзамещенными формазановыми лигандами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использованные в настоящей работе 3,6-ди-трет-бутил-о-бензохинон [26], 1,5-дифенил-3-п-толилформазан [27], 1,3,5-три-п-толилформазан [27], 3-нитро-1,5-ди-п-толилформазан [28] и трис-(3,6-ди-трет-бутил-о-бензосемихинолят)кобальта(III) [29] синтезировали согласно известным методикам. Растворители, необходимые для проведения экспериментов, очищали и обезвоживали согласно стандартным процедурам [30].
ИК-спектры соединений регистрировали на Фурье-ИК-спектрометре ФСН-1201 (диапазон 400–4000 см–1, вазелиновое масло). Элементный анализ (C, H, N) проводили на элементном анализаторе Elementar Vario EL cube. Магнетохимические измерения выполняли в Международном томографическом центре СО РАН на SQUID-магнетометре MPMSXL (Quantum Design) в интервале 2−310 K в магнитном поле 5 кЭ. Парамагнитные составляющие χ определяли с учетом диамагнитного вклада, оцененного из констант Паскаля. Эффективный магнитный момент (μэфф) вычисляли по формуле μэфф = = ${{\left[ {{{3k\chi T} \mathord{\left/ {\vphantom {{3k\chi T} {\left( {{{N}_{{\text{A}}}}\mu _{{\text{B}}}^{2}} \right)}}} \right. \kern-0em} {\left( {{{N}_{{\text{A}}}}\mu _{{\text{B}}}^{2}} \right)}}} \right]}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}},$ где NA, μB и k – число Авогадро, магнетон Бора и постоянная Больцмана соответственно.
Синтез комплекса Co(3,6-SQ)2L1 (I). К раствору 0.070 г (0.1 ммоль) трис-(3,6-ди-трет-бутил-о-бензосемихинолята)кобальта(III) в 10 мл толуола прилили раствор 0.031 г (0.1 ммоль) 1,5-дифенил-3-п-толилформазана в 5 мл толуола. Реакционную смесь перемешивали при комнатной температуре в течение суток. Цвет раствора становился темно-синим. После этого упаривали большую часть растворителя и добавляли 10 мл гексана. Полученный раствор выдерживали в холодильнике при 4°С в течение суток. В результате образуются мелкие темно-синие призматические кристаллы, которые отфильтровывали и сушили в вакууме (выход 80%).
ИК-спектр (ν, см–1): 1659 сл, 1592 сл, 1550 ср, 1515 ср, 1484 с, 1451 с, 1427 с, 1388 ср, 1357 с, 1335 с, 1305 с, 1276 с, 1194 с, 1153 сл, 1110 сл, 1078 сл, 1026 ср, 995 ср, 974 с, 955 с, 910 сл, 894 сл, 829 с, 822 с, 807 сл, 781 ср, 761 с, 692 с, 667 ср, 652 ср, 620 сл, 580 сл, 532 ср, 523 сл, 503 сл, 486 ср, 474 сл.
Синтез комплексов Co(3,6-SQ)2L2 (II) и Co(3,6-SQ)2L3 (III). Комплексы II, III получали по аналогичной методике, описанной для комплекса I.
II: темно-синие призматические кристаллы из гексана (выход 86%).
ИК-спектр (ν, см–1): 1661 сл, 1610 сл, 1599 ср, 1562 сл, 1553 ср, 1503 сл, 1433 с, 1390 с, 1359 ср, 1348 с, 1305 сл, 1287 сл, 1279 ср, 1210 ср, 1200 сл, 1183 сл, 1112 сл, 1029 ср, 978 с, 960 с, 830 с, 782 сл, 762 ср, 689 ср, 649 с, 622 сл, 577 с, 507 ср, 498 с.
III: коричневые призматические кристаллы из пентана (выход 81%).
ИК-спектр (ν, см–1): 1681 с, 1655 с, 1603 сл, 1583 сл, 1547 сл, 1525 ср, 1502 сл, 1481 с, 1427 с, 1413 ср, 1360 с, 1287 с, 1209 сл, 1197 ср, 1168 сл, 1140 сл, 1111 сл, 1024 сл, 1015 сл, 975 ср, 958 ср, 939 с, 923 ср, 898 ср, 869 сл, 841 сл, 824 с, 813 ср, 801 ср, 784 сл, 752 сл, 734 сл, 721 сл, 693 сл, 650 с, 641 ср, 578 сл, 548 сл, 529 сл, 504 сл, 483 ср.
РСА. Данные рентгеновской дифракции монокристалла комплекса I получены на дифрактометре Bruker D8 Venture Photon в режиме φ- и ω-сканирования в Центре коллективного пользования ИОНХ РАН при температуре 100 K (λ(CuKα) = 1.54178 Å, микрофокусный источник рентгеновского излучения Incoatec IµS 3.0). Первичное индицирование, уточнение параметров элементарной ячейки и интегрирование отражений производили с использованием пакета программ Bruker APEX3 [31]. Абсорбционную коррекцию интенсивности отражений производили по программе SADABS [31]. Структуру расшифровывали прямыми методами [32] и уточняли полноматричным методом наименьших квадратов по F 2 [33] в анизотропном приближения для всех неводородных атомов без применения ограничений на тепловые или геометрические параметры модели. Атомы водорода помещали в рассчитанные положения и уточняли в модели “наездника” с Uизо(H) = 1.5Uэкв(C) для атомов водорода метильных групп и Uизо(H) = 1.2Uэкв(C) для остальных атомов водорода. Расчеты выполнены с помощью программного пакета SHELXTL [33] помощью программы визуализации и обработки структурных данных OLEX2 [34].
Рентгенодифракционные данные для соединений II и III собраны на монокристальных дифрактометрах Agilent Xcalibur E и Bruker D8 Quest соответственно (МоKα-излучение, λ = 0.71073 Å, φ- и ω-сканирование). Сбор дифракционных данных, начальное индицирование отражений и уточнение параметров элементарной ячейки производили с использованием пакетов программ CrysAlisPro (для II) [35] и APEX3 (для III) [36]. Экспериментальные наборы интенсивностей интегрированы с помощью программ CrysAlisPro (для II) [35] и SAINT (для III) [37, 38]. Структуры II и III решены прямыми методами по “dual-space” алгоритму в программе SHELXT [32] и уточнены полноматричным методом наименьших квадратов по $F_{{hkl}}^{2}$ в анизотропном приближении для неводородных атомов. Атомы водорода помещены в геометрически рассчитанные положения и уточнены изотропно. Расчеты структур проведены с использованием программного пакета SHELXTL [33, 39]. Учет поглощения произведен в программах SCALE3 ABSPACK [40] и SADABS [41] для II и III соответственно. В молекуле комплекса II п-толильный заместитель при атоме N(1) разупорядочен по двум положениям. В кристалле III обнаружена сольватная молекула н-пентана в общем положении. Соотношение молекул н-пентана и комплекса кобальта составляет 1 : 1.
Кристаллографические данные и параметры уточнения структур I, II и III приведены в табл. 1, значения избранных длин связей – в табл. 2.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур I–III
| Параметр | Значение | ||
|---|---|---|---|
| I | II | III | |
| Брутто-формула | C48H57CoN4O4 | C50H61CoN4O4 | C48H66CoN5O6 |
| М | 812.90 | 840.95 | 867.98 |
| T, К | 100(2) | 298(2) | 100(2) |
| Кристаллическая система | Моноклинная | Триклинная | Моноклинная |
| Пр. группа | P21/c | $P\bar {1}$ | P21/c |
| а, Å | 10.1605(6) | 11.0609(3) | 14.2129(5) |
| b, Å | 38.045(2) | 11.5215(2) | 30.4541(10) |
| c, Å | 11.1911(6) | 19.4051(4) | 11.1943(4) |
| α, град | 90 | 101.827(2) | 90 |
| β, град | 100.840(4) | 103.185(2) | 100.116(1) |
| γ, град | 90 | 94.836(2) | 90 |
| V, Å3 | 4248.8(4) | 2334.25(9) | 4770.0(3) |
| Z | 4 | 2 | 4 |
| ρ(выч.), мг/м3 | 1.271 | 1.196 | 1.209 |
| µ, мм–1 | 3.546 | 0.414 | 0.411 |
| θ, град | 2.32–67.00 | 2.44–25.03 | 2.24–28.00 |
| Число наблюдаемых отражений | 38 299 | 32 772 | 62 753 |
| Число независимых отражений | 7439 | 8244 | 11 482 |
| Rint | 0.1656 | 0.0330 | 0.0433 |
| S(F 2) | 0.986 | 1.004 | 1.072 |
| R1, wR2 (I > 2σ(I)) | 0.0714, 0.1519 | 0.0462, 0.1065 | 0.0518, 0.1244 |
| R1, wR2 (по всем параметрам) | 0.1426, 0.1861 | 0.0755, 0.1222 | 0.0584, 0.1272 |
| Δρmax/Δρmin, e Å–3 | 0.369/–0.691 | 0.341/–0.314 | 1.732/–0.540 |
Таблица 2.
Избранные длины связей (Å) и углы (град) в комплексах I–III
| Связь | I | II | III |
|---|---|---|---|
| d, Å | |||
| Co(1)–O(1) | 1.922(3) | 1.9007(16) | 1.8915(14) |
| Co(1)–O(2) | 1.894(3) | 1.9082(17) | 1.9120(14) |
| Co(1)–O(3) | 1.906(3) | 1.9360(19) | 1.9064(14) |
| Co(1)–O(4) | 1.889(3) | 1.8674(17) | 1.8731(14) |
| Co(1)–N(1) | 1.899(4) | 1.9282(19) | 1.9246(17) |
| Co(1)–N(4) | 1.892(4) | 1.913(2) | 1.9078(17) |
| O(1)–C(1) | 1.298(5) | 1.291(3) | 1.292(2) |
| O(2)–C(2) | 1.312(5) | 1.300(3) | 1.304(2) |
| O(3)–C(15) | 1.304(6) | 1.293(3) | 1.290(2) |
| O(4)–C(16) | 1.303(6) | 1.296(3) | 1.302(2) |
| N(1)–N(2) | 1.296(5) | 1.288(3) | 1.279(2) |
| N(2)–C(35) | 1.348(6) | 1.348(3) | 1.331(3) |
| N(3)–C(35) | 1.355(6) | 1.328(3) | 1.333(3) |
| N(3)–N(4) | 1.284(5) | 1.297(3) | 1.277(2) |
| Угол | I | II | III |
| ω, град | |||
| O(1)–Co(1)–O(2) | 85.07(13) | 84.28(7) | 84.93(6) |
| O(3)–Co(1)–O(4) | 85.27(14) | 84.50(8) | 86.06(6) |
| N(1)–Co(1)–N(4) | 85.77(17) | 86.00(9) | 87.95(7) |
| N(1)–Co(1)–O(1) | 177.82(16) | 178.12(8) | 174.26(7) |
| O(2)–Co(1)–O(4) | 172.32(16) | 170.86(7) | 169.71(6) |
| O(3)–Co(1)–N(4) | 175.92(16) | 171.20(9) | 173.07(7) |
Полный набор рентгеноструктурных параметров депонирован в Кембриджском центре кристаллографических данных (CCDC № 2161722 (I), 2167094 (II), 2167095 (III); https://www.ccdc.cam.ac.uk/structures/).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Обменная реакция между трис-о-семихинолятом металла и нейтральным лигандом является общим методом синтеза гетеролигандных о-семихиноновых комплексов переходных металлов [42, 43]. С использованием данного метода нами были синтезированы новые гетеролигандные шестикоординационные бис-о-семихинонформазанатные комплексы кобальта(III), представленные на схеме 1 . Полученные комплексы I–III в кристаллическом виде устойчивы к действию кислорода и влаги воздуха, легко растворимы в большинстве органических растворителей.
Схема 1 .
ИК-спектры соединений I–III характеризуются набором полос колебаний лигандов, входящих в состав комплексов. Так, ИК-спектр данных соединений содержит интенсивные полосы валентных колебаний полуторных связей С–О о-семихиноновых лигандов (1350–1450 см–1) и полосы средней интенсивности, соответствующие валентным колебания связей С=N и N=N координированных формазанатных лигандов (1610–1540 см–1).
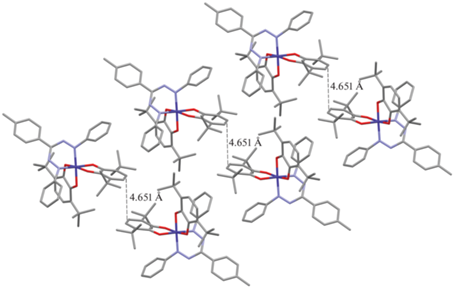
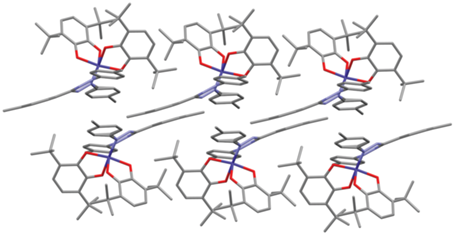
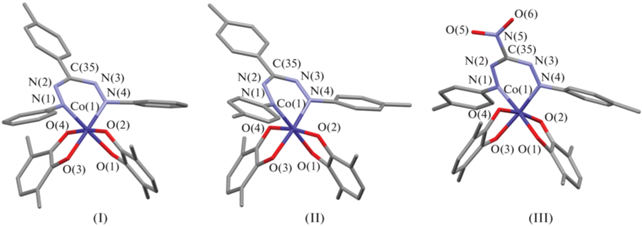
Согласно данным РСА, соединения I и III кристаллизуются в моноклинной пространственной группе P21/c, в отличие от комплекса II, который кристаллизуется в триклинной пространственной группе $P\bar {1}$. В каждой молекуле центральный атом кобальта находится в октаэдрическом окружении (рис. 1). Значения длин связей Co–O (1.8674(17)–1.9360(19) Å) и Co–N (1.892(4)–1.9282(19) Å) лежат в интервале, характерном для шестикоординационных комплексов низкоспинового кобальта(III) [44, 45]. Длины связей С–О и С–С внутри О,О'-хелатирующих хиноновых лигандов типичны для анион-радикальной о‑бензосемихиноновой формы [46, 47]. Распределение длин связей внутри формазанатного фрагмента N(1)N(2)C(35)N(3)N(4) свидетельствует об анионной форме лиганда [48, 49]. Сам формазанатный хелатный металлоцикл неплоский и изогнут по линии N(1)…N(4), кроме того наблюдается отклонении мезо-атома углерода С(35) от плоскости N(1)N(2)N(3)N(4). Следует отметить, что для соединения II с наиболее объемными заместителями в формазанатном лиганде наблюдаются самый большой угол изгиба металлоцикла (38.13°) и самое большое отклонение атома углерода С(35)–0.158 Å. Для соединения I указанные параметры составляют 34.95° и 0.154 Å, а для соединения III 33.08° и 0.140 Å соответственно. В комплексе I фенильные заместители при атомах азота N(1) и N(4) формазанового лиганда повернуты относительно плоскости азогидразонной цепи на угол ~50°. Для соединений II и III наблюдаeтся асимметрия в расположении указанных заместителей: 37° и 27° в II, и 35° и 43° в III. Такое различие, вероятно, связано с различиями в кристаллической упаковке комплексов. В кристаллах комплекса I наблюдается аналогичный мотив упаковки, описанный ранее для бис-о-семихинолятов кобальта(III) с 1-арил-3,5-дифенилформазановыми лигандами [24]: молекулы комплексов упакованы в скошенные стопки таким образом, что парамагнитные о-семихиноновые лиганды из соседних стопок обращены друг к другу и располагаются параллельно (рис. 2). Расстояние между о-семихиноновыми лигандами соседних молекул для комплекса I составляет 4.651 Å. Для соединений II и III наблюдается отличный от описанного способ упаковки: параллельно расположенные стопки молекул комплексов в данном случае обращены друг к другу формазанатными фрагментами, что приводит к взаимному отталкиванию заместителей при атомах N(1) и N(4) между соседними молекулами и, как следствие, к асимметрии в расположении указанных заместителей (рис. 3, 4). Расстояние между плоскостями N(1)N(2)N(3)N(4) соседних формазанатных фрагментов составляет 4.856 и 4.595 Å для соединений II и III соответственно. В кристалле III обнаружены межмолекулярные контакты нитрогрупп с атомами водорода п-толил (п-Tol) и трет-бутил (t-Bu) заместителей (рис. 4). Длины O…H(п-Tol) и N…H(t-Bu) контактов составляют 2.456 и 2.666 Å, что соответствуют обычным ван-дер-ваальсовым взаимодействиям O…H и N…H (2.45 и 2.64 Å соответственно [50]). Межмолекулярные укороченные ван-дер-ваальсовые контакты С…H и H…H (<2.82 и 2.31 Å [50]) обнаружены между t-Bu-заместителями в стопках молекул комплекса III вдоль оси с. Длины контактов С…H и H…H равны 2.732 и 2.192 Å соответственно.
Рис. 1.
Молекулярное строение комплексов I, II и III по данным РСА. Метилы трет-бутильных групп и атомы водорода не показаны.
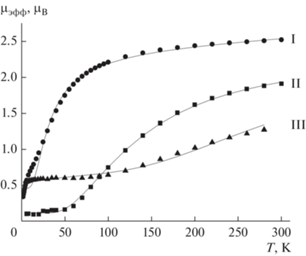
Были исследованы магнитные свойства комплексов I–III в интервале температур 2–300 К. Температурные зависимости μэфф для данных комплексов представлены на рис. 5. Магнитное поведение комплекса I незначительно отличается от магнитного поведения аналогичного бис-о-семихинонового комплекса кобальта(III) с незамещенным 1,3,5-трифенилформазановым лигандом [23]. Высокотемпературное значение μэфф для соединения I составляет 2.52 μВ, что близко к чисто спиновому значению 2.45 μВ, рассчитанному для системы из двух радикальных центров с S = 1/2 для каждого центра. Такое состояние системы соответствует комплексу Co(III), связанного с двумя анион-радикальными о-семихиноновыми лигандами и одним формазанат-анионом. С понижением температуры значение магнитного момента сначала плавно убывает в интервале 300–100 К и затем более резко снижается до 0.34 μB при 2 К, что указывает на антиферромагнитный характер обмена между радикальными центрами. Высокотемпературное значение μэфф для комплексов II, III (1.93 и 1.33 μВ соответственно) заметно ниже ожидаемого для спиновой системы из двух радикальных центров с S = 1/2. С понижением температуры значение μэфф для данных комплексов плавно убывает, достигая при 5 К 0.11 μВ и 0.45 μВ для II и III соответственно. Нами был проведен анализ экспериментальных зависимостей μэфф(T) с использованием модели обменно-связанного димера (H = –2JS1S2). Оптимальные значения параметра обменного взаимодействия J и g-фактора представлены в табл. 3. Для наглядности в таблицу добавлены аналогичные параметры для описанных ранее бис-о-семихинолятных комплексов кобальта(III) с фенильными заместителями в первом и пятом положениях формазанатного лиганда. Из табл. 3 видно, что замена фенильных заместителей на п-толильные в первом и пятом положениях формазанатного лиганда в ряду комплексов общего вида Co(3,6-SQ)2Ln приводит к значительному усилению обмена между радикальными центрами, тип обмена при этом не меняется – он остается антиферромагнитным. Максимальное значение параметра обмена наблюдается для комплекса III. Мы полагаем, что наблюдаемое усиление обмена между радикальными центрами связано с тем, что при замене фенильных заместителей в положениях 1, 5 формазанатного лиганда на п-толильные в кристаллической структуре комплексов Co(3,6-SQ)2Ln происходит уменьшение угла между о-семихиноновыми лигандами. Так, в комплексе с 1,3,5-трифенилформазаном данный угол составляет 75.94° [23], в соединении I с 1,5-дифенил-3-п-толил-формазаном – 76.16° и в соединениях II и III с 1,5-ди-п-толилзамещенными формазанами – 66.87° и 68.11° соответственно. В случае комплекса III на величину обмена, по-видимому, одновременно влияют два фактора: уменьшение угла между анион-радикальными лигандами и наличие в третьем положении формазанатного лиганда электроноакцепторной нитрогруппы.
Рис. 5.
Температурные зависимости эффективных магнитных моментов комплексов I (⚫), II (◼), III (▲) (сплошные линии – теоретические кривые).
Таким образом, проведенное исследование показало, что введение п-толильного заместителя в третье положение формазанатного лиганда не оказывает существенного влияния на магнитное поведение гетеролигандных о-семихинонформазанатных комплексов кобальта(III). Тогда как введение п-толильных заместителей в первое и пятое положения формазанатного лиганда приводит к изменению геометрии комплекса и значительному усилению обмена между радикальными о-семихиноновыми лигандами.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Lipunova G.N., Fedorchenko T.G., Chupakhin O.N. // Russ. J. Gen. Chem. 2019. V. 89. № 6. P. 1225.
Gilroy J.B., Otten E. // Chem. Soc. Rev. 2020. V. 49. P. 85.
Kamphuis A.J., Milocco F., Koiter L. et al. // ChemSusChem. 2019. V. 12. P. 3635.
Broere D.L.J., Mercado B.Q., Holland P.L. // Angew. Chem. 2018. V. 130. P. 6617.
Travieso-Puente R., Broekman J.O.P., Chang M.-C. et al. // J. Am. Chem. Soc. 2016. V. 138. P. 5503.
Milocco F., de Vriers F., Bartels I.M.A. et al. // J. Am. Chem. Soc. 2020. V. 142. P. 20170.
Milocco F., de Vriers F., Siebe H.S. et al. // Inorg. Chem. 2021. V. 60. P. 2045.
Maar R.R., Barbon S.M., Sharma N. et al. // Chem. Eur. J. 2015. V. 21. P. 15589.
Barbon S.M., Novoa S., Bender D. et al. // Org. Chem. Front. 2017. V. 4. P. 178.
Hesari M., Barbon S.M., Staroverov V.N. et al. // ChemComm. 2015. V. 51. P. 3766.
Hesari M., Barbon S.M., Mendes R.B. et al. // J. Phys. Chem. C. 2018. V. 122. P. 1258.
Novoa S., Gilroy J.B. // Polym. Chem. 2017. V. 8. P. 5388.
Dhindsa J.S., Maar R.R., Barbon S.M. et al. // ChemComm. 2018. V. 54. P. 6899.
Mandal A., Schwederski B., Fiedler J. et al. // Inorg. Chem. 2015. V. 54. P. 8126.
Milocco F., Demeshko S., Meyer F. et al. // Dalton Trans. 2018. V. 47. P. 8817.
Broere D.L.J., Mercado B.Q., Lukens J.T. et al. // Chem. Eur. J. 2018. V. 24. P. 9417.
Broere D.L.J., Mercado B.Q., Bill E. et al. // Inorg. Chem. 2018. V. 57. P. 9580.
Kabir E., Patel D., Clark K. et al. // Inorg. Chem. 2018. V. 57. P. 10906.
Mu G., Jiang C., Teets T. S. // Chem. Eur. J. 2020. V. 26. P. 11877.
Protasenko N.A., Poddel’sky A.I. // Theor. Exp. Chem. 2020. V. 56. P. 338.
Bellan E.V., Poddel’sky A.I., Protasenko N.A. et al. // Inorg. Chem. Commun. 2014. V. 50. P. 1.
Protasenko N.A., Poddel’sky A.I., Bogomyakov A.S. et al. // Polyhedron. 2013. V. 49. P. 239.
Protasenko N.A., Poddel’sky A.I., Bogomyakov A.S. et al. // Inorg. Chem. 2015. V. 54. P. 6078.
Протасенко Н.А., Поддельский А.И., Румянцев Р.В. и др. // Коорд. химия. 2021. Т. 47. № 10. С. 620 (Protasenko N.A., Poddelskii A.I., Rumyantsev R.V. et al. // Russ. J. Coord. Chem. 2021. V. 47. P. 687). https://doi.org/10.1134/S1070328421100067
Protasenko N.A., Arsenyev M.B., Baranov E.V. et al. // Eur. J. Inorg. Chem. 2022. https://doi.org/10.1002/ejic.202200152
Белостоцкая И.С., Комиссарова Н.Л., Джуарян З.В. и др. // Изв. АН СССР Сер. хим. 1972. № 7. С. 1594.
Ashley J.N., Davis B.M., Nineham A.W. et al. // J. Chem. Soc. 1953. P. 3881.
von Eschwege K.G. // J. Photochem. Photobiol. A. 2013. V. 252. P. 159.
Lange C.W., Couklin B.J., Pierpont C.G. // Inorg. Chem. 1994. V. 33. P. 1276.
Гордон А., Форд Р. Спутник химика. М.: Мир, 1976. 543 с. (Gordon A.J., Ford R.A. The Chemist’s Companion. N.Y.: Wiley Intersci. Publ., 1972. 537 p.).
APEX3. SAINT and SADABS. Madison (WI, USA): Bruker AXS Inc., 2016.
Sheldrick G.M. // Acta Crystallogr. A. 2015. V. 71. P. 3.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. A-ppl. Cryst. 2009. V. 42. P. 339.
CrysAlisPro 1.171.38.46. Data Collection, Reduction and Correction Program. Software Package, Rigaku OD, 2015.
APEX3. Version 2018.7-2. Bruker Molecular Analysis Research Tool. Madison (WI, USA): Bruker AXS Inc., 2018.
SAINT. Version 8.38A. Data Reduction and Correction Program. Madison (WI, USA): Bruker AXS Inc., 2017.
Krause L., Herbst-Irmer R., Sheldrick G.M., Stalke D. // J. Appl. Cryst. 2015. V. 48. P. 3.
Sheldrick G.M. SHELXTL. Version 6.14. Structure Determination Software Suite. Madison (WI, USA): Bruker AXS, 2003.
SCALE3 ABSPACK: Empirical absorption correction. CrysAlisPro 1.171.38.46. Software Package, Rigaku OD, 2015.
Sheldrick G.M. SADABS. Version 2016/2. Bruker/Siemens Area Detector Absorption Correction Program. Madison (WI, USA): Bruker AXS Inc., 2016.
Pierpont C.G., Buchanan M.N. // Coord. Chem. Rev. 1981. V. 38. P. 45.
Abakumov G.A., Lobanov A.V., Cherkasov V.K. et al. // Inorg. Chim. Acta. 1981. V. 49. P. 135.
Lange C.W., Couklin B.J., Pierpont C.G. // Inorg. Chem. 1994. V. 33. P. 1276.
Dai J., Kanegawa S., Li Z. et al. // Eur. J. Inorg. Chem. 2013. P. 4150.
Brown S.N. // Inorg. Chem. 2012. V. 51. № 3. P. 1251.
Pavlova N.A., Poddel’sky A.I., Bogomyakov A.S. et al. // Inorg. Chem. Commun. 2011. V. 14. № 10. P. 1661.
Gilroy J.B., Ferguson M.J., McDonald R. et al. // Chem. Commun. 2007. P. 126.
Chang M.-Ch., Dann T., Day D.P. et al. // Angew. Chem. Int. Ed. 2014. V. 53. P. 4118.
Зефиров Ю. В., Зоркий П.М. // Успехи химии. 1995. Т. 64. № 5. С. 446.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия