Координационная химия, 2022, T. 48, № 2, стр. 93-97
Термодинамические характеристики перфторбензоатов серебра C6F5COOAg · 0.5 C6F5COOН и C6F5COOAg
И. П. Малкерова 1, Д. Б. Каюмова 1, Е. В. Белова 1, М. А. Шмелев 1, А. А. Сидоров 1, *, И. Л. Еременко 1, 2, А. С. Алиханян 1
1 Институт общей и неорганической химии им. Н.С. Курнакoва РАН
Москва, Россия
2 Институт элементорганических соединений им. А.Н. Несмеянова PAH
Москва, Россия
* E-mail: sidorov@igic.ras.ru
Поступила в редакцию 13.07.2021
После доработки 22.07.2021
Принята к публикации 23.07.2021
- EDN: FMZFQG
- DOI: 10.31857/S0132344X22020050
Аннотация
Методами термогравиметрии, дифференциальной сканирующей калориметрии и масс-спектрометрии исследованы термодинамические характеристики перфторбензоатов серебра C6F5COOAg · · 0.5C6F5COOН и C6F5COOAg. Установлено, что процесс парообразования этих соединений протекает инконгруэнтно с образованием металлического серебра и молекул C6F5COOН, C12F10, СО2 и C18F14. По 2-му и 3-му законам термодинамики найдена стандартная энтальпия образования перфторбензоата серебра ${{\Delta }_{f}}H_{{{\text{298}}}}^{^\circ }$(C6F5СООAg, к) = –1195.6 ± 15.7 кДж/моль и оценена энтальпия образования радикала пентафторбензойной кислоты ${{\Delta }_{f}}H_{{{\text{298}}.{\text{15}}}}^{^\circ }$(C6F5СОО•, к) = –878.6 ± 25.0 кДж/моль.
Термодинамические характеристики веществ (энтальпии, энергии Гиббса образования, энтальпии сублимации, величины парциальных давлений и др.) необходимы для разработки методов синтеза, эксплуатации функциональных материалов и моделирования различных химико-технологических процессов. Например, при получении тонких металлических, оксидных, карбидных пленок, покрытий, нанокристаллического материала с уникальными оптическими, электрическими, механическим свойствами часто применяют химические гетерофазные процессы [1, 2], которые требуют знаний термодинамических характеристик используемых прекурсоров и получаемого материала. В качестве основных реактивов в этих методиках часто используются координационные соединения металлов с органическими лигандами [3–6], термодинамические характеристики которых, к сожалению, мало изучены. Главным образом это связано с экспериментальными проблемами, возникающими при исследовании этих веществ. Ранее нами была предложена методика определения основной энергетической характеристики вещества – стандартной энтальпии образования триметилацетатов металлов (пивалатов металлов), основанная на измерении методом ДСК энтальпии гетерофазной реакции металла с пивалатом серебра [7, 8]:
(1)
$n{\text{AgPiv}}\left( {\text{к}} \right) + {\text{М}}\left( {\text{к}} \right) = {\text{МPi}}{{{\text{v}}}_{n}}\left( {\text{к}} \right) + n{\text{Ag}}\left( {\text{к}} \right).$Этот метод характеризуется относительно малой энергией связи Ag–Piv [8, 9].
Вместо пивалатного комплекса в данной методике могут быть использованы и иные карбоновые соли серебра с термически устойчивым кислотным остатком и невысокой энергией связи металл–лиганд. Поиск подобных соединений весьма заманчив, так как значительно расширяет возможность использования этой методики.
Настоящая работа посвящена исследованию термодинамических характеристик пентафторбензоата серебра C6F5COOAg (AgPfb) эффузионным методом Кнудсена с масс-спектральным анализом газовой фазы. Кроме масс-спектрального подхода термическое поведение AgPfb было исследовано методами термогравиметрии (ТГ) и дифференциальной сканирующей калориметрии (ДСК).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали следующие реактивы: EtOH (96%), Ag(NO3) (ч.д.а., Реахим), KOH (х.ч., Реахим), C6F5COOH (99%, P&MInvest).
Синтез пентафторбензоата серебра. К раствору 0.050 г (2.358 ммоль) C6F5COOH в 15 мл EtOH добавляли навеску 0.013 г (2.358 ммоль) KOH и перемешивали в течение 15 мин при 75°С. К полученной реакционной смеси добавляли 0.038 г Ag-NO3 и перемешивали при комнатной температуре в течение 10 мин до выпадения белого осадка нитрата калия. Образовавшийся белый осадок отфильтровывали и полученный раствор оставляли медленно упариваться при комнатной температуре без доступа света. Через 5 сут наблюдали образование белого осадка, который отделяли от маточного раствора декантацией, промывали холодным EtOH (Т ≈ 5°C) и сушили на воздухе.
ИК-спектр (ν, см–1): 2637 сл, 1712 сл, 1649 сл, 1550 с, 1525 с, 1489 с, 1415 ср, 1370 с, 1289 ср, 1144 сл, 1106 ср, 990 с, 932 ср, 818 сл, 758 с, 705 сл, 620 сл, 512 сл, 439 сл.
Элементный анализ выполняли на CHNS-анализаторе EuroЕА 3000. ИК-спектр снимали на ИК спектрофотометре с Фурье-преобразованием Spectrum 65 (Perkin Elmer) методом нарушенного полного внутреннего отражения (НПВО) в интервале частот 4000–400 см–1.
Изменение массы исследуемого образца определяли на термовесах TG 209 F1 Iris производства фирмы NETZSCH в температурном диапазоне 35–400°С. Измерения проводили в алундовых тиглях с открытой поверхностью при постоянной скорости нагрева 10 К/мин в атмосфере аргона (поток газа 30 мл/мин) при защитном потоке инертного газа 10 мл/мин. Регистрацию поглощения или выделения тепла, сопровождающая фазовые переходы и процессы деструкции, выполняли на дифференциальном сканирующем калориметре DSC 204 F1 Phoenix производства фирмы NETZSCH в температурном диапазоне 20–300°С при постоянной скорости нагрева 10 К/мин и атмосферном давлении в динамической атмосфере аргона (поток газа 40 мл/мин) при защитном потоке инертного газа 70 мл/мин. Прибор заранее калибровали по температуре и чувствительности в температурном диапазоне от –100 до 500°C по параметрам фазовых переходов высокочистых стандартов Hg, In, Sn, Zn, Bi, Pb, CsCl (производство фирмы NETSZCH) и C6H5COOH (99.99%) при скорости нагрева 10 K/мин согласно стандартам ASTM E967-08 (2014) и ASTM E968-02 (2014) соответственно.
Пробоподготовку проводили следующим образом: порошкообразные образцы массой 1–2 мг, взвешенные с точностью 0.02 мг, помещали в алюминиевые тигли с завальцованной и проколотой крышкой.
Исследование процесса парообразования комплекса выполняли на масс-спектрометре МС 1301, предназначенном для термодинамических исследований, в интервале температур 370–461 К. В работе использовали стандартные молибденовые эффузионные ячейки Кнудсена с отношением площади испарения к площади эффузии ≥600. Температуру измеряли Pt-Pt/Rh-термопарой и поддерживали постоянной с точностью ±2 град.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Интенсивности основных ионов, зарегистрированные в масс-спектре насыщенного пара, при разных ионизирующих напряжениях приведены в табл. 1. Анализ экспериментальных данных, представленных в табл. 1, и известных литературных [10–13] позволяет заключить, что газовая фаза над исследуемым соединением состоит главным образом из молекул пентафторбензойной кислоты (С6F5COOH), перфторбифинила (C12F10), диоксида углерода (CO2) и незначительного количества перфтортрифинила (C18F14).
Таблица 1.
Масс-спектр газовой фазы пентафторбензоата серебра
| Ион | Относительная интенсивность | Т, К | ||
|---|---|---|---|---|
| 70 В | 14 В | 13.5 В | ||
| C6F5COOH+ | 0.95 | Не измеряли | 1.0 | 370 |
| C6F5COO+ | 1.0 | |||
| C6${\text{F}}_{5}^{ + }$ | 0.60 | |||
| C6CO+ | 0.13 | |||
| $*{\text{CO}}_{2}^{ + }$ | ~0.5(40) | (1.5) | ||
| C12${\text{F}}_{{10}}^{ + }$ | 1.0 | 1.0 | 1.0 | 430 |
| C6${\text{F}}_{5}^{ + }$ | 0.65 | 1.0 | ||
| C12${\text{F}}_{9}^{ + }$ | 0.15 | |||
| C12${\text{F}}_{8}^{ + }$ | 0.15 | |||
| C12${\text{F}}_{5}^{ + }$ | 0.14 | |||
| C12${\text{F}}_{4}^{ + }$ | 0.08 | |||
| C6F5COOH+ | 0.015 | |||
| C6${\text{C}}_{2}^{ + }$ | 0.13 | |||
| C18${\text{F}}_{{14}}^{ + }$ | 0.025 | |||
| *С${\text{O}}_{2}^{ + }$ | ~0.3(35) | 0.3(5) | ||
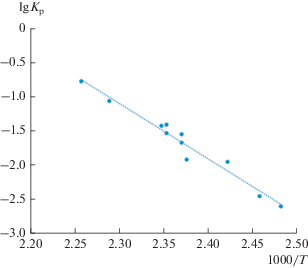
Для установления характера парообразования и расчета величин парциальных давлений был выполнен эксперимент по полному испарению известной навески пентафторбензоата серебра при двух постоянных температурах. Результаты этого опыта приведены на рис. 1.
Рис. 1.
Изотерма парообразования С6F5COOAg · · 0.5С6F5COOН: С6F5COO+ (1); ${{{\text{C}}}_{{{\text{12}}}}}{\text{F}}_{{10}}^{ + }$ (2).

Первоначальные постоянные интенсивности ионных токов ${{I}_{{{{{\text{C}}}_{{\text{6}}}}{{{\text{F}}}_{{\text{5}}}}{\text{COOH}}}}},$ ${{I}_{{{{{\text{C}}}_{{\text{6}}}}{{{\text{F}}}_{{\text{5}}}}{\text{COO}}}}}$ при Т = 375 К до их практически полного исчезновения соответствуют переходу в газовую фазу молекул пентафторбензойной кислоты C6F5COOH. Последующие постоянные интенсивности ионных токов ${{I}_{{{{{\text{C}}}_{{{\text{12}}}}}{{{\text{F}}}_{{{\text{1}}0}}}}}},$ ${{I}_{{{{{\text{C}}}_{{\text{6}}}}{{{\text{F}}}_{{\text{5}}}}}}}$ при Т = 425 К вплоть до полного выгорания навески отражают процесс перехода в газовую фазу молекул C12F10. По завершению эксперимента в эффузионной камере оказался нелетучий остаток, который был идентифицирован как металлическое серебро. Наблюдаемая картина позволяет сделать два важных вывода: исследуемое и синтезированное вещество представляет собой сольват состава С6F5COOAg · nC6F5COOH, парообразование которого протекает в две стадии. Первый этап парообразования при Т = 375 К связан с переходом в газовую фазу молекул пентафторбензойной кислоты и образованием индивидуального соединения пентафторбензоата серебра. На втором этапе при температуре 425 К это соединение термически разлагается с образованием кристаллического серебра и переходом в газовую фазу молекул перфтордифинила C12F10, диоксида углерода СО2. Эксперимент по полной сублимации позволил найти массу серебра в исследуемом сольвате и определить его состав, который оказался равным С6F5COOAg · 0.5C6F5COOH (2 : 1). Таким образом, процесс парообразования этого соединения может быть представлен следующими реакциями:
(2)
$\begin{gathered} {{{\text{С}}}_{{\text{6}}}}{{{\text{F}}}_{{\text{5}}}}{\text{COOAg}} \cdot 0.5{{{\text{C}}}_{{\text{6}}}}{{{\text{F}}}_{{\text{5}}}}{\text{COOH}}\left( {\text{к}} \right) = \\ = {{{\text{С}}}_{{\text{6}}}}{{{\text{F}}}_{{\text{5}}}}{\text{COOAg}}\left( {\text{к}} \right) + 0.5{{{\text{C}}}_{{\text{6}}}}{{{\text{F}}}_{{\text{5}}}}{\text{COOH}}\left( {\text{г}} \right), \\ \end{gathered} $(3)
${{{\text{С}}}_{{\text{6}}}}{{{\text{F}}}_{{\text{5}}}}{\text{COOAg}}\left( {\text{к}} \right) = {\text{Ag}}\left( {\text{к}} \right) + 0.5{{{\text{C}}}_{{{\text{12}}}}}{{{\text{F}}}_{{{\text{10}}}}}\left( {\text{г}} \right) + {\text{С}}{{{\text{О}}}_{2}}.$Похожие результаты получены при термогравиметрическом исследовании комплекса серебра (рис. 2). В температурном диапазоне 35–120°С образец терял 24.3% от исходной массы, в диапазоне 120–240°С 38.6% (рис. 2). Потеря массы на первом этапе связана с удалением 0.5C6F5COOH (расчетная потеря массы 24.9% соответственно). Таким образом, молярная масса исходного соединения 425 ± 4 г/моль, что соответствует его химической формуле С6F5COOAg · 0.5C6F5COOH. Далее соль C6F5COOAg разлагается с образованием в качестве твердого остатка AgF (расчетная масса сухого остатка 29.9%) и продукта поликонденсации (C6F5 –x)n, и удалением CO2 и C12F10.
(4)
$\begin{gathered} {{{\text{С}}}_{{\text{6}}}}{{{\text{F}}}_{{\text{5}}}}{\text{COOAg}}\left( {\text{к}} \right) \to \\ \to {\text{AgF}}\left( {\text{к}} \right) + {{\left( {{{{\text{C}}}_{{\text{6}}}}{{{\text{F}}}_{{5 - x}}}} \right)}_{n}}\left( {\text{к}} \right) + 0.5{{{\text{C}}}_{{{\text{12}}}}}{{{\text{F}}}_{{{\text{10}}}}}\left( {\text{г}} \right) + {\text{С}}{{{\text{О}}}_{2}}. \\ \end{gathered} $Рис. 2.
Результаты ТГ-исследования процесса термолиза сольвата перфторбензоата серебра. Скорость сканирования 10 K мин при атмосферном давлении в динамической атмосфере аргона.

Продукты разложения при атмосферном давлении отличаются от продуктов, получаемых в вакууме в ходе масс-спектрального эксперимента. В этом нет ничего удивительного, так как масс-спектральные исследования в отличие от ДСК- и ТГ-исследований, протекают в равновесных условиях.
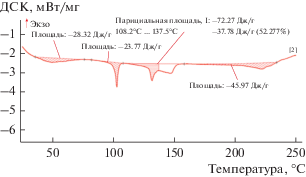
На кривой ДСК (рис. 3) в температурном диапазоне 20–65°С можно наблюдать эндотермический эффект, связанный с удалением сорбированной C6F5COOH или воды, после чего происходит инконгруэнтное плавление C6F5COOAg ∙ ∙ 0.5C6F5COOH (теплота плавления 11 ± 2 кДж/моль, температура плавления 102 ± 1°С) и запаздывающее (относительно открытой поверхности в измерении на термовесах) испарение C6F5COOH через небольшое отверстие в крышке. Этот процесс перекрывается с инконгруэнтным плавлением AgC6F5COO при 130°С, и можно утверждать, что теплоты, поглощающиеся в ходе этих процессов, достаточно близки по величине (на каждый из процессов приходится около 15 ± 3 кДж/моль). Выше 150°C при разложении C6F5COOAg поглощается около 20 ± 4 кДж/моль.
Рис. 3.
Результаты ДСК-исследования процесса термолиза сольвата перфторбензоата серебра. Скорость сканирования 10 K мин при атмосферном давлении в динамической атмосфере аргона.
Для расчета абсолютных величин парциальных давлений компонентов газовой фазы в процессе парообразования сольвата пентафторбензоата серебра на каждой стадии в ходе масс-спектрального эксперимента была выполнена калибровка эффузионной камеры по термодинамическим характеристикам пивалата лития [14] (табл. 2).
Таблица 2.
Значения парциальных давлений (Па) компонентов насыщенного пара С6F5COOAg · 0.5C6F5COOH
| Конденсированная фаза | Условие сублимации |
${{P}_{{{{{\text{C}}}_{{\text{6}}}}{{{\text{F}}}_{{\text{5}}}}{\text{COOH}}}}}$ | ${{P}_{{{{{\text{C}}}_{{{\text{12}}}}}{{{\text{F}}}_{{{\text{10}}}}}}}}$ | ${{P}_{{{\text{C}}{{{\text{O}}}_{2}}}}}$ | Т, К |
|---|---|---|---|---|---|
| Па | |||||
| С6F5COOAg · 0.5C6F5COOH | Кнудсен | 8.8 × 10–4 | 378 | ||
| С6F5COOAg | Кнудсен. | 9.4 × 10–2 | 6.8 × 10–2 | 425 | |
| Замкнутый объем | 9.5 × 10–2 | 4.8 × 10–2 | |||
Определение энтальпий реакций (2), (3) было выполнено по 2-му закону термодинамики исследованием температурных зависимостей величин, констант равновесий реакций (2), (3) k (2) = = $Р_{{{{{\text{C}}}_{{\text{6}}}}{{{\text{F}}}_{{\text{5}}}}{\text{COOH}}}}^{{0.{\text{5}}}},$ k (3) = ${{Р}_{{{\text{С}}{{{\text{О}}}_{{\text{2}}}}}}}$$Р_{{{{{\text{C}}}_{{{\text{12}}}}}{{{\text{F}}}_{{{\text{1}}0}}}}}^{{0.{\text{5}}}}$ (рис. 4). Причем в силу постоянного соотношения ${{{{Р}_{{{\text{С}}{{{\text{О}}}_{{\text{2}}}}}}}} \mathord{\left/ {\vphantom {{{{Р}_{{{\text{С}}{{{\text{О}}}_{{\text{2}}}}}}}} {{{Р}_{{{{{\text{C}}}_{{{\text{12}}}}}{{{\text{F}}}_{{{\text{1}}0}}}}}}}}} \right. \kern-0em} {{{Р}_{{{{{\text{C}}}_{{{\text{12}}}}}{{{\text{F}}}_{{{\text{1}}0}}}}}}}}$ = 2 исследовалась температурная зависимость выражения k (3) = $Р_{{{{{\text{C}}}_{{{\text{12}}}}}{{{\text{F}}}_{{{\text{1}}0}}}}}^{{{\text{1}}.{\text{5}}}}.$ Расчет стандартных энтальпий реакций (2) и (3) выполняли по уравнению изобары химической реакции методом наименьших квадратов в интервалах температур 375–405 и 410–445 К соответственно. Средние значения стандартных энтальпий реакций (2), (3), полученные из трех независимых экспериментов оказались равны ${{\Delta }_{r}}H_{Т}^{^\circ }$(2) = 82.6 ± 12.6 кДж/моль, ${{\Delta }_{r}}H_{Т}^{^\circ }$(3) = 154.2 ± 19.6 кДж/моль. Энтальпия реакции (3) была также рассчитана по 3-му закону термодинамики. В расчете были использованы абсолютные величины парциальных давлений молекул СО2 и C12F10 при Т = 425 К (табл. 2) и значение изменения энтропии реакции (3) равное $\Delta S_{Т}^{^\circ }$ = 244.4 Дж/(моль К) величине изменения энтропии реакции разложения нитрата серебра при Т = 298 К [15]. Рассчитанная таким образом стандартная энтальпия реакции (3) равна ${{\Delta }_{r}}H_{Т}^{^\circ }$(3) = = 180.1 ± 12.3 кДж/моль. Анализ результатов, полученных по 2-му и 3-му законам термодинамики, позволяет рекомендовать величину ${{\Delta }_{r}}H_{Т}^{^\circ }$(3) = = 167.2 ± 23.1 кДж/моль, а учитывая низкие температуры исследования, принять Т = 298.15 К. По найденной таким образом энтальпии реакции (3), стандартным энтальпиям образования диоксида углерода ${{\Delta }_{f}}H_{{298}}^{^\circ }$(CO2, г) = –393.5 ± 0.04 кДж/моль [15] и перфтордифинила ${{\Delta }_{f}}H_{{298}}^{^\circ }$(C12F10, г) = = ‒1264.2 ± 5.2 кДж/моль [16] по закону Гесса нашли стандартную энтальпию образования кристаллического пентафторбензоата серебра ${{\Delta }_{f}}H_{{298}}^{^\circ }$ (C6F5СООAg, к) = –1192.8 ± 23.6 кДж/моль. Значение этой величины и анализ известных литературных данных по энтальпиям образования радикалов ряда карбоновых кислот позволил оценить стандартную энтальпию образования радикала пентафторбензойной кислоты ${{\Delta }_{f}}H_{{298.15}}^{^\circ }$(C6F5СОО•, к) = –878.6 ± 25.0 кДж/моль и энтальпию гетерофазной реакции ${{\Delta }_{r}}H_{{298.15}}^{^\circ }$ (4) = 314 ± 34.4 кДж/моль
(5)
${{{\text{C}}}_{{\text{6}}}}{{{\text{F}}}_{{\text{5}}}}{\text{СООAg}}\left( {\text{к}} \right) = {{{\text{C}}}_{{\text{6}}}}{{{\text{F}}}_{{\text{5}}}}{\text{СО}}{{{\text{О}}}^{\centerdot }}\left( {\text{г}} \right) + {\text{Ag}}\left( {\text{к}} \right).$Высокое значение энтальпии этой реакции и термическая нестабильность радикала C6F5COO• дает возможность использовать пентафторбензоат серебра в гетерофазных реакциях в качестве карбоксилирующего агента при синтезе солей при относительно низких температурах и с высокой энтальпией связи ${{\Delta }_{r}}H_{{298}}^{^\circ }$(C6F5СОО–М) > 340 кДж/моль.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Pierson H.O. Handbook of Chemical Vapor Deposition (CVD): Principles, Technology and Applications. New Jork: Noyes Publications, 1992. 436 p.
Сыркин В.Г. CVD-метод. Химическое парофазное осаждение. М.: Наука, 2000. 496 с.
Grodzicki A., Lakomska I., Piszcek P. et al. // Coord. Chem. Rev. 2005. V. 249. P. 2232.
Kretzschmar B.S.M., Assim K., Preub A. et al. // RSC Adv. 2018. V. 8. P. 15632.
Mungkalasiri J., Bedel L., Emieux F. et al. // Chem. Vap. Deposition. 2010. V. 16. P. 35.
Puurunen R.L. // J. Appl. Phys. 2005. V. 97. P. 121.
Morozova E.A., Dobrokhotova Zh.V., Alikhanyan A.S. // J. Therm. Anal. Calorim. 2017. V. 130. P. 2211.
Lukyanova V.A., Papina T.S., Didenko K.V., Alikhanyan A.S. // J. Therm. Anal. Calorim. 2008. V. 92. P. 743
Lukyanova V.A., Pimenova S.M., Ilin D.Yu. et al. // J. Chem. Thermodynamics. 2019. V. 131. P. 336–339. https://doi.org/10.1016/j.jct.2018.11.016
Szlyk E., Lakomska I., Grodzicki A. // Thermochim. Acta. 1993. V. 223. P. 207.
Logvinenko V. Polunina O., Michailov Yu et al. // J. Therm. Anal. Calorim. 2007. V. 90. № 3. P. 813.
Бажанова З.Г., Тарасов Ю.И., Ковтун Д.М. и др. // Журн. структур. химии. 2010. Т. 51. № 3. С. 433.
Roberts G. D., Edward W. V. // Org. Mass Spectrom. 1981. V. 16. P. 546.
Каюмова, Д.Б., Малкерова И.П., Кискин М.А., Алиханян А.С. // Журн. неорган. химии. 2021. Т. 66. № 6. С. 767 (Kayumova D.B., Malkerova I.P., Kiskin M.A. et al. // Russ. J. Inorg. Chem. 2021. V. 66. P. 868). https://doi.org/10.1134/S0036023621060127
База данных Термические константы веществ. http://www.chem.msu.ru/cgi-bin/tkv.pl
NIST Chemistry Webbook. http://webbook.nist.gov/ chemistry/
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия