Координационная химия, 2022, T. 48, № 2, стр. 74-82
Карбоксилаты Cu(II) и Co(II), содержащие 1,3,4-оксадиазольный фрагмент: строение и свойства
Л. Д. Попов 1, *, С. А. Бородкин 1, М. А. Кискин 2, А. А. Павлов 3, **, Н. Н. Ефимов 2, Е. А. Уголкова 2, В. В. Минин 2, ***, И. Н. Щербаков 1
1 Южный федеральный университет
Ростов-на-Дону, Россия
2 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
3 Институт элементорганической химии им. А.Н. Несмеянова РАН
Москва, Россия
* E-mail: ldpopov@mail.ru
** E-mail: pavlov@ineos.ac.ru
*** E-mail: minin@igic.ras.ru
Поступила в редакцию 10.02.2021
После доработки 24.05.2021
Принята к публикации 27.05.2021
- EDN: VMYFIV
- DOI: 10.31857/S0132344X22020062
Аннотация
При взаимодействии ацетатов меди(II) и кобальта(II) с 3-[5-п-толил)-1,3,4-оксадиазол-2-ил]акриловой кислотой (HL) синтезированы комплексы состава [Сu2L4(MeOH)2] (I) и [СoL2] (II). Кристаллическая структура комплекса I установлена методом РСА (CIF file CCDC № 2052347). Кристаллы моноклинные, пр. гр. C2/c, a = 26.056(4), b = 19.677(3), c = 13.998(2) Å, β = 91.571(3)°, V = 7175(2) Å3, ρ(выч.) = 1.026 г/см3, Z = 4. В молекуле I пара центросимметричных атомов меди связаны четырьмя мостиковыми карбоксильными группами. Внутримолекулярное расстояние Cu…Cu составляет 2.654(2) Å. Координационный полиэдр CuO5 соответствует искаженной квадратной пирамиде. Изучены магнитные свойства комплексов. Показано, что в I магнитные взаимодействия между ионами меди(II) носят антиферромагнитный характер (2J = –185 см–1). Приложение внешнего магнитного поля в случае II приводит к уменьшению скорости магнитной релаксации; наиболее вероятным путем релаксации намагниченности комплекса II является механизм Рамана и прямой механизм. Комплекс II, в отличие от комплекса меди(II), как в растворе, так и в твердой фазе, вероятно, имеет моноядерное строение.
Одной из важнейших проблем современной координационной химии является исследование реакций комплексообразования переходных металлов с полидентантными органическими лигандами. Сочетание свойств органических и неорганических веществ в координационных соединениях дают возможность получать новые гибридные материалы и выявлять участие комплексов металлов в химико-биологических процессах.
Карбоксилаты металлов занимают важное место в координационной химии благодаря их использованию в различных областях науки и техники [1, 2]. Их строение зависит как от природы металла и карбоновой кислоты, так и от условий синтеза [3, 4]. Особое место занимают непредельные карбоксилаты металлов [5, 6]. Они используются в качестве материалов для создания фотоактивных агентов [7–9], катализаторов [10, 11], молекулярных магнетиков [12, 13], биомиметических моделей различных ферментов. Некоторые моно- и полимерные карбоксилаты являются хорошими прекурсорами для создания нанокомпозитных и гибридных материалов [14–18].
В настоящей работе в качестве лиганда была выбрана 3-(5(п-толил)-1,3,4-оксадиазол-2-ил) акриловая кислота (HL). Хорошо известно, что соединения, содержащие 1,3,4-оксадиазольный фрагмент, обладают ярко выраженной биологической активностью [19, 20], интересными фотохимическими свойствами [21–24]. Ранее нами были синтезированы и изучены комплексы цинка(II) [25, 26] и серебра(I) [27] с 1,3,4-оксадиазолилакриловыми кислотами. В связи с тем что комплексы меди(II) являются хорошими моделями металлопротеинов [28], а комплексы кобальта(II) способны проявлять аномальные магнитные свойства, связанные с замедленной релаксацией магнитной восприимчивости [29, 30], явлением спин-кроссовера [31–33], в настоящей работе исследованы комплексы меди(II) и кобальта(II) c HL – [Сu2L4(MeOH)2] (I) и [СoL2] (II).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали ацетаты меди(II) и кобальта(II), метанол, ДМСО квалификации “х. ч.” фирмы Acros.
Синтез комплексных соединений осуществляли по схеме 1.
Схема 1.
Синтез I. К кипящей суспензии 0.200 г (4.30 ммоля) кислоты HL [34] в 10 мл метанола добавляли раствор 0.086 г (2.15 ммоля) моногидрата ацетата меди(II) в 5 мл метанола. Сразу наблюдалось образование голубого осадка. Полученную суспензию кипятили 5 ч, отфильтровывали, промывали кипящим метанолом и высушивали в вакууме. Выход I 0.098 г (51%). По данным элементного анализа, соединение I отвечает составу CuL2 · CH3OH.
| Найдено, %: | C 55.60; | H 3.80; | N 10.40; | Cu 12.50. |
| Для C25H22N4O7Cu | ||||
| вычислено, %: | C 54.20; | H 4.00; | N 10.11; | Cu 11.47. |
ИК (ν, см–1): 3077 сл, 1617 о.с, 1557 ср, 1532 ср, 1497 с, 1407 о.с, 1234 сл, 1187 сл, 1094 сл, 978 сл, 876 сл, 828 сл, 763 ср, 613 сл, 506 сл, 437 сл.
Монокристалл соединения I · СН3ОН, получали медленным испарением раствора комплекса меди(II) в метаноле.
Синтез II. К кипящей суспензии 0.200 г (4.30 ммоль) кислоты HL в 10 мл метанола добавляли раствор 0.107 г (2.15 ммоль) тетрагидрата ацетата кобальта(II) в 5 мл метанола и 0.048 г (4.30 ммоль) КОН в 5 мл метанола. Сразу наблюдалось образование розового осадка. Полученную суспензию кипятили 5 ч, отфильтровывали, промывали кипящим метанолом, высушивали в вакууме. Выход II 0.120 г (71%). По данным элементного анализа, соединение II отвечает составу CoL2.
| Найдено, %: | C 55.40; | H 3.80; | N 11.30; | Co 11.70. |
| Для C24H18N4O6Co | ||||
| вычислено, %: | С 55.74; | Н 3.48; | N 10.83; | Co 11.39. |
ИК (ν, см–1): 3076 сл, 1614 о.с, 1585 ср, 1567 ср, 1497 о.с, 1397 о.с, 1309 сл, 1262 с, 1176 сл, 1092 сл, 1025 сл, 974 сл, 837 сл, 761 ср, 701 сл, 614 сл, 503 сл, 439 сл.
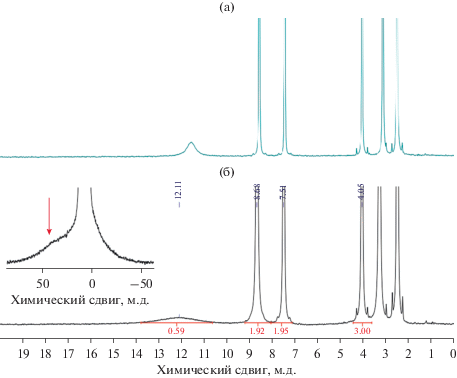
ЯМР 1H (300 МГц; 293 К; ДМСО; δ, м.д.): 4.05 (с., 3H, CH3), 7.51 (с., 2H, CHAr, 8.68 (с., 2H, CHAr, 12.11 (уш.с., CH), 35–45 (уш.с., CH–COO).
РСА монокристалла соединения I · СН3ОН выполнен на дифрактометре Bruker Apex II, оборудованном CCD-детектором (MoKα, λ = 0.71073 Å, графитовый монохроматор) [35], по программе SADABS [36] введена полуэмпирическая поправка на поглощение (Tmin/Tmax = 0.6055/0.7461). Структура расшифрована прямым методом и уточнена полноматричным МНК в анизотропном приближении для всех неводородных атомов. Положение атомов водорода при атомах кислорода и углерода органических лигандов сгенерировано геометрически и уточнено в модели “наездника”. Расчеты проведены по комплексу программ SHELX [37] с использованием OLEX2 [38]. Вследствие разупорядоченности сольватных молекул рентгеноструктурные данные были скорректированы с помощью метода “squeeze” программы PLATON [39]. Относительно низкое качество кристаллов (было изучено несколько кристаллов) обуславливает высокие значения R‑факторов. Кристаллографические параметры и детали уточнения структуры I при T = 100(2) K: C50H44Cu2N8O14, M = 1108.00 г/моль, пр. гр. C2/c, зеленый игольчатый кристалл, 0.30 × 0.05 × × 0.05 мм, a = 26.056(4), b = 19.677(3), c = = 13.998(2) Å, β = = 91.571(3)°, V = 7175(2) Å3, Z = 4, ρ(выч.) = 1.026 г см–3, μ = 0.645 мм–1, 1.30° ≤ θ ≤ ≤ 26.37°, сегмент сферы –32 ≤ h ≤ 32, –24 ≤ k ≤ 24, –17 ≤ l ≤ 17, 27213 измеренных рефлексов, 7341 независимых рефлексов, 4687 отражений с I > > 2.0σ(I), Rint = 0.0893, GООF = 1.231, R1 (I > > 2σ(I)) = 0.1433, wR2 (I > 2σ(I)) = 0.4306, R1 (все данные) = 0.1855, wR2 (все данные) = 0.4609, Δρmin/Δρmax, е Å–3 = –1.866/3.962.
Структурные параметры депонированы в Кембриджском банке структурных данных (CCDC № 2052347; deposit@ccdc.cam.ac.uk или http:// www.ccdc.cam.ac.uk/data_request/cif).
Спектры ЯМР регистрировали на спектрометре Bruker Avance 300 (рабочая частота по ядрам 1Н – 300.13 МГц). Значения химических сдвигов (δ, м.д.) определяли относительно остаточного сигнала растворителя ДМСО (1H – 2.50 м.д.).
Спектры ЭПР регистрировали на ЭПР-спектрометре BRUKER Elexsys E680X в Х-диапазоне (частота ~9.8 ГГц) при комнатной температуре (297 К).
Магнитное поведение комплексов исследовали методами статической и динамической магнитной восприимчивости с использованием автоматизированного комплекса проведения физических измерений PPMS-9 Quantum Design с опцией измерения магнитных свойств. Данное оборудование позволяет производить измерения в диапазоне температур 2–300 К в постоянных магнитных полях напряженностью до 9 Тл. При исследованиях динамической магнитной восприимчивости использовали переменные магнитные поля амплитудой 5, 3 и 1 Э для диапазонов частот 10–100, 100–1000 и 10–10 000 Гц соответственно. Такие условия измерения позволяют избежать нагрева образца при низких температурах (может происходить при больших значениях амплитуды и частоты модуляции) и получить наилучшее соотношение сигнал/шум. Исследования магнитного поведения проводили на поликристаллических образцах, смоченных минеральным маслом (с целью предотвращения ориентации кристаллитов в магнитном поле) и запаянных в полиэтиленовые пакетики [40]. Парамагнитную составляющую магнитной восприимчивости (χ) определяли с учетом диамагнитного вклада самого образца, оцененного из постоянных Паскаля, магнитных вкладов минерального масла и прободержателя.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
При взаимодействии ацетатов кобальта(II) и меди(II) с HL происходит образование комплексных соединений, отвечающих составу ML2. В ИК-спектрах комплексов, по сравнению с ИК-спектром лиганда, происходит исчезновение полосы поглощения валентных колебаний ОН-группы (наблюдается в HL в области 2500–2600 см–1) и значительное уменьшение частоты валентных колебаний группы С=О (на ~100 см–1), свидетельствующее о координации карбонильной группы к иону металла. Строение комплекса I представляет собой классический биядерный тетракарбоксилатно-связанный димер меди(II), в котором центр инверсии расположен между атомами меди (Cu…Cu 2.654(2) Å) (рис. 1). Атомы кислорода карбоксилатных групп (Cu–O 1.948(7)–1.968(7) Å, OCuO 88.8(3)°–90.1(3)°, 167.8(3)°, 168.3(3)°) располагаются в основании квадратной пирамиды CuO5 (τ = 0.008 [41], выход атома Cu(1) из плоскости O4 составляет 0.20 Å). Атом кислорода молекулы метанола располагается в вершине пирамиды (Cu–O 2.134(7) Å). Расстояния Cu…Cu и Cu–O аналогичны наблюдаемым в подобных биядерных комплексах [42, 43]. Карбоксильная группа и оксодиазольный фрагмент в обоих L лежат в одной плоскости (среднее отклонение атомов от плоскости составляет менее 0.088 Å). Угол между вышеуказанной плоскостью и бензольным кольцом составляет 11.7° и 23.4°. В кристалле между оксодиазольным циклом (O(3)C(4)N(1)N(2)C(5)) и фенильным фрагментом соседней молекулы комплекса (C(6)–C(11), 1 – x, 1 – y, 1 – z) наблюдается π–π-стекинг-взаимодействия (расстояние между центроидами – 3.730(6) Å, угол между плоскостями – 6.5(5)°, кратчайшее расстояние между атомами колец – 3.572(4) Å), приводящих к образованию супрамолекулярной трехмерной пористой структуры, полости которой заполнены разупорядоченными сольватными молекулами (рис. 2).
Измерения статической магнитной восприимчивости комплексов проводили в диапазоне температур 2–300 К во внешнем магнитном поле напряженностью 5000 Э (рис. 3). Для комплексов II и I наблюдается принципиально различное поведение.
Рис. 3.
Температурные зависимости χT соединений: II – в пересчете на один атом металла (1) и I – в пересчете на два атома металла (2) в магнитном поле 5000 Э. Линия – теоретическая кривая с параметрами, указанными в тексте.

Значение величины χT для соединения II в пересчете на один атом металла при 300 К составляет 1.40 см3 K/моль, что заметно меньше значения, характерного для невзаимодействующего иона Co2+, находящегося в высокоспиновом состоянии (3d7, 4F9/2, χT = 1.875 см3 K/моль) [44]. При охлаждении соединения II значения χT плавно уменьшаются до 1.19 см3 K/моль при 100 К, а затем наблюдается более резкое уменьшение вплоть до 0.62 см3 K/моль при 2 К. Следует отметить, что для комплексов Co(II), более характерно завышение экспериментальных значений над теоретическими вследствие заметного спин-орбитального взаимодействия. Магнитное поведение комплекса II может указывать на наличие заметных взаимодействий антиферромагнитного типа, сильной магнитной анизотропии или заметной доли ионов кобальта, находящихся в низкоспиновом состоянии.
Для комплекса I значение χT при 300 К составляет 0.57 см3 K/моль в расчете на два атома металла. Указанное значение заметно меньше величины, характерной для двух невзаимодействующих ионов Cu2+ (3d9, 2D5/2, χT = 0.76 см3 K/моль). При понижении температуры χT равномерно уменьшается до 0.08 см3 K/моль при 100 К, а затем наблюдается более плавное уменьшение вплоть до 0.02 см3 K/моль при 2 К. Такая зависимость типична для обменносвязанных биядерных комплексов меди. С целью определения величины параметра обменного взаимодействия, экспериментальную зависимость χT(Т) аппроксимировали уравнением Блини–Бауэрса:
где N – число Авагадро, g – фактор иона меди, μB – магнетон Бора, k – постоянная Больцмана, J – параметр обмена. По данным ЭПР-спектроскопии, при моделировании температурной зависимости статической магнитной восприимчивости, с целью минимизации параметров подгонки и получения более реальных значений других параметров аппроксимации можно использовать в качестве g-фактора значения giso= (gx + gy + gz)/3. В случае комплекса I значение giso= 2.134. С учетом возможного наличия мономерной примеси, в результате наилучшего приближения теоретической кривой к экспериментальным данным величина обменного интеграла оказалась равной 2J = –185 см–1 (R2 = 0.9898). Содержание примеси мономера в исследуемом образце не превышало 5%. Данные статической магнитной восприимчивости однозначно подтверждают биядерное строение комплекса I [45–47].
Известно, что комплексные соединения, содержащие анизотропные ионы, могут проявлять свойства мономолекулярных магнетиков (SMM – от англ. single-molecule magnet), что подразумевает наличие медленной релаксации намагниченности. Среди ионов 3d-металлов наиболее перспективными являются комплексные соединения, содержащие высокоспиновый ион Co2+ [48–52].
С целью определения времен релаксации намагниченности ионов кобальта в комплексе II были проведены измерения динамической магнитной восприимчивости. Даже при температуре 2 К измерения, проведенные в нулевом внешнем магнитном поле, показали отсутствие отличного от нуля сигнала на частотной зависимости мнимой компоненты динамической магнитной восприимчивости χ'' (рис. 4), что указывает на малое время релаксации намагниченности комплекса. Приложение внешнего магнитного поля может существенно увеличить время релаксации намагниченности вследствие уменьшения влияния эффекта квантового туннелирования (КТ). Увеличение времени релаксации может дать возможность наблюдать медленную релаксацию намагниченности в доступном для используемого оборудования диапазоне частот 10–10 000 Гц.
Рис. 4.
Частотные зависимости действительной (χ') (а) и мнимой (χ") (б) компоненты динамической магнитной восприимчивости образца II при различных значениях напряженности магнитного поля. Т = 2 К.
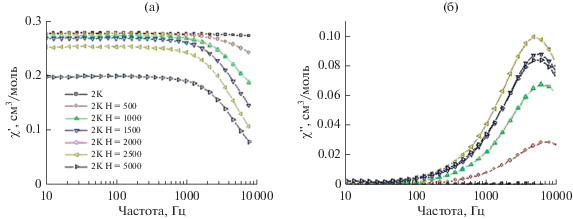
Рис. 5.
Частотные зависимости действительной (χ') (а) и мнимой (χ") (б) компонент динамической магнитной восприимчивости образца II в интервале температур 2–3.5 К (шаг 0.25 К) при напряженности магнитного поля 2500 Э.

В случае комплекса II приложение внешнего магнитного поля приводит к уменьшению скорости магнитной релаксации, что позволяет наблюдать отличные от нулевых значения с максимумом на зависимостях χ'' от частоты осциллирующего магнитного поля. С целью определения температурной зависимости времени релаксации измерения изотерм частотных зависимостей динамической магнитной восприимчивости проводили при оптимальной напряженности магнитного поля – значении, при котором время релаксации намагниченности наибольшее. Наибольшее время релаксации соответствует наименьшему значению частоты осциллирующего магнитного поля, которой соответствует максимум частотной зависимости мнимой компоненты динамической магнитной восприимчивости. В результате измерения динамики магнитного поведения комплекса в магнитных полях различной напряженности оптимальное значение напряженности постоянного магнитного поля для комплекса II оказалось равным 2500 Э (рис. 5). Аппроксимацией экспериментальных данных обобщенной моделью Дебая (линии χ" на рис. 5) определяли времена релаксации при фиксированных значениях температуры.
Экспериментальные значения времени релаксации от обратной температуры, изображенные в полулогарифмической системе координат, не ложатся на одну прямую линию (рис. 6), что указывает на наличие отличных от механизма Орбаха (τ = τ0 exp{ΔE/kBT}, уравнение Аррениуса) путей релаксации намагниченности образца. С целью возможности сравнения результатов настоящего исследования с другими работами, посвященными изучению динамики магнитного поведения комплексов кобальта, проводили аппроксимацию высокотемпературной (2.75–3.5 К) части зависимости τ (1/T) уравнением Аррениуса. Наилучшее приближение теоретической кривой к экспериментальным данным было получено при следующих значениях параметров: τ0 = 4.1 × 10–6 с и ΔE/kB = 5 К.
Рис. 6.
Зависимости времени релаксации от обратной температуры τ(1/Т) комплекса II при оптимальной напряженности магнитного поля 2500 Э. Красная сплошная линия – аппроксимация суммой механизмов релаксации Рамана и КТ; синяя пунктирная линия – аппроксимация суммой механизмов Орбаха и КТ; зеленая пунктирная линия – аппроксимация высокотемпературной части (2.75–3.5 К) уравнением Аррениуса; серая сплошная линия – аппроксимация суммой прямого механизма и механизма релаксации Рамана.

С целью установления наиболее вероятных путей релаксации намагниченности комплекса II, проводили аппроксимацию температурной зависимости времени релаксации во всем диапазоне температур с использованием возможных механизмов релаксации. При анализе экспериментальных данных, кроме механизма релаксации Орбаха, использовали механизмы релаксации Рамана ($\tau _{{{\text{Raman}}}}^{{ - {\text{1}}}}$ = CRamanTn_Raman, где CRaman и nRaman – параметры механизма релаксации Рамана), КТ ($\tau _{{{\text{КТ}}}}^{{--{\text{1}}}}$ = BQT, где BQT – скорость релаксации по механизму КТ) и прямой механизм релаксации ($\tau _{{{\text{direct}}}}^{{ - {\text{1}}}}$ = AdirectH4T, Adirect – параметр прямого механизма релаксации), а также их линейные комбинации. Экспериментальные данные наиболее хорошо описываются зависимостями, определяемыми суммой механизмов релаксации Рамана и КТ с параметрами CRaman = 1756 K–n_Raman с–1, nRaman = 2.6, BQT = 20 585 с–1; Орбаха и КТ с параметрами τ0 = = 1.8 × 10–6 с, ΔE/kB = 9 K, BQT = 25 965 с–1; прямого механизма и механизма релаксации Рамана с параметрами CRaman = 2.5 K–n_Raman с–1, nRaman = 6.7, Adirect = 3.9 × 10–6 K−1 Oe−4 с−1 (рис. 6). Использование других механизмов релаксации и их комбинаций приводит к избыточной параметризации или неудовлетворительному соответствию между теоретической кривой и экспериментальными данными.
Эффект КТ иногда не подавляется даже достаточно сильным магнитным полем. Однако, как указано выше, приложение внешнего магнитного поля заметным образом влияет на скорость релаксации комплекса, уменьшая ее. На основании этого можно утверждать, что механизм КТ не задействован в релаксации намагниченности иона кобальта комплекса II в поле 2500 Э.
Для комплекса II, при учете механизма релаксации Орбаха, величина предэкспоненциального множителя τ0 ≈ 10–6 с. Времена релаксации, характерные для надбарьерного однофононного перемагничивания, соответствующего механизму Орбаха, должны принимать значения ~10–10–10–12 с [53]. Использование суммы прямого механизма и механизма релаксации Рамана дает наиболее убедительное описание экспериментальной зависимости τ (1/T) с точки зрения величин параметров теоретической модели.
На основании вышесказанного, наиболее вероятным путем релаксации намагниченности комплекса II является механизм Рамана и прямой механизм.
Спектроскопия ЭПР позволяет установить наличие неспаренных электронов в координационных соединениях, определить строение координационной сферы иона, содержащего неспаренные электроны. Комплексные соединения, содержащие в своем составе ионы Cu2+, являются прекрасными объектами для исследований методом спектроскопии ЭПР. В частности, с применением метода ЭПР становится возможным однозначно различить моно-/биядерное строение комплексов этого иона [54].
Спектр ЭПР комплекса I (рис. 7) представляет собой суперпозицию сигнала димера меди (спин S = 1) с тонкой структурой и спектра моноядерного комплекса меди(II) (S = 1/2; сигнал в области магнитных полей ~350 мT). Наличие сигнала моноядерного комплекса меди(II) (S = 1/2) хорошо согласуется с исследованиями методом статической магнитной восприимчивости. При теоретическом описании спектра димера меди использовали аксиальный спиновый гамильтониан (СГ) с тонкой структурой:
Рис. 7.
Спектр соединения I при 293 К (порошок). Параметры теоретической модели: S = 1, C = 85.7%, |D| = 0.3512 cm–1, gz = 2.320, gx = 2.042, gy = 2.040; S = 1/2, C = 14.3%, gz = 2.300, gx = 2.055, gy = 2.055.

где S = 1, Sx, Sy, Sz – проекции полного спина на оси x, y, z соответственно; D – компонента тензора тонкого взаимодействия, gx, gy, gz – компоненты g-тензора; H – приложенное магнитное поле.
Компьютерное моделирование спектра ЭПР, описываемого СГ, проводили с использованием метода Белфорда (eigenfield method) [55]. Наилучшее совпадение между экспериментальными данными и теоретической кривой было получено для значений параметров, приведенных в подписи к рис. 7.
Спектр ЭПР комплекса II при комнатной температуре представляет собой широкую неразрешенную линию. Следует отметить, что сигнал ЭПР при комнатной температуре возможно наблюдать только, если ион кобальта Co2+ в соединении находится в низкоспиновом состоянии. Это подтверждается данными статической магнитной восприимчивости о сосуществовании высокоспиновых и низкоспиновых соединений кобальта в исследуемом веществе.
Комплекс кобальта II был протестирован на наличие эффекта спинового кроссовера методом ЯМР. В спектре ЯМР 1Н комплекса II (рис. 8) наблюдается сильное уширение сигналов, нехарактерные для диамагнитных спектров значения 1Н химических сдвигов в несколько десятков м.д., а также изменение этих значений с температурой (как следствие закона Кюри), что красноречиво говорит о парамагнитной природе исследуемого образца. Как правило, скорость ядерной релаксации (и, следовательно, уширение) связано с удалением ядра от парамагнитного центра [56]. В спектре соединения II также прослеживается данная закономерность: сигнал метильной группы наименее уширен (полная ширина на 1/2hmax равна 8.0 Гц), сигналы протонов фенильного фрагмента более уширены (18.5 и 27.1 Гц), а сигналы СН-протонов уширены наибольшим образом (~550 и 4000 Гц), что делает их трудноразличимыми на спектре. Таким образом, количество, интегральные интенсивности и релаксационные характеристики сигналов в спектре ЯМР 1Н II соответствуют составу комплекса, что говорит о его стабильности в растворе ДМСО. Кроме того, уменьшение парамагнитных сдвигов при увеличении температуры свидетельствует об отсутствии спинового перехода в исследуемом температурном диапазоне 293–340 К [57]. Таким образом, для данного соединения явление спин-кроссовера не наблюдается.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Помогайло А.Д., Джардималиева Г.И. Мономерные и полимерные карбоксилаты металлов. М.: Физматлит, 2009. 400 с.
Tokito S., Noda K., Tanaka H. et al. // Synth. Met. 2000. V. 111–112. P. 393.
Mehrotra R.C., Bohra R. Metal Carboxylates. London: Academic Press, 1983. 396 p.
Кискин М.А., Еременко И.Л. // Успехи химии. 2006. Т. 75. С. 627.
Джардималиева Г.И. Помогайло А.Д. // Успехи химии. 2008. Т. 77. С. 270.
Schubert U. // Chem. Mater. 2001. V. 13. P. 3487.
Петухова М.В., Петроченкова Н.В., Мирочник А.Г. и др. // Высокомол. соед. Б. 2000. Т. 44. С. 1267.
Ling Q.D., Cai Q.L., Kang E.T. et al. // J. Mater. Chem. 2004. V. 14. P. 2741.
Ling Q., Yang M., Wu Z. et al. // Polymer. 2001. V. 42. P. 4605.
Metal Complexes and Metals in Macromolecules / Eds. Wohrle D., Pomogailo A.D. Wiley VCH, 2003. P. 667.
Supported Catalysts and Their Applications / Eds. Sherrington D.C., Kubert A.P. Cambridge: Royal Soc. Chem., 2001. P. 250.
Shcherbakov I.N., Ivanova T.M., Kiskin M.A. et al. // Inorg. Chim. Acta. 2014. V. 421. P. 507.
Иванова Т.М., Маслаков К.И., Линко Р.В. и др. // Журн. неорган. химии. 2014. Т. 59. № 7. С. 878 (Ivanova T.M., Maslakov K.I., Linko R.V. et al. // Russ. J. Inorg. Chem. 2014. V. 59. № 7. P. 670). https://doi.org/10.1134/S0036023614070067
Liu G., Yan X. Lu Z. et al. // Chem. Mater. 2005. V. 17. P. 4985.
Hu N.X., Esteghamatian M., Xie S. et al. // Adv. Mater. 1999. V. 11. № 17. P. 1460.
Gao M.Y., Yang Y., Yang B. et al. // Chem. Commun. 1994. P. 2779.
Волков А.В., Москвина М.А., Карачевцев И.В. и др. // Высокомол. соед. А. 1998. Т. 40. С. 45.
Uflyand I.E., Shcherbakov I.N., Popov L. D. et al. // J. Coord. Chem. 2020. V. 73. № 24. P. 3465.
Mazumder S.A., Yar M.S., Mazumder R. et al. // Synth. Commun. Rev. 2017. V. 47. № 20. P. 1805.
Попов Л.Д., Зубенко А.А., Фетисов Л.Н. и др. // Биоорг. химия. 2018. Т. 44. № 2. С. 225.
Feng L., Wang X., Chen Z. // Spectrochim. Acta. A. 2008. V. 71. № 2. P. 312.
Tangb H., Zhanga Zh., Yuana J. et al. // Synthetic Metals. 2009. V. 159. P. 72.
Михайлов И.Е., Попов Л.Д., Викрищук Н.Е. и др. // Журн. общ. химии. 2015. Т. 85. № 1. С. 159.
Михайлов И.Е., Артюшкина Ю.М., Душенко Г.А. и др. // Журн. общ. химии. 2018. Т. 88. № 3. С. 512.
Михайлов И.Е., Попов Л.Д., Душенко Г.А. и др. // Журн. общ. химии. 2018. Т. 88. № 4. С. 700.
Mikhailov I.E., Popov L.D., Tkachev V.V. et al. // J. Mol. Struct. 2018. V. 1157. P. 374.
Кокунов Ю.В., Горбунова Ю.Е., Попов Л.Д. и др. // Коорд. химия. 2016. Т. 42. № 6. С. 323 (Kokunov Yu.V., Gorbunova Yu.E., Popov L.D. et al. // Russ. J. Coord. Chem. 2016. V. 42. № 6. P. 361). https://doi.org/10.1134/S1070328416060038
Ураев А.И. Автореф. дис. … док. хим. наук. Ростов-на-Дону, 2014. 52 с.
Tupolova Y.P., Shcherbakov I.N., Popov L.D. et al. // Dalton. Trans. 2019. V. 48. № 20. P. 6960.
Tupolova Y.P., Shcherbakov I.N., Korchagin D.V. et al. // J. Phys. Chem. C. 2020. V. 124. № 47. P. 25957.
Goodwin H.A. // Top. Curr. Chem. 2004. V. 234. P. 23.
Murray K.S. // Eur. J. Inorg. Chem. 2008. № 20. P. 3101.
Pavlov A.A., Denisov G.L., Kiskin M.A. et al. // Inorg. Chem. 2017. V. 56. P. 14759.
Рожков С.С., Овчинников К.Л., Красковская Г.Г. и др. // Журн. орг. химии. 2015. Т. 51. № 7. С. 1000.
SMART (control) and SAINT (integration) Software. Version 5.0. Madison (WI, USA): Bruker AXS Inc., 1997.
Krause L., Herbst-Irmer R., Sheldrick G.M., Stalke D. // J. Appl. Cryst. 2015. V. 48. P. 3.
Sheldrick G. // Acta Crystalljgr. A. 2007. V. 64. P. 112.
Dolomanov O.V, Bourhis L.J., Gildea R.J. et al. // J. A-ppl. Cryst. 2009. V. 42. P. 339.
Spek A.L. // Acta Crystalljgr. C. 2015. V. 71. P. 9.
Петросянц С.П., Илюхин А.Б., Ефимов Н.Н., Новоторцев В.М. // Коорд. химия. 2018. Т. 44. № 6. С. 383 (Petrosyants S.P., Ilyukhin A.B., Efimov N.N., Novotortsev V.M. // Russ. J. Coord. Chem. 2018. V. 44. № 12. P. 733). https://doi.org/10.1134/S1070328418120060
Addison A.W., Rao T.N., Reedijk J. et al. // Dalton Trans. 1984. № 7. P. 1349.
Фомина И.Г., Доброхотова Ж.В., Александров Г.Г. и др. // Изв. АН. Сер. хим. 2007. С. 1660.
Гоголева Н.В., Александров Г.Г., Павлов А.А. и др. // Коорд. химия. 2018. Т. 44. № 1. С. 3 (Gogoleva N.V., Aleksandrov G.G., Pavlov A.A. et al. // Russ. J. Coord. Chem. 2018. V. 44. № 2. P. 91). https://doi.org/10.1134/S1070328418020057
Ракитин Ю.В., Калинников В.Т. Современная магнетохимия. СПб.: Наука, 1984. 272 с.
Lukov V.V., Tsaturyan A.A., Tupolova Y.P. et al. // J. Mol. Struct. 2020. V. 1199. P. 126952.
Кочнева И.К., Полякова И.Н., Авдеева В.В. и др. // Докл. РАН. 2017. Т. 474. № 5. С. 581.
Gusev A.N., Nemec I., Herchel R. et al. // Dalton Trans. 2019. № 48. P. 3052.
Yambulatov D.S., Nikolaevskii S.A., Kiskin M.A. et al. // Molecules. 2020. V. 25. № 9. P. 2054.
Pavlov A.A., Aleshin D.Y., Savkina S.A. et al. // ChemPhysChem. 2019. V. 20. № 8. P. 1001.
Pavlov A.A., Nelyubina Y.V., Kats S.V. et al. // J. Phys. Chem. Lett. 2016. V. 7. № 20. P. 4111.
Pavlov A.A., Savkina S.A., Belov A.S. et al. // Inorg. Chem. 2017. V. 56. № 12. P. 6943.
Varzatskii O.A., Kats S.V., Pavlov A.A. et al. // Inorg. Chim. Acta. 2018. V. 471. P. 413.
Polyzou C.D., Koumousi E.S., Lada. Z.G. et al. // Dalton Trans. 2017. V. 46. P. 14812.
Ракитин Ю.В., Ларин Г.М., Минин В.В. Интерпретация спектров ЭПР координационных соединений. М.: Наука, 1993. 339 с.
Belford G., Belford R.L., Burkhaven J.F. // J. Magn. Res. 1973. V. 251. № 11. P. 2749.
Solomon I. // Phys. Rev. 1955. V. 99. P. 559.
Pavlov A.A., Denisov G.L., Kiskin, M.A. et al. // Inorg. Chem. 2017. V. 56. № 24. P. 14759.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия