Координационная химия, 2022, T. 48, № 3, стр. 131-149
Координационная химия и магнитные свойства би- и полиядерных обменно-связанных металл-оксиматов Сu(II) и Ni(II)
В. В. Луков 1, *, Ю. П. Туполова 1, И. Н. Щербаков 1, Л. Д. Попов 1, К. Б. Гишко 1, В. А. Четверикова 1
1 Южный федеральный университет
г. Ростов-на-Дону, Россия
* E-mail: vlukov@mail.ru
Поступила в редакцию 26.02.2021
После доработки 08.05.2021
Принята к публикации 01.07.2021
- EDN: HNJJAI
- DOI: 10.31857/S0132344X22020037
Аннотация
В настоящем обзоре предпринята попытка изложить возможности магнетохимического метода при описании строения и свойств би- и полиядерных металлхелатов на основе координационных соединений с ограниченным по типам числом лигандных систем, главным образом оксимсодержащих азометинов и их аналогов. Систематизированы известные литературные данные для би- и полиядерных комплексов меди(II) и никеля(II), парамагнитные центры которых связаны как внутри-, так и межмолекулярным обменным взаимодействием. В рамках ограниченного анализа рассмотрены основные типы и механизмы обменных взаимодействий, выявлены некоторые электронные и геометрические факторы, оказывающие определяющее влияние на магнитные свойства би- и полиядерных комплексов меди(II) и никеля(II) с оксиматными лигандами. Рассмотрена взаимосвязь между особенностями электронного и геометрического строения комплексов и характером обменных эффектов, сделана попытка систематизации магнетоструктурных корреляций в обсуждаемых соединениях, представляющих собой важные модельные объекты при разработке стратегии направленного дизайна одно-, двух- и трехмерных магнитно-упорядоченных структур.
Обменно-связанные комплексы, в которых спин-спиновое взаимодействие между парамагнитными ионами металлов транслируется через мостиковые фрагменты различного состава и структуры, уже не одно десятилетие являются одними из наиболее изучаемых объектов у исследователей, занимающихся направленным поиском новых магнитоактивных материалов, проявляющих также нетривиальные фотохимические и биохимические свойства, в первую очередь, в отношении их определяющей роли в процессе биосинтеза белковых молекул [1–11]. При этом оксимсодержащие лиганды играют одну из главных ролей в этом отношении, начиная с пионерских работ Чугаева, впервые использовавшего диметилглиоксим как аналитический реагент на ионы никеля. Сочетание, с одной стороны, высокой устойчивости оксимов, а с другой – их выраженной реакционной способности, обусловило широкое применение данных соединений в качестве биохимических моделей, объектов металлоорганической химии и химической практики получения материалов с ценными технологическими свойствами [12–22]. Как будет показано ниже, наличие свободной ОН-группы в большинстве оксимсодержащих металлохелатов дает потенциальную возможность самосборки макромолекулярных архитектур, формирование которых может играть определяющую роль в управлении их оптическими, электронными и магнитными свойствами [8, 9, 23, 24]. Кроме этого, координационная химия оксимсодержащих лигандов в последние годы представляется весьма привлекательной областью исследований вследствие способности таких систем стабилизировать определенные степени окисления многих металлов, образовывать селективные реагенты и катализаторы кислородной активации, соединения с интересными оптическими свойствами [25–27]. С медицинской точки зрения известно, что различные оксимсодержащие лиганды и их металлокомплексы показали выраженную биологическую активность как хелатирующие терапевтические препараты, ингибиторы патологического ферментативного катализа, важные промежуточные звенья в биосинтезе оксидов азота [28, 29], антибактериальные и антиопухолевые препараты [30, 31], фунгициды [32], бактерициды [33], антиокислители [34].
В настоящем обзоре основное внимание будет сконцентрировано на анализе публикаций, посвященных исследованию би- и полиядерных комплексов с оксимсодержащими лигандами, причем основной акцент сделан в отношении магнитных свойств комплексов. Обсуждение подробно сконцентрировано на таких системах, в которых либо уже реализованы важные магнетоструктурные корреляции, либо где такая предполагаемая работа будет иметь особую ценность.
ОБМЕННОЕ ВЗАИМОДЕЙСТВИЕ В БИ- И ПОЛИЯДЕРНЫХ КОМПЛЕКСАХ Cu(II) С ОКСИМАТНЫМ МОСТИКОМ
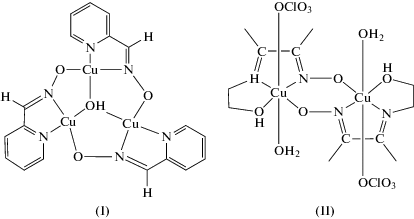
Следует отметить, что оксимсодержащие лиганды, образующие би- и полиядерные металлхелаты меди(II), в большинстве случаев способствуют проявлению выраженного обменного взаимодействия между парамагнитными центрами. При этом для ряда соединений даже при комнатной температуре реализуется полное спиновое спаривание, что впервые было отмечено для трехъядерного комплекса с пиридин-2-альдоксимом состава [Cu3(L)3(OH)SO4] типа I [35].
Первый диамагнитный биядерный комплекс меди(II) типа II состава [Cu2(HL)2(H2O)2(ClO4)2] с обменом через оксиматные мостики был описан в работе [36]. Уникальная особенность NO-группы оксиматных лигандов способствовать существенному антиферромагнитному взаимодействию независимо от того, реализуется ли связывание парамагнитных центров через атомы азота и кислорода или только через атом кислорода, была также продемонстрирована для тетраядерного металлхелата, включающего биядерные фрагменты типа III, для которых величина обменного параметра J = –475 см–1 [37, 38].
Считается, что сила спин-спинового взаимодействия в комплексах металлов зависит от длин связей N–O и C=N оксимного фрагмента лиганда; последнее обстоятельство служит, по мнению авторов, надежным аргументом в пользу того, что π-обменный механизм не является основным в плане трансляции магнитного взаимодействия. Данное положение будет ниже рассмотрено на примере последних результатов исследования оксиматных комплексов меди(II). Кроме того, биядерные оксиматные комплексы меди(II) в соответствии с характером и силой обменных эффектов могут быть разделены на две группы:
a) cистемы с выраженным обменным взаимодействием антиферромагнитного типа, приводящим к диамагнетизму комплексов уже при комнатной температуре вне зависимости от того, является ли обменный фрагмент Cu2(NO)2 планарным;
б) cистемы с очень слабым ферро- или антиферромагнитным обменом, характеризующиеся существенным искажением мостикового оксиматного фрагмента, в этом случае важные магнето-структурные корреляции были выявлены на основании квантово-химических расчетов в рамках расширенного метода Хюккеля [39].
При этом следует также отметить практическую независимость выраженного антиферромагнетизма комплексов от величин углов между плоскостями координационных узлов металлхелатов меди(II), что согласуется, по мнению авторов [40], с доминирующим характером обмена по системе σ-, а не π-связей, поскольку в последнем случае такая зависимость имела бы выраженный характер. Считается, что основным состоянием ионов меди в данном случае является состояние ${{d}_{{{{x}^{2}} - {{y}^{2}}}}};$ данное обстоятельство с учетом σ-характера обмена приводит к эффективному перекрыванию указанных магнитных орбиталей с МО оксиматного мостика (sp2-гибридизация атомов азота и кислорода). Таким образом, с учетом ориентации магнитных орбиталей ионов меди в биядерном комплексе с оксиматным мостиком (схема 1 ), разрешенный по симметрии канал обмена имеет вид ${{d}_{{{{x}^{2}} - {{y}^{2}}}}}$||$\sigma _{{{\text{SP}}}}^{2}$(NO)||${{d}_{{{{x}^{2}} - {{y}^{2}}}}}$ [41].
Схема 1 .
Констатируется, что участие оксиматного мостика в син- или анти-конфигурациях, а также при координации только через атом кислорода всегда должно приводить к выраженному обменному взаимодействию антиферромагнитного типа. Вместе с тем даже при весьма значительных величинах параметров обменного антиферромагнитного взаимодействия небольшие структурные вариации близких по строению и идентичных по каналам трансляции обмена комплексов могут приводить к заметным изменениям этих величин. Примером являются результаты магнетохимического анализа обменно-связанных металлхелатов меди на основе двух лигандных систем – продуктов конденсации моногидразона диацетилмонооксима с 4-метилимидазол-5-карбоксиальдегидом (H2L) или 1-метилимидазол-2-карбоксиальдегидом (H2L') [42]. Строение комплексов [Cu2L2(H2O)2](ClO4)2] (IV), [Cu2${\text{L}}_{2}^{'}$(H2O)2](ClO4)2] (V), [Cu2${\text{L}}_{2}^{'}$(NO3)(H2O)](NO3) · 0.5H2O (VI) приведено на рис. 1.
Рис. 1.
Строение комплексов [Cu2L2(H2O)2](ClO4)2] (IV), [Cu2${\text{L}}_{2}^{'}$(H2O)2](ClO4)2] (V), [Cu2${\text{L}}_{2}^{'}$(NO3)(H2O)](NO3) · · 0.5H2O] (VI).
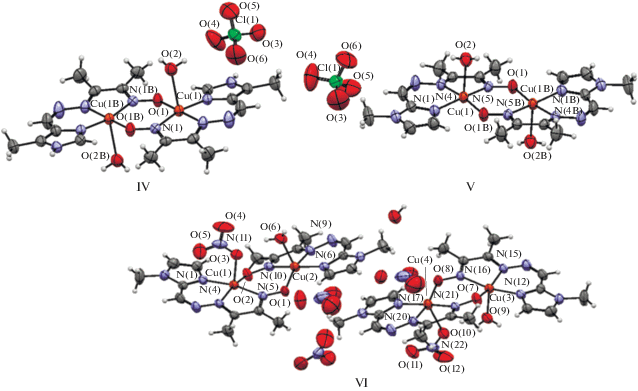
Величины обменных параметров J составляют –718, –795 и –880 см–1 для IV, V и VI соответственно. Как полагают авторы данной работы, антиферромагнитное обменное взаимодействие должно быть несколько более выраженным для IV, нежели для V, однако наличие водородной связи между молекулой H2O и ионом ${\text{ClO}}_{4}^{ - },$ отсутствующее в V, снижает соответствующее значение параметра J, что хорошо согласуется с полученными ранее результатами [43–46] и с данными РСА [47, 48]. Относительно значения J = –880 см–1 авторы [42] отмечают, что оно носит исключительно ориентировочный характер вследствие наличия в данном соединении достаточно большого количества парамагнитной примеси [49].
Как уже отмечалось нами ранее [50], межмолекулярные нековалентные взаимодействия, определяющие молекулярную упаковку функциональных наноразмерных материалов, могут рассматриваться в качестве основной “движущей силы” создания или средства управления магнитным обменным взаимодействием в супрамолекулярных архитектурах. В частности, реализация водородных связей, катион-анионные, π–π- и ван-дер-ваальсовые взаимодействия между отдельными молекулами могут быть направленно использованы для формирования каналов обменного взаимодействия, величина которого может быть предопределена как по знаку, так и по абсолютному значению [51, 52]. В цитируемых ниже работах отмечается, что указанные взаимодействия в ряде случаев могут быть столь же и даже более эффективными в формировании различных типов обмена, как и традиционные ковалентные взаимодействия, определяющие внутримолекулярный характер магнитного взаимодействия. Так, авторы [53–55] отмечают, что удобными лигандами для синтеза супрамолекулярных комплексов являются диоксиматные системы типа VII (Н2L).
С данным лигандом получены комплексы меди(II) состава [${\text{Cu}}_{6}^{{{\text{II}}}}$(µ3-O…H…O-µ3)L3(H2O)6]X3 (X = BF4; X = ClO4) с одинаковым строением гексаядерного узла; структура комплекса VIII (Х = = BF4) приведена на рис. 2.
Рис. 2.
Строение комплекса [${\text{Cu}}_{6}^{{{\text{II}}}}$(µ3-O…H…O-µ3)L3(H2O)6]X3 (X = BF4) (VIII).
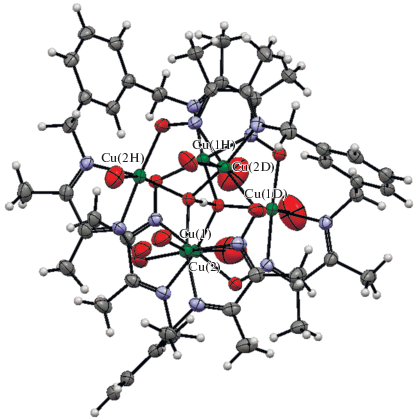
Дважды депротонированный лиганд координирован к ионам Cu(1) и Cu(2) через иминный и оксиматный атомы азота, а атомы кислорода координируют атом меди соседнего фрагмента. Расстояние между ионами Cu(1) и Cu(2) составляет 3.686(1) Å. Кроме того, два µ3-атома кислорода расположены на оси третьего порядка, что приводит к образованию гексаядерного медного кластера, содержащего фрагменты [Cu3O]. Авторы отмечают также наличие выраженной H-связи между указанными фрагментами за счет протона, инкапсулированного внутри гексаядерной структуры (рис. 3).
Магнитные свойства комплекса интерпретированы исходя из предположения о наличии двух обменных каналов в гексаядерном фрагменте:
а) антиферромагнитный обмен между ионами меди(II) в ядре [Cu3O] (обменный параметр J1) через µ3-оксо(гидроксо)-группы (валентный угол CuOCu равен 113.98°) и оксиматный фрагмент Cu–N–O–Cu.
б) антиферромагнитный обмен между фрагментами [Cu3O] (обменный параметр J2) по каналу Cu–O…H…O–Cu.
Спин-гамильтониан такой системы рассчитывался по уравнению (1), строение обменного фрагмента показано на рис. 4.
(1)
$\begin{gathered} \hat {H} = --2{{J}_{1}}\left( {{{S}_{1}}{{S}_{{{\text{1A}}}}} + {{S}_{1}}{{S}_{{{\text{1B}}}}} + {{S}_{{{\text{1A}}}}}{{S}_{{{\text{1B}}}}} + {{S}_{2}}{{S}_{{{\text{2A}}}}} + {{S}_{2}}{{S}_{{{\text{2B}}}}} + {{S}_{{{\text{2A}}}}}{{S}_{{{\text{2B}}}}}} \right)-- \\ - \,\,2{{J}_{2}}\left( {{{S}_{1}}{{S}_{2}} + {{S}_{1}}{{S}_{{{\text{2A}}}}} + {{S}_{1}}{{S}_{{{\text{2B}}}}} + {{S}_{{{\text{1A}}}}}{{S}_{2}} + {{S}_{{{\text{1A}}}}}{{S}_{{{\text{2A}}}}} + {{S}_{{{\text{1A}}}}}{{S}_{{{\text{2B}}}}} + {{S}_{{{\text{1B}}}}}{{S}_{2}} + {{S}_{{{\text{1B}}}}}{{S}_{{{\text{2A}}}}} + {{S}_{{{\text{1B}}}}}{{S}_{{{\text{2B}}}}}} \right). \\ \end{gathered} $Рассчитанные величины обменных параметров составляют J1 = –201.5 см–1, J2 = –4.5 см–1, причем авторы указывают что последнее значение хорошо коррелирует с известными литературными данными по обмену через H-связи [56–59].
Авторы [60] получили трехъядерные комплексы, используя так называемую “лигандную смесь” – взаимодействие карбоксилатов меди(II) с ди-2-пиридилкетон оксимами IX, X:
Строение комплекса состава [${\text{Cu}}_{3}^{{{\text{II}}}}$(µ3-OH)- (O2CMe)2(Py)2(CNO)3] представлено на рис. 5.
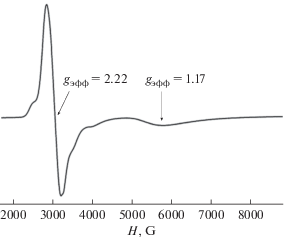
Изучение температурной зависимости магнитной восприимчивости показало наличие выраженного обменного взаимодействия антиферромагнитного типа. К сожалению, авторы данной работы не приводят значение величины обменного параметра J, однако ЭПР-исследование данного соединения дает им основание утверждать, что указанное взаимодействие имеет характер анизотропного антисимметричного обмена.
На рис. 6 представлен ЭПР спектр данного соединения в X-диапазоне, зарегистрированный при 4.2 K. В спектре отмечен высокоинтенсивный сигнал при ~3 кГс с gэфф ≈ 2.2 и плечо в более слабом поле. Наибольший интерес, с точки зрения авторов, представляет широкий сигнал с gэфф ≈ 1.17, происхождение которого не может быть отнесено к ${{g}_{ \bot }}$ основного состояния с S = 1/2 [61].
Напротив, такая особенность спектров ЭПР, как утверждают авторы, отмечена в ряде комплексов меди(II), содержащих трехионное ядро {Cu3(µ3-OH)}5+, и характеризующихся антисимметричным обменом [62, 63].
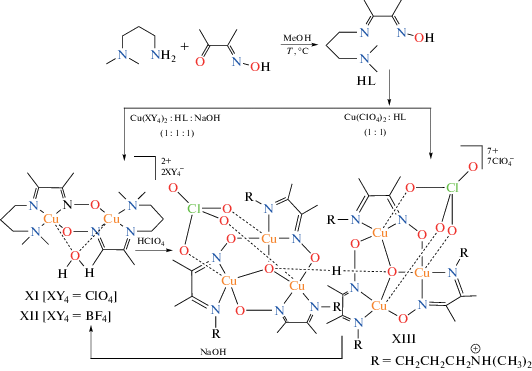
Более детально вопрос о наличии антисимметричного обменного взаимодействия в трехъядерных комплексах меди(II) с оксиматными лигандами рассмотрен в [64]. Авторы данного исследования выделили два биядерных комплекса составов [Cu2L2(H2O)](ClO4)2 (типа XI) и [Cu2L2(H2O)](BF4)2 (типа XII) и гексаядерное производное XIII общей формулой [{Cu3(HL)3(O3ClO)(μ3-O)}2(μ-H)](ClO4)7, содержащее трехъядерные фрагменты состава Cu3O, синтез которых представлен на схемe 2 .
Схема 2 .
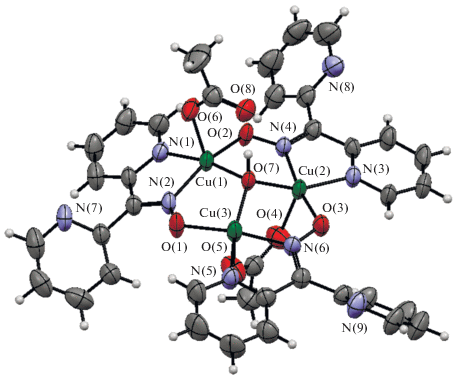
Авторы отмечают, что гексаядерное производное типа XIII получено в таких же синтетических условиях, что и биядерные комплексы XI, XII, но в отсутствии NaOH. Структуры трехъядерного фрагмента и металлохелата XIII представлены на рис. 7, 8.
Биядерные комплексы XI, XII (схема 2 ) характеризуются “обычным” для подобных систем существенным антиферромагнетизмом: J = –562.6 см–1 для XI и J = –633.1 см–1 для XII. Обменное взаимодействие в трехъядерном фрагменте является доминирующим для соединения XIII. При этом, как отмечают авторы цитируемой работы, попытка применения для интерпретации магнитных свойств изотропного гамильтониана (2) не привела к успеху.
(2)
$\hat {H} = - {{J}_{{12}}}{{S}_{1}}{{S}_{2}} - {{J}_{{23}}}{{S}_{2}}{{S}_{3}} - {{J}_{{13}}}{{S}_{1}}{{S}_{3}}.$Авторы отмечают, что с учетом так называемой “спиновой фрустрации” [61, 65–67], адекватная интерпретация магнитных свойств XIII требует учета антисимметричной составляющей обменного взаимодействия, что приводит к гамильтониану (3).
(3)
$\begin{gathered} \hat {H} = - J\left( {{{S}_{1}}{{S}_{2}} + {{S}_{2}}{{S}_{3}}} \right) - j\left( {{{S}_{1}}{{S}_{3}}} \right) + \\ + \,\,{{G}_{Z}}\left[ {\left( {{{S}_{1}}{{S}_{2}}} \right) + \left( {{{S}_{2}}{{S}_{3}}} \right) + \left( {{{S}_{1}}{{S}_{3}}} \right)} \right], \\ \end{gathered} $где J = J1,2 = J2,3, j = J1,3, GZ – параметр антисимметричного обмена.
С учетом гамильтониана (3) в [67] и Jсред = (2J + + j)/3 были получены выражения для анизотропных значений магнитной восприимчивости:
(4)
$\chi _{M}^{\parallel } = \frac{{N{{\beta }^{2}}g_{\parallel }^{2}}}{{4kT}}\left[ {\frac{{{\text{ch}}\left( x \right) + 5{\text{exp}}\left( {{{3{{J}_{{{\text{сред}}}}}} \mathord{\left/ {\vphantom {{3{{J}_{{{\text{сред}}}}}} {2kT}}} \right. \kern-0em} {2kT}}} \right)}}{{{\text{ch}}\left( x \right) + {\text{exp}}\left( {{{3{{J}_{{{\text{сред}}}}}} \mathord{\left/ {\vphantom {{3{{J}_{{{\text{сред}}}}}} {2kT}}} \right. \kern-0em} {2kT}}} \right)}}} \right],$(5)
$\chi _{M}^{ \bot } = \frac{{N{{\beta }^{2}}g_{ \bot }^{2}}}{{4kT}}\left[ {\frac{{{{\rho }^{2}}{\text{ch}}\left( x \right) + 5{\text{exp}}\left( {{{3{{J}_{{{\text{сред}}}}}} \mathord{\left/ {\vphantom {{3{{J}_{{{\text{сред}}}}}} {2kT}}} \right. \kern-0em} {2kT}}} \right) + \left( {{{1~--~{{\rho }^{2}}{\text{sh}}\left( x \right)} \mathord{\left/ {\vphantom {{1~--~{{\rho }^{2}}{\text{sh}}\left( x \right)} {\left( x \right)}}} \right. \kern-0em} {\left( x \right)}}} \right)}}{{{\text{ch}}\left( x \right) + {\text{exp}}\left( {{{3{{J}_{{{\text{сред}}}}}} \mathord{\left/ {\vphantom {{3{{J}_{{{\text{сред}}}}}} {2kT}}} \right. \kern-0em} {2kT}}} \right)}}} \right];\,\,\,\,\chi _{M}^{{{\text{сред}}}}~\,\, = \,\,~\frac{{\chi _{M}^{\parallel } + 2\chi _{M}^{ \bot }}}{3},$где x = Δ/2kT и ρ = δ/Δ.
Приведенные выражения с учетом параметра θ, отражающего обмен между трехъядерными фрагментами с участием H-связи (рис. 4), позволили получить следующие значения Jсред = –636 см–1, g|| = 2.05, g⊥ = 2.11, Δ = 87.3 см–1, δ = 36.8 см–1, θ = = –0.18, а с учетом выражения Gz = ((Δ2 – δ2)/3)1/2, величина Gz = 45.5 см–1. Поскольку Jсред = (2J + + j)/3 и δ = J – j, авторы получили J = –623.7 см–1 и j = –660.7 см–1, что, по их мнению, прекрасно согласуется с результатами магнетохимической интерпретации аналогичных трехъядерных систем с антисимметричным обменом [61, 68, 69].
Кластерные комплексы с содержанием атомов меди в обменном ядре выше трех и интересными физико-химическими свойствами на основе оксиматных лигандов описаны в [70]. Строение лигандных систем XIV, XV, использованных для получения полиядерных комплексов меди(II), представлено ниже
Взаимодействием Cu(ClO4)2 c HL1 получен биядерный комплекс состава [Cu2(L1)2(H2O)2](ClO4)2 (XVI), аналогичная реакция в присутствии SCN– ионов приводит к частичному восстановлению CuII → CuI и образованию смешановалентной 3D-структуры состава {[${\text{Cu}}_{2}^{{{\text{II}}}}$(L1)2][Cu$_{4}^{{\text{I}}}$(μ1,3-SCN)4- (μ1,1,3-SCN)2]}n (XVII) с HL1 и пентаядерного смешановалентного кластера состава {[${\text{Cu}}_{2}^{{{\text{II}}}}$(L2)2(NCS)]2- [CuI(SCN)(μ1,1-SCN)(μ1,3-SCN)]} (XVIII) с HL2. Строение комплексов XVI–XVIII представлено на рис. 9.
Рис. 9.
Строение комплексов XVI, XVII, включающего асимметричный анионный фрагмент, XVIII с идентификацией фрагментов A, A′ и B [70].
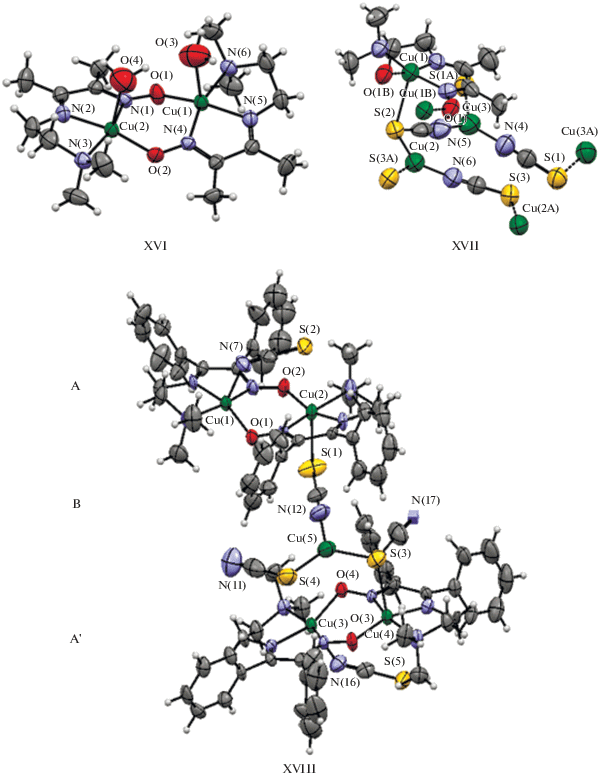
В случае соединения XVIII A и A' представляют биядерные фрагменты, связанные с центральным анионным фрагментом B. Комплексы XVI–XVIII проявляют выраженный характер антиферромагнитного обменного взаимодействия, адекватно интерпретируемого в рамках изотропной модели ГДВФ [71]; значения обменных параметров составляют J = –721 и –744 см–1 для XVI и XVII соответственно. Идентичность структурных параметров двух биядерных фрагментов в пентаядерном кластере XVIII позволила авторам [70] предположить их магнетохимическую идентичность, что в итоге дало значение обменного параметра J = –988 см–1.
Как отмечают авторы [72], тиоцианат-ион представляет собой прекрасный пример амбидентного лиганда с двумя донорными атомами N и S, возможные способы координации которого (A–E) представлены на схеме 3 [73–78].
Схема 3 .
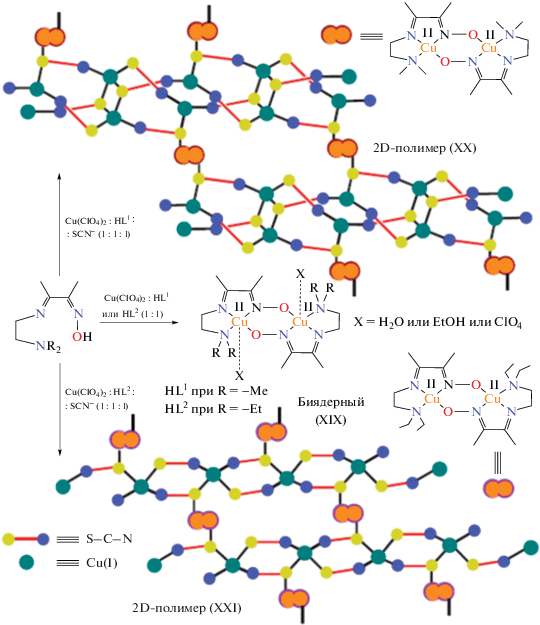
В [72] получены четыре новых оксиматных медных комплекса с лигандными системами HL1 (3-[2-(диметиламино)этилимино]бутан-2-он) и HL2 (3-[2-(диэтиламино)этилимино]бутан-2-он); составы комплексов отвечают брутто-формулам [Cu2${\text{L}}_{2}^{{\text{2}}}$(EtOH)0.5(ClO4)](ClO4) (XIX), $_{\infty }^{{\text{2}}}$[{(${\text{Cu}}_{2}^{{{\text{II}}}}{\text{L}}_{2}^{1}$)}- {${\text{Cu}}_{4}^{{\text{I}}}$(μ1,3-SCN)2(μ1,1,3-SCN)4}]n (XX) и $_{\infty }^{{\text{2}}}$[{(${\text{Cu}}_{2}^{{{\text{II}}}}{\text{L}}_{2}^{2}$)}- {${\text{Cu}}_{2}^{{\text{I}}}$(μ1,3-SCN)2(μ1,1,3-SCN)2}]n (XXI) соответственно. Синтез металлохелатов XIX–XXI представлен на схеме 4 .
Схема 4 .
Биядерные комплексы XIX получены взаимодействием перхлората меди(II) с HL1 и HL2 в этанольном растворе, соединения XX, XXI получены аналогичным образом, но в присутствии тиоцианата натрия; наличие последнего обуслoвливает частичное восстановление Cu(II) в Cu(I) в процессе реакции комплексообразования при комнатной температуре. Все комплексы обладают выраженным антиферромагнитным обменным взаимодействием, величины параметров обмена составляют: J = –549.6 (R = Et), –578.7, –663.8 см–1 для XIX, XX, XXI соответственно.
Авторы [72] отмечают, что в 2D-полимерах XX, XXI расстояния между двумя ионами меди превышают 8 Å, так что потенциальное обменное взаимодействие с участием CuISCN-фрагмента должно быть пренебрежимо малым, следовательно, приведенные выше величины обменных параметров для XX, XXI практически полностью обусловлены взаимодействием в биядерных фрагментах с оксиматными мостиками.
ОБМЕННО-СВЯЗАННЫЕ ОКСИМАТНЫЕ КОМПЛЕКСЫ Ni(II)
Как известно [79, 80], переход от обменно-связанных комплексов ионов меди(II) к аналогичным комплексам
высокоспиновых ионов никеля(II), характеризующихся суммарным спином S = 1 и полузаполненными магнитными орбиталями типов  и ${{d}_{{{{z}^{2}}}}},$ приводит к следующим потенциальным каналам обмена,
и ${{d}_{{{{z}^{2}}}}},$ приводит к следующим потенциальным каналам обмена,
что с учетом теории обменных каналов [79] при прочих равных условиях в большинстве случаев имеет следствием значительное уменьшение по абсолютной величине значений обменных параметров. И действительно, как будет показано ниже, практически все синтезированные к настоящему времени обменно-связанные оксиматные комплексы никеля проявляют относительно слабое антиферромагнитное взаимодействие. Одним из примеров может служить комплекс состава [Ni2(L)2](ClO4)2, синтезированный авторами [81], строение которого изображено на рис. 10. Расстояние между двумя ионами никеля(II), связанными оксиматными мостиками, составляет 3.706(1) Å, что, по мнению авторов данной работы, исключает возможность прямого обмена; величина обменного параметра J = –79 см–1 и согласуется с предположением о трансляции обменного взаимодействия по системе σ-связей.
Взаимодействием оксиматной лигандной системы XX (H2L1) с перхлоратом никеля(II) [82] получен биядерный комплекс типа XIII, строение которого показано на рис. 11.
Из рис. 11 видно, что два иона никеля связаны двумя иминными и двумя аминными атомами азота, а также атомом кислорода оксиматного фрагмента второго лиганда.
Биядерный комплекс Ni(II) типа XXIII характеризуется достаточно слабым антиферромагнитным обменом (J = –12 см–1), что, по мнению авторов цитируемой работы, обусловлено как отмеченными выше орбитальными факторами, так и особенностями строения обменного фрагмента Ni2(NO)2.
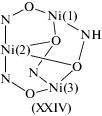
Увеличение числа атомов никеля(II) в обменном фрагменте в большинстве случаев не приводит к радикальной трансформации магнитных свойств. Так, в [83] описан трехъядерный комплекс состава [Ni3(L)(HL)2](ClO4)2, в котором октаэдрически координированные ионы никеля располагаются в вершинах равнобедренного треугольника, включающего оксиматные мостики (тип XXIV).
Проведенный магнитный анализ в предположении реализации обменного взаимодействия через два оксиматных мостика и атом кислорода позволил авторам данной работы получить следующие значения обменных параметров JXII = JXXIII = = –14.4 см–1, JXIII = –7.6 см–1.
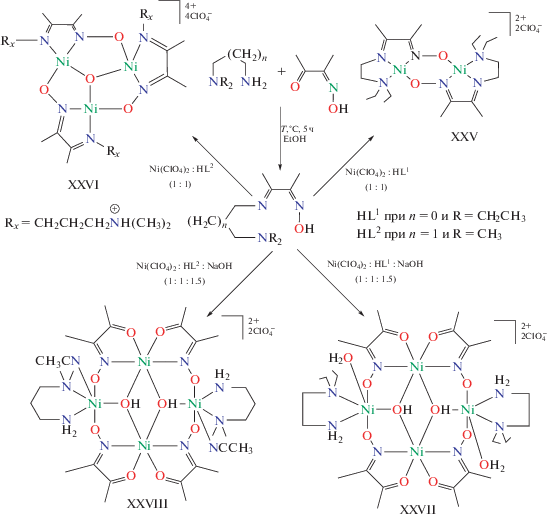
Би-, три- и тетраядерные комплексы никеля(II) описаны в [84], в качестве лигандов использованы основания Шиффа 3-[2-(диэтиламино)этилимино]бутан-2-он оксим (HL1) и 3-[3-(диметиламино)пропилимино]бутан-2-он оксим (HL2). При взаимодействии указанных лигандов с перхлоратом никеля получены бидерный комплекс состава [Ni2${\text{L}}_{2}^{1}$](ClO4)2 (XXV) и трехъядерный состава [Ni3(HL2)3(μ3-O)](ClO4)4 ∙ CH3CN (XXVI), a добавление NaOH приводит к депротонированию гидроксильной группы оксиматного фрагмента и образованию тетраядерных комплексов составов [{Ni(Deen)(H2O)}2(μ3-OH)2{Ni2(Moda)4}] (ClO4)2 · 2CH3CN (XXVII) и [{Ni(Dmpn)(CH3CN)}2(μ3-OH)2{Ni2(Moda)4}](ClO4)2 · CH3CN (XXVIII) (Deen = 2-(диэтиламино)этиламин, Dmpn = 3-(диметиламино)метиламино)-1-пропиламин, ModaH = бутан-2,3-дион монооксим) (схема 5 ). В комплексах XXV и XXVI оксиматный атом кислорода депротонирован и связан с ионом никеля, в XX-VII и XXVIII основание Шиффа подвергается гидролизу с образованием молекул диамина и оксима, образующих фрагменты {Ni(Diamine)}2+ и {Ni(Moda)2}2+, далее трансформирующиеся в тетраядерные комплексы.
Схема 5 .
Структура комплекса XXVII включает центросимметричную тетраядерную единицу [{Ni(Deen)- (H2O)}2(μ3-OH)2{Ni2(Moda)4}]2+ (рис. 12а), координационное окружение каждого иона никеля представляет искаженный октаэдр.
Структура комплекса XXVIII также состоит из тетраядерных единиц [{Ni(Dmpn)(CH3CN)}2(μ3-OH)2{Ni2(Moda)4}]2+ (рис. 12б). Строение обоих комплексов практически идентично за исключением структуры аминной составляющей и координированных молекул растворителя или воды.
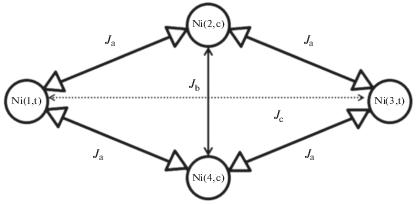
Обменный тетраядерный фрагмент Ni4N4O6 в обоих комплексах, по определению авторов, имеет конфигурацию “кресла” (рис. 13).
Такая структура позволила авторам принять допущение о том, что четыре атома никеля находятся в вершинах ромба и обменное взаимодействие может быть интерпретировано с помощью изотропного спин-гамильтониана (6), включающего три обменных параметра. Каналы обменного взаимодействия в комплексах XXVII и XXVIII представлены на схеме 6 .
Схема 6 .
(6)
$\hat {H} = - 2{{J}_{{\text{a}}}}\left( {{{S}_{1}}{{S}_{2}} + {{S}_{1}}{{S}_{4}} + {{S}_{2}}{{S}_{3}} + {{S}_{3}}{{S}_{4}}} \right) - 2{{J}_{{\text{b}}}}\left( {{{S}_{2}}{{S}_{4}}} \right) - 2{{J}_{{\text{c}}}}\left( {{{S}_{1}}{{S}_{3}}} \right).$Рассчитанные величины составили соответственно Ja = –43.5(1) см–1, Jb = 19(1) см–1, Jc = 0 для XXVII и Ja = –48.4(1) см–1, Jb = 15(1) см–1, Jc = 0 для XXVIII, что, по мнению авторов работы, хорошо согласуется с литературными данными [85‒91].
Способность оксиматных лигандов в сочетании с аминоспиртами генерировать металлоциклы различного состава и структуры описана в [92]. Для реализации этой задачи авторами цитируемой работы были выбраны изображенные ниже лигандные системы: диацетилмоноксим (HDamo), ди-2-пиридилкетоноксим (HDpko) и метил-2-пиридилкетоноксим (HMpko), а также аминоспирты (HEa, H2Dea, HMea) в качестве линкеров.
Взаимодействием HDamo с Ni(ClO4)2 ∙ 6H2O в присутствии триэтиламина получен трехъядерный комплекс [(NiHL1)3(μ3-O)]ClO4 (XXIX), а при добавлении HEa в аналогичных синтетических условиях – тетраядерный (Et3NH)[Ni4(Damo)4- (HEa)2(Ea)2](ClO4)3 (XXX, схема 7 ).
Схема 7 .
По определению авторов комплекс XXX представляет собой новый тип металлокраунпроизводных, обозначенный как 12-MC-4, с внутренней полостью, включающей пары анионов (OH…O)–, связанных H-связью. Фрагмент 12-MC-4 содержат также полученные авторами близкие по структуре тетраядерные комплексы [Ni4(Damo)4- (H2Dea)2(HDea)2](ClO4)2 ∙ 2H2O, [Ni4(Dpko)4(HEa)2- (Ea)2](ClO4)2 ∙ 4H2O (XXXII) и [Ni4(Mpko)4(HMea)2- (Mea)2](ClO4)2 (XXXIII). Строение комплекса XXXI изображено на рис. 14.
Авторы отмечают, что в комплексах XXXI–XXXIII атомы никеля геометрически образуют квадратную структуру и находятся в октаэдрической координации за счет аксиального связывания, например молекул иминооксима (Damo-) и аминоспирта (HDea-, в случае XXXI).
Магнитные измерения показали, что комплексы XXIX, XXX оказались диамагнитными, а в комплексах XXXI–XXXIII отмечено обменное взаимодействие антиферромагнитного типа. Графическая зависимость χT vs T изображена на рис. 15.
Рис. 15.
Температурная зависимость χT для соединений XXXI–XXXIII. Сплошные кривые для XXXI (1), XXXII (2) и XXXIII (3) соответствуют теоретическим параметрам обмена.
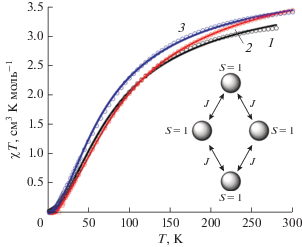
Интерпретация температурной зависимости магнитной восприимчивости осуществлена в рамках простейшей для данной ситуации модели с использованием только одного обменного параметра J с помощью изотропного спин-гамильтониана (7):
(7)
$\begin{gathered} \hat {H} = - 2J({{S}_{{{\text{Ni}}1}}}{{S}_{{{\text{Ni}}2}}} + {{S}_{{{\text{Ni}}2}}}{{S}_{{{\text{Ni}}3}}} + \\ + \,\,{{S}_{{{\text{Ni}}3}}}{{S}_{{{\text{Ni}}4}}} + {{S}_{{{\text{Ni}}1}}}{{S}_{{{\text{Ni}}4}}}). \\ \end{gathered} $Соответствующие теоретические значения J составили –23(1) K для XXXI, –26.4(4) K для XXXII и –20.4(8) K для XXXIII, что, по мнению авторов, хорошо согласуется с известными результатами для тетраядерных комплексов никеля с аналогичной топологией [9, 93, 94].
Приведенные выше примеры дают наглядное доказательство “выборочного” характера анализа магнитных свойств обменно-связанных комплексов никеля(II) с оксиматными лигандами и отсутствия значимых магнетоструктурных корреляций для данных систем, что подразумевает необходимость дальнейшего проведения систематических экспериментально-теоретических исследований в данном направлении.
В заключение следует отметить, что в данном обзоре в рамках ограниченного анализа рассмотрены основные типы и механизмы обменных взаимодействий, выявлены некоторые электронные и геометрические факторы, оказывающие определяющее влияние на магнитные свойства би- и тетраядерных комплексов меди(II) и никеля(II) с оксиматными лигандами. Авторы сознательно ограничились описанием магнитных свойств обменно-связанных комплексов, парамагнитные центры которых находятся в орбитально-невырожденных состояниях. Между тем совершенно очевидно, что дальнейшее теоретическое и экспериментальное развитие магнетохимического метода в плане адекватной интерпретации свойств подобных систем, включающих ионы второго и третьего переходных рядов, а также РЗЭ, является весьма актуальной задачей, особенно в плане направленного дизайна супрамолекулярных структур с заданными или управляемыми физико-химическими характеристиками, и для выявления основополагающих закономерностей взаимосвязи “структура–свойство” с целью получения новых материалов, таких как молекулярные магнетики, для инновационных технологий ближайшего будущего.
Список литературы
Zhao L., Niel V., Thompson L.K. et al. // Dalton Trans. 2004. № 9. P. 1446.
Anwar M.U., Shuvaev K.V., Dawe L.N. et al. // Inorg. Chem. 2011. V. 50. P. 12141.
Vigato P.A., Tamburini S. // Coord. Chem. Rev. 2004. V. 248. P. 1717.
Naskar S., Corbella M., Blake A.J. et al. // Dalton Trans. 2007. № 11. P. 1150.
Bermejo M.R., González-Noya A.M., Martínez-Calvo M. et al. // Eur. J. Inorg. Chem. 2008. № 24. P. 3852.
Mezei G., Zaleski C.M., Pecoraro V.L. // Chem. Rev. 2007. V. 107. P. 4933.
Bai Y., Dang D.-B., Duan C.-Y. et al. // Inorg. Chem. 2005. V. 44. P. 5972.
Ruben M., Rojo J., Romero-Salguero F.J. et al. // Angew. Chem. Int. Ed. 2004. V. 43. P. 3644.
Moroz Y.S., Kulon K., Haukka M. et al. // Inorg. Chem. 2008. V. 47. P. 5656.
Moroz Y.S., Szyrwiel L., Demeshko S. et al. // Inorg. Chem. 2010. V. 49. P. 4750.
Moroz Y.S., Demeshko S., Haukka M. et al. // Inorg. Chem. 2012. V. 51. P. 7445.
Feig A.L., Lippard S.J. // Chem. Rev. 1994. V. 94. P. 759.
Que L., True A.E. // Prog. Inorg. Chem. 1990. V. 38. P. 97.
Lippard S.J., Berg J.M. Principles of Bioinorganic Chemistry. Mill Valley (CA, USA): University Science Books, 1994.
Kaim W., Schwederski B. Bioanorganische Chemie. Stuttgart: B.G. Teubner, 1991.
Mechanistic Bioinorganic Chemistry / Eds. Thorp H.H., Pecoraro V.L. Washington: American Chemical Society, 1995.
Magneto-Structural Correlations in Exchange Coupled Systems / Eds .Willett R.D., Gatteschi D., Kahn O. Dordrecht: Kluwer Academic Publishers, 1985.
Magnetic Molecular Materials / Eds. Gatteschi D., Kahn O., Miller J.S., Palacio F. Dordrecht: Kluwer Academic Publishers, 1991.
Kahn O. Molecular Magnetism. Weinheim: VCH-Verlagsgesellschaft, 1993.
Kahn O. // Adv. Inorg. Chem. 1995. V. 43. P. 179.
Murray K.S. // Adv. Inorg. Chem. 1995. V. 43. P. 261.
Research Frontiers in Magnetochemistry / Ed. O’Connor C.J. Singapore: World Scientific, 1993.
Ruben M., Lehn J.-M., Müller P. // Chem. Soc. Rev. 2006. V. 35. P. 1056.
Anwar M.U., Dawe L.N., Alam M.S. et al. // Inorg. Chem. 2012. V. 51. P. 11241.
Lone I.H., Khan K.Z., Fozdar B.I. et al. // Steroids. 2013. V. 78. P. 945.
Handbook of Toxicology of Chemical Warfare Agents / Ed. Gupta R.C. San Diego: Academic Press, 2009.
Boyko Y.D., Sukhorukov A.Y., Semakin A.N. et al. // Polyhedron. 2014. V. 71. P. 24.
Sauer J., Hachem M.A., Svensson B. et al. // Carbohydr. Res. 2013. V. 375. P. 21.
Kassa J., Karasová J.Ž., Kuča K. et al. // J. Appl. Biomed. 2014. V. 12. P. 111.
Harini S.T., Kumar H.V., Rangaswamy J. et al. // Bioorg. Med. Chem. Lett. 2012. V. 22. P. 7588.
Banday A.H., Akram S.M.M., Shameem S.A. // Steroids. 2014. V. 84. P. 64.
Wen Y., Li J., Yang F. et al. // Talanta. 2013. V. 106. P. 119.
Odžak R., Skočibušić M., Maravić A. // Bioorg. Med. Chem. 2013. V. 21. P. 7499.
Türkkan B., Özyürek M., Bener M. et al. // Spectrochim. Acta. A. 2012. V. 85. P. 235.
Beckett R., Colton R., Hoskins B.F. et al. // Aust. J. Chem. 1969. V. 22. P. 2527.
Bertrand J.A., Smith J.H., Eller P.G. // Inorg. Chem. 1974. V. 13. P. 1649.
Ruiz R., Sanz J., Cervera B. et al. // Dalton Trans. 1993. № 10. P. 1623.
Ruiz R., Sanz J., Lloret F. et al. // Dalton Trans. 1993. № 20. P. 3035.
Cervera B., Ruiz R., Lloret F. et al. // Dalton Trans. 1997. № 3. P. 395.
Chaudhuri P., Winter M., Della Vedova B.P.C. et al. // Inorg. Chem. 1991. V. 30. P. 2148.
Bertrand J.A., Smith J.H., VanDerveer D.G. // Inorg. Chem. 1977. V. 16. P. 1477.
Naskar J.P., Biswas C., Guhathakurta B. et al. // Polyhedron. 2011. V. 30. P. 2310.
Gingsberg A.P. // Inorg. Chim. Acta Rev. 1971. V. 5. P. 45.
Song Y., Chen X.-T., Zheng C.-G. et al. // Transition Met. Chem. 2001. V. 26. P. 247.
Butcher R.J., O’Connor C.J., Sinn E. // Inorg. Chem. 1979. V. 18. P. 1913.
Thompson L.K., Xu Z., Goeta A.E. et al. // Inorg. Chem. 1998. V. 37. P. 3217.
Naskar J.P., Guhathakurta B., Lu L. et al. // Polyhedron. 2012. V. 43. P. 89.
Guhathakurta B., Basu P., Kumar G.S. et al. // Polyhedron. 2016. V. 110. P. 227.
Tandon S.S., Bunge S.D., Motry D. et al. // Inorg. Chem. 2009. V. 48. P. 4873.
Луков В.В., Щербаков И.Н., Левченков С.И. и др. // Коорд. химия. 2019. Т. 45. С. 131 (Lukov V.V., Shcherbakov I.N., Levchenkov S.I. et al. // Russ. J. Coord. Chem. 2019. V. 45. P. 163). https://doi.org/10.1134/S1070328419030060.
Atzori M., Serpe A., Deplano P. et al. // Inorg. Chem. Front. 2015. V. 2. P. 108.
Biswas R., Mukherjee S., Ghosh S. et al. // Inorg. Chem. Commun. 2015. V. 56. P. 108.
Karmakar S., Das O., Ghosh S. et al. // Dalton Trans. 2010. V. 39. P. 10920.
Khanra S., Weyhermüller T., Chaudhuri P. // Dalton Trans. 2007. № 41. P. 4675.
Khanra S., Weyhermüller T., Chaudhuri P. // Dalton Trans. 2008. № 36. P. 4885.
Estes W.E., Hatfield W.E. // Inorg. Chem. 1978. V. 17. P. 3226.
Talukder P., Sen S., Mitra S. et al. // Eur. J. Inorg. Chem. 2006. V. 2006. P. 329.
Valigura D., Moncol J., Korabik M. et al. // Eur. J. Inorg. Chem. 2006. V. 2006. P. 3813.
Tang J., Costa J.S., Golobič A. et al. // Inorg. Chem. 2009. V. 48. P. 5473.
Stamatatos T.C., Vlahopoulou J.C., Sanakis Y. et al. // Inorg. Chem. Commun. 2006. V. 9. P. 814.
Liu X., de Miranda M.P., McInnes E.J.L. et al. // Dalton Trans. 2004. № 1. P. 59.
Tsukerblat B.S., Belinskii M.I., Fainzil’berg V.E. // Sov. Sci. Rev. B. 1987. V. 9. P. 339.
Rakitin Y.V., Yablokov Y.V., Zelentsov V.V. // J. Magn. Res. 1981. V. 43. P. 288.
Das L.K., Drew M.G.B., Diaz C. et al. // Dalton Trans. 2014. V. 43. P. 7589.
Ferrer S., Lloret F., Bertomeu I. et al. // Inorg. Chem. 2002. V. 41. P. 5821.
Moriya T. // Phys. Rev. Lett. 1960. V. 4. P. 228.
Ferrer S., Lloret F., Pardo E. et al. // Inorg. Chem. 2012. V. 51. P. 985.
Yoon J., Mirica L.M., Stack T.D.P. et al. // J. Am. Chem. Soc. 2004. V. 126. P. 12586.
Afrati T., Dendrinou-Samara C., Raptopoulou C. et al. // Dalton Trans. 2007. № 44. P. 5156.
Dhal P., Nandy M., Sadhukhan D. et al. // Dalton Trans. 2013. V. 42. P. 14545.
Bleaney B., Bowers K.D. // Proc. Roy. Soc. Lond. A. 1952. V. 214. P. 451.
Das L.K., Diaz C., Ghosh A. // Cryst. Growth Des. 2015. V. 15. P. 3939.
Bie H.-Y., Yu J.-H., Xu J.-Q. et al. // J. Mol. Struct. 2003. V. 660. P. 107.
Sen S., Mitra S., Hughes D.L. et al. // Polyhedron. 2007. V. 26. P. 1740.
Mesa J.L., Rojo T., Arriortua M.I. et al. // Dalton Trans. 1989. № 1. P. 53.
Hou L., Li D., Shi W.-J. et al. // Inorg. Chem. 2005. V. 44. P. 7825.
Goher M.A.S., Yang Q.-C., Mak T.C.W. // Polyhedron. 2000. V. 19. P. 615.
Krautscheid H., Emig N., Klaassen N. et al. // Dalton Trans. 1998. № 18. P. 3071.
Калинников В.Т., Ракитин Ю.В. Введение в магнетохимию. Метод статической магнитной восприимчивости. М.: Наука, 1980. 301 с.
Ракитин Ю.В., Калинников В.Т. Современная магнетохимия. СПб.: Наука, 1994. 272 с.
Agnus Y., Louis R., Jesser R. et al. // Inorg. Nucl. Chem. Lett. 1976. V. 12. P. 455.
Das O., Adarsh N.N., Paul A. et al. // Inorg. Chem. 2010. V. 49. P. 541.
Pavlishchuk V.V., Kolotilov S.V., Addison A.W. et al. // Inorg. Chem. 1999. V. 38. P. 1759.
Das L.K., Biswas A., Kinyon J.S. et al. // Inorg. Chem. 2013. V. 52. P. 11744.
Escuer A., Vicente R., Kumar S.B. et al. // Dalton Trans. 1998. № 20. P. 3473.
Pavlishchuk V.V., Kolotilov S.V., Addison A.W. et al. // Dalton Trans. 2003. № 8. P. 1587.
Pavlishchuk V.V., Kolotilov S.V., Addison A.W. et al. // Angew. Chem. Int. Ed. 2001. V. 40. P. 4734.
Nanda K.K., Thompson L.K., Bridson J.N. et al. // Chem. Commun. 1994. № 11. P. 1337.
Escuer A., Font-Bardía M., Kumar S.B. et al. // Polyhedron. 1999. V. 18. P. 909.
Halcrow M.A., Sun J.-S., Huffman J.C. et al. // Inorg. Chem. 1995. V. 34. P. 4167.
Serna Z.E., Lezama L., Urtiaga M.K. et al. // Angew. Chem. Int. Ed. 2000. V. 39. P. 344.
Audhya A., Maity M., Bhattacharya K. et al. // Inorg. Chem. 2010. V. 49. P. 9026.
Dawe L.N., Thompson L.K. // Dalton Trans. 2008. № 27. P. 3610.
Jiang Y.-B., Kou H.-Z., Wang R.-J. et al. // Inorg. Chem. 2005. V. 44. P. 709.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия