Координационная химия, 2022, T. 48, № 5, стр. 314-320
Синтез и строение бис(аренсульфонатов) трис(фторфенил)сурьмы (3-FC6H4)3Sb(OSO2R)2 (R = Ph, С6H3Me2-2,4) и (4-FC6H4)3Sb(OSO2Ph)2
В. В. Шарутин 1, *, О. К. Шарутина 1
1 Национальный исследовательский Южно-Уральский государственный университет
Челябинск, Россия
* E-mail: vvsharutin@rambler.ru
Поступила в редакцию 30.06.2021
После доработки 14.07.2021
Принята к публикации 17.12.2021
- EDN: NVFYIC
- DOI: 10.31857/S0132344X22050085
Аннотация
Взаимодействием трис(3-фторфенил)сурьмы и трис(4-фторфенил)сурьмы с бензолсульфоновой и 2,4-диметилбензолсульфоновой кислотами в присутствии трет-бутилгидропероксида (мольное соотношение 1 : 2 : 1 соответственно) в эфире синтезированы бис(аренсульфонаты)-трис(фторфенил)сурьмы: (3-FC6H4)3Sb(OSO2R)2, R = Ph (I), С6H3Me2-2,4 (II) и (4-FC6H4)3Sb(OSO2Ph)2 (III), в которых атомы Sb имеют искаженную тригонально-бипирамидальную координацию с аренсульфонатными лигандами в аксиальных положениях (CIF files № 2055557 (I), 2055820 (II), 2060295 (III)).
Известно, что дикарбоксилаты триарилсурьмы способны оказывать противоопухолевое, антилейшманиозное и антибактериальное действие, обладают электрохимическими, фотолюминисцентными и фотокаталитическими свойствами [1–8]. Гораздо в меньшей степени известно о синтезе и свойствах подобных дисульфонатных производных триарилсурьмы [8–11]. В настоящей работе осуществлен синтез и выявлены особенности строения бис(аренсульфонато)трис(фторфенил)сурьмы: (3-FC6H4)3Sb(OSO2R)2, R = Ph (I), С6H3Me2-2,4 (II) и (4-FC6H4)3Sb(OSO2Ph)2 (III).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали бензолсульфоновую и 2,4-диметилбензолсульфоновую кислоты (Alfa Aesar). Триарилсурьму получали по методике, описанной в [12]. Перед проведением синтеза растворители бензол и октан квалификации “х. ч.” просушивали над хлоридом кальция, диэтиловый эфир – над натрием.
Синтез бис(бензолсульфонато)триc(3-фторфенил)сурьмы (3-FC6H4)3Sb(OSO2Ph)2) (I) проводили по методике, описанной в [11]. Выход бесцветных кристаллов 81%, Тпл = 229°С. ИК-спектр (ν, см–1): 3073, 1587, 1474, 1422, 1314, 1269, 1250, 1217, 1165, 1157, 1142, 1094, 1067, 1024, 997, 932, 914, 893, 878, 856, 818, 800, 783, 727, 675, 596, 583, 536, 521, 438.
Соединения II, III синтезировали по аналогичной методике.
Сольват бис(2,4-диметилбензолсульфонато)триc(3-фторфенил)сурьмы (3-FC6H4)3Sb(OSO2C6H3Me-2,4)2 ∙ ∙ 2PhH (II): бесцветные прозрачные кристаллы, выход 82%, Тпл = 175°С. ИК-спектр (ν, см–1): 3075, 3030, 1589, 1518, 1474, 1445, 1422, 1315, 1290, 1271, 1223, 1165, 1136, 1094, 1045, 1022, 997, 908, 891, 858, 795, 762, 727, 692, 673, 627, 604, 588, 561, 538, 521, 430.
Бис(бензолсульфонато)триc(4-фторфенил)-сурьмы (4-FC6H4)3Sb(OSO2Ph)2 (III): бесцветные прозрачные кристаллы, выход 83%, Тразл = 236°С. ИК-спектр (ν, см–1): 3055, 1585, 1489, 1472, 1447, 1422, 1396, 1315, 1132, 1101, 1087, 1041, 1020, 997, 937, 907, 823, 752, 729, 691, 624, 608, 582, 557, 509, 419.
ИК-спектры соединений I−III записывали на ИК-Фурье спектрометре Shimadzu IRAffinity-1S в таблетках KBr в области 4000−400 см−1.
Элементный анализ на C и H выполняли на элементном анализаторе Carlo Erba CHNS-O EA 1108. Температуры плавления измеряли на синхронном термоанализаторе Netzsch 449C Jupiter.
РСА кристаллов I−III проведен на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор) при 293 К. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [13]. Все расчеты по определению и уточнению структуры выполнены по программам SHELXL/PC [14] и OLEX2 [15]. Структуры I−III определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Основные кристаллографические данные и результаты уточнения структур I−III приведены в табл. 1.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур I−III
| Параметр | Значение | ||
|---|---|---|---|
| I | II | III | |
| М | 721.34 | 933.73 | 721.34 |
| Сингония | Моноклинная | Моноклинная | Моноклинная |
| Пр. группа | C2/c | C2/c | C2/c |
| a, Å | 17.865(17) | 17.015(8) | 19.62(3) |
| b, Å | 10.901(13) | 22.980(7) | 13.832(18) |
| c, Å | 14.619(14) | 13.149(9) | 12.349(17) |
| α, град | 90 | 90 | 90 |
| β, град | 91.61(4) | 123.345(17) | 117.45(7) |
| γ, град | 90 | 90 | 90 |
| V, Å3 | 2846(5) | 4295(4) | 2974(7) |
| Z | 4 | 4 | 4 |
| ρ(выч.), г/см3 | 1.684 | 1.4438 | 1.611 |
| μ, мм−1 | 1.180 | 0.800 | 1.129 |
| F(000) | 1440.0 | 1903.5 | 1440.0 |
| Размер кристалла, мм | 0.2 × 0.13 × 0.06 | 0.55 × 0.25 × 0.19 | 0.35 × 0.2 × 0.19 |
| Область сбора данных по 2θ, град | 7.04−56.998 | 5.98−57 | 6.72−59.36 |
| Интервалы индексов отражений | −23 ≤ h ≤ 23, −14 ≤ k ≤ 14, −19 ≤ l ≤ 19 |
−22 ≤ h ≤ 25, −34 ≤ k ≤ 34, −19 ≤ l ≤ 19 |
−26 ≤ h ≤ 26, −18 ≤ k ≤ 18, −16 ≤ l ≤ 16 |
| Измерено отражений | 33 469 | 104 135 | 37 259 |
| Независимых отражений | 3592 (Rint = 0.0774) | 5433 (Rint = 0.0394) | 4046 (Rint = 0.0315) |
| Отражений с I > 2σ(I) | 2805 | 4842 | 3319 |
| Переменных уточнения | 197 | 275 | 192 |
| GOOF | 1.035 | 1.080 | 1.059 |
| R-факторы по F 2 > 2σ(F 2) |
R1 = 0.0341, wR2 = 0.0610 |
R1 = 0.0301, wR2 = 0.0844 |
R1 = 0.0340, wR2 = 0.0836 |
| R-факторы по всем отражениям | R1 = 0.0558, wR2 = 0.0661 |
R1 = 0.0363, wR2 = 0.0918 |
R1 = 0.0461, wR2 = 0.0934 |
| Остаточная электронная плотность (max/min), e/A3 | 0.54/−0.82 | 0.79/−0.63 | 0.82/−0.87 |
Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (ССDC № 2055557 (I), 2055820 (II), 2060295 (III); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Среди методов получения дисульфонатов триарилсурьмы наиболее эффективным является способ, основанный на реакции окислительного присоединения, с помощью которого из триарилсурьмы и сульфоновой кислоты в присутствии окислителя в эфире синтезируют целевой продукт [8]. В качестве окислителя чаще всего использовали пероксид водорода или трет-бутилгидропероксид. Именно по этой схеме были синтезированы бис(бензолсульфонат) три-мета-толилсурьмы [10], бис(2,5-диметилбензолсульфонат)трис(5-бром-2-метоксифенил)сурьмы и бис(3,4-диметилбензолсульфонат)трис(4-метилфенил)сурьмы [11], однако для трис(фторфенильных) соединений сурьмы подобные реакции не были известны.
Мы установили, что взаимодействие триc(3-фторфенил)сурьмы с бензолсульфоновой или 2,4-диметилбензолсульфоновой кислотами в присутствии трет-бутилгидропероксида при мольном соотношении 1 : 2 : 1 соответственно в диэтиловом эфире протекает по схеме реакции окислительного присоединения c образованием дисульфонатов трис(3-фторфенил)сурьмы (3-FC6H4)3Sb(OSO2R)2, R = Ph (I), С6H3Me2-2,4 (II) с выходом до 89%.
Соединение II после перекристаллизации из смеси бензол–октан (3 : 1 объемн.) выделяли в виде сольвата с бензолом (3-FC6H4)3Sb(OSO2С6H3Me2-2,4)2 ∙ 2 PhH.
Подобная реакция триc(4-фторфенил)сурьмы с бензолсульфоновой кислотой в аналогичных условиях привела к образованию бис(бензолсульфонато)трис(4-фторфенил)сурьмы (4-FC6H4)3Sb(OSO2Ph)2 (III) с выходом 69%.
Соединения I−III представляют собой устойчивые к действию влаги и кислорода воздуха бесцветные кристаллические вещества, хорошо растворимые в ароматических углеводородах и полярных органических растворителях. На кривой ДСК для сольвата комплекса II с бензолом наблюдалось два эндотермических пика, один из которых (при 80°С) можно отнести к потере сольватного бензола, а второй (при 177°С) – с плавлением образующегося свободного от бензола комплекса II. В ИК-спектрах соединений I, II и III наблюдаются интенсивные полосы при 438, 430 и 419 см−1 (Sb−C), 1474, 1474 и 1489 см−1 (Ar), 3072, 3075 и 3067 см−1 (H−CAr) соответственно, кроме того в ИК-спектре комплекса II присутствовала полоса при 3030 см−1 (H−CAlk). Наличие в ИК-спектрах интенсивных полос поглощения в области 1100−1300 см−1 (1093, 1165, 1217 см−1 для I, 1094, 1165, 1223 см−1 для II и 1101, 1171, 1236 см−1 для III) свидетельствуют о присутствии в комплексах I−III сульфогрупп [16, 17].
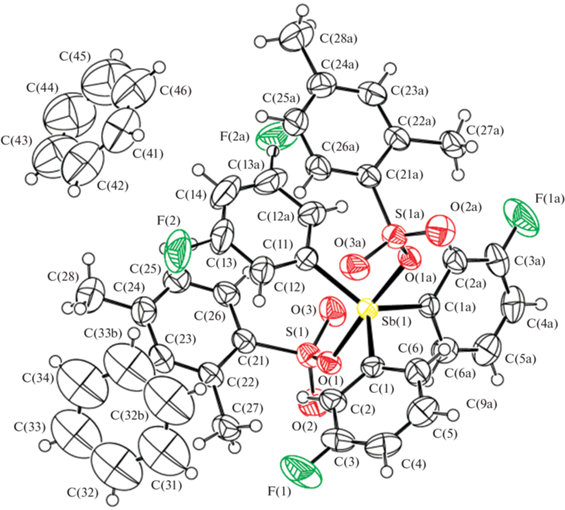
По данным РСА, в центросимметричных молекулах I−III атомы Sb имеют искаженную тригонально-бипирамидальную координацию с атомами кислорода аренсульфонатных лигандов в аксиальных положениях, причем в кристалле II присутствуют сольватные молекулы бензола (рис. 1−3).
Рис. 1.
Строение соединения I (на рис. 1–3 атомы показаны в виде эллипсоидов тепловых колебаний с вероятностью 40%).

Аксиальные углы OSbO в I−III несколько отличаются от идеального значения (180°) и составляют 178.93(10)°, 176.72(8)° и 177.04(11)° соответственно. Валентные углы между аксиальными и экваториальными связями (87.36(11)°−93.04(11)°, 85.59(6)°−92.61(6)° и 87.26(11)°−91.20(11)°) также отличаются от теоретического значения (90°) менее чем на 5°. В комплексах I−III суммы углов CSbC в экваториальных плоскостях составляют 360°, причем атомы сурьмы находятся строго в экваториальной плоскости. Величины индивидуальных углов CSbC изменяются в обычном для соединений Ar3SbX2 интервалах 112.74(17)°−123.63(8)°, 113.78(9)°−123.11(4)° и 117.5(2)°−121.26(10)° соответственно, причем наибольшая разница между максимальным и минимальным значениями углов имеет место в молекулах I, а наименьшая в молекулах III, хотя отличие в их строении заключается лишь в положении атома фтора в арильных лигандах. Отметим, что введение атомов фтора в мета- или пара-положения ароматических колец влияет на расстояния Sb–C и Sb–O. Так, значения экваториальных связей Sb–C в соединениях I, II, III варьируют в интервалах 2.086(3)−2.096(3), 2.0768(14)−2.086(3), 2.092(4)−2.094(5) Å соответственно (при этом максимальные значения наблюдаются в молекулах III). Средние значения длин аксиальных связей Sb–О уменьшаются в ряду I (2.128(2) Å), II (2.1108(18) Å), III (2.098(4) Å) и не превышают значения аналогичных связей в дикарбоксилатах триорганилсурьмы (2.105–2.156 Å) [18], приближаясь к сумме ковалентных радиусов указанных атомов (2.14 Å) [19]. Отметим незначительное уменьшение внутримолекулярных расстояний между атомом сурьмы и атомами кислорода сульфогрупп Sb···О=S (3.266(2) Å для I, 3.333(2) Å для II, 3.408(4) Å для III) по сравнению с суммой ван-дер-вааальсовых радиусов (3.7 Å [19]). Аренсульфонатные лиганды в молекулах I, II и III расположены относительно фрагмента SbC3 таким образом, что внутримолекулярные контакты Sb⋅⋅⋅O(=C) формируются внутри двух экваториальных углов, значения которых возрастают до 123.63(8)°, 123.11(4)° и 121.26(10)° соответственно, при этом можно отметить зависимость между прочностью контакта Sb⋅⋅⋅О и величиной максимального угла СSbC. В аренсульфонатных группах молекул I, II, III длины одинарной связи S–O (1.534(2), 1.538(2), 1.518(3) Å) и двойных связей S=O (1.430(2), 1.432(2), 1.413(3) Å) различаются, что свидетельствует о ковалентном характере связывания этих групп с атомом сурьмы. Упаковка молекул дисульфонатов триарилсурьмы в кристалле определяется сложной системой слабых межмолекулярных водородных связей типа С–Н⋅⋅⋅F (2.4 Å для I) и С–Н⋅⋅⋅О (2.6 Å для II и 2.4 Å для III).
Таким образом, в полученных из трис(фторфенил)сурьмы, аренсульфоновой кислоты и трет-бутилгидропероксида в эфире (мольное соотношение 1 : 2 : 1) соединениях I−III наблюдаются короткие контакты между атомами кислорода сульфогрупп с центральным атомом металла. Введение атомов фтора в мета- или пара-положения ароматических колец влияет на расстояния Sb–C и Sb–O.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Iftikhar T., Rauf M.K., Sarwar S. et al. // J. Organomet. Chem. 2017. V. 851. P. 89. https://doi.org/10.1016/j.jorganchem.2017.09.002
Mushtaq R., Rauf M.K., Bond M. et al. // Appl. Organomet. Chem. 2016. V. 30. № 6. P. 465. https://doi.org/10.1002/aoc.3456
Mushtaq R., Rauf M.K., Bolte M. et al. // Appl. Organomet. Chem. 2017. V. 31. № 5. P. e3606. https://doi.org/10.1002/aoc.3606
Islam A., Da Silva J.G., Berbet F.M. et al. // Molecules. 2014. V. 19. № 5. P. 6009. https://doi.org/10.3390/molecules19056009
Zhang X.-Y., Cui L., Zhang X. et al. // J. Mol. Struct. 2017. V. 134. P. 742. https://doi.org/10.1016/j.molstruc.2017.01.039
Duffin R.N., Blair V.L., Kedzierski L., Andrews P.C. // J. Inorg. Biochem. 2020. V. 203. P. 110932. https://doi.org/10.1016/j.jinorgbio.2019.110932
Артемьева Е.В., Шарутина О.К., Шарутин В.В., Буланова А.В. // Журн. неорган. химии. 2020. Т. 65. № 1. С. 25 (Artem’eva E.V., Sharutina O.K., Sharutin V.V., Bulanova A.V. // Russ. J. Inorg. Chem. 2020. V. 65. № 1. P. 22). https://doi.org/10.1134/S0036023620010039
Шарутин В.В., Поддельский А.И., Шарутина О.К. // Коорд. химия. 2020. Т. 46. № 10. С. 579 (Sharutin V.V., Poddel’sky A.I., Sharutina O.K. // Russ. J. Coord. Chem. 2020. V. 46. № 10. P. 663). https://doi.org/10.1134/S1070328420100012
Robertson A.P.M., Chitnis S.S., Jenkins H.A. et al. // Chem.-Eur. J. 2015. V. 21. № 21. P. 7902. https://doi.org/10.1002/chem.201406469
Шарутин В.В., Шарутина О.К., Сенчурин В.С. // Вестник ЮУрГУ. Сер. Химия. 2015. Т. 7. № 4. С. 93. https://doi.org/10.14529/chem150412
Шарутин В.В., Шарутина О.К., Сенчурин В.С. и др. // Журн. неорган. химии. 2018. Т. 63. № 7. С. 823 (Sharutin V.V., Sharutina O.K., Senchurin V.S. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 7. P. 867). https://doi.org/10.1134/S0036023618070185
Кочешков К.А., Сколдинов А.П., Землянский Н.Н. Методы элементоорганической химии. Сурьма, висмут. М.: Наука, 1976. 483 с.
SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Madison (WI, USA): Bruker AXS Inc., 1998.
SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Madison (WI, USA): Bruker AXS Inc., 1998.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Ap-pl. Cryst. 2009. V. 42. P. 339. https://doi.org/10.1107/S0021889808042726
Васильев А.В., Гриненко Е.В., Щукин А.О., Федулина Т.Г. Инфракрасная спектроскопия органических и природных соединений. СПб: СПбГЛТА, 2007. 54 с.
Тарасевич Б.Н. ИК спектры основных классов органических соединений. М.: МГУ, 2012. 55 с.
Cambridge Crystallographic Data Center. 2020. http://www.ccdc.cam.ac.uk
Бацанов С.С. // Журн. неорган. химии. 1991. Т. 36. № 12. С. 3015.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия