Координационная химия, 2022, T. 48, № 6, стр. 343-351
Циклометаллированный комплекс рутения с 3,3',5,5'-тетраметил-1,1'-бифенил-4,4'-бипиразолом и 2,2'-дикарбоксибипиридином: синтез, оптические свойства и квантово-химическое моделирование
М. А. Лаврова 1, *, А. М. Лунев 1, В. Е. Гончаренко 1, 2, И. В. Тайдаков 2, В. Д. Долженко 1, Ю. А. Белоусов 1, 2
1 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
2 Физический институт им. П.Н. Лебедева РАН
Москва, Россия
* E-mail: mariia.lavrova@chemistry.msu.ru
Поступила в редакцию 11.10.2021
После доработки 19.11.2021
Принята к публикации 22.11.2021
- EDN: MAFLTU
- DOI: 10.31857/S0132344X22060032
Аннотация
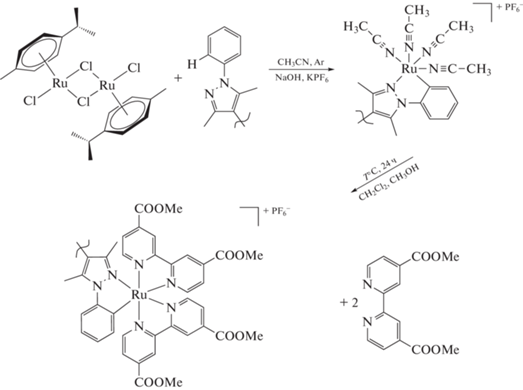
Новый комплекс [RuL(Dmdcbp)2]PF6 (I) получен последовательным взаимодействием [Ru-p-cymene]2Cl4 с 3,3',5,5'-тетраметил-1,1'-бифенил-4,4'-бипиразолом (L) и 4,4'-дикарбокси-2,2'-бипиридином в среде метанол–хлороформ. Состав комплекса I подтвержден методами ЯМР и элементным анализом, изучены оптические и люминесцентные свойства комплекса. Лиганд L впервые охарактеризован методом РСА (CIF file CCDC № 2118676). Для интерпретации спектров поглощения и испускания проведены квантово-химические расчеты в рамках теории функционала плотности. Комплекс I перспективен для применения в качестве фотосенсибилизатора.
Циклометалированные комплексы (ЦМК) рутения(II) находят применение в качестве противораковых препаратов [1], в материалах для фотокаталитического восстановления CO2 [2], восстановления [3] и окисления [4] воды, а также в качестве красителей [5, 6] в ячейках Гретцеля (DSSC).
В состав комплексов для DSSC должны входить “якорный” лиганд с кислотными группами, способными ковалентно связываться с поверхностью диоксида титана, используемого в фотоанодах ячеек Гретцеля, и “донорный” лиганд, отвечающий за эффективное поглощение солнечного света [5, 6]. Наиболее изученными комплексами для DSSC являются тиоцианатные комплексы рутения(II) [7]. В их состав входят монодентатные лиганды, что приводит к лабильности комплексов. Для повышения термодинамической и кинетической стабильности комплексов предложено вводить в них вместо монодентатных лигандов бидентатный циклометаллированный лиганд, что приводит к образованию ковалентной связи металл–углерод [8]. Однако при использовании комплексов с циклометаллированым фрагментом уменьшается эффективность работы солнечных элементов по сравнению с элементами на основе тиоцианатных комплексов.
Ранее мы исследовали комплексы рутения(II) на основе 2-арилбензимидазолов. С помощью модификации арильного фрагмента различными донорными и акцепторными заместителями мы исследовали влияние природы заместителя на фотофизические и электрохимические свойства комплексов, а также на эффективность их работы в ячейке [9].
Фенилпиразольные лиганды схожи с бензимидазольными, однако гораздо хуже исследованы [10–19]. ЦМК рутения на основе производных 1‑фенил- и 3-фенил-пиразолов были исследованы в качестве противоопухолевых препаратов [13, 16, 17], катализаторов С–С алкилирования [10], циклотримеризации [14] и восстановления кетонов [12], фотокатализаторов восстановления муравьиной кислоты [11].
С высокими выходами 1-фенилпиразолы получаются конденсацией β-дикетонов с фенилгидразином [20, 21]. Вариации заместителей возможны как при введении заместителя в исходный дикетон [21, 22], так и в исходный гидразин [23]. Несмотря на синтетическую доступность [24], среди бипиразольных лигандов хорошо исследованы только незамещенные бипиразолы, тогда как для N-фенилзамещенных бипиразолов комплексы не получены за более чем 40 лет с публикации методики синтеза лиганда [25].
Лиганд 3,3',5,5'-тетраметил-1,1'-бифенил-4,4'-бипиразол (L) потенциально может образовывать как моноядерные, так и биядерные комплексы благодаря наличию двух координационных сайтов. Моноядерные комплексы с данным лигандом должны эффективно поглощать солнечное излучение ввиду наличия большого числа электрон-донорных групп. К недостаткам моноядерных комплексов металлов можно отнести возможность обратного переноса электрона из зоны проводимости TiO2, а также локализация процессов переноса электрона и восстановления.
Использование биядерных комплексов в DSSC позволяет пространственно разделить эти процессы, что снизит нежелательные переходы [25]. В биядерных комплексах возможен перенос электрона, причем это осуществляется под действием длинноволнового света с высокими коэффициентами экстинкции. Этот процесс будет конкурировать с обратным переносом, снижая его влияние. Кроме того, восстановление будет происходить на атоме металла, расположенном на большем расстоянии от поверхности TiO2, что препятствует рекомбинации заряда [25].
Цель настоящей работы – синтез и исследование фотофизических свойств ЦМК комплекса рутения(II) на основе лигандов L и Dmdcbp.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использованные в работе коммерчески доступные реагенты и растворители: [Ru(p-cymene)Cl2]2, I2 (х. ч.), KPF6 (х. ч.), NaOH (ос. ч.), ацетилацетон, фенилгидразин, диметиловый эфир 4,4'-дикарбокси-2,2'-бипиридина (Dmdcbp).
ЭСП измеряли в CH3CN c помощью прибора СФ-2000 в кварцевых кюветах длиной 1 см (в диапазоне 400–900 нм). Спектры фотолюминесценции (ФЛ) растворов измеряли с помощью люминесцентного спектрометра Shimazu RF-1501. Измерения проводили в кварцевых кюветах диаметром 1 см при комнатной температуре. Спектры ЯМР регистрировали при 25°С на приборе Bruker Avance 400, химические сдвиги приведены в миллионных долях (м.д.) относительно сигналов растворителя. Масс-спектры высокого разрешения (HRMS) регистрировали на приборе Bruker maXis Q-TOF (Bruker Daltonik GmbH, Bremen, Germa-ny).
Синтез ацетилацетоната натрия (NaAcac). 3.7 г NaOH растворяли в 5 мл воды и добавляли 18 мл этанола и полученный раствор добавляли (скорость 1 мл/мин) к 9.16 г ацетилацетона при перемешивании в конической колбе на 100 мл. Образовался желтоватый осадок, который охлаждали, затем отфильтровывали при пониженным давлением на стеклянном фильтре и промывали малым количеством ледяного метанола. Выход 11.67 г Na(Аcac) · 2H2O (81%).
Синтез 3,4-диацетилгексан-2,5-диона [26]. Раствор 9.14 г иода в 40 мл ДМФА добавляли (скорость 3 мл/мин) к раствору 11.67 г Na(Аcac) · 2H2O в 58 мл ДМФА при интенсивном перемешивании. Полученный красно-коричневый раствор вылили в 400 мл ледяной воды, смесь перемешивали в течение 15 мин, выпавший белый осадок отфильтровывали на стеклянном пористом фильтре и промывали водой. Выход 4.66 г (65%).
ЯМР 1H (400 MГц; CDCl3; δ, м.д.): 2.01 (с., 12 H). ЯМР 13С (400 MГц; CDCl3; δ, м.д.): 23 (с.), 108 (с.), 192 (с.).
Синтез 3,3',5,5'-тетраметил-1,1'-бифенил-4,4'-бипиразола (L) [27]. Раствор 1.26 г (ρ = 1.01 г/мл – 1.15 мл) фенилгидразина и 1.15 г диацетилацетона в 11.5 мл этанола кипятили с обратным холодильником в течение 24 ч. При кипячении раствор стал прозрачным и оранжевым. Раствор упаривали досуха, сухой остаток перекристаллизовывали из циклогексана, при охлаждении выпадали бесцветные кристаллы. Полученный осадок промывали 1 мл циклогексана и высушивали. Выход 1.85 г (93%).
ЯМР 1H (400 MГц; CDCl3; δ, м.д.): 2.21 (с., 6 H), 2.21 (с., 6 H), 7.33–7.39 (м, 2 H), 7.45–7.55 (м., 8 H). ЯМР 13С (400 MГц; CDCl3; δ, м.д.): 11 (с.), 12 (с.), 112 (с.), 124 (с.), 127 (с.), 129 (с.), 137 (с.), 139 (с.), 148 (с.).
Синтез [RuL(CH3CN)4]PF6. В пробирку с плотно закручивающейся пробкой помещали 0.165 г (0.48 ммоль) L, 0.0094 г (0.24 ммоль) NaOH и 0.089 г (0.48 ммоль) KPF6, смесь растворяли в 5 мл предварительно аргонированного ацетонитрила при нагревании и пропускании аргона. 0.0735 г (0.12 ммоль) [Ru(p-cymene)Cl2]2 растворяли в 2 мл хлористого метилена и полученный раствор добавляли к реакционной смеси. Образовался темно-красный раствор. Пробирку термостатировали 72 ч при 45°С. Полученный темно-коричневый раствор упаривали досуха и остаток растворяли в метилене. Провели очистку колоночной хроматографией (силикагель, элюент CH2Cl2–CH3CN (10 : 1)). Собрали желтую фракцию. Осадок высаливали гексаном и упаривали досуха. Выход 0.15 г (83% в рассчете на [Ru(p-cymene)2Cl2]2.
Синтез [RuL(Dmdcbp)2]PF6 (I). 0.15 г (0.2 ммоль) [RuL(CH3CN)4]PF6 и 0.109 г (0.4 ммоль) Dmdcbp в смеси 5 мл MeOH и 5 мл CH2Cl2 кипятили при перемешивании в атмосфере аргона в темноте в течение 24 ч. Образовавшийся черный раствор упаривали досуха. Полученное вещество очищали колоночной хроматографией (силикагель, элюент CH2Cl2–CH3CN (85 : 1)). Для хорошего разделения элюирование проводили медленно. Собирали окрашенную фракцию. Далее проводили перекристаллизацию: вещество растворяли в 10 мл смеси метилен–гексан (3 : 2 по объему) и оставляли в холодильнике на 24 ч. Из раствора выпадали черные кристаллы, которые отделяли на стеклянном пористом фильтре, промывали гексаном и высушивали в вакууме. Выход 0.206 г (91%).
ЯМР 1H (400 MГц; CDCl3; δ, м.д.): 1.96 (с., 3 H), 2.18 (м, 6 H), 2.65 (с., 3 H), 4.03 (м., 12 Н), 6.80 (т., J = = 6.85 Гц, 1 H) 7.00 (уш.с., 1 H) 7.37–7.50 (м., 5 H), 7.56–7.60 (м., 1 H), 7.71–7.75 (м., 1 H), 7.75–7.91 (м., 3 H), 7.95–7.99 (м., 1 H), 8.03–8.10 (м., 1 H), 8.26 (д., J = 7.89 Гц, 1 H), 8.28–8.38 (м., 1 H), 8.78 (т., J = 10.12 Гц, 2 H), 8.89–8.97 (м., 2 H). HRMS, m/z: найдено 987.2393, рассчитано для C50H45N8O8Ru+ 987.2412, изотопное распределение пиков совпадает с расчетным.
РСА монокристалла L проведен на дифрактометра Bruker D8 Quest c детектором Photon III (MoKα-излучение, λ = 0.71073 Å, ω-сканирование) при температуре 293(2) К. Структура расшифрована прямыми методами и уточнена полноматричным анизотропным МНК по F 2 с использованием программных пакетов SHELXTL и Olex2 [28–30]. Атомы водорода помещены в рассчитанные позиции и уточнены с использованием модели наездника. Лиганд L кристаллизуется в хиральной пространственной группе, однако абсолютная конфигурация структуры не была определена из-за слабого аномального рассеяния рентгеновских лучей, вызванного отсутствием в структуре тяжелых атомов. Кристаллографические данные, параметры эксперимента и уточнения структуры приведены в табл. 1.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структуры L
| Параметр | Структура |
|---|---|
| Брутто-формула | C22H22N4 |
| M | 342.43 |
| Температура съемки, K | 293(2) |
| Сингония | Моноклинная |
| Пр. группа | P21 |
| a, Å | 10.258(2) |
| b, Å | 7.8910(16) |
| c, Å | 11.334(2) |
| β, град | 99.02(3) |
| V, Å3 | 906.1(3) |
| Z | 2 |
| ρ(выч.), г/см3 | 1.255 |
| μ(MoKα), мм–1 | 0.076 |
| F(000) | 364 |
| θмин–θмакс, град | 2.491–29.999 |
| Всего отражений | 6872 |
| Число независимых отражений (Rint) | 5087 (0.0253) |
| Число отражений с I > 2σ(I) | 4568 |
| Число параметров | 240 |
| R-факторы (по отражениям с I > 2σ(I)) | R1 = 0.0500, wR2 = 0.1118 |
| R-факторы (по всем отражениям) | R1 = 0.0580, wR2 = 0.1151 |
| GOOF | 1.058 |
| Δρmax / Δρmin, e/Å3 | 0.342/–0.336 |
Координаты атомов, длины связей, валентные углы и параметры теплового смещения депонированы в Кембриджском банке структурных данных (CCDC № 2118676; deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk).
Квантово-химические расчеты проводили в программном пакете FireFly [31] с использованием функционала B3LYP. Для атома рутения использовали базис Stuttgart RSC 1997 c псевдопотенциалом. Для всех остальных атомов (C, N, H и О) использовали базисный набор 6-311G(d,p). Эта комбинация базисных наборов и функционала дает хорошую корреляцию с экспериментом [32]. Начальные координаты молекулы лиганда L основаны на его кристаллической структуре, а расположение молекул диметилового эфира дикарбоксибипиридина взяты из структуры комплекса с другим C^N-донорным лигандом [9]. Для оценки длины волны испускания оптимизирована геометрия триплетного состояния, а также рассчитана энергия синглетного состояния в данной геометрии. Затем оптимизирована геометрия синглетного состояния для проведения одноточечного расчета TD-DFT, чтобы получить энергии возбуждения для моделирования спектра поглощения комплекса. Для оптимальных геометрий рассчитаны частоты колебаний, мнимых частот не обнаружено (малые мнимые частоты до −10 см–1, вызванные неточностями в сетке интегрирования, игнорировали). Визуализацию выполнялали с помощью программы ChemCraft v. 1.8.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Кристаллическая структура лиганда представлена на рис. 1. Кристаллы получены охлаждением раствора лиганда в горячем ДМСО, однако они не содержат в своем составе молекул растворителя. Примечательно, что в полученной структуре все ароматические фрагменты лежат в разных плоскостях, а значит, не сопряжены друг с другом. Значения торсионных углов между плоскостями пиразольного фрагмента и фенильного заместителя составляют: N(1)−N(2)−C(6)−C(5) 128.5(2)° и N(4)−N(3)−C(17)−C(18) 142.1(2)°, а между пиразольными фрагментами − С(10)−С(9)−С(12)−С(15) 48.8(4)°. При рассмотрении упаковки молекул в ячейке не обнаруживается каких-либо π-стекинг-взаимодействий.
Схема 1 .
Рис. 1.
Молекулярная структура L. Атомы водорода не показаны, тепловые эллипсоиды представлены с вероятностью 50%.

Синтез комплекса [RuL(Dmdcbp)2]PF6 (I) протекает в две стадии (схема 1 ). На первой стадии проводили циклометаллирование, на второй вводили диметиловый эфир 4,4'-дикарбокси-2,2'-бипиридина (Dmdcbp). В результате первой стадии образуется продукт, который легко окисляется на воздухе, поэтому его использовали во второй стадии без промежуточной характеризации. По данным литературы [5], образуется комплекс с четырьмя молекулами ацетонитрила, поэтому мы предполагаем аналогичный состав.
Полученный на второй стадии синтеза комплекс I моноядерный, т.е. бипиразольный лиганд координирован к металлу только одной своей половиной, что подтверждается количеством и соотношением сигналов в его спектре ЯМР. Cигналы в области 6.5–7.0 м.д. указывают на наличие ковалентной связи рутений–углерод (рис. 2). Наиболее интенсивный сигнал в масс-спектре отвечает катиону [RuL(Dmdcbp)2]+, что подтверждается данными изотопного распределения (рис. 3).
Рис. 3.
HRMS-спектр комплекса I. Во врезке увеличенный фрагмент, отвечающий пику при m/z = 987.23932 и расчeтные данные для катиона [RuL(Dmdcbp)2]+.

Для комплекса I определены молярные коэффициенты поглощения. Полученный спектр разложили на гауссовы составляющие с помощью МНК (рис. 4). Согласно данным расчетов TDDFT (Time-dependent density functional theory, времязависимая теория функционала электронной плотности), электронные переходы в видимой области соответствуют переходам MLCT (metal-to-ligand charge-transfer, перенос заряда с металла на лиганд).
Рис. 4.
Спектр поглощения комплекса I в ацетонитриле с разложением на гауссовы составляющие (а); результаты расчета вертикальных переходов методом TDDFT (б).

Комплекс эффективно поглощает в видимой области – длинноволновая полоса с максимумом поглощения 735 нм, характеризуется достаточно высоким значением экстинкции (ε = 1800 л моль–1 см–1), что превышает значение в данной области для классических красителей N3 и black dye [5].
Спектры ФЛ комплекса I измеряли для разбавленного раствора в ацетонитриле (рис. 5). Из положения полосы испускания оценили энергию возбужденного состояния, она составляет 11 500 см–1.
Рис. 5.
Спектры возбуждения (λвозб = 890 нм) и испускания (λисп = 550 нм) раствора [RuL(Dmdcbp)2]PF6 в CH3CN.

Электронное строение комплекса изучали с помощью метода DFT. Основной вклад в верхние занятые орбитали комплекса (ВЗМО) вносят d‑орбитали металла и π-орбитали С^N‑донорного лиганда (табл. 2). В рассмотренном комплексе симметричный лиганд L, способный выполнять мостиковую функцию, координирован только через один координационный сайт. Интересно, что орбиталь H локализована на лиганде L, а орбитали (H-1, H-2, H-3) на металле (рис. 6). Низколежащие свободные орбитали (НСМО) локализованы на дикарбоксибипиридиновых лигандах с участием d‑орбиталей металла.
Таблица 2.
Некоторые расчетные спектральные характеристики комплекса [RuL(Dmdcbp)2]+: возбужденные состояния, длины волн (λ, нм), силы осцилляторов и отнесение электронных переходов с вкладами соответствующей конфигурации
| Состояние | λ, нм | Сила осциллятора |
Основные вклады от переходов МО | |||
|---|---|---|---|---|---|---|
| S2 | 725 | 0.012 | ВЗМО | → | НСМО + 1 | 73.7% |
| S5 | 553 | 0.13 | ВЗМО-3 | → | НСМО | 13.4% |
| ВЗМО-2 | → | НСМО | 22.9% | |||
| ВЗМО-2 | → | НСМО + 1 | 15.5% | |||
| ВЗМО-1 | → | НСМО | 32.1% | |||
| S6 | 516 | 0.035 | ВЗМО-2 | → | НСМО + 1 | 36.4% |
| ВЗМО-1 | → | НСМО | 11.3% | |||
| ВЗМО-1 | → | НСМО + 1 | 13.0% | |||
| ВЗМО | → | НСМО + 3 | 12.4% | |||
| S8 | 487 | 0.028 | ВЗМО-3 | → | НСМО | 35.6% |
| ВЗМО | → | НСМО + 2 | 39.1% | |||
| S12 | 447 | 0.064 | ВЗМО-3 | → | НСМО + 1 | 33.5% |
| ВЗМО | → | НСМО + 3 | 13.1% | |||
| ВЗМО | → | НСМО + 4 | 22.3% | |||
Для моделирования ЭСП методом TDDFT рассчитаны характеристики 25 возбужденных состояний. На рис. 3 во врезке представлены положения, интенсивности переходов и огибающая при фиксированной ширине линия поглощения отдельных переходов.
Длину волны испускания (λ0-0), оценивали по разности энергии триплетного и синглетного состояния для оптимизированной геометрии в триплетном состоянии (ΔSCF). Рассчитанное значение 930 нм смещено в длинноволновую область относительно эксперимента, что согласуется с данными литературы [33]. ВЗМО триплетного состояния локализована на якорных лигандах, содержащих карбоксильные группы (рис. 7)
Рис. 7.
Изображение ВЗМО основного синглетного и нижнего триплетного состояний комплекса [RuL(Dmdcbp)2]+ по данным DFT расчета.
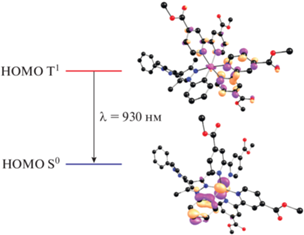
Таким образом можно заключить, что комплекс [RuL(Dmdcbp)2]PF6 соответствует основным требованиям [5], предъявляемым к фотосенсибилизаторам для DSSC: обладает высоким поглощением в видимой области, ВЗМО-орбитали локализованы на донорном лиганде L и металле, а НСМО – на акцепторном якорном лиганде Dmdcbp.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Huang H., Zhang P., Chen H. et al. // Chem. Eur. J. 2015. V. 21. P. 715.
Ono T., Qu S., Gimbert-Surinach C. et al. // ACS Catal. 2017. V. 7. P. 5932.
Yuan Y.J., Yu Z.T., Chen D.Q. //Chem. Soc. Rev. 2017. V. 46. P. 603.
Tseng H., Zong R., Muckerman J.T., Thummel R. // I-norg. Chem. 2008. V. 47. P. 11763.
Aghazada S., Nazeeruddin M.K. // Inorganics. 2018. V. 6. P. 52.
Mauri L., Colombo A., Dragonetti C. et al. // Molecules. 2021. V. 26. P. 7638.
Zakeeruddin S., Nazeeruddin M., Humphry-Baker R., Grätzel M. // Inorg. Chim. Acta. 1999. V. 296. P. 250.
Bomben P.G. Cycloruthenated Chromophores for the Dye-Sensitized Solar Cells. Calgary, 2012.
Lavrova M.A., Mishurinskiy S.A., Smirnov D.E. et al. // Dalton Trans. 2020. V. 49. P. 16935.
Korvorapun K., Moselage M., Struwe J. et al. // Angew. Chem. Int. Ed. 2020. V. 59. P. 18795.
Nakahara Y., Toda T., Matsunami A. et al. // Chem. Asian J. 2018. V. 13. P. 73.
Toda T., Saitoh K., Yoshinari A. et al. // Organometallics. 2017. V. 36. P. 1188.
Novohradsky V., Yellol J., Stuchlikova O. et al. // Chem. Eur. J. 2017. V. 23. P. 15294.
Grigg R., Kilner C., Senthilnanthanan M. et al. // Arkivoc. 2007. V. 2007. P. 145.
Alharis R.A., McMullin C.L., Davies D.L. et al. // Faraday Discuss. 2019. V. 220. P. 386.
Ballester F.J., Ortega E., Porto V. et al. // Chem. Commun. 2019. V. 55. P. 1140.
Kamatchi T.S., Kalaivani P., Fronczek F.R. et al. // RSC Adv. 2016. V. 6. P. 46531.
Boutadla Y., Davies D.L., Jones R., Singh K. // Chem. Eur. J. 2011. V. 17. P. 3438.
Toda T., Suzuki S., Kuwata S. // Chem. Commun. 2019. V. 55. P. 1028.
Reddy C.S., Kumar G.R., Devi M.V., Nagaraj A. // Acta Chim. Slov. 2011. V. 58. P. 576.
Svistunova I.V., Shapkin N.P., Nikolaeva O.V., Apa-nasenko O.A. //Russ. J. Gen. Chem. 2011. V. 81. P. 756.
Chambers D., Denny W.A., Buckleton J.S., Clark G.R. // J. Org. Chem. 1985. V. 50. P. 4736.
Texier-Boullet F., Klein B., Hamelim J. // Synthesis. 1986. V. 1986. P. 409.
Mosby W.L. // J. Chem. Soc. 1957. P. 3997.
Anon I. // Bulletin de la Societe Chimique de France. 1975. P. 1371.
Ponomarova V.V., Komarchuk V.V., Boldog I. et al. // CrystEngComm. 2013. V. 15. P. 8280.
Imai Y., Nakajima T., Ueda M. // J. Polym. Sci. 1981. V. 19. P. 1421.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Sheldrick G.M. // Acta Crystallogr. A. 2015. V. 71. P. 3.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Ap-pl. Crystallogr. 2009. V. 42. P. 339.
Alex A. Granovsky, Firefly version 8. http://classic.chem.msu.su/gran/firefly/index.html
Derrat H.S., Robertson C.C., Meijer A.J.H.M., Thomas J.A. // Dalton Trans. 2018. V. 47. P. 12300.
Soupart A., Dixon I.M., Alary F., Heully J.L. // Theor. Chem. Acc. 2018. P. 137.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия