Координационная химия, 2022, T. 48, № 6, стр. 323-333
Синтез и структура псевдомакроциклических комплексных катионов бис(дианилинглиоксимато)кобальта(III)
Д. Уреке 1, И. Булхак 1, С. Шова 1, П. Боурош 1, 2, *
1 Институт химии
Кишинев, Республикa Молдова
2 Институт прикладной физики
Кишинев, Республикa Молдова
* E-mail: pavlina.bourosh@ifa.md
Поступила в редакцию 24.11.2021
После доработки 21.12.2021
Принята к публикации 22.12.2021
- EDN: PDUNNC
- DOI: 10.31857/S0132344X2206007X
Аннотация
На основе хлорида кобальта(ІІ) шестиводного, дианилинглиоксима (DAnH2) и разных пиридил-лигандов (L) получены четыре координационных соединения, одно из них в двух полиморфных формах, с формулами [Co(DAnH)2(L1)2]Cl ∙ 2Dmf (I), [Co(DAnH)2(L2)2]Cl ∙ H2O (II), [Co(DAnH)2(L3)2]Cl (III и IV) и [Co(DAnH)2(L4)2]Cl (V) (L1 и L2 – 3- и 4-метилпиридин cоответственно, L3 – этиловый эфир никотиновой кислоты и L4 – N,N-диэтилникотинамид). Реакция проходила при окислении кислородом воздуха метанольного раствора содержащего СоCl2 : DAnH2 : L в молярном соотношении 1 : 2 : 2. Состав и структура этих соединений определены методами элементного анализа, ИК-спектроскопии и РСА (CIF files CCDC № 2122240–2122244 соответственно). Соединения I–V ионные и образованы центросимметричными комплексными катионами [Co(DAnH)2(L)2]+ и анионами Сl–. Моноядерные комплексные катионы с координационным узлом CoN6 имеют октаэдрическое строение. Два монодепротонированных лиганда DAnH– координируются к иону металла по бидентатно-хелатному типу и связаны между собой двумя водородными связями О–Н∙∙∙О, а дополняют координационный полиэдр центрального атома два лиганда L. Компоненты в кристаллах объединены в основном межмолекулярными водородными связями.
Начало исследований диоксиматов переходных металлов связанo с первыми работами Л.А. Чугаева [1, 2]. Показано, что комплексные соединения с различными диоксимами и диоксиматами можно использовать как в неорганической, органической и аналитической химии, так и в био-, медицинской и промышленной химии [3–10]. В последние десятилетия велись исследования, связанные с использованием этих соединений для получения водорода из воды с помощью видимого света [11], при этом первоначально на основе электрокаталитического метода [12, 13], а потом и фотохимическим способом [14, 15]. Подавляющее большинство исследований связаны с симметричными диоксиминами/диоксиматами [3], хотя есть работы, посвященные асимметричным диоксиминам [16–18]. В последнее время большое внимание уделяется полиядерным комплексам металлов не только благодаря их роли в определенных биологических системах, а также потенциального использования в качестве многоэлектронных окислительно-восстановительных катализаторов [19]. Хотя в основном биядерные и триядерные комплексы с этими лигандами получены способом координации через оксимный атом кислорода [20–22]. При этом получить полиядерные комплексы на основе диоксимов можно с использованием дополнительных мостиковых лигандов [23–27], а также модифицированием диоксимов, конденсируя их с различными органическими молекулами, содержащими дополнительные донорные центры [28, 29].
Исключительная стабильность и уникальные электронные свойства бис-диоксиматов можно объяснить их структурой, которая стабилизируется внутримолекулярными водородными связями, приводящими к образованию псевдомакроциклов [30–32].
Ранее мы получили комплексы Ni(II), Zn(II) Mn(II) [27, 28] с дианилинглиоксимом. В настоящей работе представлены результаты исследования взаимодействия солей кобальта с этим модифицированным диоксимом и различными дополнительными органическими лигандами на основе производных пиридина. При этом в качестве дополнительных лигандов использованы такие производные пиридина, как 3-,4-метилпиридин (L1, L2 cоответственно), этиловый эфир никотиновой кислоты (L3) и N,N-диэтилникотинамид (L4), которые привели к образованию четырех соединений, одно их которых – в виде двух полиморфов, кристаллизованных в пространственных группах различных сингоний: [Co(DAnH)2(L1)2]Cl ∙ 2Dmf (I), [Co(DAnH)2(L2)2]Cl ∙ H2O (II), [Co(DAnH)2(L3)2]Cl (III и IV) и [Co(DAnH)2(L4)2]Cl (V).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза использовали коммерческие реактивы и растворители марки “x. ч.” без дополнительной очистки. Дианилинглиоксим получали конденсацией дихлорглиоксима с анилином по методике [33].
Синтез [Co(DAnH)2(L1)2]Cl · 2Dmf (I). Дианилинглиоксим массой 0.54 г (0.2 моль) растворяли в 20 мл Dmf (раствор 1). Гексагидрат хлорида кобальта(II) массой 0.24 г (0.1 моль) растворяли в 20 мл метанола (раствор 2). При постоянном перемешивании оба раствора смешивали, в результате реакционная смесь приобретала красный цвет. Через 10 мин добавляли 0.2 мл (0.2 моль) γ-пиколина, при этом цвет реакционной смеси менялся на темно-коричневый. Затем в течение 2 ч через раствор пропускали воздух для окисления кобальта. Раствор отфильтровывали и оставляли при комнатной температуре для кристаллизации. Через 20 сут в растворе образовывались темно-коричневые кубические кристаллы, пригодные для РСА. Выход 0.41 г (~43%).
| Найдено, %: | C 57.20; | H 5.66; | N 17.43; | Co 6.09. |
| Для C46H54N12O6ClCo | ||||
| вычислено, %: | C 57.23; | H 5.64; | N 17.41; | Co 6.10. |
ИК-спектр (ν, см–1): 3391 с.ш, 3226 с, 3198 с, 3147 с, 3095 с, 3020 ср, 2956 ср, 2936 пл, 1654 о.с, 1608 пл, 1595 пл, 1572 о.с, 1522 ср, 1494 с, 1455 пл, 1445 ср, 1418 ср, 1390 с, 1355 о.сл, 1316 ср, 1291 о.сл, 1248 с, 1227 с, 1178 сл, 1156 о.сл, 1103 с, 1084 ср, 1059 с, 1029 пл, 1001 сл, 979 о.сл, 950 сл, 915 ср, 892 о.сл, 883 о.сл, 853 о.сл, 842 о.сл, 825 сл, 803 ср, 747 с, 698 сл, 686 ср, 662 ср, 620 ср, 535 ср, 489 ср, 419 сл.
Синтез [Co(DAnH)2(L2)2]Cl · H2O (II) выполняли по методике, аналогичной для I, с использованием β-пиколина вместо γ-пиколина. Через 16 сут образовывались темно-коричневые кристаллы кубической формы, пригодные для РСА. Выход 0.38 г (~45%).
| Найдено, %: | C 56.75; | H 5.17; | N 16.57; | Co 6.95. |
| Для C40H42N10O5ClCo | ||||
| вычислено, %: | C 57.38; | H 5.06; | N 16.73; | Co 7.04. |
ИК-спектр (ν, см–1): 3360 c, 3220 c, s, 3143 cл, 3083 с, 2996 с, 2952 ср, 1657 пл, 1639 с, 1617 оч.с, 1570 оч.с, 1508 ср, 1494 оч.с, 1441 с, 1380 ср, 1345 сл, 1310 ср, 1244 с, 1229 ср, 1214 с, 1081 пл, 1066 с, 1033 с, 1001 ср, 973 оч.сл, 953 оч.сл, 936 оч.сл, 916 сл, 887 оч.сл, 812 с, 787 пл, 749 с, 720 сл, 691 с, 511−500 сл.шир.
Синтез [Co(DAnH)2(L3)2]Cl (III) выполняли по методике, аналогичной для I, с использованием этилового эфира никотиновой кислоты вместо γ‑пиколина и без использования Dmf. Через 12 cут образовывались темно-коричневые кристаллы кубической формы, пригодные для РСА. Выход 0.43 г (~46%).
| Найдено, %: | C 56.47; | H 4.81; | N 14.91; | Co 6.28. |
| Для C44H44N10O8ClCo | ||||
| вычислено, %: | C 56.50; | H 4.74; | N 14.98; | Co 6.30. |
ИК-спектр (ν, см–1): 3242 ср, 3200 ср, 3147 ср, 3090 с, 3008 с, 2960 ср, 1716 с, 1613 пл, 1571 о.с, 1526 с, 1492 о.с, 1445 с, 1391 сл, 1367 ср, 1337 ср, 1313 пл, 1287 о.с, 1246 пл, 1227 с, 1175 ср, 1133 ср, 1119 ср, 1083 ср, 1059 с, 1010 ср, 949 ср, 918 ср, 891 ср, 858 ср, 824 сл, 804 сл, 791 сл, 742 о.с, 708 сл, 686 с, 660 сл, 625 ср, 581сл, 569 сл, 538 ср, 490 с, 427 о.сл.
Синтез [Co(DAnH)2(L3)2]Cl (IV) выполняли по методике, аналогичной для III, используя тригидрат тиоцианата кобальта(II) вместо хлорида кобальта(II). При перемешивании смеси образовывался коричневый осадок, который исчезал при добавлении 3 капель HCl (конц.). Полученный раствор отфильтровывали и медленно испаряли на воздухе. Через 13 cут образовывались темно-коричневые кристаллы кубической формы, пригодные для РСА. Выход 0.38 г (~41%).
| Найдено, %: | C 56.58; | H 4.83; | N 14.99; | Co 6.31. |
| Для C44H44N10O8ClCo | ||||
| вычислено, %: | C 56.50; | H 4.74; | N 14.98; | Co 6.30. |
ИК-спектр (ν, см–1): 3241 ср, 3200 ср, 3146 ср, 3090 ср, 3007 ср, 2962 ср, 1717 оч.с, 1614 ср, 1574 о.с, 1528 с, 1492 с, 1445 ср, 1392 сл, 1367 ср, 1337 сл, 1326 о.сл, 1285 очс, 1247 ср, 1227 ср, 1195 сл, 1174 ср, 1132 ср, 1116 ср, 1086 ср, 1059 ср, 1042 ср, 1025 ср, 1010 ср, 950 ср, 918 ср, 891 ср, 882 о.сл, 856 ср, 838 о.сл, 824 сл, 804 сл, 790 сл, 741 о.с, 686 ср, 659 сл, 625 ср, 581 сл, 536 ср, 514 сл, 490 ср, 441 о.сл, 427 о.сл, 415 о.сл.
Синтез [Co(DAnH)2(L4)2]Cl (V) выполняли по методике, аналогичной для III, с использованием N,N-диэтилникотинамида (никетамида) вместо этилового эфира никотиновой кислоты. Через 10 сут образовывались темно-коричневые кристаллы кубической формы, пригодные для РСА. Выход 0.44 г (~44%).
| Найдено, %: | C 58.29; | H 5.61; | N 16.95; | Co 5.97. |
| Для C48H54N12O6ClCo | ||||
| вычислено, %: | C 58.27; | H 5.50; | N 16.99; | Co 5.96. |
ИК-спектр (ν, см–1): 3412 ср.ш, 3230 ср, 3190 ср, 3134 ср, 3086 ср, 3059 сл, 2987 с, 2948 ср, 1634 о.с, 1609 о.с, 1591 о.с, 1571 о.с, 1523 ср, 1491 с, 1471 с, 1454 пл, 1439 о.с, 1430 ср,1383 ср, 1363 ср, 1347 ср, 1314 ср, 1291 ср, 1240 ср, 1220 ср, 1203 пл, 1189 пл, 1174 пл, 1109 ср, 1081 ср, 1058 ср, 1041 ср, 1031 ср, 983 о.сл, 959 сл, 940 пл, 932 сл, 913 сл, 877 ср, 823 ср, 786 сл, 762 сл, 753 с, 728 ср, 710 ср, 693 с, 659 сл, 618 сл, 598 сл, 577 сл, 562 сл, 526 ср, 487 ср.
Состав соединений I–V устанавливали на основе элементного анализа и ИК-спектроскопии, строение – на основе РСА на монокристаллах. ИК-спектры снимали на FT-IR Perkin-Elmer Spectrum 100 в вазелиновом масле в области 4000–400 см–1 и ATР в области 4000–650 cм–1.
РСА. Экспериментальные данные получены при низкой температуре для I и II, для остальных – при комнатной температуре на дифрактометрах Xcalibur Е (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор и ω сканирование). Параметры элементарных ячеек уточнены c учетом полным массивом экспериментальных данных. Кристаллические структуры решены прямыми методами и уточнены МНК в анизотропном полноматричном варианте для неводородных атомов (SHELX-97) [34]. Соединение II кристаллизуется в виде двублочного немероэдрического двойника, компоненты которого были определены в процессе интегрирования данных по программе CrysAlis и уточнены используя процедуру HKLF 5 в программе SHELXL. Позиции атомов водорода частично рассчитаны геометрически, частично определены их Фурье-синтезы и уточнены изотропно в модели “жесткого тела”. Кристаллографические данные и характеристики эксперимента для I–V приведены в табл. 1, межатомные расстояния и валентные углы в координационных полиэдрах – в табл. 2 , геометрические параметры водородных связей (ВС) – в табл. 3.
Таблица 1.
Кристаллографические данные, характеристики эксперимента и параметры уточнения структуры I–V
| Параметры | Значение | ||||
|---|---|---|---|---|---|
| I | II | III | IV | V | |
| Эмпирическая формула | C46H54N12O6ClCo | C40H42N10O5ClCo | C44H44N10O8ClCo | C44H44N10O8ClCo | C48H54N12O6ClCo |
| М | 965.39 | 837.21 | 935.27 | 935.27 | 989.41 |
| Температура, К | 160.2(5) | 160.0(1) | 293(2) | 293(2) | 293(2) |
| Сингония | Триклинная | Mоноклинная | Mоноклинная | Тригональная | Mоноклинная |
| Пр. группа | $P\bar {1}$ | P2/c | I2/c | $R\bar {3}$ | P2/n |
| a, Å | 9.2438(13) | 11.9552(8) | 13.0432(6) | 23.2162(12) | 9.0962(5) |
| b, Å | 10.9459(15) | 9.1175(5) | 16.0285(8) | 23.2162(12) | 12.6758(9) |
| c, Å | 12.2358(17) | 18.9469(14) | 22.7795(12) | 21.2789(12) | 20.5932(14) |
| α, град | 95.622(11) | 90 | 90 | 90 | 90 |
| β, град | 105.473(12) | 105.503(8) | 102.944(5) | 90 | 91.417(5) |
| γ, град | 102.045(12) | 90 | 90 | 120 | 90 |
| V, Å3 | 1151.3(3) | 1990.1(2) | 4641.4(4) | 9932.6(12) | 2373.7(3) |
| Z | 1 | 2 | 4 | 9 | 2 |
| ρ(выч.), г/см3 | 1.392 | 1.397 | 1.338 | 1.407 | 1.384 |
| μ, мм–1 | 0.493 | 0.556 | 0.489 | 0.514 | 0.481 |
| F(000) | 506 | 872 | 1944 | 4374 | 1036 |
| Размеры кристалла, мм | 0.25 × 0.22 × 0.08 | 0.20 × 0.12 × 0.05 | 0.20 × 0.17 × 0.08 | 0.26 × 0.22 × 0.10 | 0.50 × 0.08 × 0.05 |
| Область θ, град | 1.75–25.50 | 2.23–25.03 | 2.98–25.05 | 2.87–25.24 | 3.34–25.24 |
| Интервалы индексов отражений | –11 ≤ h ≤ 19, –13 ≤ k ≤ 13, –13 ≤ l ≤ 14 |
–14 ≤ h ≤ 14, –10 ≤ k ≤ 10, –21 ≤ l ≤ 22 |
–11 ≤ h ≤ 15, –18 ≤ k ≤ 19, –27 ≤ l ≤ 24 |
–18 ≤ h ≤ 27, –24 ≤ k ≤ 23, –16 ≤ l ≤ 25 |
–7 ≤ h ≤ 10, –15 ≤ k ≤ 9, –24 ≤ l ≤ 44 |
| Число измеренных/независимых рефлексов (Rint) | 9967/4283 (0.0408) | 3443/3443 | 8067/4081(0.0622) | 6835/3995(0.0551) | 8569/4266(0.0415) |
| Число рефлексов с I > 2σ(I) | 3634 | 2510 | 2194 | 2034 | 2824 |
| Заполнение, % | 100.0 (θ = 25.24°) | 98.7 (θ = 25.03°) | 99.5 (θ = 25.05°) | 99.6 (θ = 25.24°) | 99.3 (θ = 25.05°) |
| Число уточняемых параметров | 290 | 262 | 292 | 289 | 312 |
| GOOF | 1.005 | 1.001 | 1.002 | 1.001 | 1.005 |
| R факторы (I > 2σ(I)) |
R1 = 0.0533, wR2 = 0.1344 |
R1 = 0.0536, wR2 = 0.1135 |
R1 = 0.0704, wR2 = 0.1147 |
R1 = 0.0745, wR2 = 0.1149 |
R1 = 0.0566, wR2 = 0.1108 |
| R факторы (по всему массиву) | R1 = 0.0635, wR2 = 0.1443 |
R1 = 0.0849, wR2 = 0.1274 |
R1 = 0.1440, wR2 = 0.1370 |
R1 = 0.1544, wR2 = 0.1393 |
R1 = 0.0962, wR2 = 0.1286 |
| Δρmax /Δρmin, e Å–3 | 0.625/–0.479 | 0.520/–0.560 | 0.459/–0.311 | 0.561/–0.396 | 0.508/–0.322 |
Таблица 2.
Межатомные расстояния (d) и валентные углы (ω) в координационных полиэдрах структуры I–V*
| Связь | d, Å | ||||
|---|---|---|---|---|---|
| I | II | III | IV | V | |
| Co(1)–N(1) | 1.895(2) | 1.905(3) | 1.895(3) | 1.894(3) | 1.893(2) |
| Co(1)–N(2) | 1.909(2) | 1.892(3) | 1.896(3) | 1.901(3) | 1.902(2) |
| Co(1)–N(5) | 1.967(2) | 1.967(3) | 1.961(3) | 1.977(4) | 1.972(3) |
| Угол | ω, град | ||||
| I | II | III | IV | V | |
| N(1)Co(1)N(2) | 81.52(9) | 81.7(1) | 81.5(1) | 81.8(2) | 81.38(10) |
| N(1)Co(1)N(5) | 91.25(9) | 89.6(1) | 89.3(1) | 90.6(1) | 90.41(11) |
| N(1)Co(1)N(2)#1 | 98.48(9) | 98.3(1) | 98.5(1) | 98.2(2) | 98.62(10) |
| N(1)Co(1)N(5)#1 | 88.75(9) | 90.4(1) | 90.7(2) | 89.4(2) | 89.59(11) |
| N(2)Co(1)N(5) | 91.06(9) | 89.7(1) | 90.1(1) | 90.4(2) | 89.57(11) |
| N(2)Co(1)N(5)#1 | 88.94(9) | 90.3(1) | 89.9(1) | 89.6(2) | 90.43(11) |
Таблица 3.
Геометрические параметры внутри- и межмолекулярых водородных связей в структуре I–V
| Контакт D–H⋅⋅⋅A | Расстояние, Å | Угол DHA, град | Координаты атомов А | ||
|---|---|---|---|---|---|
| (D–H) | (H···A) | (D···A) | |||
| I | |||||
| N(3)–H···Cl(1) | 0.88 | 2.62 | 3.112(2) | 117 | x, y, z |
| N(4)–H···Cl(1) | 0.88 | 2.38 | 3.157(2) | 147 | x, y, z |
| O(1)–H···O(2) | 0.84 | 1.71 | 2.521(3) | 160 | –x + 1, –y + 1, –z + 1 |
| C(3)–H···O(2) | 0.95 | 2.55 | 3.224(3) | 128 | –x + 1, –y + 1, –z + 1 |
| C(7)–H···O(2) | 0.95 | 2.52 | 3.257(3) | 135 | x, y, z |
| C(26)–H···N(2) | 0.95 | 2.68 | 3.200(3) | 115 | x, y, z |
| C(2D)–H(2)···Cl(1) | 0.98 | 2.91 | 3.818(4) | 154 | x, y + 1, z |
| C(2D)–H···O(1) | 0.98 | 2.50 | 3.351(5) | 145 | –x + 1, –y + 1, –z + 1 |
| C(5D)–H···Cl(1) | 0.98 | 2.84 | 3.569(8) | 132 | x, y + 1, z |
| II | |||||
| N(3)–H···Cl(1) | 0.88 | 2.43 | 3.241(4) | 153 | x, y, z |
| N(4)–H···Cl(1) | 0.88 | 2.34 | 3.205(3) | 170 | x, y, z |
| C(3)–H···O(1) | 0.95 | 2.54 | 3.218(5) | 129 | x, y, z |
| C(3)–H···O(2) | 0.95 | 2.57 | 3.277(5) | 132 | –x + 1, –y + 1, –z + 1 |
| C(7)–H···O(2) | 0.95 | 2.52 | 3.222(5) | 130 | x, y, z |
| O(1w)–H(1)···O(1) | 0.87 | 2.35 | 3.033(3) | 136 | x, y, z |
| III | |||||
| N(3)–H···Cl(1) | 0.86 | 2.36 | 3.212(4) | 174 | x, y, z |
| N(4)–H···Cl(1) | 0.86 | 2.33 | 3.179(4) | 168 | x, y, z |
| O(1)–H···O(2) | 1.05 | 1.47 | 2.498(4) | 166 | –x + 1, –y + 1, –z + 1 |
| C(3)–H···O(2) | 0.93 | 2.49 | 3.187(5) | 132 | –x + 1, –y + 1, –z + 1 |
| C(7)–H···O(1) | 0.93 | 2.57 | 3.259(6) | 131 | –x + 1, –y + 1, –z + 1 |
| IV | |||||
| N(3)–H···Cl(1) | 0.67 | 2.62 | 3.213(4) | 149 | x, y, z |
| N(4)–H···Cl(1) | 0.87 | 2.66 | 3.267(4) | 128 | x, y, z |
| O(1)–H···O(2) | 1.13 | 1.38 | 2.490(4) | 166 | –x + 5/3, –y + 4/3, –z + 4/3 |
| C(3)–H···O(2) | 0.93 | 2.54 | 3.217(6) | 130 | –x + 5/3, –y + 4/3, –z + 4/3 |
| C(7)–H···O(1) | 0.93 | 2.59 | 3.231(6) | 127 | –x + 5/3, –y + 4/3, –z + 4/3 |
| C(7)–H···O(2) | 0.93 | 2.58 | 3.297(6) | 134 | x, y, z |
| C(10)–H···Cl(3) | 0.96 | 2.94 | 3.815(11) | 152 | x, y, z |
| C(10)–H···Cl(4) | 0.96 | 2.86 | 3.745(9) | 155 | x, y, z |
| C(22)–H···Cl(4) | 0.93 | 2.93 | 3.69(7) | 141 | x – 2/3, y – 1/3, –z + 1/3 |
| V | |||||
| N(3)–H···Cl(1) | 0.86 | 2.44 | 3.286(3) | 170 | x, y, z |
| N(4)–H···Cl(1) | 0.86 | 2.24 | 3.100(3) | 173 | x, y, z |
| O(1)–H···O(2) | 0.85 | 1.65 | 2.481(3) | 164 | –x + 2, –y, –z + 1 |
| C(3)–H···O(2) | 0.93 | 2.44 | 3.183(4) | 137 | –x + 2, –y, –z + 1 |
| C(7)–H···O(2) | 0.93 | 2.48 | 3.230(4) | 137 | x, y, z |
| C(10)–H···O(1) | 0.96 | 2.64 | 3.254(4) | 122 | –x + 5/2, y – 1/2, –z + 1/2 |
Позиционные и тепловые параметры для I–V депонированы в Кембриджском банке структурных данных (CCDC № 2122240–2122244 соответственно; deposit@ccdc.cam.ac.uk, http://www.ccdc.cam.ac.uk).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
При взаимодействии солей кобальта(II) с дианилинглиоксимом и различными дополнительными производными пиридина в воздушной среде получены четыре новых соединения, одно из которых – в виде двух полиморфов, кристаллизованных в пространственных группах различных сингоний. В результате определена кристаллическая структура для пяти соединений: [Co(DAnH)2(L1)2]Cl ∙ 2Dmf (I), [Co(DAnH)2(L2)2]Cl ∙ H2O (II), [Co(DAnH)2(L3)2]Cl (III и IV) и [Co(DAnH)2(L4)2]Cl (V). Все полученные соединения ионные, образованные в основном комплексными катионами [Co(DAnH)2L2]+ и анионами Cl–, при этом только в I и II обнаружены кристаллизационные молекулы.
В ИК-спектрах рассматриваемых соединений много общих полос поглощения, так как все описанные вещества содержат близкий по составу и структуре комплексный катион [Co(DAnH)2L2]+ (L = 3-,4-метилпиридин, этиловый эфир никотиновой кислоты или N,N-диэтилникотинамид). Координационные полиэдры Co(III) во всех соединениях имеют октаэдрическое строение, и отличия контура спектров связаны в основном с природой аксиальных лигандов, а также присутствием в их составах кристаллизационных молекул диметилформамида (I) или воды (II). В области 3400–2700 см–1 проявляется общая группа полос поглощения (~3242, ~3200, ~3146, ~3090, ~3008 и ~2960 см–1), которые относятся к разным типам валентныx колебаний С–Н (ароматических колец, метильных и этильных групп), к валентным колебаниям ν(NH) диоксима, а также к возможным обертонам некоторых колебаний. В спектрах этих соединений проявляется одна из самых интенсивных полос поглощения спектра, широкая сложная полоса в интервале 1615–1550 см–1, наблюдаемая в спектре дианилинглиоксима при 1595 см–1, содержащая и колебания δ(NH). Компоненты этой сложной полосы хорошо разделяются в спектре комплекса V при 1609, 1591 и 1571 см–1. Отдельная полоса при 1634 см–1 относится к ν(C=N) оксимных лигандов [35]. Полосы при 1609 и 1591 см–1 можно отнести к колебаниям ароматического кольца [35, 36], а полосу при 1571 см–1 – к колебаниям δ(NH) [36]. Колебаниям δпл(C–H) бензольных колец 1-замещенных (пять смежных незамещенных атомов) проявляются тремя полосами в интервалах 1181–1174, 1103–1089 и 1084–1001 см–1, а колебания δнепл(С–Н) – в виде двух очень интенсивных полос поглощения в интервалах 753–742 и 693–686 см–1 [37]. Полосы в интервалах 538–511 и 487–419 см–1 можно отнести к колебаниям ν(Co–N) [7].
Спектр комплекса I отличается от спектров остальных соединений, так как I содержит как 4‑метилпиридин (γ-пиколин) в качестве координированного лиганда по аксиальной координате в координационном полиэдре металла, так и кристаллизационные молекулы диметилформамида. В результате в спектре I наблюдаются сильная полоса при 1654 см–1, обусловленная колебаниями ν(С=О) и полосы поглощения при 2960, 1455 и 1390 см–1, соответствующие νаs(СН3), δаs(СН3) и δs(СН3) соответственно [37]. В спектре I наблюдается полоса поглощения при 1418 см–1, которая соответствует колебаниям δs(N–CH3) и отличается от колебаний CH3-группы, связаной с другими атомами (C, O, P, S) [35]. Также присутствует полоса поглощения при 803 см–1, характерная колебаниям δнепл(С–Н) для 4-замещенных производных пиридина (2 смежных незамещенных атома водорода) [37]. Полоса поглощения при 1316 см–1 относится к колебаниям ν(С–N) в амидах [38]. Следует отметить тот факт, что при тщательном промыванием метанолом комплекса I после синтеза и его высушиванием при температуре 60°С, полосы, характерные для диметилформамида, не наблюдаются.
Соединение II содержит в своем составе, помимо дианилинглиоксим-3-метилпиридина (β‑пиколин), кристаллизационные молекулы воды, поэтому в ИК-спектре проявляются полосы поглощения при 3360 и 1617 см–1, обусловленные колебаниями ν(ОН) и δ(ОН) соответственно, а также полосы при 2952, 1465 и 1380 см–1, характерные колебаниям νаs(СН3), δаs(СН3) и δs(СН3) в 3-метилпиридине соответственно. В спектре проявляются также сильные полосы поглощения при 812 и 749 см–1, относящиеся к колебаниям δнепл(СН) для ароматического кольца в 3-замещеных производных пиридина: для изолированного незамещенного атома водорода и для трех смежных незамещенных атомов водорода соответственно [35].
Соединения III и IV имеют одинаковую молекулярную структуру, поэтому и ИК-спектры практически идентичны. Колебания ν(С=О) этилового эфира никотиновой кислоты проявляется в виде сильной полосы при 1716 см–1, а ν(С–О–С) – в виде еще более силной полосы при 1287 см–1 и полосы при 1119 см–1 [35, 37]. Колебания δнепл(С–Н) гетероциклического кольца проявляются при 891 см–1 для одиночного атома водорода и при 804 см–1 для трех смежных незамещенных атомов водорода.
Соединение V содержит в своем составе N,N-диэтилникотинамид, который проявляется в ИК-спектре характерными полосами поглощения (см–1): 1634 ν(С=О), 1471 δas(СН3), 1383 δs(СН3), 1314 ν(С–N) [36]. Наблюдаются также полосы поглощения при 877 и 823 см–1, характерные колебаниям δas(С–Н) для трех смежных незамещенных атомов водорода и для изолированного незамещенного атома водорода соответственно [37].
Соединение I кристаллизуется в пространственной группе $P\bar {1}$ триклинной сингонии, соединения II, III и V – в пространственных группах моноклинной сингонии, а IV – в $R\bar {3}$ (табл. 1). Координационный полиэдр атома кобальта во всех центросимметричных комплексных катионах I–V представляет собой октаэдр, образованный донорными атомами N6: четыре атома азота принадлежат двум копланарным бидентатным диоксимат-моноанионам, расположенным в экваториальной плоскости, а два – производным пиридина, находящимся в транс-аксиальных позициях (рис. 1a–1д). Копланарное расположение центральных фрагментов хелатных лигандов и металлического центра поддерживается парой сильных внутримолекулярных водородных связей (ВС) O(1)–H···O(2) (табл. 3). В результате, вокруг металла образуются псевдомакроциклы из 14 атомов с четырьмя чередующимися пятичленными хелатными и шестичленными циклами, стабилизированными Н-связями. Межатомные расстояния в координационных полиэдрах металла Co–Noxime 1.892(4)–1.909(9), Co–Npy 1.958(3)–1.973(3) Å (табл. 2) согласуются с данными для структур подобных соединений [39–48]. Структура комплексного катиона чаще стабилизирована дополнительно слабыми внутримолекулярными ВС С–H···O, в которых как донор задействованы атомы С(3) или С(7) пиридиновых фрагментов, а как акцепторы О(1) или О(2) оксимных (табл. 3). В I можно отметить слабую внутримолекулярную ВС С–H···O между фенильными кольцами и оксимными атомами килорода. При этом ароматические фрагменты объемных диоксиматных лигандов имеют различное расположение друг относительно друга: если в II, IV и V угол между соответствующими плоскостями равны 62.3°, 70.9° и 63.1°, то в I и III значения этих углов – 101.8° и 128.1° соответственно.
Рис. 1.
Строение комплексных катионов в I–V с нотацией кристаллографически независимых атомов (a–д).

В I–V комплексные катионы и анионы объединены ВС N–H···Cl, образованными донорными NH-группами органических лигандов с внешними хлорид-анионами, при этом если в структурах I–III и V можно выделить цепочки из чередующихся компонентов, то в IV – слои (рис. 2–6). Поскольку координированные лиганды в I–V не так богаты функциональными группами, способными образовывать сильные межмолекулярные ВС, в этих кристаллах, кроме N–H···Cl, были обнаружены лишь различные слабые взаимодействия. В II цепочки объединены в слои слабыми π···π-взаимодействиями между параллельными ароматическими кольцами соседних комплексных катионов (расстояния центроид···центроид равны 3.910 Å) (рис. 3), а в III слабые π···π-взаимодействиями стабилизируют цепочки (расстояния центроид···центроид равны 4.325 Å, а угол между плоскостями соответствующих ароматических колец равен 6.1°). При этом в IV комплексные катионы и анионы дополнительно объединены слабыми ВС C–H···Cl (табл. 3), а C–H···O между комплексными катионами в V объединяют цепочки из чередующихся катионов и анионов в слой (рис. 6). Упаковка компонентов в I выявила для молекул Dmf те же слабые ВС C–H···O и C–H···Cl, а в II внешнесферные молекулы воды объединены с основными компонентами ВС О(w)–H···O.
Рис. 2.
Фрагмент кристаллической структуры I с цепочками из чередующихся комплексных катионов Co(III) и хлорид-анионов и связанными с ними молекулами Dmf.
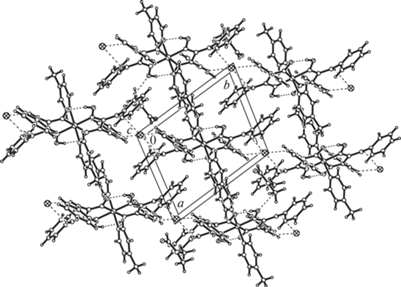
Рис. 3.
Объединение в слой цепочек из чередующихся комплексных катионов Co(III) и анионов в II и раcположенные в пустотах кристаллизационные молекулы воды.

Рис. 4.
Формирование цепочек из чередующихся комплексных катионов и анионов хлорида в III, стабилизированных слабыми π···π-взаимодействиями.
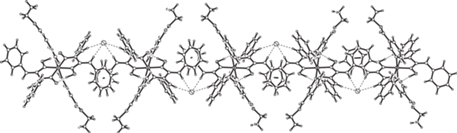
Рис. 6.
Формирование слоя из цепочек с чередующимися комплексными катионами Co(III) и анионами хлорида в V.

В кристаллах компоненты хорошо упакованы, при этом только в I при удалении молекул Dmf объем пустот занимает 23.5% от общего объема элементарной ячейки, в II при удалении молекул воды объем пустот равен 7.2%, а в III–V, cоединений не содержащих кристаллизационных молекул, – в интервале от 0–6.0%.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Чугаев Л.А. // Журн. рус. физ.-хим. общества. 1905. Т. 37. № 2. С. 243.
Чyгaeв Л.A. // Z. Anorg. Chem. 1905. V. 46. P. 144.
Allen F.H. // Acta Crystallogr. B. 2002. V. 58. P. 380.
Чугаев Л.А. // Избранные труды. Т. 1 / Под ред. Черняева И.И. М.: Изд-во АН СССР, 1954. С. 636.
Аблов А.В., Симонов Ю.А., Малиновский С.Т. и др. // Докл. АН СССР. 1975. Т. 221. № 3. С. 605.
Brescian-Pahor N., Farcolin M., Marzilli L.G. et al. // Coord. Chem. Rev. 1985. V. 63. P. 1.
Боурош П.Н., Коропчану Э.Б., Чилочи А.А. и др. // Коорд. химия. 2013. Т. 39. №11. С. 669 (Bourosh P.N., Coropceanu E.B., Ciloci A.A. et al. // Russ. J. Coord. Chem. 2013. V. 39. № 11. P. 777). https://doi.org/10.1134/S107032841311002X
Kantekin H., Bakaray A., Biyiklioglu Z., Kilicaslan M.B. // Transition Met. Chem. 2008. V. 33. P. 161.
Kurtoglu M., Purtas F., Toroglu S. // Transition Met. Chem. 2008. V. 33. P. 705.
Pingwu D., Schneider J., Luo G. et al. // Inorg. Chem. 2009. V. 48. P. 4952.
Hu X.L., Cossairt B.M., Brunschwig B.S. et al. // Chem. Commun. 2005. P. 4723.
Baffert C., Artero V., Fontecave M. // Inorg. Chem. 2007. V. 46. P. 1817.
Probst B., Kolano C., Hamm P., Alberto R. // Inorg. Chem. 2009. V. 48. P. 1836.
Fihri A., Artero V., Razavet M. et al. // Angew. Chem., Int. Ed. 2008. V. 47. P. 564.
Du P.W., Knowles K., Eisenberg R. // J. Am. Chem. Soc. 2008. V. 130. P. 12576.
Szilagyi I.M., Deak A., Varhelyi Jr. C. // Polyhedron. 2010. V. 29. P. 2185.
Малиновский С.Т., Болога О.А., Коропчану Э.Б. и др. // Коорд. химия. 2004. Т. 30. № 5. С. 363 (Malinovskii S.T., Bologa O.A., Koropceanu E.B. et al. // Russ. J. Coord. Chem. 2004. V. 30. № 5. P. 339). https://doi.org/10.1023/B:RUCO.0000026004.00556.10
Yanase Y., Yoshimura H., Kinoshita S. et al. // Acta Crystallogr. C. 1990. V. 46. P. 36.
Gok Y., Kantekin H., Degirmencioglu I. // Polyhedron. 1993. V. 12. P. 2047.
Симонов Ю.А., Заводник В.Е., Шкурпело А.И., Болога О.А. // Журн. структур. химии. 1985. Т. 26. № 2. С. 99 (Simonov Yu.A., Zavodnik V.E., Shkurpelo A.I., Bologa O.A. // J. Struct. Chem. 1985. V. 26. № 2. P. 229).
Симонов Ю.А., Малиновский С.Т., Болога О.А. и др. // Кристаллография. 1983. Т. 28. № 4. С. 682 (Simonov Yu.A., Malinovskii S.T., Bologa O.A. et al. // Crystallogr. Rep. 1983. V. 28. № 4. P. 682).
Cullen W.R., Dolphin D., Einstein F.W.B. et al. // J. Am. Chem. Soc. 1979. V. 101. P. 6898.
Coropceanu E., Rija A., Lozan V. et al. // Cryst. Growth Des. 2016. V. 16. P. 814.
Coropceanu E.B., Croitor L., Gdaniec M. et al. // Inorg. Chim. Acta. 2009. V. 362. P. 2151.
Vijaikanth V., Gupta B.D., Mandal D., Shekhar S. // Organometal. 2005. V. 24. P. 4454.
Kumar S., Seidel R.W. // Inorg. Chem. Commun. 2013. V. 27. P. 1.
Уреке Д., Булхак И., Рижа А. и др. // Коорд. химия. 2019. Т. 45. № 12. С. 720 (Ureche D., Bulhac I., Rija A. et al. // Russ. J. Сооrd. Chem. 2019. V. 45. № 12. Р. 843). https://doi.org/10.1134/S107032841912008X
Уреке Д., Рижа А., Булхак И. и др. // Журн. неорган. химии. 2020. Т. 65. № 12. С. 1633 (Ureche D., Rija A., Bulhac I. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 12. P. 1838). https://doi.org/10.1134/S0036023620120189
Xie L.S., Park S.S., Chmielewski M.J. et al. // Angew. Chem. Int. 2020. V. 59. P. 19623.
Gurol I., Ahsen V., Bekaroglu O. // Dalton Trans. 1992. P. 2283.
Cocu M., Bulhac I., Coropceanu E. et al. // J. Mol. Struct. 2014. V. 1063. P. 274.
Bourosh P.N., Coropceanu E.B., Rija A.P. et al. // J. Mol. Struct. 2011. V. 998. P. 198.
Rija A., Bulhac I., Coropceanu E. et al. // Chem. J. Mold. 2011. V. 6. № 2. P. 73. https://doi.org/10.19261/cjm.2011.06(2).16
Sheldrick G.M. // Acta Crystallogr. A. 2008. 64. № 1. P. 112.
Тарасевич Б.Н. ИК спектры основных классов органических соединений. Справочные материалы. М.: МГУ, 2012. 54 с.
Беллами Л. Инфракрасные спектры сложных молекул / Под ред. Пентина Ю.А. М.: ИЛ, 1963. 592 с.
Наканиси К. Инфракрасные спектры и строение органических соединений / Под ред. Мальцева А.А. М.: Мир, 1965. 216 с.
Гордон А., Форд Р. Спутник химика. М.: Мир, 1976. 541 с.
Боурош П.Н., Коропчану Э.Б., Десятник А.А. и др. // Коорд. химия. 2009. Т. 35. № 10. С. 761 (Bourosh P.N., Кoropchanu E.B., Desyatnik A.A. et al. // Russ. J. Coord. Chem. 2009. V. 35. № 10. P. 751). https://doi.org/10.1134/S1070328409100078
Булхак И.И., Боурош П.Н., Шолмеер Д. и др. // Коорд. химия. 2009. Т. 35. № 5. С. 358 (Bulhac I.I., Bourosh P.N., Schollmeyer D. et al. // Russ. J. Coord. Chem. 2009. V. 35. № 5. P. 352). https://doi.org/10.1134/S1070328409050078
Боурош П., Булхак И., Ковач О. и др. // Коорд. химия. 2018. Т. 44. № 4. С. 255 (Bourosh P., Bulhac I., Covaci О. et al. // Russ. J. Coord. Chem. 2018. V. 44. № 8. P. 507). https://doi.org/10.1134/S1070328418080018
Чобэника О., Боурош П., Лозан В.И. и др. // Журн. неорган. химии. 2011. Т. 56. № 7. С. 1114 (Chiobenika O., Bourosh P., Lozan V. et al. // Russ. J. Inorg. Chem. 2011. V. 56. № 7. P. 1050). https://doi.org/10.1134/S0036023611070060
Lopez C., Alvarez, Solans X., Font-Bardia M. // Poly-hedron. 1992. V. 11. P. 1637.
Uchida A., Sasada Y., Ohashi Y. // Acta Crystallogr. B. 1988. V. 44. P. 249.
Uchida A., Ohashi Y., Sasada Y. // Nature (London). 1986. V. 320. P. 51.
Sekine A., Tatsuki H., Ohashi Y. // J. Organomet. Chem. 1997. V. 536. P. 389.
Ohashi Y., Tomotake Y., Uchida A., Sasada Y. // J. Am. Chem. Soc. 1986. V. 108. P. 1196.
Vithana C., Uekusa H., Sekine A., Ohashi Y. // Acta Crystallogr. B. 2002. V. 58. P. 227.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия



