Координационная химия, 2022, T. 48, № 7, стр. 389-403
Вердазилы в координационной химии
Г. Н. Липунова 1, Т. Г. Федорченко 1, *, О. Н. Чупахин 1, 2
1 Институт органического синтеза им. И.Я. Постовского УрO РАН
Екатеринбург, Россия
2 Уральский федеральный университет им. первого Президента России Б.Н. Ельцина
Екатеринбург, Россия
* E-mail: deryabina@ios.uran.ru
Поступила в редакцию 14.01.2022
После доработки 01.02.2022
Принята к публикации 02.02.2022
- EDN: AQRVJA
- DOI: 10.31857/S0132344X22070064
Аннотация
Настоящий миниобзор, описывающий моно- и бирадикальные структуры гетероциклических радикалов – вердазилов – в роли лигандов и типы их металлокомплексов основан на анализе научной литературы, опубликованной с 2000 по 2021 гг. В большинстве случаев в составе комплексов моновердазильные радикалы описаны как N,N-бидентатные или N,N,N-тридентатные редокс-активные лиганды. Рассмотрены бирадикальные системы, содержащие вердазил. Приведены примеры других соединений вердазилов с металлами.
π-Делокализованные стабильные радикалы стали важным структурным элементом ультрасовременных материалов для технологического и биологического применения [1–3]. К такому типу соединений относятся гетероциклические радикалы – вердазилы, различающиеся природой группы в положении 6: вердазилы Куна (1) представляют радикалы с насыщенным углеродным атомом и оксовердазилы (2), содержащие карбонильную группу (схема 1 ).
Схема 1 .
Высокая химическая стабильность, синтетическая гибкость, способность к образованию металлокомплексов делают вердазилы одним из наиболее привлекательных и больших классов стабильных радикалов [4]. Они находят применение в различных областях химии, физики, биологии в качестве стабилизаторов, спиновых меток, строительных блоков для создания молекулярных магнетиков, органических материалов с фотопереключаемыми или проводящими свойствами. Пристальное внимание к металлокомплексам этих радикалов обусловлено возможностью создания на их основе новых гибридных магнитных материалов [5–8]. Химии вердазильных радикалов, в том числе координационной химии, посвящен ряд обзоров [9–12]. В данном миниобзоре рассмотрены структуры вердазилов как лигандов и типы металлокомплексов на их основе.
МОНОВЕРДАЗИЛЬНЫЕ ЛИГАНДЫ И МЕТАЛЛОКОМПЛЕКСЫ НА ИХ ОСНОВЕ
Бидентатные лиганды. Способность вердазильных радикалов к образованию металлокомплексов привлекла внимание исследователей значительно позднее, чем другие их свойства. 6-Оксовердазилы являются стабильными редокс-активными гетероциклическими радикалами, которые обладают структурной универсальностью благодаря различным заместителям и могут быть включены непосредственно в лиганды полипиридильного типа. Они стали платформой для стремительного развития координационной химии вердазилов.
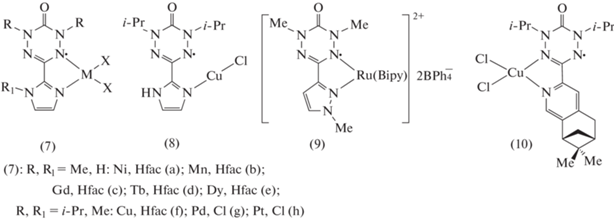
Введение N-содержащих гетероциклов в положение 3 оксовердазила позволило получить бидентатные редокс-активные лиганды для синтеза моно- и биядерных комплексов. Так, ряд металлокомплексов (3a–3k) получен на основе 1,5-R-6-оксо-3-(пиридин-2-ил)вердазилов. Структура таких комплексов зависит от природы металла, аниона Х, условий получения и наличия заместителей в лиганде. Комплексы с диамагнитными металлами Zn(II) (3a), (3b) и Cd(II) (3c), (3d) характеризуются тетраэдрическим окружением металла (схема 2 ) [13]. Моноядерную псевдооктаэдрическую структуру имеют комплексы с парамагнитными металлами Mn(II) (3e), Ni(II) (3f) [14]. Комплексы Ru(II) (3j), (3k) c дополнительными ацетилацетонатными (Аcac) и гексафторацетилацетонатными (Нfac) лигандами имеют близкое строение c октаэдрическим координационным узлом (рис. 1) [15]. Однако большое различие в их спектрах ЭПР и электрохимических свойствах показывает, что делокализация заряда очень чувствительна к природе β-дикетонатного лиганда. В комплексах Pd(II) (3g) и Pt(II) (3h) окружение металла планарное (рис. 2) [16].
Схема 2 .
Для комплекса, полученного с использованием CuBr, определена димерная структура (4), в которой имеет место слабый антиферромагнитный обмен между свободными радикалами [17]. Координационный полиэдр комплекса Cu(I) (5) на основе 1,5-диметил-3-(6-метилпиридин-2-ил)-6-оксовердазила представляет собой уплощенный псевдотетраэдр [18]. Комплекс (4) с 1,5-ди(изопропил)-3-(6-изопропилпиридин-2-ил)-6-оксовердазилом получен не из радикала, а окислением его предшественника – тетразана –бензохиноном в присутствии Cu(I) [19]. Координационный узел представляет собой искаженный тетраэдр, угол между плоскостями вердазильных лигандов равен 75°. Структура комплексов (3) c Zn, Cd, Mn, Ni, Pd, Pt, а также комплексов (4)–(6) подтверждена данными РСА.
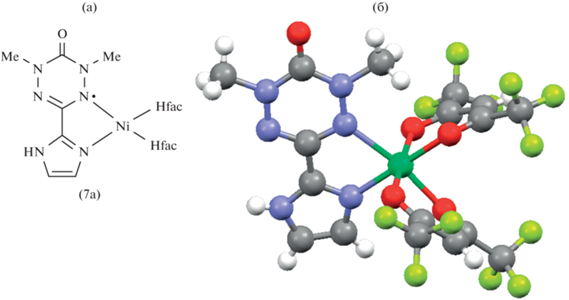
На основе 3-(имидазол-2-ил)содержащих вердазилов синтезирована группа моноядерных металлокомплексов (7) и изучена их структура различными методами, включая РСА (схема 3 ) [20]. Комплекс Cu(II) c 1,5-ди(изопропил)-3-(N-метил-имидазол-2-ил)вердазилом (7f) характеризуется октаэдрическим окружением иона меди, причем связанные с Cu атомы азота вердазила занимают аксиальные положения. Комплексы Ni(II) (7a) и Mn(II) (7b) с 1,5-диметил-3-(имидазол-2-ил)вердазилом изоструктурны. Ион металла связан с четырьмя атомами кислорода лиганда Нfac и двумя атомами азота вердазила с образованием искаженной октаэдрической структуры (рис. 3) [21]. В комплексах Pd(II) (7g) и Pt(II) (7h) на основе 1,5-ди(изопропил)-3-(N-метилимидазол-2-ил)вердазила окружение металла планарное [16]. В кристалле комплексы образуют ансамбли с π-стэкинговой архитектурой. Первые комплексы лантанидов (Gd, Tb, Dy) (7c)–(7e) получены с 1,5-диметил-3-(имидазол-2-ил)вердазилом [22]. Все они изоморфны, в их структуре присутствуют одномерные цепи, в которых вердазильный лиганд мостиком связывает два иона лантанида.
Схема 3 .
Комплекс (8) синтезирован взаимодействием тетразана и хлорида Cu(II) [23]. В процессе реакции имеет место окисление тетразана и восстановление меди. По данным РСА, структура комплекса не совсем обычна, ион меди находится в квазилинейном окружении. Вердазил в данном случае выступил в роли монодентатного лиганда. С использованием в качестве лиганда 1,5-диметил-3(1-метилпиразол-3-ил)-6-оксовердазила был получен комплекс рутения (9) [24]. С энантиочистым оксоведазилом, содержащим у С3 (–)-пинен-пиридинильный заместитель, синтезирован комплекс Cu(II) (10) [25]. По данным РСА, структура этого комплекса подобна ранее описанным комплексом типа Vd⋅⋅⋅CuCl2 (Vd = вердазил). Однако длинный межмолекулярный контакт Cu···N (3.889 Å) связывает две молекулы комплекса (10) в центросимметричные димеры. Атом Cu находится в псевдооктаэдрическом координационном окружении.
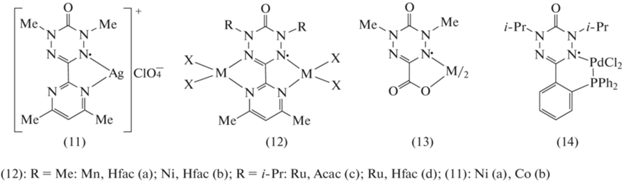
Введение в положение 3 оксовердазила пиримидинового фрагмента позволило синтезировать как моно-, так и биядерные комплексы. Взаимодействие 1,5-диметил-3-(4,6-диметилпиримидин-2-ил)оксовердазила с перхлоратом Ag(I) привело к образованию моноядерного комплекса (11) (схема 4 ) [26]. По данным РСА комплекс (11) построен из катионных цепей ионов серебра, мостиком связывающих бидентатные лиганды. С ионами Mn(II) и Ni(II) этот вердазил образует биядерные комплексы (12) с октаэдрическим окружением каждого иона металла [27]. Подобную структуру имеют и комплексы (12) c Ru(II), синтезированные на основе 1,5-ди(изопропил)-3-(4,6-диметилпиримидин-2-ил)оксовердазила [28].
Схема 4 .
1,5-Диметил-3-карбоксил-6-оксовердазил использован как бидентатный N,O-лиганд, депротонированная форма которого хорошо растворима в воде, что позволяет синтезировать комплексы в водной среде, в том числе с использованием гидротермального метода [29]. Комплексы на его основе с Ni(II) и Co(II) (13) получены взаимодействием предшественника радикала с перхлоратами металлов в водно-щелочной среде. По данным РСА, оба комплекса имеют псевдооктаэдрическое окружение иона металла, состоящее из двух N,O-хелатирующих вердазильных лигандов в анти-конфигурации в экваториальной плоскости и двух транс-аквалигандов в аксиальных положениях.
Вердазил, содержащий дифенилфосфиновую группу, был использован как еще один бидентатный лиганд для синтеза комплекса Pd(II) (14) (рис. 4) [30]. Данными РСА показано непланарное расположение хелатного узла в этом комплексе и различие в длинах связи Pd–Cl. Электрохимические свойства этого комплекса отличаются от свойств других комплексов Pd с вердазилами. Показана способность комплекса (12) в восстановительных условиях обратимо трансформироваться в стабильный биядерный комплекс состава (VdP)2Pd2Cl2, структура которого была определена с помощью РСА. В этом биядерном комплексе два иона Pd(II), находящихся в плоско-квадратном окружении, связаны хлоридными мостиками.
В течение длительного времени в синтезе металлокомплексов использовали только оксовердазилы. На примере 3-(пиридин-2-ил)-1,5-дифенил-вердазила была впервые показана способность радикалов Куна, содержащих sp3-гибридизованный атом углерода в положении 6, координировать ионы металла, подобно оксовердазилам. Взаимодействием этого лиганда с хлоридом палладия при нагревании в ацетонитриле был получен комплекс (15) (схема 5 ) [31]. Проведено сравнительное изучение структуры и свойств этого комплекса с аналогичным на основе 6-оксовердазила. По данным РСА показано, что оба комплекса имеют плоско-планарный металлохелатный узел.
Позднее на основе 3-(пиридин-2-ил)-1,5-дифенилвердазила были синтезированы комплексы Zn(II) и Mn(II) (16) (схема 5 ) [32]. Структуры комплексов подтверждены данными РСА, при комнатной температуре они изоморфны, окружение металла октаэдрическое. Диамагнитный фрагмент Zn(Нfac)2 выступает в роли спейсера между вердазильными радикалами, что приводит к образованию одномерной магнитной структуры.
Схема 5 .
Недавно группой H. Yamaguchi синтезированы и исследованы комплексы Zn(II) (17a, 17b) и Mn(II) (17с) (схема 5 ) с использованием в качестве лиганда 3-(3-R-пиридин-2-ил)-1,5-ди(4-F-фенил)вердазилов [33–35]. Авторами получены данные РСА для всех комплексов, обсуждается кристаллическая структура и магнитные свойства с привлечением квантово-химических расчетов. Комплекс Zn(II) (15b) представлен как модельное соединение для ферромагнитной цепи Гейзенберга S = 1/2 [33]. В работе [34] представлена антиферромагнитная (AF) сотовая решетка S = 1/2, состоящая из комплекса Zn(II) (17a). Комплекс с парамагнитным ионом Mn(II) (17с) представлен как антиферромагнетик S = 2 [35]. По заключению авторов, молекулярные комплексы вердазила с 3d-переходными металлами продемонстрировали, что сильная связь между спинами металла и вердазила приводит к образованию гибридного спина в низкотемпературных областях.
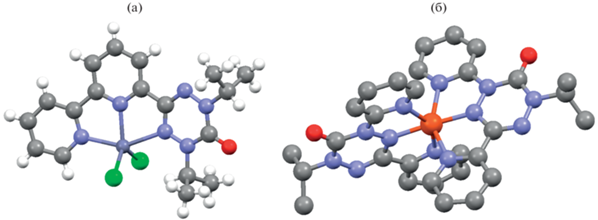
Тридентатные лиганды. Вердазилы как тридентатные лиганды были синтезированы путем введения бипиридинильного фрагмента в положение С(3), либо введением двух пиридинильных остатков в положения С(1) и С(3). Так, на основе 3-(2,2'-бипиридин-2-ил)-1,5-ди(изопропил)-6-оксовердазила получен комплекс Zn(II) (18) с тригонально-пирамидальным координационным узлом по данным РСА (схема 6 ) (рис. 5а) [36].
С использованием 1,5-диметил-3-(2,2'-бипиридин-2-ил)-6-оксовердазила получена серия комплексов (19) с ионами Mn(II), Ni(II), Cu(II), Zn(II) [37, 38]. Во всех случаях по данным РСА два вердазильных лиганда расположены почти перпендикулярно друг другу в меридианальных положениях, образуя псевдооктаэдрический комплекс. Внутримолекулярные обменные взаимодействия металл–вердазил в этих комплексах зависят от природы металла.
Схема 6 .
Комплекс (20a) получен из 5-изопропил-6-оксо-1,3-ди(пиридин-2-ил)вердазила и трифлата Ni(II) [39]. В этих же условиях синтезирован и комплекс Fe(II) (20b) [40], однако авторы в этой работе показали, что результаты легче воспроизводятся, если для синтеза использовать не радикал, а его предшественник – тетразин, который образуется при частичном окислении тетразана. В комплексах (20) с координационным узлом МN6 и псевдооктаэдрической структурой связи М–вердазил более короткие, чем в комплексах с другими радикалами (рис. 5б).
Синтез комплекса Co(II) c 1,5-диметил-6-оксо-3-(4,6-бис(2-пиридил)пиримидин-2-ил)вердазилом (21) описан в работе [41] (схема 7 ). Попытка получить комплекс непосредственно из радикала оказалась неудачной из-за недостаточной стабильности последнего. Реакция же соответствующего тетразана с хлоридом кобальта в насыщенном кислородом метаноле привела к образованию комплекса (21). В этом комплексе радикал выступает как тридентатный лиганд только для одного иона металла. Вторая тридентатная координационная позиция радикала остается вакантной. Анализ кристаллической структуры показывает, что комплекс представляет собой димер, в котором ионы кобальта связаны хлоридными мостиками. Узел CoCl2 асимметричен и включает две короткие и две длинные связи Co–Cl.
Схема 7 .
В недавней работе [42] всесторонне изучено комплексообразование 5-изопропил-6-оксо-1,3-ди(пиридин-2-ил)вердазила с трифлатом Co(II). Показано, что координация этого вердазила к кобальту приводит к дикатиону (22), лучше всего описываемому в твердом состоянии как ион Со(II) с высоким спином, координированный с двумя вердазильными лигандами с S = 3/2 в основном состоянии. Был выделен монокристалл, соответствующий ранее определенной тетрагональной элементарной ячейке; полный анализ с помощью рентгеновской дифракции подтвердил ранее отмеченный изоморфизм и дал длины связей металл–лиганд, соответствующие иону металла с высоким спином. При растворении в ацетонитриле наблюдается равновесие комплекса Со(II) с Со(III) валентным таутомером с S = 1/2 в основном состоянии. Переключение между двумя таутомерами в растворе и наличие различных форм при низкой температуре в растворе по сравнению с твердым телом указывает на то, что на равновесие могут сильно влиять изменения в молекулярной среде.
Комплексы Pd(II) (23) получены реакцией 5‑изопропил-6-оксо-1,3-ди(пиридин-2-ил)вердазила с (MeCN)4Pd(BF4)2 или лейкоформы этого радикала с (MeCN)4PdCl2 [43]. По данным РСА, искаженная квадратная плоская геометрия вокруг металла (сумма углов вокруг Pd = 360.0°) соответствует палладию(II). Авторами изучены редокс-реакции вердазил-палладиевых комплексов.
В работе [44] сообщается о синтезе нового тетразанового лиганда, предназначенного для окисления до его вердазильной формы (24), способной одновременно связываться с ионами переходных металлов и лантанидов. 1,5-Диметил-3-[6'-(гидроксиметил)-2'-пиридин]-6-оксотетразан получен конденсацией 6-(гидроксиметил)-2-пиридинальдегида с бис(1-метилгидразид)карбоновой кислотой. Реакция тетразана с ацетатными солями Co(II) и Dy(III) в ацетонитриле в аэробных условиях методом самосборки привела к образованию молекулярного кластера формулы [(V-CH2O)2Co2Dy2Ac8] (Ac = = CH3COO−), состоящего из шести спиновых центров. Структура кластера определена данными РСА (рис. 6). Кластер обладает свойствами одномолекулярного магнита.
Рис. 6.
Структура (24) (а) и вид 2p–3d–4f-кластера (б). Атомы диспрозия, кобальта, углерода, азота и кислорода изображены в виде зеленых, розовых, серых, синих и красных сфер соответственно (CCDC № 1499890) [44].

БИРАДИКАЛЬНЫЕ СИСТЕМЫ, СОДЕРЖАЩИЕ ВЕРДАЗИЛ
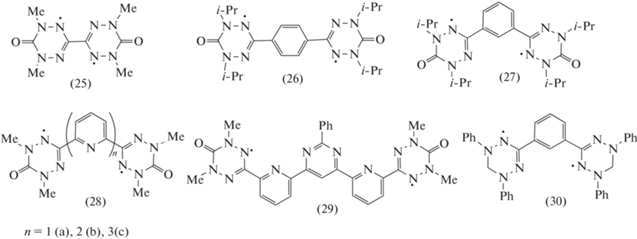
Способность к хелатообразованию полидентатных вердазильных радикалов делает их эффективными лигандами для формирования комплексов с различными металлами. С целью создания парамагнитных аналогов олигопиридиновых металлсодержащих супрамолекулярных “строительных блоков” были синтезированы бирадикалы, в которых 6-оксовердазильные фрагменты связаны непосредственно (25) [45] или через спейсер (26)–(29) (схема 8 ) [46, 47]. Позднее был получен бирадикал Куна (30) в виде высокочистого кристалла [48].
Схема 8 .
С некоторыми из них были описаны металлокомплексы. Так, взаимодействием бисвердазила (25) с галогенидами Cu(I) получены комплексы (31) (схема 9 ) [45]. Полимерная структура установлена методом РСА и представлена на рис. 7а на примере бромидного комплекса (31b). Бисбидентатная молекула дирадикала координирована двумя атомами меди, и эти фрагменты связаны в цепи бромидными мостиками.
Схема 9 .
Для сравнения свойств синтезированы и изучены комплексы Cu(I) на основе этого же бирадикала, но имеющие не полимерную, а биядерную структуру (32) [49].
Реакцией бис[1,5-ди(изопропил)-6-оксо-3]-2,6-пиридинсвязанного вердазила с хлоридом цинка синтезирован тригонально-пирамидальный комплекс (33), в котором связи Zn–N с вердазилом более длинные, чем с пиридином (рис. 7б) [36].
Одним из самых интересных в ряду синтезированных бирадикалов вердазильного класса является 1,1'-бис(вердазил)ферроцен (34), структура которого представлена на рис. 8 [50]. По данным РСА, в твердом состоянии вердазильные циклы расположены практически идеально друг над другом, что свидетельствует об образовании внутримолекулярного π-димера. В кристаллах вердазил диамагнитен, что указывает на связывание спинов. Однако в растворе этот бирадикал не является π-димером, поскольку обменное взаимодействие очень слабое. В более поздней работе [51] проведены теоретические исследования бирадикала (34) и двух низкоэнергетических изомеров этого бирадикала, полученных вращением одного из вердазильных фрагментов вдоль оси
Cp–Fe–Cp (Cp = циклопентадиенил) на 19° (34') и на 144° (34"). В результате исследований в бирадикале (34) была обнаружена уникальная двухэлектронная восьмицентровая связь. Авторами отмечено, что согласно экспериментально зарегистрированным и теоретически рассчитанным спектрам поглощения трех бирадикалов бирадикал (34) способен трансформироваться в растворе в изомер (34") с двумя “разделенными” радикальными фрагментами.В [52] описаны аналоги бирадикала (34), содержащие вердазильный и иминонитроксидный (35) или нитронил-нитроксидный (36) радикальные фрагменты, проведено квантово-химическое исследование всех трех бирадикалов. Было рассмотрено влияние степени окисления атома железа в ферроцене на магнитные взаимодействия. По мнению авторов [52], исследованные бирадикальные системы могут представлять интерес как молекулярные магнетики (схема 10 ).
Схема 10 .
Гетероспиновые бирадикальные системы, включающие вердазильный фрагмент, представлены в [53–56]. Разработан подход к синтезу толан-связанных бирадикалов (37)–(40), содержащих два вердазильных радикала или вердазильный и нитронилнитроксидный, причем вердазильный радикал может быть N- или С-связанным (схема 11 ) [53, 54]. Метод основан на реакции сочетания Sonogashira иодзамещенных радикалов с этинилсодержащими билдинг-блоками. Авторы отмечают, что комбинация вердазилов и нитроксидов может считаться перспективной для синтеза многоспиновых молекул и возможных материалов для двумерных 2D- и 3D-упорядоченных триплонных возбуждений спиновых димеров в кристаллической решетке.
Схема 11 .
Оксовердазил-нитронилнитроксидные бирадикалы (41)–(43) с укороченным пара- или мета-фениленовым мостиком описаны в [55] (схема 12 ). Эти соединения получены Pd-катализируемой реакцией кросс-сочетания йодзамещенных вердазилов с комплексом Au(I) нитронилнитроксида. Этим же методом синтезированы бирадикал (44) и трирадикал (45), которые исследованы в [56].
Несмотря на то, что бирадикалы (37)–(45) не являются лигандами для синтеза стабильных комплексов, мы сочли возможным привести соединения в этой статье. Все эти соединения характеризуются высокой стабильностью, особенно трирадикал, и открывают новые перспективы для дальнейшей функционализации. И не удивительно, если в ближайшее время появятся и металлокомплексы на основе подобных соединений.
Схема 12 .
ДРУГИЕ СОЕДИНЕНИЯ ВЕРДАЗИЛОВ С МЕТАЛЛАМИ
Как уже отмечалось выше на примере комплекса (8), не всегда координируемый металл в комплексе вердазила непосредственно связан с тетразинильным циклом, на котором распределен неспаренный электрон. Реакция 1,5-диметил-3(имидазол-2-ил)-6-оксовердазила с Ln(Нfac)3 привела к комплексам (46) (рис. 9) [22]. Все комплексы изоморфны, в их структуре присутствуют одномерные цепи, в которых вердазильный лиганд мостиком связывает два иона лантанида. На примере комплекса Dy(III) структура подтверждена данными РСА (рис. 9).
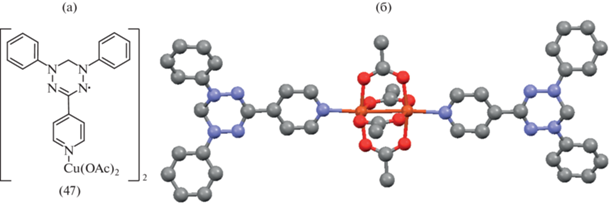
Вердазилы Куна, содержащие в качестве заместителя остаток пиридина, использовали для синтеза комплексов, в которых донорные центры для связи с металлом сознательно удалены от тетразинильного цикла. Так, на основе 1,5-дифенил-6-оксо-3(пиридин-4-ил)вердазила синтезирован и структурно охарактеризован комплекс Cu(II) (47) (рис. 10) [57]. Изучены магнитные свойства в широком интервале температур и показано, что имеют место антиферромагнитные обменные взаимодействия между радикалами в кристаллической структуре. Обменные взаимодействия между Cu(II) и радикалом малы по сравнению с сильными внутримолекулярными Cu···Cu антиферромагнитными взаимодействиями.
Несимметричный (48) и симметричный (49) (алкинил)рутениевые комплексы вердазилов описаны в [58] (схема 13 ). Соединение (48) синтезировали взаимодействием [Ru=С=СHPh(Dppe)2][OTf] (Dppe = 1,2-бис(дифенилфосфино)этан) с 1,5-диметил-6-оксо-3-(4-этинилфенил)вердазилом. Комплекс (49) синтезировали из цис-[RuCl2(Dppe)2] и этого же вердазила, содержащего ацетиленовую группу. Комплексы рутения (48) и (49) могут рассматриваться как системы с редокс-активным металлоцентром, связывающим спиновые блоки.
Схема 13 .
Осуществлена самосборка комплекса Pd(II) (51) состава M6L4 в условиях, когда смесь 1,3,5-три(пиридин-4-ил)вердазила (50) и [Pd(Bipy)(NO3)2] перемешивалась в воде при комнатной температуре (схема 14 ) [59]. Лигандв данном случае является билдинг-блокомдля конструкции “спин-клетки” с четырьмя спиновыми центрами. Гексаядерная структура комплекса (49) охарактеризована методом РСА.
Схема 14 .
Другой пример успешной самосборки комплекса Pd(II) (52) с использованием того же вердазила (50) (схема 15 ) описан в [60].
Схема 15 .
По данным РСА, комплекс (52) состоит из двух параллельных радикальных фрагментов, связанных “лицом к лицу” атомами палладия и молекулами пиразина с включением трифенилена (Tf) в качестве гостя. Данные ЭПР показывают взаимодействие между радикалами в этом комплексе. Осуществлено инкапсулирование в данную “спин-клетку” планарных комплексов меди(II), что расширяет возможности для наблюдения спин-спиновых взаимодействий через пространство.
Описан синтез солей с переносом заряда (53a, 53b), в которых вердазил находится в катион-радикальной форме (схема 16 ) [61, 62]. Эти соединения синтезированы метилированием 1,5-диарил-3-(пиридин-2-ил)вердазилов иодистым метилом при комнатной температуре и последующей обработкой полученных иодидов тетрахлороферратом 1-бутил-3-метилимидазолия. Изучена структура кристаллов солей (53a, 53b) и их магнитные свойства. Соли характеризуются наличием спина S = 1/2 на вердазильном катион-радикале и спина S = 5/2 на анионе ${\text{FeCl}}_{4}^{ - }.$ На основании расчетов методом ab initio для соединения (53a) предположена модель, включающая три типа обменных взаимодействий в слое (структура которого напоминает соты), образованном катион-радикалами, и два типа взаимодействий сайтов слоя с ионом ${\text{FeCl}}_{4}^{ - }.$ На основании широкого спектра полученных магнитных данных авторы утверждают, что гетероспиновое соединение (53b) с трехмерной сетью неэквивалентных антиферромагнитных взаимодействий является уникальным, поскольку проявляет классические свойства магнита в слабом поле и квантовое поведение при наложении сильного поля [61].
В [63–66] описаны соли (54), состоящие из катиона вердазила и аниона комплекса Ni(Dt)2 (Dt = = 1,3-дитиол-2-тион-4,5-дитиолат). Анализ кристаллической структуры соли показывает образование димеров анионов Ni(Dt)2 и димеров сэндвичевого типа между двумя вердазильными катионами с формированием магнитного линейного тетрамера. Измерена проводимость солей и показано, что они являются молекулярными парамагнитными полупроводниками.
Схема 16 .
Проведенный краткий анализ литературных данных показывает, что интерес к вердазильным радикалам не ослабевает. Одной из причин внимания к этим радикалам является то, что они обладают делокализованной π-электронной спиновой плотностью в непланарной молекулярной структуре. Гибкость молекулярных орбиталей в вердазильном радикале позволяет настраивать межмолекулярные магнитные взаимодействия, используя принципы молекулярного дизайна. Введение атома металла в структуру вердазила позволяет значительно изменять магнитное поведение лиганда и получать системы с новыми свойствами. В структуру вердазила достаточно легко можно вводить дополнительные донорные центры, что приводит к би- и тридентатным лигандам и стабильным комплексам с различным окружением металлхелатного узла. Получение гомо- и гетероспиновых бирадикальных систем открывают перспективы для дальнейшей функционализации, включая и введение дополнительных центров для координации, и синтез много-спиновых структур как молекулярных магнетиков.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Chen Z.X., Li Y., Huang F. // Chem. 2020. V. 7. P. 288.
Li Min, Case J., Minteer Sh.D. // ChemElectroChem. 2021. V. 8. 1215.
Magnan F., Dhindsa J.S., Anghel M. et al. // Polim. Chem. 2021. V. 12. P. 2786.
Полумбрик О.М. Химия вердазильных радикалов. Киев: Наук. думка, 1984. 252 с.
Koivisto B.D., Hicks R.G. // Coord. Chem. Rev. 2005. V. 249. P. 2612.
Train C., Norel L., Baumgarten M. // Coord. Chem. Rev. 2009. V. 253. P. 2342.
Brook D.J.R. // Comments Inorg. Chem. 2015. V. 35. P. 1.
Lemaire M.T. // Pure Appl. Chem. 2004. V. 76. P. 277.
Venneri S., Wilson J., Rawson J.M. et al. // ChemPhys-Chem. 2015. V. 80. P. 1624.
Paquette J.A., Ezugwu S., Yadav V. et al. // J. Polym. Sci. A. 2016. V. 54. P. 1803.
Липунова Г.Н., Федорченко Т.Г., Чупахин О.Н. // Успехи химии. 2013. Т. 82. С. 701 (Lipunova G.N., Fedorchenko T.G., Chupakhin O.N. // Russ. Chem. Rev. 2013. V. 82. P. 701). https://doi.org/10.1070/RC2013v082n08ABEH004341
Липунова Г.Н., Федорченко Т.Г., Цмокалюк А.Н., Чупахин О.Н. // Изв. АН. Сер. хим. 2020. № 7. С. 1203 (Lipunova G.N., Fedorchenko T.G., Tsmokalyuk A.N., Chupakhin O.N. // Russ. Chem. Bull. 2020. V. 69. P. 1203). https://doi.org/10.1007/s11172-020-2892-6
Brook D.J.R., Fornell S., Stevens J.E. et al. // Inorg. Chem. 2000. V. 39. P. 562.
Hicks R.G., Lemaire M.T., Thompson I.K. et al. // J. Am. Chem. Soc. 2000. V. 122. P. 8077.
McKinnon S.D.J., Gilroy J.B., McDonald R. et al. // Chem. Commun. 2010. V. 46. P. 773.
McKinnon S.D.J., Gilroy J.B., McDonald R. et al. // J. Mater. Chem. 2011. V. 21. P. 1523.
Brook D.J.R., Fornell S., Noll B. et al. // Dalton Trans. 2000. P. 2019.
Barklay T.M., Hicks R.G., Lemaire M.T. et al. // Inorg. Chem. 2001. V. 40. P. 6521.
Brook D.J.R., Yee G.T., Hundley M. et al. // Inorg. Chem. 2010. V. 49. P. 8573.
Gilroy J.B., Koivisto B.D., McDonald R. et al. // J. Mater. Chem. 2006. V. 16. P. 2618.
Norel L., Train C., Pointillart F. et al. // Inorg. Chem. 2008. V. 47. P. 2396.
Norel L., Chamoreau L.-M., Journaux Y. et al. // Chem. Commun. 2009. P. 2381.
Norel L., Rota J.-B., Chamoreau L.-M. et al. // Angew. Chem. Int. Ed. 2011. V. 50. P. 7128.
Wu J.-Z., Bouwman E., Reedijk J. et al. // Inorg. Chim. Acta. 2003. V. 351. P. 326.
Solea A.B., Wohlhauser T., Abbasi P. et al. // Dalton Trans. 2018. V. 47. P. 4785.
Pointillart F., Train C., Herson P. et al. // New J. Chem. 2007. V. 31. P. 1001.
Barklay T.M., Hicks R.G., Lemaire M.T. et al. // Inorg. Chem. 2001. V. 40. P. 5581.
McKinnon S.D.J., Patrick B.O., Lever A.B.P. et al. // Inor-g. Chem. 2013. V. 52. P. 8053.
Barklay T.M., Hicks R.G., Lemaire M.T. et al. // Chem. Commun. 2002. P. 1688.
Sanz C.A., Ferguson M.J., McDonald R. et al. // Chem. Commun. 2014. V. 50. P. 11676.
Johnston C.W., McKinnon S.D.J., Patrick B.O. et al. // Dalton Trans. 2013. V. 42. P. 16829.
Yamaguchi H., Shinpuku Y., Kono Y. et al. // Phys. Rev. B. 2016. V. 93. Article 115145.
Uemoto N., Kono Y., Kitaka S. et al. // Phys. Rev. B. 2019. V. 99. Article 094418.
Kono Y., Okabe T., Uemoto N. et al. // Phys. Rev. B. 2020. V. 101. Article 014437.
Iwasaki Y., Okabe T., Uemoto N. et al. // Phys. Rev. B. 2020. V. 101. Article 174412.
Anderson K.J., Gilroy J.G., Patrick B.O. et al. // Inorg. Chim. Acta. 2011. V. 374. P. 480.
Barklay T.M., Hicks R.G., Lemaire M.T. et al. // Chem. Commun. 2000. P. 2141.
Barklay T.M., Hicks R.G., Lemaire M.T. et al. // Inorg. Chem. 2003. V. 42. P. 2261.
Richardson C.J., Haller B.C., Brook D.J.R. et al. // Chem. Commun. 2010. V. 46. P. 6590.
Brook D.J.R., Fleming C., Chung D. et al. // Dalton Trans. 2018. V. 47. P. 6351.
Lemaire M.T., Barklay T.M., Thompson I.K. et al. // I-norg. Chim. Acta. 2006. V. 359. P. 2616.
Fleming C., Chung D., Ponce S. et al. // Chem. Commun. 2020. V. 56. P. 4400.
Sanz C.A., Patrick B.O., Hicks R.G. // Dalton Trans. 2019. V. 48. P. 12674.
Novitchi G., Shova S., Lan Y. et al. // Inorg. Chem. 2016. V. 55. P. 12122.
Brook D.J.R., Lynch V., Conklin B. et al. // J. Am. Chem. Soc. 1997. V. 119. P. 5155.
Hicks R.G. Koivisto B.D. Lemaire M.T. // Org. Lett. 2004. V. 6. P. 1887.
Gilroy J.B., McKinnon S.D.J., Kennepohl P. et al. // J. Org. Chem. 2007. V. 72. P. 8062.
Iwase K., Yamaguchi H., Ono T. et al. // J. Phys. Soc. Jpn. 2013. V. 82. Article 074719.
Green M.T., McCormick T.A. // Inorg. Chem. 1999. V. 38. P. 3061.
Koivisto B.D., Ichimura A.S., McDonald R. et al. // J. Am. Chem. Soc. 2006. V. 128. P. 690.
Sun C.-Z., Xu H.-L., Su Z.-M. // Dyes Pigm. 2018. V. 148. P. 380.
Pal A.K., Datta S.N. // Chem. Phys. Lett. 2017. V. 676. P. 70.
Petunin P.V., Rybalova T.V., Trusova M.E. et al. // ChemPlusChem. 2019. V. 85. P. 159.
Votkina D.E., Petunin P.V., Zhivetyeva S.I. et al. // Eur. J. Org. Chem. 2020. V. 2020. P. 1996.
Tretyakov E.V., Zhivetyeva S.I., Petunin P.V. et al. // Angew. Chem. Int. Ed. 2020. V. 52. P. 20704.
Tretyakov E.V., Petunin P.V., Zhivetyeva S.I. et al. // J. Am. Chem. Soc. 2021. V. 143. P. 8164.
Yakovenko A.V., Rolotilov S.V., Cador O. et al. // Eur. J. Inorg. Chem. 2009. P. 2354.
Di Piazza E., Merhi A., Norel L. et al. // Inorg. Chem. 2015. V. 54. P. 6347.
Nakabayashi K., Ozaki Y., Kawano M. et al. // Angew. Chem. Int. Ed. 2008. V. 47. P. 2046.
Ozaki Y., Kawano M., Fujita M. // Chem. Commun. 2009. P. 4245.
Iwasaki Y., Kida T., Hagiwara M. et al. // Phys. Rev. B. 2018. V. 97. Article 085113.
Iwasaki Y., Kida T., Hagiwara M. et al. // Phys. Rev. B. 2018. V. 98. Article 224411.
Mukai K., Natanaka T., Senba N. et al. // Inorg. Chem. 2002. V. 41. P. 5066.
Mukai K., Senba N., Natanaka T. et al. // Inorg. Chem. 2004. V. 43. P. 566.
Mukai K., Shiba D., Yoshida K. et al. // Bull. Chem. Soc. Jpn. 2005. V. 78. P. 2114.
Mukai K., Shiba D., Mukai Ky. et al. // Polyhedron. 2005. V. 24. P. 2513.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия