Координационная химия, 2022, T. 48, № 8, стр. 506-511
Особенности взаимодействия триарилсурьмы с гидроксибензойными кислотами. Строение продуктов реакций
Ю. О. Пупкова 1, *, В. В. Шарутин 1, О. К. Шарутина 1, А. С. Фоминых 2
1 Национальный исследовательский Южно-Уральский государственный университет
Челябинск, Россия
2 Томский политехнический университет
Томск, Россия
* E-mail: ulchik7757@mail.ru
Поступила в редакцию 23.01.2022
После доработки 30.01.2022
Принята к публикации 31.01.2022
- EDN: XVVHMG
- DOI: 10.31857/S0132344X22080059
Аннотация
Три-мета-толилсурьма и трифенилсурьма взаимодействуют в присутствии пероксида водорода с 2,6-дигидроксибензойной и 3,5-динитросалициловой кислотами с образованием дикарбоксилатов триарилсурьмы (I, II ∙ 2PhH соответственно). Взаимодействием трис(5-бром-2-метоксифенил)сурьмы с 2,6-дигидроксибензойной кислотой получено биядерное сурьмаорганическое соединение с мостиковым атомом кислорода (III ∙ MeCN). Особенности строения продуктов реакций установлены методом рентгеноструктурного анализа (CCDC № 1911551, 2117678, 1970910).
Синтез новых производных сурьмы(V), несомненно, является актуальной задачей, поскольку такие соединения широко применимы в различных областях науки и техники [1], например в синтезе высокомолекулярных соединений для варьирования их свойств [2, 3]. Известна каталитическая [4–6], биологическая [7–10] и фотокаталитическая активность [11] указанных производных. Одним из эффективных методов синтеза арильных соединений сурьмы(V) является реакция окислительного присоединения триарильных производных сурьмы, впервые предложенная в [12], которая изучена для большого количества органических О−Н-кислот [13–15]. Однако данная реакция систематически не исследована для соединений, содержащих несколько подвижных атомов водорода, когда образующиеся продукты могут иметь различное строение. Например, в реакции трифенилсурьмы (галогенида трифенилсурьмы) с салициловой [16], 5-бромсалициловой [17], 2,3-, 2,6-дигидроксибензойной кислотами [18] принимает участие только карбоксильная группа, продуктами реакции являются дикарбоксилаты триарилсурьмы. 3,4-Дигидроксибензойная кислота в реакции с трифенилсурьмой проявляет свойства дигидроксибензола с образованием тетраядерного макроцикла [19]. В реакции дихлорида триарилсурьмы с (±)манделиновой кислотой участвуют карбоксильная и гидроксильная группы, продуктом реакции также является тетраядерный макроцикл [20].
В продолжение исследования сурьмаорганических производных гидроксибензойных кислот мы провели реакции три-мета-толилсурьмы и трис(5-бром-2-метоксифенил)сурьмы с 2,6-дигидроксибензойной кислотой, трифенилсурьмы с 3,5-динитросалициловой кислотой и установили особенности строения продуктов реакций.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали коммерчески доступные соединения: 2,6-дигидроксибензойную кислоту, 3,5-динитросалициловую кислоту (Sigma Аldrich) без дополнительной очистки. Трифенилсурьму, три-мета-толилсурьму и трис(5-бром-2-метоксифенил)сурьму синтезировали по стандартным методикам и перекристаллизовывали из бензола или толуола. Диэтиловый эфир, ацетонитрил, толуол, бензол, гептан, октан высушивали перед использованием по стандартным методикам.
Синтез соединения m-Tol3Sb[O(O)CC6H3(OH)2-2,6]2 (I). Смесь 0.2 г (0.51 ммоль) три-мета-толилсурьмы и 0.16 г (1.02 ммоль) 2,6-дигидроксибензойной кислоты растворяли в 30 мл диэтилового эфира, к полученному раствору добавляли 0.051 г 30%-ного водного раствора пероксида водорода. После перекристаллизации из смеси толуол−гептан получили красные кристаллы. Выход 0.32 г (81%). Тпл = 181°С.
ИК-спектр (ν, см−1): 3265 с, 2360 сл, 1646 с, 1602 с, 1499 сл, 1474 сл, 1395 сл, 1354 с, 1256 с, 1219 с, 1156 с, 1117 с, 1078 ср, 1030 ср, 992 сл, 851 сл, 818 с, 773 ср, 702 ср, 685 ср, 667 ср, 609 с, 584 сл, 533 сл, 484 ср, 428 ср.
Аналогично синтезировали соединения II ∙ 2PhH и III ∙ MeCN.
Соединение Ph3Sb[O(O)CC6H2(OH)-2-(NO2)2-3,5]2 ∙ 2PhH (II): после перекристаллизации из бензола с добавлением октана получили желтые кристаллы. Выход 0.41 г (75%). Тпл = 215°С.
ИК-спектр (ν, см−1): 3097 cр, 2924 ср, 2858 сл, 2354 ср, 1650 с, 1597 с, 1539 с, 1433 с, 1362 с, 1338 с, 1260 с, 1176 с, 1087 ср, 1019 ср, 999 ср, 939 с, 740 с, 687 ср, 684 с, 669 с, 547 с, 468 с, 452 с.
Соединение [(5-Br-2-MeOC6H3)3SbO(O)-CC6H3(OH)2-2,6]2О ∙ MeCN (III): после перекристаллизации из ацетонитрила получили белые кристаллы. Выход 0.51 г (68%). Тпл = 192°С (с разложением).
ИК-спектр (ν, см−1): 3091 сл, 2934 сл 1644 с, 1599 с, 1476 с, 1437 ср, 1375 с, 1330 ср, 1282 с, 1254 с, 1220 ср, 1180 сл, 1155 сл, 1126 ср, 1093 сл, 1046 ср, 1013 ср, 885 сл, 805 с, 704 с, 620 ср, 603 ср, 532 с, 488 сл, 471 сл, 434 с.
ИК-спектры соединений I, II ∙ 2PhH, III ∙ MeCN записывали на ИК-Фурье спектрометре Shimadzu IR Affinity-1S в таблетках KBr.
РСА кристаллов I, II ∙ 2PhH, III ∙ MeCN осуществлен на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (MoKα- излучение, λ = 0.71073 Å, графитовый монохроматор). Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены с помощью программы SMART SAINT-Plus [21]. Определение и уточнение структуры кристаллов выполнено c помощью программ SHELX/PC [22] и OLEX2 [23]. Структура расшифрована прямым методом и уточнена методом наименьших квадратов вначале в изотропном, затем в анизотропном приближении для неводородных атомов. Атомы водорода помещены в геометрически рассчитанные положения и включены в уточнение по модели “наездника”.
Кристаллы соединения I красные, призматические, моноклинные, C35H31O8Sb, М = 701.35 г/моль; а = 9.014(12), b = 11.391(16), c = 30.67(4) Å, α = 90.00°, β = 92.78(5)°, γ = 90.00°, V = 3146(7) Å3, ρ(выч.) = 1.481 г/см3, Z = 2, пространственная группа P21/c. Измерено всего 34 622 отражения, 3694 независимых отражения, μ = 0.928 мм−1. Окончательные значения факторов расходимости: R1 = 0.0893 и wR2 = 0.0980 (по всем рефлексам), R1 = = 0.0551 и wR2 = 0.0876 (по рефлексам F 2 > 2σ(F 2)).
Кристаллы соединения II ∙ 2PhH желтые, призматические, триклинные, C44H33N4O14Sb, М = 963.49 г/моль; а = 10.198(10), b = 11.867(10), c = 18.906(15) Å, α = 75.24(3)°, β = 79.32(4)°, γ = = 85.54(6)°, V = 2173(3) Å3, ρ(выч.) = 1.472 г/см3, Z = 2, пространственная группа P$\bar {1}$. Измерено всего 57 753 отражения, 9112 независимых отражения, μ = 0.707 мм−1. Окончательные значения факторов расходимости: R1 = 0.0464 и wR2 = 0.0683 (по всем рефлексам), R1 = 0.0301 и wR2 = 0.0629 (по рефлексам F 2 > 2σ(F 2)).
Кристаллы соединения III ∙ MeCN бесцветные, призматические, моноклинные, C58H49NO15Br6Sb2, М =1722.94 г/моль; а = 12.259(8), b = 15.501(10), c = 32.54(3) Å, α = 90.00°, β = 90.18(3)°, γ = 90.00°, V = 6184(8) Å3, ρ(выч.) = 1.851 г/см3, Z = 4, пространственная группа P21/n. Измерено всего 119 381 отражения, 13 659 независимых отражений, μ = 4.815 мм−1. Окончательные значения факторов расходимости: R1 = 0.0829 и wR2 = 0.1199 (по всем рефлексам), R1 = 0.0451 и wR2 = 0.1012 (по рефлексам F 2 > 2σ(F 2)).
Полный набор рентгеноструктурных параметров структур I, II ∙ 2PhH, III ∙ MeCN депонированы в Кембриджском банке структурных данных (CCDC № 1911551, 2117678, 1970910 соответственно; deposit@ccdc.cam.uk).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Взаимодействием три-мета-толилсурьмы с 2,6-дигидроксибензойной кислотой и трифенилсурьмы с 3,5-динитросалициловой кислотой в присутствии пероксида водорода получены дикарбоксилаты триарилсурьмы. В реакциях участвуют только карбоксильные группы кислот, гидроксильные группы остаются инертными:
Соединение II после перекристаллизации было выделено в форме сольвата с двумя молекулами бензола.
Отметим, что дикарбоксилаты триарилсурьмы образуются и в реакциях трифенил- и три-пара-толилсурьмы с 2,6-дигидроксибензойной кислотой [18]. Также не удалось задействовать гидроксильную группу салициловой и 5-бромсалициловой кислот в реакциях с трифенилсурьмой [16, 17].
Продуктом реакции трис(5-бром-2-метоксифенил)сурьмы с 2,6-дигидроксибензойной кислотой вне зависимости от мольного соотношения компонентов является μ2-оксо-бис[(2,6-дигидроксибензоато)трис(5-бром-2-метоксифенил)сурьма] (продукт выделен в форме сольвата с ацетонитрилом после перекристаллизации), в котором атомы сурьмы связаны μ2-мостиковым кислородным атомом:
В ИК-спектрах соединений I, II, III полосы поглощения групп С=О (1646, 1650, 1644 см−1 соответственно) смещены в более низкочастотную область относительно ИК-спектров исходных кислот (1674 и 1680 см−1 в 2,6-дигидроксибензойной и 3,5-динитросалициловой кислоте соответственно).
В молекулах I и II (рис. 1) атомы сурьмы имеют мало искаженную тригонально-бипирамидальную координацию, о чем свидетельствует небольшой выход атома сурьмы из экваториальной плоскости (0.005 и 0.015 Å соответственно) и сумма углов в экваториальной плоскости, близкая к 360°. Аксиальные углы OSbO cоставляют 170.6(2)° и 175.29(6)°, длины связей Sb–C и расстояния Sb–O в I несколько короче, чем в II: 2.082(8)–2.122(8) Å (I), 2.115(3)–2.131(3) Å (II) и 2.137(5), 2.143(6) Å (I), 2.185(2), 2.161(2) Å (II) (табл. 1). В синтезированных ранее бис(2,6-дигидроксибензоатах) триарилсурьмы расстояния Sb−O лежат в диапазоне 2.120(3)–2.141(3) Å [18], что соизмеримо с I. В дисалицилатах трифенилсурьмы (цис- и транс-форма) связи Sb–O составляют 2.100(3)–2.127(3) Å, что значительно короче, чем аналогичные расстояния в II [24]. Расстояния Sb∙∙∙O между атомом сурьмы и карбонильными атомами кислорода составляют 2.900(3), 3.017(4) Å (I) и 2.992(2), 2.994(2) Å (II), что позволяет судить о выраженной асимметрии координации карбоксилатных лигандов. Длины одинарных С−О и двойных С=О связей в карбоксильных группах также отличаются: 1.306(9), 1.318(8) и 1.234(8), 1.227(8) Å (I) и 1.308(3), 1.307(3) и 1.246(3), 1.247(3) Å (II). В молекулах I и II имеются две и одна соответственно внутримолекулярные водородные связи между гидроксильными группами и атомами кислорода карбоксильной группы с параметрами: О–Н 0.82–0.91 (I), 0.82 Å (II), O∙∙∙H 1.72−1.85 (I), 1.81, 1.84 Å (II), O∙∙∙O 2.54(1)–2.58(2) (I), 2.545(2), 2.568(2) Å (II), углы ОНО 146°–157° (I), 147° (II).
Рис. 1.
Молекулярная структура соединений I и II ∙ 2PhH (сольватные молекулы бензола в II не показаны).
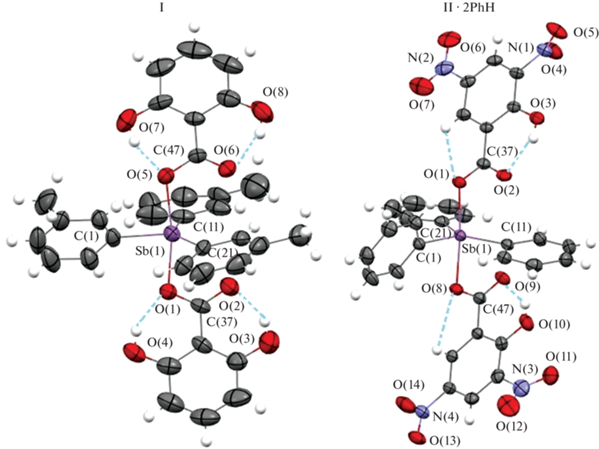
Таблица 1.
Основные длины связей и валентные углы в структурах I, II ∙ 2PhH, III ∙ MeCN
| Связь | d, Å | Угол | ω, град | ||
|---|---|---|---|---|---|
| I | |||||
| Sb(1)−C(1) | 2.122(8) | C(1)Sb(1)O(1) | 86.0(3) | ||
| Sb(1)−O(1) | 2.137(5) | C(1)Sb(1)O(5) | 84.6(3) | ||
| Sb(1)−O(5) | 2.143(6) | O(1)Sb(1)O(5) | 170.6(2) | ||
| Sb(1)−C(11) | 2.082(8) | C(11)Sb(1)C(1) | 110.1(3) | ||
| Sb(1)−C(21) | 2.094(9) | C(11)Sb(1)O(1) | 92.1(3) | ||
| С(37)−O(1) | 1.306(9) | C(11)Sb(1)O(5) | 91.9(2) | ||
| С(37)−O(1) | 1.234(8) | C(11)Sb(1)C(21) | 137.5(4) | ||
| C(47)−O(5) | 1.318(8) | C(21)Sb(1)C(1) | 112.5(4) | ||
| C(47)−O(6) | 1.227(8) | C(21)Sb(1)O(1) | 91.2(3) | ||
| C(21)Sb(1)O(5) | 91.6(3) | ||||
| II ∙ 2PhH | |||||
| Sb(1)−O(8) | 2.185(2) | O(1)Sb(1)O(8) | 175.29(6) | ||
| Sb(1)−O(1) | 2.161(2) | C(21)Sb(1)O(8) | 88.70(10) | ||
| Sb(1)−C(21) | 2.115(3) | C(21)Sb(1)O(1) | 90.94(10) | ||
| Sb(1)−C(11) | 2.116(3) | C(21)Sb(1)C(11) | 138.79(11) | ||
| Sb(1)−C(1) | 2.131(3) | C(21)Sb(1)C(1) | 112.06(12) | ||
| O(8)−C(47) | 1.308(3) | C(11)Sb(1)O(8) | 91.12(10) | ||
| O(9)−C(47) | 1.246(3) | C(11)Sb(1)O(1) | 92.24(10) | ||
| C(11)Sb(1)C(1) | 109.14(11) | ||||
| C(1)Sb(1)O(8) | 88.77(10) | ||||
| C(1)Sb(1)O(1) | 87.01(10) | ||||
| Связь | d, Å | Угол | ω, град | Угол | ω, град |
| III ∙ MeCN | |||||
| Sb(1)−O(8) | 2.263(4) | O(1)Sb(1)O(8) | 177.27(15) | O(1)Sb(2)O(12) | 173.77(16) |
| Sb(1)−O(1) | 1.925(4) | O(1)Sb(1)C(21) | 91.46(18) | O(1)Sb(2)C(41) | 93.59(18) |
| Sb(1)−C(21) | 2.102(5) | O(1)Sb(1)C(11) | 98.80(18) | O(1)Sb(2)C(61) | 89.92(19) |
| Sb(1)−C(11) | 2.106(5) | O(1)Sb(1)C(1) | 94.6(2) | O(1)Sb(2)C(51) | 92.3(2) |
| Sb(1)−C(1) | 2.101(5) | C(21)Sb(1)O(8) | 86.21(16) | C(41)Sb(2)O(12) | 91.51(18) |
| Sb(2)−O(12) | 2.214(4) | C(21)Sb(1)C(11) | 122.8(2) | C(61)Sb(2)O(12) | 91.30(19) |
| Sb(2)−O(1) | 1.936(4) | C(11)Sb(1)O(8) | 81.31(16) | C(61)Sb(2)C(41) | 113.7(2) |
| Sb(2)−C(41) | 2.104(5) | C(1)Sb(1)O(8) | 87.69(18) | C(61)Sb(2)C(51) | 119.9(2) |
| Sb(2)−C(61) | 2.100(5) | C(1)Sb(1)C(21) | 113.4(2) | C(51)Sb(2)O(12) | 81.81(19) |
| Sb(2)−C(51) | 2.103(5) | C(1)Sb(1)C(11) | 121.5(2) | C(51)Sb(2)C(41) | 126.0(2) |
| Sb(1)O(1)Sb(2) | 178.1(2) | ||||
В кристалле соединения II имеется множество внутри- и межмолекулярных связей между атомами кислорода нитрогруппы, карбоксильной и гидроксильной групп. Сольватные молекулы бензола не принимают участия в образовании внутри- и межмолекулярных связей.
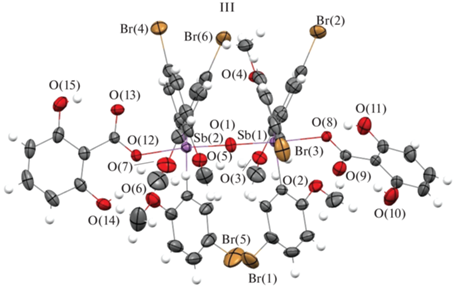
В молекуле III (рис. 2) угол Sb(1)O(1)Sb(2) отличен от 180° и равен 178.1(2)°, экваториальные углы CSb(1,2)C варьируют в интервалах 113.4(2)°–122.8(2)°, 113.7(2)°–126.0(2)°, при этом их суммы незначительно отличаются от теоретического значения (357.7(2)°, 359.6(2)°). Аксиальные углы ОкSb(1,2)Oм составляют 177.27(15)° и 173.77(16)°. Валентные углы OкSb(1,2)C, равные 81.31(16)°–87.69(18)° и 81.81(19)°–91.51(18)°, несколько отличаются от 90°. Расстояния Sb(1,2)–C равны 2.101(5)–2.106(5), 2.100(5)–2.104(5) Å. Длины связей Sb(1,2)−O(1)м (1.925(4) и 1.936(4) Å) значительно короче связей Sb(1,2)–Oк, которые составляют 2.263(4) и 2.214(4) Å. В молекуле III имеются внутримолекулярные водородные связи между свободными гидроксильными группами и атомами кислорода карбоксильных групп с параметрами: расстояния O–H 0.82 Å, O∙∙∙H 1.82–1.89 Å, O∙∙∙O 2.54(9)–2.57(5) Å, углы OHO 138°–147°.
Рис. 2.
Молекулярная структура соединения III ∙ MeCN (cольватная молекула ацетонитрила не показана).
Таким образом, установлено, что реакции три-мета-толилсурьмы с 2,6-дигидроксибензойной кислотой, трифенилсурьмы с 3,5-динитросалициловой кислотой протекают с участием только карбоксильной группы с образованием дикарбоксилатов триарилсурьмы, атомы сурьмы в которых имеют мало искаженную тригонально-бипирамидальную координацию. Взаимодействие трис(5-бром-2-метоксифенил)сурьмы с 2,6-дигидроксибензойной кислотой также протекает с участием только карбоксильной группы, но с образованием продукта иного строения – биядерного сурьмаорганического с мостиковым атомом кислорода, где атомы сурьмы также имеют искаженную тригонально-бипирамидальную координацию.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Шарутин В.В., Поддельский А.И., Шарутина О.К. // Коорд. химия. 2020. Т. 46. № 10. С. 579 (Sharutin V.V., Sharutina O.K., Poddel’sky A.I. // Russ. J. Coord. Chem. 2020. V. 46. № 10. Р. 663). https://doi.org/10.1134/S1070328420100012
Гущин А.В., Малеева А.И., Кипелкин Е.В. и др. // Журн. общ. химии. 2021. Т. 91. № 2. С. 274 (Gushchin A.V., Maleeva A.I., Kipelkin E.V. et al. // Russ. J. Gen. Chem. 2021. V. 91. № 2. Р. 227). https://doi.org/10.1134/S1070363221020110
Гущин А.В., Шашкин Д.В., Щербакова Т.С. и др. // Вестник Нижегородского ун-та им. Н.И. Лобачевского. 2010. № 6. С. 68.
Li N., Qiu R., Zhang X. et al. // Tetrahedron 2015. V. 71. № 25. P. 4275. https://doi.org/10.1016/J.TET.2015.05.013
Yang M., Gabbaï F.P. // Inorg. Chem. 2017. V. 56. № 16. P. 8644. https://doi.org/10.1021/acs.inorgchem.7b00293
Yang M., Hirai M., Gabbaï F.P. // Dalton Trans. 2019. V. 48. № 20. P. 6685. https://doi.org/10.1039/C9DT01357A
Mushtaq R., Rauf M., Bolte M. et al. // Appl. Organomet. Chem. 2016. V. 31. № 5. P. 1. https://doi.org/10.1002/aoc.3606
Duffin R.N., Blair V.L., Kedzierskib L. et al. // Dalton Trans. 2018. V. 47. № 3. P. 971. https://doi.org/10.1039/C7DT04171C
Polychronis N.M., Banti C.N., Raptopoulou C.P. et al. // Inorg. Chim. Acta. 2019. V. 489. № 1. P. 39. https://doi.org/10.1016/j.ica.2019.02.004
Islam A., Rodrigues B.L., Marzano I.M. et al. // Eur. J. Med. Chem. 2016. V. 109. № 15. P. 254. https://doi.org/10.1016/j.ejmech.2016.01.003
Zhang X., Cui L., Zhang X. et al. // J. Mol. Struct. 2017. V. 1134. P. 742. https://doi.org/10.1016/j.molstruc.2017.01.039
Thepe T.C., Garascia R.I., Selvoski M.A. et al. // Sci. 1977. V. 77. № 3. P. 134.
Шарутин В.В., Шарутина О.К., Сенчурин В.С. и др. // Вестник ЮУрГУ. Сер. Химия. 2017. Т. 9. № 3. С. 71. https://doi.org/10.14529/chem170309
Шарутин В.В., Шарутина О.К., Сенчурин В.С. и др. // Журн. общ. химии. 2016. Т. 86. № 1. С. 92 (Sharutin V.V., Sharutina O.K., Senchurin V.S. et al. // Russ. J. Gen. Chem. 2016. V. 86. № 1. P. 85). https://doi.org/10.1134/S1070363216010151
Шарутин В.В., Шарутина О.К., Молокова О.В. // Журн. неорган. химии. 2012. Т. 57. № 6. С. 902 (Sharutin V.V., Sharutina O.K., Molokova O.V. // Russ. J. Inorg. Chem. 2012. V. 57. № 6. P. 832). https://doi.org/10.1134/S0036023612010226
Шарутин В.В., Шарутина О.К., Пакусина А.П. и др. // Журн. общ. химии. 1997. Т. 67. № 9. С. 1536.
Quan L., Yin H., Cui J. et al. // J. Organomet. Chem. 2009. V. 694. № 23. P. 3708. https://doi.org/10.1016/j.jorganchem.2009.07.040
Шарутин В.В., Шарутина О.К., Губанова Ю.О. и др. // Журн. общ. химии. 2020. Т. 90. № 1. С. 136 (Sharutin V.V., Sharutina O.K., Gubanova Y.O. et al. // Russ. J. Gen. Chem. 2020. V. 90. № 1. Р. 105).https://doi.org/10.1134/S1070363220010168
Sharutin V.V., Sharutina O.K., Gubanova Y.O. et al. // Mendeleev Commun. 2020. V. 30. № 6. P. 97. https://doi.org/10.1016/j.mencom.2020.01.032
Jiang J., Yin H., Wang F. et al. // Dalton Trans. 2013. V. 42. P. 8563. https://doi.org/10.1039/c3dt50221j
SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Madison (WI, USA): Bruker AXS Inc., 1998.
SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Madison (WI, USA): Bruker AXS Inc., 1998.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. A-ppl. Cryst. 2009. V. 42. P. 339. https://doi.org/10.1107/S0021889808042726
Baruchki H., Coles S.L., Costello J.F. et al. // Dalton Trans. 2000. V. 14. P. 2319. https://doi.org/10.1039/b002337j
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия


