Координационная химия, 2022, T. 48, № 9, стр. 566-571
Синтез и строение комплексов палладия [Ph3PEt][PdBr3(Dmso)], [Ph3PCH2OMe][PdBr3(Dmso)], [Ph3PC5H9-cyclo][PdBr3(Dmso)], [Ph3PCH2CH=CHCH2PPh3][PdBr3(Dmso)]2
В. В. Шарутин 1, *, О. К. Шарутина 1, В. С. Сенчурин 1
1 Национальный исследовательский Южно-Уральский государственный университет
Челябинск, Россия
* E-mail: sharutin50@mail.ru
Поступила в редакцию 16.12.2021
После доработки 01.02.2022
Принята к публикации 02.02.2022
- EDN: ULGHHA
- DOI: 10.31857/S0132344X22090055
Аннотация
Из бромида органилтрифенилфосфония и бромида палладия(II) в присутствии бромоводородной кислоты получены ионные комплексы палладия(II) с моноядерными анионами [Ph3PEt][PdBr3(DMSO)] (I), [Ph3PCH2OMe][PdBr3(DMSO)] (II), [Ph3PC5H9-cyclo][PdBr3(DMSO)] (III) и [Ph3PCH2CH=CHCH2PPh3]- [PdBr3(DMSO)]2 (IV), строение которых установлено методом рентгеноструктурного анализа (CCDC № 2115506 (I), 2115228 (II), 888748 (III), 2115007 (IV)). В состав комплексов входят катионы органилтрифенилфосфония и анионы [PdBr3(DMSO)].
Координационная химия комплексов палладия интересна из-за их эффективного применения в катализе [1–10], широкого использования в реакциях органического и элементоорганического синтеза [11–15]. В настоящее время интенсивно изучаются структурные особенности координационных соединений палладия. Многочисленные структурно охарактеризованные ионные галогенсодержащие комплексы палладия в основном представлены моноядерными [PdHal4]2– и в меньшей степени биядерными анионами [Pd2Hal6]2– [16]. Влияние растворителей на дизайн Pd-содержащих анионов, а также взаимных превращений анионов друг в друга в различных растворителях рассматривалось в [17]. Ранее сообщалось о синтезе комплексов палладия(II) с S-координированной молекулой диметилсульфоксида в моноядерных анионах [PdHal3(DMSO)]– [18–28], однако бромсодержащие производные среди них немногочисленны.
В настоящей работе продолжено изучение синтеза и особенностей строения неизвестных ранее ионных комплексов палладия [Ph3PR]+- [PdBr3(DMSO)]–.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали 48%-ную бромоводородную кислоту (Sigma-Aldrich), бромид палладия(II) (ABCR), бромиды этилтрифенилфосфония, метоксиметилтрифенилфосфония и циклопентилтрифенилфосфония, а также дибромид бутен-2-бис-трифенилфосфония (Alfa Aesar). Растворитель диметилсульфоксид марки “х. ч.” использовали без дополнительной очистки.
Синтез [Ph3PEt][PdBr3(DMSO)] (I). В 2 мл 48%-ной бромистоводородной кислоты растворяли 0.15 г бромида палладия(II) (0.56 ммоль) и при перемешивании прибавляли раствор 0.42 г (1.12 ммоль) бромида трифенилэтилфосфония в 20 мл горячей воды. Наблюдали образование осадка коричневого цвета, который отфильтровывали, сушили и растворяли в 5 мл диметилсульфоксида. После испарения растворителя на воздухе в течение 3 нед. получили коричневые кристаллы I. Выход 0.31 г (78%). Тразл = 114°С.
ИК-спектр (ν, см−1): 3053, 3022, 2988, 2941, 2909, 1585, 1479, 1437, 1186, 1117, 1022, 995, 976, 914, 733, 721, 690, 529, 503, 488, 424.
Синтез [Ph3PCH2OMe][PdBr3(DMSO)] (II) выполняли методом, аналогичным для комплекса I исходя из бромида метоксиметилтрифенилфосфония 0.43 г (1.12 ммоль) и бромида палладия (II) 0.15 г (0.56 ммоль). II: кристаллы коричневого цвета, Тразл = 118°С. Выход 0.30 г (72%). ИК-спектр (ν, см−1): 3061, 3021, 2992, 2909, 2828, 1585, 1483, 1439, 1314, 1188, 1113, 1022, 997, 972, 947, 934, 918, 893, 793, 745, 721, 691, 532, 501, 426.
Синтез [Ph3PC5H9-cyclo][PdBr3(DMSO)] (III) выполняли методом, аналогичным для комплекса I исходя из бромида циклопентилтрифенилфосфония 0.46 г (1.12 ммоль) и бромида палладия (II) 0.15 г (0.56 ммоль). III: кристаллы коричневого цвета, Тразл = 166°С. Выход 0.37 г (86%). ИК-спектр (ν, см−1): 3052, 3040, 3027, 3010, 2993, 2962, 2924, 2914, 2872, 1586, 1487, 1440, 1343, 1317, 1294, 1111, 1024, 996, 908, 759, 750, 725, 693, 530, 515, 457, 433.
Синтез [Ph3PCH2CH=CHCH2PPh3][PdBr3(DMSO)]2 (IV) выполняли методом, аналогичным для комплекса I исходя из дибромида бутен-2-бис-трифенилфосфония 0.41 г (0.56 ммоль) и бромида палладия (II) 0.15 г (0.56 ммоль). IV: кристаллы коричневого цвета, Тразл = 202°С. Выход 0.26 г (65%). ИК-спектр (ν, см−1): 3051, 3013, 2974, 2935, 2907, 2851, 1634, 1607, 1585, 1481, 1435, 1311, 1184, 1161, 1113, 995, 974, 812, 746, 721, 689, 540, 507, 461, 447, 428.
ИК-спектры соединений записывали на ИК-Фурье спектрометре Shimadzu IRAffinity-1S в таблетках KBr. Элементный анализ проводили на анализаторе Euro EA3028-НТ.
РСА проведен на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (графитовый монохроматор) при 293 К. Сбор, первичная обработка данных, уточнение параметров элементарной ячейки, учет поглощения, определение и уточнение структур проведены по программам [29–31]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов.
Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (ССDС № 2115506 (I), 2115228 (II), 888748 (III), 2115007 (IV); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/ data_request/cif).
Соединение I: коричневые кристаллы триклинные, пр. гр. $P\bar {1}$, a = 9.571(6), b = 11.169(6), c = = 12.978(10) Å, α = 77.51(3)°, β = 77.26(4)°, γ = = 70.21(2)°, V = 1257.9(14) Å3, Z = 2, ρ(выч.) = = 1.889 г/см3; μ = 5.661 мм–1, F(000) = 696.0. Измерено всего 29 674 отражений, независимых отражений 5588 (Rint = 0.0590), параметров уточнения 265: R1 = 0.0509, wR2 = 0.1243.
Соединение II: коричневые кристаллы моноклинные, пр. гр. P21, a = 12.596(15), b = 9.141(10), c = 22.96(2) Å, β = 91.81(5)°, V = 2643(5) Å3, Z = 2, ρ(выч.) = 1.839 г/см3; μ = 5.394 мм–1, F(000) = 1424.0. Измерено всего 36 366 отражений, независимых отражений 8088 (Rint = 0.0480), параметров уточнения 547: R1 = 0.0290, wR2 = 0.0625.
Соединение III: коричневые кристаллы моноклинные, пр. гр. Cm, a = 12.5097(2), b = 14.1923(3), c = 17.6335(7) Å, β = 116.3960(10)°, V = 1418.05(5) Å3 , Z = 2, ρ(выч.) = 1.810 г/см3; μ = 5.142 мм–1, F(000) = = 740.0. Измерено всего 30 522 отражений, независимых отражений 5948 (Rint = 0.0423), параметров уточнения 291: R1 = 0.0173, wR2 = 0.0191.
Соединение IV: коричневые кристаллы триклинные, пр. гр. Р$\bar {1}$, a = 9.755(75), b = 11.241(6), c = 12.276(7) Å, α = 92.48(2)°, β = 111.02(3)°, γ = = 96.03(3)°, V = 1244.8(13) Å3, Z = 2, ρ(выч.) = = 1.904 г/см3; μ = 5.720 мм–1, F(000) = 692.0. Измерено всего 30 998 отражений, независимых отражений 5560 (Rint = 0.0345), параметров уточнения 264: R1 = 0.0387, wR2 = 0.0926.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для синтеза ионных комплексов палладия(II) водный раствор бромида алкилтрифенилфосфония приливали к раствору бромида палладия(II) в бромоводородной кислоте, при этом наблюдали образование осадка коричневого цвета, который после фильтрования и высушивания растворяли в диметилсульфоксиде.
После испарения растворителя получали диметилсульфоксидотрибромопалладат алкилтрифенилфосфония [Ph3PR]+[PdBr3(DMSO)]– в виде коричневых кристаллов:
Использование в реакции соли фосфония с более сложным катионом приводило к синтезу комплекса также с моноядерным анионом:
Соединения I−IV − коричневые кристаллические вещества, устойчивые к действию влаги и кислорода воздуха, хорошо растворимые в ацетонитриле, хлороформе, тетрагидрофуране и нерастворимые в алифатических углеводородах.
В ИК-спектрах соединений I−IV наблюдаются интенсивные полосы поглощения в областях 1440−1435 и 997−995 см–1, которые характеризуют валентные колебания связи P−СPh [32]. Наблюдаемое смещение полос поглощения связи S=O (1117−1111 см–1) в коротковолновую область по сравнению с несвязанным диметилсульфоксидом (1055 см–1) характерно для подобных комплексов с S-координированным ДМСО [33].
По данным РСА, кристаллы комплексов I−IV состоят из катионов органилтрифенилфосфония и моноядерных анионов (рис. 1–4), причем в кристалле II присутствуют по два типа кристаллографически независимых катионов и анионов.
Рис. 1.
Общий вид комплекса I. Длина связи: Pd(1)−Br(1) 2.4258(13), Pd(1)−Br(2) 2.4320(13), Pd(1)−Br(3) 2.4429(17), Pd(1)−S(1) 2.2669(18), P(1)−C(1) 1.792(4), P(1)−C(7) 1.811(5) Å и валентный угол: Br(1)Pd(1)Br(2) 178.13(3)°, S(1)Pd(1)Br(3) 177.30(3)°, C(1)P(1)C(7) 106.2(2)°, C(7)P(1)C(11) 113.5(2)°.
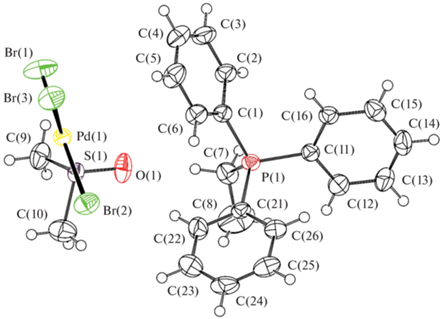
Рис. 2.
Общий вид комплекса II. Длина связи: Pd(1)−Br(1) 2.441(2), Pd(1)−Br(2) 2.444(2), Pd(1)−Br(3) 2.437(3), Pd(1)−S(1) 2.265(3), Pd(2)−Br(4) 2.431(2), Pd(2)−Br(5) 2.447(3), Pd(2)−Br(6) 2.427(2), Pd(2)−S(2) 2.270(3), P(1)−C(11) 1.788(5), P(1)−C(7) 1.832(5), P(2)−C(31) 1.795(5), P(2)−C(37) 1.813(5) Å и валентный угол: Br(1)Pd(1)Br(2) 176.43(3)°, S(1)Pd(1)Br(3) 172.12(4)°, C(1)P(1)C(7) 105.7(2)°, C(7)P(1)C(11) 110.6(3)°, Br(4)Pd(2)Br(6) 178.01(3)°, S(2)Pd(2)Br(5) 177.51(4)°, C(37)P(2)C(51) 105.4(2)°, C(31)P(2)C(51) 111.5(2)°.
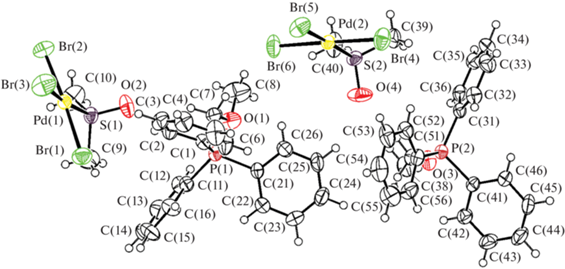
Рис. 3.
Общий вид комплекса III. Длина связи: Pd(1)−Br(1) 2.4298(19), Pd(1)−Br(2) 2.436(3), Pd(1)−Br(3) 2.428(3), Pd(1)−S(1) 2.2691(19), P(1)−C(1) 1.783(5), P(1)−C(31) 1.804(4) Å и валентный угол: Br(2)Pd(1)Br(3) 176.30(2)°, S(1)Pd(1)Br(3) 178.85(3)°, C(11)P(1)C(21) 108.0(2)°, C(11)P(1)C(31) 111.4(2)°.
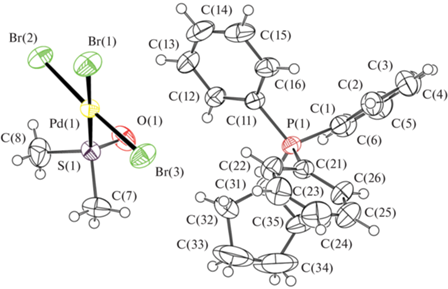
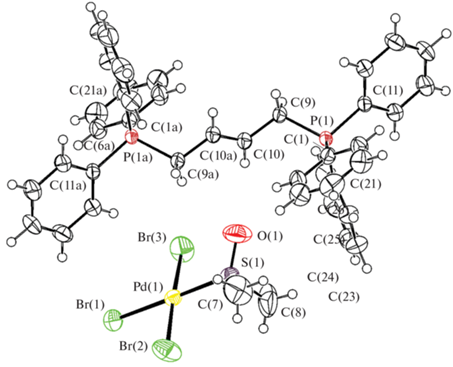
Рис. 4.
Общий вид комплекса IV. Pd(1)−Br(1) 2.4343(14), Pd(1)−Br(2) 2.4240(13), Pd(1)−Br(3) 2.4099(12), Pd(1)−S(1) 2.2571(16), P(1)−C(21) 1.787(4), P(1)−C(9) 1.806(3) Å и валентный угол: Br(2)Pd(1)Br(3) 175.42(3)°, S(1)Pd(1)Br(1) 177.42(3)°, C(9)P(1)C(11) 107.51(16)°, C(1)P(1)C(9) 111.77(17)°.
Атомы фосфора в катионах имеют мало искаженную тетраэдрическую координацию с валентными углами CPC 106.2(2)°−113.5(2)°, 105.4(2)°− 111.5(2)° (II), 108.0(2)°−111.4(2)° (III), 107.51(16)°− 111.77(17)° (IV), которые мало отличаются от теоретического значения, и близкими длинами связей P−C (1.792(4)−1.811(5), 1.788(5)−1.832(5), 1.783(5)− 1.804(4), 1.787(4)−1.806(3) Å соответственно). Связи P−CAlk длиннее, чем связи P−CPh. В плоско-квадратных анионах [PdBr3(DMSO)]− длины связей Pd−Br изменяются в интервалах 2.4258(13)− 2.4429(17), 2.437(3)−2.444(2) и 2.431(2)−2.447(2), 2.428(3)−2.436(3), 2.4099(12)−2.4343(14) Å соответственно, а расстояния S−Pd (2.2669(18), 2.265(3) и 2.270(3), 2.2691(19), 2.2571(16) Å) меньше суммы ковалентных радиусов атомов палладия и серы (2.44 Å [34]). цис-Углы BrPdBr (89.19(4)° и 90.24(4)°, 89.23(3)°−91.33°, 89.32(6)° и 89.65(6)°, 89.80(4)° и 89.80(4)°) практически не отличаются от теоретического значения (90°); значения транс-углов BrPdBr и SPdBr сравнимы между собой и составляют 178.13(3)° и 177.30(3)° для I, 176.43(3)°, 172.12(4)° и 178.01(3)°, 177.51(4)° для II, 176.30(2)° и 178.85(3)° для III, 175.42(3)° и 177.42(3)° для IV. В анионах комплексов I−IV отклонение атома палладия от плоскости Br3S незначительно (0.026−0.057 Å), причем минимальная и максимальная величины проявляются в структурах III и IV соответственно.
Структурная организация в кристаллах комплексов I−IV сформирована межионными контактами S=O∙∙∙H−C 2.35−2.71 Å и Pd−Br∙∙∙H−C 2.72−3.04 Å, что близко к сумме ван-дер-ваальсовых радиусов атомов кислорода и водорода (2.62 Å), а также брома и водорода (2.93 Å) [35].
В заключение oтметим, что из бромидов органилтрифенилфосфония и бромида палладия(II) в присутствии бромоводородной кислоты получены ионные комплексы палладия с моноядерными анионами, в которых при растворении в диметилсульфоксиде легко происходит лигандный обмен с образованием комплексов [Ph3PEt][PdBr3(DMSO)] (I), [Ph3PCH2OMe][PdBr3(DMSO)] (II), [Ph3PC5H9-cyclo][PdBr3(DMSO)] (III) и [Ph3PCH2CH= CHCH2PPh3] [PdBr3(DMSO)]2 (IV). В анионах наблюдается эффект транс-влияния диметилсульфоксидного заместителя, приводящий к удлинению транс-связей Pd–Br по сравнению со средними значениями цис-связей на 0.014–0.018 Å.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Эльшенбройх К. Металлоорганическая химия. М.: Лаборатория знаний, 2021. 749 с.
Gardiner M.G., Ho C.C., McGuinness D.S., Liu Y.L. // Austr. J. Chem. 2020. V. 73. P. 1158. https://doi.org/10.1071/CH20194
Gacal E., Denizalti S., Kinal A. et al. // Tetrahedron. 2018. V. 74. № 47. P. 6829. https://doi.org/10.1016/j.tet.2018.10.003
Mansour W., Fettouhi M., El Ali B. // ACS Omega. 2020. V. 5. № 50. P. 32515. https://doi.org/10.1021/acsomega.0c04706
Mansour W., Suleiman R., Fettouhi M., El Ali B. // ACS Omega. 2020. V. 5. № 50. P. 23687. https://doi.org/10.1021/acsomega.0c02413
Trofimov B.A., Vasilevsky S.F., Gusarova N.K. et al. // Mendeleev Commun. 2008. V. 18. № 6. P. 318. https://doi.org/10.1016/j.mencom.2008.11.010
Bykov M.V., Abramov Z.D., Orlov T.S. et al. // J. Struct. Chem. 2021. V. 62. № 8. P. 1218. https://doi.org/10.1134/S0022476621080072
Artem’ev A.V., Malysheva S.F., Gusarova N.K. et al. // Tetrahedron. 2016. V. 72. № 4. P. 443. https://doi.org/10.1016/j.tet.2015.11.009
Artem’ev A.V., Kuimov V.A., Matveeva E.A. et al. // Inorg. Chem. Commun. 2017. V. 86. P. 94. https://doi.org/10.1016/j.inoche.2017.09.008
Adamson A., Budiman Y.P., Mkhalid I. // J. Struct. Chem. 2020. V. 61. P. 466. https://doi.org/10.1134/S0022476620030130
Wolfe M.M.W., Shanahan J.P., Kampf J.W., Szymczak N.K. // J. Am. Chem. Soc. 2020. V. 142. № 43. P. 18698. https://doi.org/10.1021/jacs.0c09505
Mori M., Sunatsuki Y., Suzuki T. // Inorg. Chem. 2020. V. 59. № 24. P. 18225. https://doi.org/10.1021/acs.inorgchem.0c02706
Behnia A., Fard M.A., Blacquiere J.M., Puddephatt R.J. // Organometallics. 2020. V. 39. № 22. P. 4037. https://doi.org/10.1021/acs.organomet.0c00615
Materne K., Braun-Cula B., Herwig C. et al. // Chem. Eur. J. 2017. V. 23. P. 11797. https://doi.org/10.1002/chem.201703489
Lin T.-P., Ke I.-Sh., Gabbaï F.P. // Angew. Chem., Int. Ed. 2012. V. 51. P. 4985. https://doi.org/10.1002/anie.201200854
Cambridge Crystallographic Data Center. 2020. deposit@ccdc.cam.ac.uk. http://www.ccdc.cam.ac.uk
Шарутин В.В., Шарутина О.К., Сенчурин В.С. и др. // Журн. общ. химии. 2017. Т. 87. № 1. С. 128 (Sharutin V.V., Sharutina O.K., Senchurin V.S. et al. // Russ. J. Cen. Chem. 2017. V. 87. № 1. P. 122). https://doi.org/10.1134/S1070363217010194
Шарутин В.В., Сенчурин В.С., Шарутина О.К. // Журн. неорган. химии. 2013. Т. 58. № 5. С. 616 (Sharutin V.V., Senchurin V.S., Sharutina O.K. // Russ. J. Inorg. Chem. 2013. V. 58. № 5. P. 543). https://doi.org/10.1134/S0036023613050203
Шарутин В.В., Шарутина О.К., Сенчурин В.С., Ильченко И.А. // Коорд. химия. 2015. Т. 41. № 7. С. 430 (Sharutin V.V., Sharutina O.K., Senchurin V.S., Il’chenko B.A. // Russ. J. Coord. Chem. 2015. V. 41. № 7. P. 462). https://doi.org/10.1134/S1070328415070088
Sharutin V.V., Sharutina O.K., Senchurin V.S., Il’chenko I.A. // Bulletin of the South Ural State University. Ser. Chemistry. 2015. V. 7. № 2. P. 11.
Ярыгина Д.М., Баталов А.Е., Сенчурин В.С. // Вестник ЮУрГУ. Сер. “Химия”. 2018. Т. 10. № 3. С. 51. https://doi.org/10.14529/chem180306
Шарутин В.В., Шарутина О.К., Сенчурин В.С., Андреев П.В. // Журн. неорган. химии. 2018. Т. 63. № 6. С. 712 (Sharutin V.V., Sharutina O.K., Senchurin V.S., Andreev P.V. // Russ. J. Inorg. Chem. 2018. V. 63. № 6. P. 747). https://doi.org/10.1134/S0036023618060220
Денисов М.С., Дмитриев М.В., Ерошенко Д.В. и др. // Журн. неорган. химии. 2019. Т. 64. № 1. С. 38 (Denisov M.S., Dmitriev M.V., Eroshenko D.V. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 1. P. 56). https://doi.org/10.1134/S0036023619010054
Gupta A., Deka R., Butcher R.J., Singh H.B. // Acta Crystallogr. E. 2020. V. 76. P. 1520. https://doi.org/10.1107/S2056989020011482
Hazell A., McKenzie C.J., Nielsen L.P. // Dalton Trans. 1998. № 11. P. 1751. https://doi.org/10.1039/a800602d
Geary W.J., Mason N.J., Nixon L.A., Nowell I.W. // Chem. Commun. 1980. № 22. P. 1064. https://doi.org/10.1039/c39800001064
Schroeter F., Soellner J., Strassner T. // Chem. Eur. J. 2019. V. 25. P. 2527. https://doi.org/10.1002/chem.201804431
Lang C., Pahnke K., Kiefer C. et al. // Polym. Chem. 2013. V. 4. № 21. P. 5456. https://doi.org/10.1039/C3PY00648D
SMART and SAINT-Plus. Version 5.0. Data Collection and Processing Software for the SMART System. Madison (WI, USA): Bruker AXS Inc., 1998.
SHELXTL/PC. Version 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Madison: (WI, USA): Bruker AXS Inc., 1998.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. A-ppl. Cryst. 2009. V. 42. P. 339. https://doi.org/10.1107/S0021889808042726
Преч Э., Бюльманн Ф., Аффольтер К. Определение строения органических соединений. Таблицы спектральных данных М.: Мир; БИНОМ. Лаборатория знаний, 2006. 438 с.
Кукушкин Ю.Н. Химия координационных соединений: Учебное пособие для студентов хим. и хим.-технол. спец. вузов. М.: Высш. школа, 1985. С. 162.
Cordero B., Gómez V., Platero-Prats A.E. et al. // Dalton Trans. 2008. V. 21. P. 2832. https://doi.org/10.1039/B801115J
Mantina M., Chamberlin A.C., Valero R. et al. // J. Phys. Chem. A. 2009. V. 113. № 19. P. 5806. https://doi.org/10.1021/jp8111556
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия


