Координационная химия, 2022, T. 48, № 9, стр. 558-565
Метакрилатоуранилаты кобальта и кальция – синтез и строение
В. Н. Сережкин 1, *, Н. А. Шимин 1, М. С. Григорьев 2, Л. Б. Сережкина 1, **
1 Самарский национальный исследовательский университет им. академика С.П. Королева
Самара, Россия
2 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
Москва, Россия
* E-mail: serezhkin@samsu.ru
** E-mail: lserezh@samsu.ru
Поступила в редакцию 04.02.2022
После доработки 15.03.2022
Принята к публикации 16.03.2022
- EDN: DOUGQY
- DOI: 10.31857/S0132344X22090043
Аннотация
Проведены синтез, рентгеноструктурное (CCDC № 2124087 (I), 2124088 (II)) и ИК-спектроскопическое исследование кристаллов двух новых комплексов уранила: [Co(H2O)6][UO2(Mac)3]2 ∙ 8H2O (I) и {Ca(H2O)2[UO2(Mac)3]2} (II) (Mac = метакрилат-ион CH2C(CH3)COO–). Урансодержащими структурными единицами кристаллов I и II являются одноядерные комплексы [UO2(Mac)3]– с кристаллохимической формулой ${\text{AB}}_{3}^{{01}}$ (A = ${\text{UO}}_{2}^{{2 + }},$ B01 = Mac). В кристаллах I комплексы [UO2(Mac)3]– сосуществуют с октаэдрическими аквакомплексами [Co(H2O)6]2+ и внешнесферными молекулами воды. В кристаллах II каждый ион кальция связывает две молекулы воды и два аниона [UO2(Mac)3]–, образуя трехъядерные электронейтральные комплексы {Ca(H2O)2(UO2)2(Mac)6} с кристаллохимической формулой ${\text{A}}{\kern 1pt} {\text{'M}}_{2}^{1}{{{\text{A}}}_{{\text{2}}}}{\text{B}}_{2}^{{01}}{\text{B}}_{4}^{{11}}$ (A' = Ca2+, A = ${\text{UO}}_{2}^{{2 + }}{\text{,}}$ B01 и B11 = Mac, M1 = H2O). C помощью метода молекулярных полиэдров Вороного−Дирихле охарактеризованы межмолекулярные контакты, которые связывают в II урансодержащие комплексы в 3D-каркас.
К настоящему времени охарактеризовано около 20 метакрилатсодержащих соединений уранила, сведения о составе и строении которых были получены лишь в последние годы. Кроме дигидрата метакрилата уранила UO2(Мac)2 ⋅ 2Н2О [1], где Мac – анион метакриловой кислоты CH2C(CH3)COO–, изучено несколько аддуктов UO2(Мac)2 ⋅ nL ⋅ mН2О, где L – карбамид или его производные [1, 2]. Установлена также структура кристаллов метакрилатоуранилатов некоторых одно- (Li, Na, Rb, Cs, Tl [3]) и двухвалентных (Mg, Zn, Sr, Ba, Pb [4–6]) металлов. В охарактеризованных соединениях отношение rm = Мac : U равно 2, 3 или 4. Имеющиеся данные показывают, что наиболее часто встречается rm = 3, при котором образуются гексагонально-бипирамидальные комплексы [UO2(Мac)3]– с кристаллохимической формулой (КХФ) ${\text{AB}}_{3}^{{01}}$ (A = ${\text{UO}}_{2}^{{2 + }},$ B01 = Мac). Параметры КХФ и входящие в них типы координации лигандов записаны в соответствии с [7]. В таких комплексах атомы U(VI) проявляют координационное число (КЧ) 8, а каждый метакрилат-ион выступает в роли бидентатно-хелатного лиганда B01. При rm = 2 метакрилат-ионы также обычно координированы по типу B01. Однако состав и строение возникающих комплексов зависит от природы электронейтральных солигандов L, присутствующих в кристаллизующейся системе. В простейшем случае (солиганд – вода [1]) образуются центросимметричные нейтральные комплексы [UO2(Mac)2-(Н2О)2] с КЧ(U) 8 и КХФ ${\text{AB}}_{2}^{{01}}{\text{M}}_{2}^{1}{\text{.}}$ Если же при образовании аддуктов в роли L выступают молекулы амидов, то строение возникающих комплексов зависит от отношения rL = L : U в составе кристаллов. Так, при rL = 1.5, которому отвечает состав (UO2)2(Mac)4(L)3, происходит диспропорционирование веществ на уже рассмотренный анионный комплекс [UO2(Mac)3]– с КЧ(U) 8 и катионный комплекс [UO2(Mac)(L)3]+ с КХФ ${\text{A}}{{{\text{B}}}^{{{\text{01}}}}}{\text{M}}_{3}^{1}$ и КЧ(U) 7. Если же rL = 1.0, то аддукт состоит из димеров [UO2(Mac)2(L)]2 c КЧ(U) 7 и КХФ AB2B01M1 (A = ${\text{UO}}_{2}^{{2 + }}{\text{,}}$ B2 и B01 = Mac, M1 = тетраметилкарбамид [1]). Как видно из КХФ, в указанном аддукте анионы Mac проявляют разный тип координации, а именно бидентатно-мостиковый B2 и бидентатно-циклический B01. Другим известным примером соединений, содержащих ионы Mac с разной кристаллоструктурной ролью, является структура Pb[UO2(Mac)4], для которой rm = 4 и КХФ имеет вид ${\text{A}}{{{\text{B}}}^{{{\text{01}}}}}{\text{M}}_{3}^{1}$ [6].
Цель настоящей работы – изучение строения и некоторых свойств новых метакрилатных комплексов уранила: триметакрилатоуранилата гексааквакобальта(II)октагидрата [Co(H2O)6][UO2(Mac)3]2 ∙ ∙ 8H2O (I) и триметакрилатоуранилата диаквакальция {Ca(H2O)2[UO2(Mac)3]2} (II), в которых роль двухвалентных катионов играют Са и Со.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение метакрилатоуранилатов затруднено предрасположенностью метакриловой кислоты к быстрой и необратимой полимеризации, которая проявляется в помутнении водного раствора и сопровождается образованием гелеобразного продукта, поэтому синтез проводили в сосудах, окрашенных в черный цвет. Оксид урана(VI) получали термическим (350°С) разложением гексагидрата нитрата уранила.
Синтез кристаллов I. В водном растворе метакриловой кислоты (8.40 ммоль, 0.723 г) растворяли CoCO3 (1.575 ммоль, 0.1875 г) при нагревании на водяной бане до полного прекращения выделения углекислого газа. К раствору добавляли UO3 (0.525 ммоль, 0.150 г). Исходное мольное соотношение реагентов CoCO3 : UO3 : HМac составляло 3 : 1 : 16. Изотермическое испарение при комнатной температуре полученного раствора в течение 4–5 сут приводило к образованию бордовых призматических кристаллов. Выход 75%. По результатам химического анализа: найдено, %: U 34.3. Для Co(UO2(CH2C(CH3)COO)3)2 ∙ 14H2O вычислено, %: U 34.97.
Синтез кристаллов II. К водно-спиртовому раствору метакриловой кислоты (8.40 ммоль, 0.723 г) добавляли навеску CaCO3 (1.05 ммоль, 0.105 г) и нагревали до полного прекращения выделения углекислого газа, после чего добавляли UO3 (0.525 ммоль, 0.150 г). Полученный раствор подвергали изотермическому испарению при комнатной температуре. Мольное соотношение исходных реагентов CaCO3 : UO3 : HМac составляло 2 : 1 : 16. Через примерно 5 сут формировались желтые кристаллы. Выход около 60%. По результатам химического анализа: найдено, %: U 41.9. Для Ca(UO2)2(CH2C(CH3)COO)6 ⋅ 2Н2О вычислено, %: U 42.27.
РСА проведен на автоматическом четырехкружном дифрактометре с двумерным детектором Bruker KAPPA APEX II. Параметры элементарной ячейки уточнены по всему массиву данных [8]. В экспериментально определенные значения интенсивности рефлексов внесены поправки на поглощение с использованием программы SADABS [9]. Структуры расшифрованы прямым методом SHELXS97 [10] и уточнены полноматричным методом наименьших квадратов SHELXL-2014 [11] по F 2 по всем данным в анизотропном приближении для всех неводородных атомов кроме атомов O разупорядоченных молекул воды в I. Атомы H метакрилат-анионов размещены в геометрически вычисленных позициях с Uизо = 1.2Uэкв(C) для групп CH2 и Uизо = 1.5Uэкв(C) для групп CH3, при этом в структуре II уточнена ориентация групп CH3. В структуре I положения групп CH2 и CH3 разупорядочены. Атомы H молекул воды в структуре I не локализованы. Координаты атомов H молекулы воды в структуре II найдены с помощью процедуры CALC_OH [12] в программном комплексе WinGX [13]. После одного цикла уточнения этих атомов с Uизо = 1.5Uэкв(O) их координаты зафиксированы. Структура I уточнена как псевдомероэдрический двойник с вкладом второго домена 0.4190(13). Параметр Флэка x [14] (табл. 1) показывает правильность определения абсолютной структуры для II.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур I и II
| Парамeтр | Значение | |
|---|---|---|
| I | II | |
| Сингония | Моноклинная | Ромбическая |
| Пр. группа, Z | P21/n, 2 | P21212, 2 |
| a, Å | 6.8455(2) | 8.9635(3) |
| b, Å | 24.0652(8) | 23.8200(7) |
| c, Å | 14.0593(6) | 8.0466(2) |
| β, град | 90.078(2) | 90 |
| V, Å3 | 2316.10(14) | 1718.03(9) |
| ρ, г/см3 | 1.953 | 2.178 |
| μ, мм−1 | 7.417 | 9.636 |
| T, K | 100(2) | 100(2) |
| Размеры кристалла, мм | 0.40 × 0.10 × 0.08 | 0.36 × 0.18 × 0.12 |
| θmax, град | 29.999 | 34.996 |
| Область h, k, l | –9 ≤ h ≤ 9, –33 ≤ k ≤ 33, –19 ≤ l ≤ 19 |
–13 ≤ h ≤ 14, –38 ≤ k ≤ 38, –12 ≤ l ≤ 12 |
| Число отражений измеренных/независимых (N1), (Rint) | 32 498/6654 (0.0393) | 46 252/7533 (0.0392) |
| Число отражений с I > 1.96σ(I) (N2) | 5660 | 7153 |
| Число уточняемых параметров | 256 | 213 |
| R1 по N2 | 0.0297 | 0.0170 |
| wR2 по N1 | 0.0641 | 0.0344 |
| S | 1.082 | 1.002 |
| Остаточная электронная плотность (min/max), е/Å3 | –2.386/2.046 | –1.392/1.013 |
Параметры рентгеноструктурного эксперимента и окончательные значения факторов недостоверности для кристаллов I и II приведены в табл. 1, характеристики основных длин связей и валентных углов полиэдров UO8 и параметры водородных связей – в табл. 2, 3. Координационные числа атомов в структурах рассчитаны с помощью метода пересекающихся сфер [15, 16].
Таблица 2.
Основные геометрические параметры полиэдра урана(VI) и параметры водородных связей (BC) в структуре I
| Связь | d, Å | Ω, % * | Угол | ω, град | |||
|---|---|---|---|---|---|---|---|
| Гексагональная бипирамида UO8 | |||||||
| U–O(1) | 1.762(4) | 21.95 | O(1)UO(2) | 179.94(17) | |||
| U–O(2) | 1.770(4) | 21.92 | O(3)UO(4) | 52.19(11) | |||
| U–O(3) | 2.483(3) | 9.26 | O(4)UO(5) | 68.37(10) | |||
| U–O(4) | 2.465(3) | 9.54 | O(5)UO(6) | 52.09(10) | |||
| U–O(5) | 2.486(3) | 9.27 | O(6)UO(7) | 67.68(10) | |||
| U–O(6) | 2.470(3) | 9.46 | O(7)UO(8) | 51.85(11) | |||
| U–O(7) | 2.487(3) | 9.22 | O(8)UO(3) | 67.81(11) | |||
| U–O(8) | 2.476(3) | 9.39 | |||||
| Параметры ВС** | |||||||
| D–H…A | Расстояния, Å | Угол D–H…A, град |
Ω(D–H), % | Ω(H…A), % | Ранг грани | ||
| D–H | H…A | D…A | |||||
| C(4)H(3)…O(12) | 0.980 | 2.781 | 3.752 | 171.16 | 26.64 | 14.36 | 0 |
| C(4)H(4)…O(6) | 0.981 | 2.652 | 3.520 | 147.61 | 26.55 | 11.10 | 0 |
| C(4)H(5)…O(6) | 0.979 | 2.619 | 3.499 | 149.75 | 26.64 | 11.54 | 0 |
| C(7)H(6)…O(14) | 0.978 | 2.822 | 3.794 | 172.69 | 26.71 | 11.04 | 0 |
| C(7)H(7)…O(4) | 0.981 | 2.622 | 3.517 | 151.80 | 26.55 | 11.05 | 0 |
| C(7)H(8)…O(4) | 0.981 | 2.647 | 3.496 | 145.02 | 26.56 | 11.40 | 0 |
| C(7)H(8)…O(2) | 0.981 | 2.759 | 3.570 | 140.42 | 26.56 | 10.91 | 0 |
| C(11)H(11)…O(14) | 0.979 | 2.834 | 3.806 | 172.01 | 26.64 | 13.57 | 0 |
| C(11)H(12)…O(8) | 0.978 | 2.684 | 3.541 | 146.48 | 26.63 | 11.56 | 0 |
| C(11)H(13)…O(8) | 0.982 | 2.609 | 3.495 | 150.25 | 26.51 | 11.48 | 0 |
| C(12)H(15)…O(13) | 0.951 | 2.843 | 3.738 | 157.29 | 33.02 | 13.73 | 0 |
Таблица 3.
Основные геометрические параметры полиэдра урана(VI) и параметры ВС в структуре II
| Связь | d, Å | Ω, % | Угол | ω, град | |||
|---|---|---|---|---|---|---|---|
| Гексагональная бипирамида UO8 | |||||||
| U–O(1) | 1.767(2) | 21.80 | O(1)UO(2) | 179.26(10) | |||
| U–O(2) | 1.778(2) | 21.82 | O(3)UO(4) | 53.24(7) | |||
| U–O(3) | 2.450(2) | 9.54 | O(4)UO(5) | 70.4 (7) | |||
| U–O(4) | 2.427(2) | 9.96 | O(5)UO(6) | 52.26(6) | |||
| U–O(5) | 2.443(2) | 9.97 | O(6)UO(7) | 64.12(6) | |||
| U–O(6) | 2.535(2) | 8.56 | O(7)UO(8) | 51.96(7) | |||
| U–O(7) | 2.511(2) | 8.86 | O(8)UO(3) | 68.19(7) | |||
| U–O(8) | 2.467(2) | 9.49 | |||||
| Параметры ВС | |||||||
| D–H…A | Расстояния, Å | Угол D–H…A, град |
Ω(D–H), % | Ω(H…A), % | Ранг грани | ||
| D–H | H…A | D…A | |||||
| O(9)–H(2)…O(3) | 0.961 | 1.866 | 2.826 | 176.56 | 33.70 | 22.59 | 0 |
| C(4)–H(6)…O(5) | 0.950 | 2.731 | 3.585 | 150.02 | 32.67 | 11.18 | 0 |
| C(7)–H(10)…O(4) | 0.980 | 2.531 | 3.405 | 148.45 | 26.76 | 12.97 | 0 |
| C(12)–H(17)…O(8) | 0.980 | 2.571 | 3.345 | 135.88 | 26.80 | 14.12 | 0 |
Координаты атомов и величины температурных параметров депонированы в Кембриджском банке структурных данных (CCDC № 2124087 (I) и 2124088 (II); http://www.ccdc.cam.ac.uk/structures).
ИК-спектры записывали на ИК Фурье-спектрометре ФТ-801 при комнатной температуре в области 500–4000 см–1. Образцы готовили прессованием таблеток с KBr. Отнесение полос поглощения проводили с использованием литературных данных [17–19].
ИК-спектр I (ν, см–1): 3418 ш ν(H2O); 2991 сл, 2967 сл, 2928 сл ν(CH3); 1644 ср. δ(H2O), ν(C=C); 1503 о.с νas(COO); 1461 о.с, 1440 о.с νs(COO); 1376 ср δ(CH3); 1238 ср δ(CH); 1009 сл ω(CH2); 931 о.с νas(UO2); 867 с, 832 ср ν(C–C); 620 с δ(OCO).
ИК-спектр II (ν, см–1): 3447 ш ν(H2O); 2928 сл ν(CH3); 1636 ср δ(H2O), ν(C=C); 1507 сл νas(COO); 1458 ср, 1438 ср νs(COO); 1374 сл δ(CH3); 1238 сл δ(CH); 930 ср νas(UO2); 866 сл, 831 сл ν(C–C); 620 с δ(OCO).
Результаты ИК-спектроскопии для I и II согласуются с указанными далее данными РСА. В обоих спектрах наиболее интенсивные полосы поглощения отвечают колебаниям иона уранила и карбоксилатных групп.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
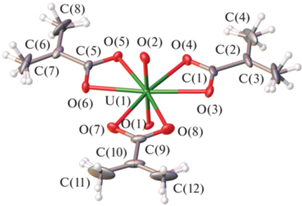
В структурах I и II содержится по одному кристаллографическому сорту атомов урана, которые занимают позиции с точечной симметрией С1. Координационным полиэдром (КП) атомов U(VI) в обеих структурах является гексагональная бипирамида UO8, в аксиальных позициях которой находятся атомы кислорода практически линейной (угол OUO 179.26°–179.93°) и равноплечной уранильной группы, а в экваториальной плоскости находятся шесть атомов кислорода трех бидентатно-циклических метакрилат-ионов (рис. 1). Урансодержащим комплексам [UO2(Мac)3]– в I и II отвечает одинаковая КХФ ${\text{AB}}_{3}^{{01}}$ (A = ${\text{UO}}_{2}^{{2 + }}{\text{,}}$ B01 = Мac). Объем полиэдров Вороного–Дирихле (ПВД) атомов урана составляет 9.45 и 9.43 Å3 для I и II соответственно, что в пределах погрешности совпадает со средним значением 9.3(2) Å3, установленным для КП UOn при n = 5–9 [20].
Рис. 1.
Строение комплекса [UO2(Мac)3]– в структуре кристаллов I. Эллипсоиды температурных смещений показаны с вероятностью 50%.
Изученные структуры I и II отличаются кристаллоструктурной ролью двухвалентных катионов (Co в I и Ca в II), которые компенсируют заряд урансодержащих ацидокомплексов. Так, I оказался изоструктурным с метакрилатоуранилатами магния и цинка, описанными в [3]. Атомы Сo занимают центросимметричные позиции, молекулы воды вокруг них разупорядочены, образуя две ориентации незначительно искаженного октаэдрического комплекса [Co(H2O)6]2+. Поэтому координационную формулу для I можно записать как [Co(H2O)6][UO2(Мac)3]2 ∙ 8H2O. Расстояния Со–О лежат в диапазоне 2.066–2.122 Å. Выявленные катионные [Co(H2O)6]2+ и анионные комплексы [UO2(Мac)3]– в I связаны между собой и расположенными между ними внешнесферными молекулами воды системой водородных связей и совокупностью электростатических взаимодействий. Из-за недостаточно высокого качества кристаллов I в их структуре не удалось определить позиции атомов водорода молекул воды и выявить все возможные H-связи, поэтому в табл. 2 указаны только некоторые из них.
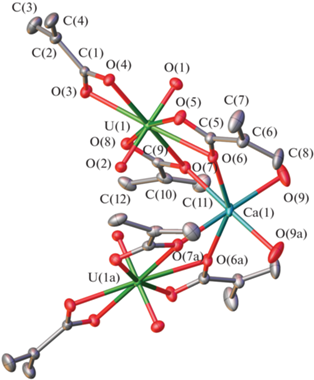
В отличие от I, при исследовании кристаллов II были установлены координаты всех атомов, включая атомы Н. Выяснилось, что атомы Ca, которые находятся на осях C2, подобно атомам Co в I проявляют КЧ 6 и образуют искаженные октаэдры CaO6 (расстояния Са–О лежат в диапазоне 2.324–2.349 Å). Однако в этих октаэдрах только два атома кислорода (оба О(9)), которые находятся на одном из ребер октаэдра, входят в состав молекул воды. Остальные же атомы (две пары O(6) и O(7)) являются атомами кислорода четырех разных метакрилат-ионов, которые содержатся в составе двух соседних комплексов [UO2(Мac)3]ˉ. Поэтому супрамолекулярной структурной единицей кристаллов II можно считать трехъядерные электронейтральные комплексы {Ca(H2O)2[UO2(Мac)3]2} с КХФ ${\text{A}}{\kern 1pt} {\text{'M}}_{2}^{1}{{{\text{A}}}_{{\text{2}}}}{\text{B}}_{2}^{{01}}{\text{B}}_{4}^{{11}}{\text{,}}$ (A' = Ca2+, A = ${\text{UO}}_{2}^{{2 + }}{\text{,}}$ B01 и B11 = Мac, M1 = H2O), которые образованы одним катионным и двумя анионными комплексами (${\text{Ca}}\left( {{{{\text{H}}}_{{\text{2}}}}{\text{O}}} \right)_{2}^{{2 + }}$ и ${\text{U}}{{{\text{O}}}_{{\text{2}}}}\left( {{\text{Мac}}} \right)_{3}^{ - }$ соответственно; рис. 2). Угол UCaU в таких тримерах, которые водородными связями объединены в цепи, распространяющиеся вдоль [001], составляет ≈86°.
Рис. 2.
Строение трехъядерного комплекса {Ca(H2O)2[UO2(Мac)3]2} в структуре II. Эллипсоиды температурных смещений показаны с вероятностью 50%. Преобразование симметрии: (а) 1 – х, 1 – y, z. Для упрощения рисунка атомы водорода не показаны.
Отсутствие статистического размещения каких-либо атомов в II позволяет охарактеризовать невалентные взаимодействия в этой структуре с помощью метода молекулярных ПВД (МПВД). Этот метод дает возможность оценить реализующиеся межмолекулярные контакты на основе характеристик МПВД, рассчитанных как сумма параметров ПВД-атомов, входящих в одну молекулу [21–23]. С позиций метода МПВД любым межмолекулярным контактам отвечают грани нулевого ранга. Как известно [21–23], ранг грани (РГ), определяющийся в процессе расчета КЧ атомов по методу пересекающихся сфер, указывает на минимальное число химических связей, которые связывают атомы с общей гранью ПВД. В кристаллах II содержатся атомы пяти химических элементов, поэтому теоретически возможно 15 типов межмолекулярных контактов. Однако реально в структуре II содержится лишь семь типов межмолекулярных контактов с РГ = 0 (табл. 4). Связывание комплексов {Ca(H2O)2[UO2(Мac)3]2} в 3D-каркас происходит в основном за счет дисперсионных взаимодействий H/H и водородных связей H/O, которым отвечают, соответственно, парциальные вклады ΔAZ ≈ 48 и 42.3% (табл. 4). Отметим, что табл. 3 детализирует некоторые данные табл. 4. Например, самый короткий межмолекулярный контакт Н/O в структуре II с расстоянием Н–O 1.866 Å, который указан в строке Н/O в табл. 4, реально отвечает взаимодействию O(9)–H(2)…O(3) (4-я строка снизу в табл. 3).
Таблица 4.
Характеристики межмолекулярных взаимодействий в структуре II с позиций метода МПВД*
| Контакт A/Z | kAZ | d, Å | SAZ, Å2 | ΔAZ, % |
|---|---|---|---|---|
| H/U | 4 | 3.303 | 0.02 | <0.01 |
| O/O | 8 | 2.873–4.273 | 0.69 | 0.09 |
| C/O | 36 | 3.280–4.349 | 3.57 | 0.49 |
| H/O | 168 | 1.866–4.843 | 310.22 | 42.32 |
| C/C | 40 | 3.390–4.286 | 19.82 | 2.70 |
| H/C | 100 | 2.925–4.138 | 46.72 | 6.37 |
| H/H | 204 | 2.425–5.375 | 351.96 | 48.02 |
| Сумма | 560 | 1.866–5.375 | 733.00 | 100 |
* kAZ – общее число граней с РГ = 0 у МПВД состава Ca[UO2(Мac)3]2 · 2H2O; d – диапазон соответствующих межатомных расстояний A/Z; SAZ – общая площадь граней указанного типа у ПВД атомов, содержащихся в одной формульной единице вещества; ΔAZ – парциальный вклад (в процентах) соответствующих невалентных контактов A/Z в величину интегрального параметра 0S = ΣSAZ МПВД (указан в нижней строке).
Согласно табл. 4 в кристаллах II присутствуют межмолекулярные взаимодействия C/C, для которых расстояние C–C изменяется от 3.39 до 4.29 Å. Дополнительный анализ показал, что расстояния между центрами ближайших связей С=С в структуре составляют от 3.84 до 3.95 Å и удовлетворяют одному из топохимических критериев Шмидта [24], необходимых для протекания твердофазной реакции [2+2]-циклоприсоединения. Однако второе обязательное условие для фотоциклодимеризации, а именно параллельное расположение двойных связей в кристаллической решетке [24], не выполняется. По-видимому, по этой причине полученные кристаллы метакрилатоуранилата II устойчивы при длительном хранении, в том числе при солнечном освещении.
В заключение отметим, что данные о структуре II являются еще одним подтверждением мнения [25] о существовании динамического равновесия между одно- и трехъядерными комплексами в водно-солевых системах, содержащих карбоксилат-ионы и катионы уранила. В концентрированных водных растворах в присутствии гидратированных катионов R2+ и комплексных анионов [UO2(L)3]– существует совокупность взаимосвязанных взаимодействий между гетероядерными комплексами разного состава и строения. Основные стадии указанного равновесия, на наш взгляд, схематически можно описать уравнением (1):
(1)
$\begin{gathered} {{[R{{(w)}_{n}}]}^{{2 + }}} + {\text{A}} \leftrightarrow {{\{ R{{(w)}_{p}}[{\text{A}}]\} }^{ + }} \leftrightarrow \\ \leftrightarrow \{ R{{(w)}_{q}}{{[{\text{A}}]}_{2}}\} \leftrightarrow {{\{ R{{(w)}_{r}}{{[{\text{A}}]}_{3}}\} }^{--}} \leftrightarrow \\ \leftrightarrow {{\{ R{{(w)}_{s}}{{[{\text{A}}]}_{4}}\} }^{{2--}}} \leftrightarrow \ldots \leftrightarrow {{\{ R{{(w)}_{x}}{{[{\text{A}}]}_{y}}\} }^{z}}, \\ \end{gathered} $где w – H2O; A – [UO2(L)3]–; {R(w)х[A]y}z – комплекс с зарядом z, который образовался на некоторой из стадий (1, 2, 3, 4, …, у); n, p, q, r, s, y – стехиометрические индексы. Судя по имеющимся данным, состав и структура кристаллов, возникающих при изотермическом испарении указанных растворов, зависит от природы как катионов R2+, так и карбоксилат-ионов L–. В частности, для ионов R2+ при L = ацетат равновесие (1) обычно смещено влево, поэтому чаще всего кристаллизуются ацетатоуранилаты, в структурах которых сосуществуют только одноядерные комплексы [R(H2O)n]2+ и [UO2(L)3]– (в соотношении 1 : 2). Примером могут служить ацетатоуранилаты с R2+ = = Be (n = 4) [26], а также Mg, Со, Zn, Ni (n = 6) [27, 28] или Ba (n = 0) [29]. В то же время в кристаллах ацетатоуранилата стронция обнаружены трехъядерные комплексы {Sr(H2O)4[UO2(L)3]2} в смеси (1 : 1) с одноядерными [Sr(H2O)6]2+ и [UO2(L)3]– [25]. В присутствии ионов цезия в похожей системе выявлены и пятиядерные ацетатоуранилат-ионы состава {Sr[UO2(L)3]4}2– [25] (аналог комплекса {R(w)s[A]4}2– в (1) при s = 0). Сходная ситуация наблюдается и в системе, содержащей n-бутиратоуранилаты стронция и уранила, в которой тоже образуются кристаллы {Sr(H2O)4[UO2(L)3]2} · 2H2O, содержащие трехъядерные комплексы [25].
Охарактеризованный в данной работе {Ca(H2O)2[UO2(Мac)3]2} (II) является первым примером трехъядерного комплекса при L = Мac. Отметим, что из водно-солевых систем, содержащих ионы Sr2+ (или Ba2+), ${\text{UO}}_{2}^{{2 + }}$ и Мac, согласно [5], кристаллизуются стехиометрически идентичные R[UO2(Мac)3]2 · 13H2O (моноклинные при R = Sr и триклинные при R = Ba). Эти метакрилатоуранилаты содержат по четыре кристаллографически разных комплекса [UO2(Мac)3]–, причем только один из них (включает атомы U(4)) входит в состав двухъядерных комплексов [R(H2O)6]- [UO2(Мac)3]}+ (аналог комплекса {R(w)p[A]}+ в (1) при p = 6). Учитывая имеющиеся результаты, можно предположить, что одним из факторов, способствующих смещению равновесия (1) вправо, является рост гидрофобности карбоксилат-ионов L при увеличении числа атомов углерода в их составе.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Сережкина Л.Б., Григорьев М.С., Шимин Н.А. и др. // Журн. неорган. химии. 2015. Т. 60. № 6. С. 746 (Serezhkina L.B., Grigor’ev M.S., Shimin N.A. et al. // Russ. J. Inorg. Chem. 2015. V. 60. № 6. Р. 672). https://doi.org/10.1134/S0036023615060121
Клепов В.В., Сережкина Л.Б., Григорьев М.С. и др. // Журн. неорган. химии. 2018. Т. 63. № 8. С. 982 (Klepov V.V., Serezhkina L.B., Grigor’ev M.S. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 8. Р. 1019). https://doi.org/10.1134/S0036023618080119
Klepov V.V., Serezhkina L.B., Grigoriev M.S. et al. // Polyhedron. 2017. V. 133. P. 40. https://doi.org/10.1016/j.poly.2017.04.041
Klepov V.V., Serezhkina L.B., Pushkin D.V. et al. // Eur. J. Inorg. Chem. 2016. № 1. P. 118. https://doi.org/10.1002/ejic.201501035
Сережкина Л.Б., Григорьев М.С., Клепов В.В. и др. // Кристаллография. 2019. Т. 64. № 2. С. 252 (Serezhkina L.B., Grigoriev M.S., Klepov V.V. et al. // Crystallography Reports. 2019. V. 64. № 2. Р. 270). https://doi.org/10.1134/S1063774519020251
Сережкина Л.Б., Григорьев М.С., Шимин Н.А., Сережкин В.Н. // Журн. неорган. химии. 2019. Т. 64. № 3. С. 272 (Serezhkina L.B., Grigor’ev M.S., Shimin N.A., Serezhkin V.N. // Russ. J. Inorg. Chem. 2019. V. 64. № 3. Р. 342). https://doi.org/10.1134/S0036023619030173
Serezhkin V.N., Vologzhanina A.V., Serezhkina L.B. et al. // Acta Crystallogr. B. 2009. V. 65. № 1. P. 45. https://doi.org/10.1107/S0108768108038846
SAINT-Plus (version 7.68). Madison (WI, USA): Bruker AXS Inc., 2007.
SADABS. Bruker AXS Inc., Madison, Wisconsin, USA, 2014.
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. № 1. P. 112.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. № 1. P. 3.
Nardelli M. // J. Appl. Cryst. 1999. V. 32. P. 563.
Farrugia L.J. // J. Appl. Cryst. 2012. V. 45. P. 849.
Parsons S., Flack H.D., Wagner T. // Acta Crystallogr. 2013. B. V. 69. P. 249.
Cережкин В.Н., Михайлов Ю.Н., Буслаев Ю.А. // Журн. неорган. химии. 1997. Т. 42. № 12. С. 2036.
Serezhkin V.N. Structural Chemistry of Inorganic Actinide Compounds / Eds. Krivovichev S., Burns P., Tananaev I. Amsterdam: Elsevier. 2007. P. 31.
Накамото К. Инфракрасные спектры неорганических и координационных соединений. М.: Мир, 1966. 411 с.
Zhu Y., Lu W., Chen F. // Acta Crystallogr. E. 2004. V. 60. P. m1459.
Помогайло А.Д., Джардималиева Г.И. Мономерные и полимерные карбоксилаты металлов. М.: Физматлит, 2009. 400 с.
Serezhkin V.N., Savchenkov A.V., Pushkin D.V., Serezhkina L.B. // Appl. Solid State Chem. 2018. № 2. P. 2.
Сережкин В.Н., Сережкина Л.Б. // Кристаллография. 2012. Т. 57. № 1. С. 39 (Serezhkin V.N., Serezhkina L.B. // Crystallography Reports. 2012. V. 57. № 1. Р. 33). https://doi.org/10.1134/S1063774511030291
Сережкин В.Н., Пушкин Д.В., Сережкина Л.Б. // Кристаллография. 2010. Т. 55. № 4. С. 597 (Serezhkin V.N., Pushkin D.V., Serezhkina L.B. // Crystallography Reports. 2010. V. 55. № 4. P. 554). https://doi.org/10.1134/S1063774510040048
Serezhkin V.N., Savchenkov A.V. // Cryst. Growth Des. 2020. V. 20. P. 1997. https://doi.org/10.1021/acs.cgd.9b01645
Schmidt G.M.J. // Pure Appl. Chem. 1971. V. 27. P. 647. https://doi.org/10.1351/pac197127040647
Savchenkov A.V., Klepov V.V., Vologzhanina A.V. et al. // CrystEngComm. 2015. V. 17. P. 740. https://doi.org/10.1039/c4ce02103g
Клепов В.В., Вологжанина А.В., Сережкина Л.Б., Сережкин В.Н. // Радиохимия. 2012. Т. 54. № 6. С. 500 (Klepov V.V., Vologzhanina A.V., Serezhkina L.B., Serezhkin V.N. // Radiochemistry. 2013. V. 55. № 1. P. 36).https://doi.org/10.1134/S1066362213010074
Klepov V.V., Peresypkina E.V., Serezhkina L.B. et al. // Polyhedron. 2013. V. 61. P. 137. https://doi.org/10.1016/j.poly.2013.05.048
Zalkin A., Ruben H., Templeton D.H. // Acta Crystallogr. B. 1982. V. 38. P. 610.
Сережкина Л.Б., Вологжанина А.В., Клепов В.В., Сережкин В.Н. // Кристаллография. 2011. Т. 56. № 2. С. 290 (Serezhkina L.B., Vologzhanina A.V., Klepov V.V., Serezhkin V.N. // Crystallography Reports. 2011. V. 56. № 2. P. 265).
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия


