Координационная химия, 2022, T. 48, № 9, стр. 515-533
Гетерометаллические комплексы Ln(III)–Cd(II) с анионами монокарбоновых кислот: синтетические подходы, анализ строения и фотолюминесцентных свойств
М. А. Шмелев 1, *, Н. В. Гоголева 1, В. К. Иванов 1, В. В. Ковалев 1, Г. А. Разгоняева 1, М. А. Кискин 1, А. А. Сидоров 1, И. Л. Еременко 1, 2
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
2 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
Москва, Россия
* E-mail: shmelevma@yandex.ru
Поступила в редакцию 11.11.2021
После доработки 03.03.2022
Принята к публикации 21.03.2022
- EDN: YJMFLT
- DOI: 10.31857/S0132344X22090067
Аннотация
Обобщены результаты исследования гетерометаллических комплексов Ln(III)–Cd(II) с анионами ароматических и алифатических монокарбоновых кислот. Продемонстрирован ряд существенных особенностей, которые наблюдаются в комплексах Ln(III)–Cd(II), но не характерны для соединений Ln(III)–М(II) с ионами 3d-металлов (M = Co, Ni, Cu, Zn). Показана склонность комплексов кадмия(II) формировать координационные полимеры при составах, типичных для молекулярных комплексов 3d-металлов. Выявлено влияние заместителя в бензойной кислоте на структуру и фотолюминесцентные свойства гетерометаллических комплексов Ln(III)–Cd(II).
Известно, что соединения лантанидов обладают уникальными физико-химическими свойствами – магнитными, оптическими, каталитическими [1–8]. Люминесценция соединений Ln покрывает весь спектральный диапазон: ультрафиолетовую (УФ) (Gd), видимую (Sm, Eu, Tb, Dy) или инфракрасную (ИК) (Pr, Nd, Ho, Er, Tm, Yb) области длин волн, а узкие линии переходов в спектрах люминесценции, соответствующие f → f-переходам, позволяют получать “чистые цвета”. При получении фотолюминесцентных материалов на основе соединений РЗЭ необходимым условием является достижение высоких значений эффективности люминесценции, что обеспечивается, в том числе большим коэффициентом экстинкции возбуждающего излучения. Одним из способов повышения эффективности люминесценции является использование “эффекта антенны”, при этом за счет введения в координационное окружение иона РЗЭ молекул ароматических органических лигандов, например монокарбоновых кислот, могут значительно возрастать значения квантовых выходов люминесценции и коэффициент экстинкции [9]. Эффективность внутримолекулярного переноса энергии на ион РЗЭ зависит как от расстояния между молекулой лиганда и ионом Ln [10], так и от разности энергий между триплетным уровнем органического лиганда и резонансного уровня иона металла. Так как положение триплетного уровня зависит от природы органического лиганда, то их варьирование при синтезе позволяет влиять на люминесцентные свойства образующихся комплексов.
Однако не всегда введение карбоксилатных анионов в координационное окружение РЗЭ приводит к эффективному энергетическому переносу на лантанидный металлоцентр. Согласно правилу Латва [11], для эффективной передачи энергии разность между триплетным уровнем ‘антенны’ и резонансным уровнем иона Ln3+ должна лежать в интервале 2500–3500 см–1 для Eu3+ и 2500–4000 см–1 для Tb3+. Несоблюдение этого условия ведет к потерям энергии за счет безызлучательных внутрисистемных переходов. Например, бензоат-анион (T1 = 23 200 см–1) способен к сенсибилизации как иона Tb3+, так и иона Eu3+, а анион 2-нафтойной кислоты (T1 = 22 000 см–1) – только иона Eu3+, тогда как в случае иона Tb3+ на спектре эмиссии присутствует исключительно полоса люминесценции лиганда [10].
Еще один способ варьирования энергии триплетного уровня “антенны” является введение d10-блока в состав карбоксилатного комплекса. В структуру d10-блока входит переходный металл с полностью заполненной d-оболочкой (Cd2+, Zn2+, Ag+), имеющий лигандное окружение, которое обеспечивает поглощение возбуждающего излучения. Эффективность данного подхода была продемонстрирована в [12, 13]. Авторами [12] была получена серия гомо- и гетерометаллических комплексов с анионами бензойной кислоты (Bnz–) и 1,10-фенантролином (Phen) и показано, что интенсивность люминесценции убывает в ряду [Tb2Zn2(Phen)2(Bnz)10] > [Tb(Phen)2(Bnz)3] > > [Tb(Bnz)3]. Аналогичный эффект наблюдался и в случае комплексов с анионами 2-фуранкарбоновой (Fur–) кислоты [Tb2Zn(H2O)2(Fur)8]n и [Tb(Fur)3] [13].
В литературе имеется информация о большом количестве гетерометаллических комплексов, в которых сочетаются ионы РЗЭ и Zn2+. По данным КБСД (5.42, Nov. 2020 + 3 upd), всего описано 1269 структур с различными O-,N-донорными лигандами (основания Шиффа [14–16], моно- и поликарбоновые кислоты [17–19] и другие полидентатные органические лиганды [20, 21]) и из них 137 соединений молекулярного, анионного и полимерного строения, где структурообразующую роль выполняют анионы монокарбоновых кислот, для которых характерны би- [22–24], трех- [25, 26], тетраядерные комплексы [27, 28] и комплексы большей ядерности [29, 30]. Химия соединений Ln(III)−Cd(II) изучена гораздо хуже. Всего описано 264 комплекса, из которых только 57 соединений с анионами монокарбоновых кислот. В то же время высокое координационное число иона Cd2+ и больший ковалентный радиус позволяет получать соединения, обладающие специфическими особенностями строения и физико-химическими свойствами. Гетерометаллические соединения {Ln-d10} проявляют свойства мономолекулярных и моноионных магнитов [31, 32], фотокаталитическую активность [33], демонстрируют люминесценцию, чувствительную к поляризации и концентрации катионов металлов [34], антибиотиков [35, 36] и других органических соединений [37, 38]. Кроме того, при переходе от цинка(II) к кадмию(II) в составе d10-блока, как правило, меняется энергия его триплетного уровня, в результате появляется дополнительная возможность подбора оптимального соответствия с энергией резонансного уровня иона РЗЭ с целью повышения эффективности фотолюминесценции [31].
Значительный вклад в фотофизические свойства вносит лигандное окружение металлов и упаковка молекул в кристалле. Исследование роли этих параметров позволяет выявить корреляции структура–свойство, которые используются при планировании синтезов веществ с требуемыми фотолюминесцентными характеристиками.
В обзоре обобщены и проанализированы данные по синтезу, строению и люминесцентным свойствам комплексов Ln(III)−Cd(II) с анионами монокарбоновых кислот и N-донорными лигандами (схема 1 ). Структурные формулы лигандов представлены на схеме 1 .
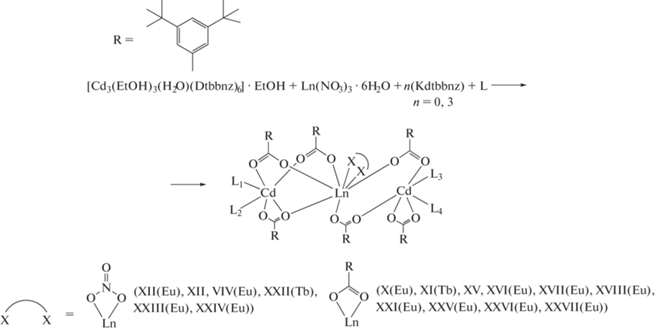
Синтез гетерометаллических комплексов Ln(III)–Cd(II) (далее Ln−Cd). Существует три разных подхода к синтезу полиядерных карбоксилатных комплексов Ln−Cd с анионами монокарбоновых кислот. В статьях Yu-Xian Chi [39–41] гетерометаллические комплексы удалось получить гидротермальным методом синтеза, при котором водный раствор солей d-металла и РЗЭ с большим избытком органических лигандов помещают в автоклав и выдерживают там при температуре 90–120°С несколько суток, после чего медленно охлаждают до комнатной температуры, что позволяет получать кристаллы гетерометаллических комплексов, пригодные для РСА. Недостатком метода является его излишняя трудоемкость и плохая воспроизводимость результатов.
В наших работах описан синтез без использования автоклавов и другого специального оборудования. Наиболее общая методика заключается в предварительном синтезе исходных карбоксилатов d- и f-элементов, например из соответствующих гидроксидов металлов и кислот. Реакция проводится в органических растворителях с добавлением N-донорного лиганда, после чего выпариванием раствора получают кристаллы гетерометаллического комплекса [42–45].
Третья известная из литературы методика предполагает синтез карбоксилатов металлов и их использование в реакции без предварительного выделения в твердом виде. Их получают обменной реакцией между нитратами металлов и карбоксилатом калия в этаноле, при этом KNO3 выпадает в осадок и в растворе остается только нужная соль. В полученную реакционную смесь добавляют N-донорный лиганд и оставляют упариваться до получения кристаллов требуемых соединений [31, 32, 46, 47]. Недостаток этой методики заключается в том, что не всегда происходит полное осаждение нитрат-анионов из реакционной смеси, что приводит к получению гетероанионных нитрато-карбоксилатных соединений {Ln2(NO3)CdL4(RCOO)6} или {Ln2(NO3)2Cd2L4(RCOO)8)}, что негативно сказывается на люминесцентных свойствах.
Схема 1 .
СТРОЕНИЕ И ФОТОЛЮМИНЕСЦЕНТНЫЕ СВОЙСТВА КОМПЛЕКСОВ Ln(III)–Cd(II)
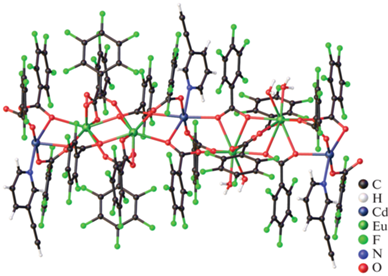
Комплексы Ln(III)−Cd(II) с анионами алифатических монокарбоновых кислот. Комплексы этого типа описаны на данный момент только для пивалиновой кислоты [LnCd2(H2O)2(Piv)7]n ∙ nMeCN (Ln3+ = Sm (I(Sm)), Eu (I(Eu)), Tb (I(Tb)), Dy (I(Dy)), Ho (I(Ho)), Er (I(Er)) Yb (I(Yb)); Piv = анион пивалиновой кислоты) [32] и [Eu2Cd(H2O)(DMF) (CH3COOO)(Piv)7]n (II(Eu), DMF = диметилформамид) [48]. В структурах I трехъядерные мономерные фрагменты {LnCd2} связаны в зигзагообразную 1D полимерную цепь мостиковыми и хелатно-мостиковыми анионами Piv– (рис. 1). В комплексах I геометрия полиэдра LnO8 изменяется от двухшапочной тригональной призмы для Ln = = Sm и Eu до треугольного додекаэдра для Ln = Tb, Dy, Er и Yb, тогда как координационное окружение иона кадмия и структура металлоостова {LnCd2} сохраняется.
Рис. 1.
Фрагмент полимерной цепи комплекса I(Eu). Атомы водорода и трет-бутильные заместители не показаны.
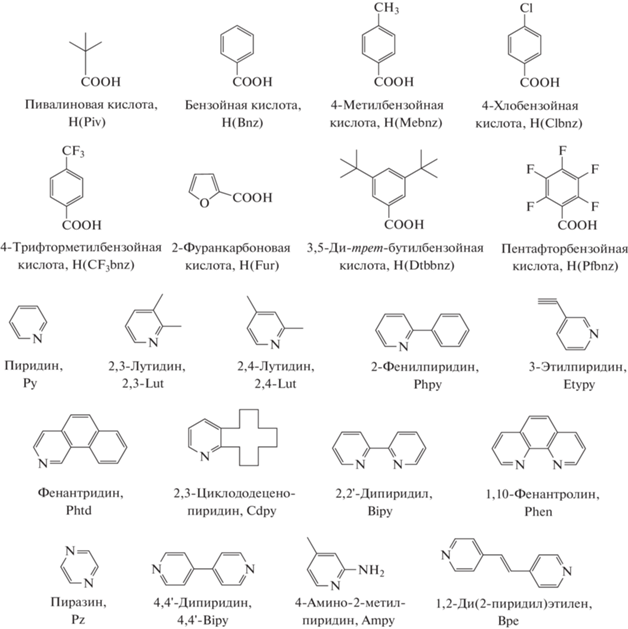
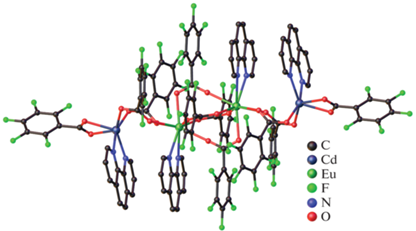
Соединение II(Eu) (рис. 2), в отличие от комплексов I, построено из мономерных фрагментов {Eu2Cd}, связанных между собой за счет мостиковых анионов Piv– и CH3COO– с формированием зигзагообразной полимерной цепи (угол EuEuCd составляет 114.5(1)°). В структуре трехъядерного металлоостова центральный ион Cd2+ связан с каждым ионом Eu3+ одним хелатно-мостиковым и двумя мостиковыми анионами Piv– или мостиковым и хелатно-мостиковым анионами Piv– и хелатно-мостиковым анионами CH3COO–. Координационное окружение иона Cd2+ соответствует искаженному октаэдру (CdO6). Ион Eu(1) достраивает свое окружение до одношапочной квадратной антипризмы (Eu(1)O9) координацией молекулы воды и DMF. Координационное окружение Eu(2) соответствует додекаэдру с треугольными гранями (Eu(2)O8). Полимерная цепь II(Eu) дополнительно стабилизирована за счет водородных связей между атомами кислорода карбоксильных групп Piv и атомами водорода координированной молекулы воды (O(13)…O(6) 2.951(8) Å, O(6)–H(6B)...O(13) 2.105(5) Å, угол O(6)H(6B)O(13) составляет 163.4(7)°; O(6)…O(18) 2.866(8) Å, O(6)–H(6A)...O(18) 2.011(5) Å, угол O(6)H(6A)O(18) составляет 167.5(4)°).
Интересно отметить, что в случае гетерометаллических пивалатных комплексов Ln(III)−M(II) (M = Co, Ni, Cu, Zn) в присутствии монодентатных и хелатирующих N-донорных лигандов (L = = пиридин (Py); 2,2'-бипиридин (Bipy); Phen; 2‑фенилпиридин; 2,3-лутидин; 2,4-лутидин (2,4-Lut); хинолин; пиразино[2,3-f][1,10]фенантролин, 1,3,5-триметилгексагидротриазин) наблюдается образование молекулярных комплексов [LnM(L)(Piv)5], [LnM2(L)2(Piv)7], [Ln(NO3)M2(L)2- (Piv)6] или [Ln2M2(L)(Piv)10] [24, 49–52]. Возможно, причиной образования пивалатного координационного полимера I и II(Eu) является то, что связывание по типу “голова к хвосту” трехъядерных фрагментов {LnCd2(L)2(Piv)7} в координационный полимер оказывается термодинамически выгоднее стабилизации таких фрагментов N-донорными лигандами в виде молекулярных комплексов, как в случае 3d-металлов. Вероятно, в данном случае, как и в случае гомометаллических координационных полимеров кадмия с целым рядом анионов монокарбоновых кислот, формированию полимерной структуры способствует большая, чем в случае 3d-металлов длина связи Cd–О [53].
Показано, что гетерометаллические полимеры Ln–Cd2 с анионами пивалиновой кислоты можно использовать как предшественники для синтеза металл-органических координационных полимеров. Причем продемонстрировано, что трехъядерный металлоостов {LnCd2} не подвергается перегруппировке при замене пивалат-аниона дианионом 1,4-нафталиндикарбоновой кислоты [54].
Для соединений I(Eu) и I(Tb) были исследованы люминесцентные свойства. Отсутствие в ближайшем координационном окружении РЗЭ-групп, которые способны эффективно тушить люминесценцию, приводит к более высоким значениям собственного квантового выхода люминесценции для I(Eu) в сравнении с Eu(NO3)3 · 6H2O. При этом его величина сопоставима со значениями для комплексов Eu(III) с ароматическими монокарбоновыми кислотами. Время жизни возбужденного состояния для I(Eu) и I(Tb) близко к значениям для гетерометаллических карбоксилатных соединений Ln−Zn и Ln−Cd, например пентафторбензоатных комплексов состава [Eu2Cd2(Phen)2(Pfbnz)10]n · · 3nMeCN и [Eu2Zn2(Phen)2(Pfbnz)10] · 2MeCN [32].
На данный момент пока не удалось выделить комплексы Ln-Cd, сочетающие анионы алифатических монокарбоновых кислот и N-донорные лиганды. При добавлении стехиометрического количества 2,4-Lut к комплексу I(Eu) удалось выделить только исходное соединение I(Eu). Использование хелатирующих N-донорных лигандов Phen, Bipy приводило к разрушению гетерометаллического металлоостова и образованию комплексов [Eu2(Bipy)2(Piv)6], [Eu2(Phen)2(Piv)6], строение которых было установлено ранее [55].
Комплексы Ln(III)−Cd(II) с анионами ароматических монокарбоновых кислот. Авторами статьи [39] за счет варьирования ионов РЗЭ в близких условиях синтеза удалось выделить гетерометаллические комплексы бензойной кислоты (HBnz) различной ядерности.
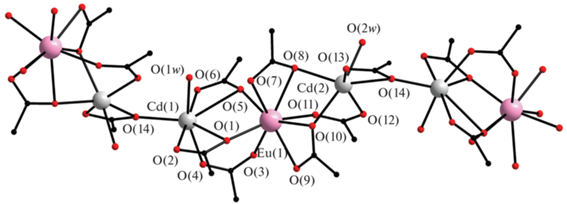
При взаимодействии Na(Bnz), Er(NO)3 · 5H2O, Cd(NO3)2 · 4H2O и Phen (при мольном соотношении Na(Bnz) : Ln(NO)3 : Cd(NO3)2 : Phen = 4 : 1 : 1 : 1) в среде H2O и EtOH формируется биядерный комплекс [ErCd(H2O)(Phen)(Bnz)5] (III(Er), рис. 3). При замене Er(NO3)3 на Ho(NO3)3, в аналогичных синтезу III(Er) условиях, формируется пентаядерная центросимметричная линейная структура [Ho2Cd3(Phen)2(Bnz)12] (IV(Ho)) (рис. 4). Тогда как в случае соединений Er−Zn и Ho−Zn, в идентичных условиях синтеза III(Er) и IV(Ho) формируются тетраядерные соединения состава [Ln2Zn2(Phen)2(Bnz)10] [39]. Присутствие Eu(NO3)3 в качестве исходного приводит к образованию трехъядерного соединения [EuCd2(Phen)2(Bnz)7] (V(Eu), рис. 5а). Замена же Phen на Bipy и использование в синтезе обменной реакции между K(Bnz), Eu(NO)3 · 6H2O, Cd(NO3)2 · 4H2O приводит к кристаллизации тетраядерного комплекса [Eu2(NO3)2Cd2(Bipy)2(EtOH)2(Bnz)10] (VI(Eu), рис. 5б), где ионы РЗЭ достраивают свое окружение за счет координации нитрат-аниона [43].
Рис. 3.
Фрагмент кристаллической упаковки комплекса III(Er). Показаны только атомы водорода, задействованные в водородном связывании.
Формирование различных комплексов при варьировании лантанида является неожиданным результатом, как правило, ионы Eu3+, Ho3+ и Er3+ образуют изоструктурные соединения [32, 56–68]. Вероятно, в данном случае комплексы энергетически очень близки, поэтому какое-то варьирование условий синтеза и кристаллизации приводит к получению соединений различного состава.
В структуре III(Er) ионы металлов связаны между собой тремя мостиковыми анионами кислоты, а ион Cd2+ дополнительно координирует два атома N молекулы Phen (КЧ 5). Эрбий(III) достраивает свое окружение за счет координации четырех атомов O двух хелатно связанных анионов кислоты и одного атома О молекулы воды (КЧ 8).
В упаковке комплекса III(Er) наблюдается объединение двух биядерных фрагментов за счет образования межмолекулярных водородных связей между координированной молекулой воды и атомом О хелатно связанного аниона кислоты (O(11)–H···O(1), O(11)–H···O(3)) (рис. 3). Ароматические фрагменты Phen двух соседних молекул комплекса задействованы в межмолекулярных π–π-взаимодействиях.
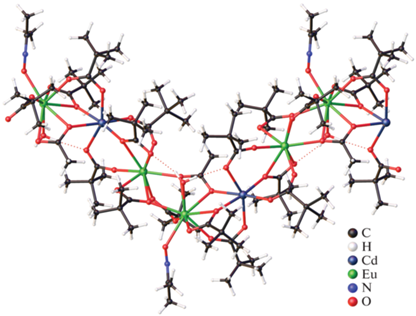
В структуре [Ho2Cd3(Phen)2(Bnz)12] (IV(Ho)) центральный ион Cd2+ (КЧ 6) связан с каждым ионом Ho3+ (КЧ 8) одним мостиковым и двумя хелатно-мостиковыми анионами Bnz–, тогда как концевые ионы Cd2+ связаны с РЗЭ двумя мостиковыми и одним хелатно-мостиковым анионами кислоты. Каждый концевой ион Cd2+ (КЧ 6) дополнительно координирует хелатно связанную молекулу Phen. Ароматические фрагменты Phen двух соседних молекул комплекса участвуют в межмолекулярных π–π-взаимодействиях.
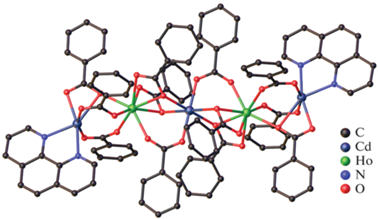
В структуре трехъядерного комплекса [EuCd2-(Phen)2(Bnz)7] (V(Eu)) концевые ионы Cd2+ связаны с центральным ионом Eu3+ одним хелатно-мостиковым и двумя мостиковыми анионами кислоты. Каждый ион Cd2+ координирует дополнительно два атома азота молекулы Phen (КЧ 6). Тогда как центральный ион Eu3+ достраивает свое окружение за счет координации хелатно связанного бензоат-аниона (КЧ 8). Ароматические фрагменты Phen двух соседних молекул комплекса участвуют в межмолекулярных π–π-взаимодействиях.
В тетраядерном комплексе [Eu2(NO3)2Cd2(Bipy)2- (EtOH)2(Bnz)10] (VI(Eu)) ионы металлов связаны между собой мостиковыми и хелатно-мостиковыми анионами Bnz–. Каждый ион Cd2+ достраивает свое октаэдрическое окружение (CdO4N2) двумя атомами азота хелатно связанной молекулы Bipy. Ион Eu3+ достраивает свое окружение (EuO8) до искаженной двухшапочной тригональной призмы за счет координации атомов кислорода молекулы этанола и хелатно связанного аниона ${\text{NO}}_{3}^{ - }$ из исходной неорганической соли.
На примере бензоатных комплексов показано [39], что d10-блок способствует снижению энергии триплетного уровня, приводит к сокращению разности энергии с резонансными уровнями ионов Ln3+ и может способствовать более эффективной передаче энергии на ион Ln3+.
На спектрах эмиссии соединений III(Er) и IV(Ho) в ближней ИК-области присутствуют полосы, характерные для переходов ионов Ho3+ и Er3+. Однако, по сравнению с литературными данными, наблюдается расщепление и сдвиги характеристических полос, что авторы [39] объясняют влиянием ионов Cd2+, входящих в структуру d10-блока, на 4f-орбитали РЗЭ, а также эффектом кристаллического поля. В видимой области присутствуют полосы соответствующие люминесценции d10-блока, что свидетельствует о неполной передаче энергии с триплетного уровня на ион Ln3+. Интенсивность люминесценции комплекса III (ErCd) намного ниже по сравнению с цинк-содержащим аналогом состава [Er2Zn2(Phen)2(Bnz)10], что авторы статьи связывают с колебательным тушением люминесценции за счет молекулы воды, входящей в координационную сферу иона РЗЭ в структуре III(Er).
На спектре эмиссии комплекса V(Eu) присутствуют полосы, характерные для переходов иона Eu3+, тогда как полосы, отвечающие внутрилигандным переходам, практически отсутствуют. Данный факт может свидетельствовать об эффективной передаче энергии на ион редкоземельного элемента. Интенсивность перехода 5D0–7F0 выше, чем перехода 5D0–7F1, что указывает на асимметричное окружение иона Eu3+.
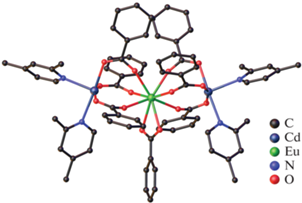
При использовании производных бензойной кислоты с заместителем в пара-положении была получена серия тетраядерных и биядерных комплексов. В случае 4-метилбензойной (H(Mebnz)), 4-трифторметилбензойной (H(CF3bnz)), 4-хлорбензойной (H(Clbnz)) кислот формируются тетраядерные соединения Ln2-Cd2 (VII–IX): [Ln2Cd2(Phen)2-(Mebnz)10], Ln3+ = Nd (VII(Nd)), Pr (VII(Pr)), Sm (VII(Sm)) [65] (рис. 6), [Ho2Cd2(Phen)2(Clbnz)10] [65], (VIII(Ho)) и [Ln2Cd2(Bipy)2(CF3bnz)10] [43], Ln3+ = Eu (IX(Eu)), Tb (IX(Tb)) близкого строения.
Соединения VII–IX с анионами Mebnz–, Clbnz– и CF3bnz– представляют собой тетраядерные комплексы с линейным металлоостовом {Cd…Ln…Ln…Cd}, в которых терминальные ионы кадмия(II) координируют хелатно связанную молекулу N-донорного лиганда (Phen в случае VII, VIII(Ho) или Bipy в случае IX(Er)). Основное различие в строении комплексов VII, VIII(Ho) и IX(Er) заключается в характере связывания ионов Cd2+ и Ln3+. Так, в VII, VIII(Ho) центральные ионы РЗЭ связаны между собой четырьмя мостиковыми карбоксильными группами и с терминальными ионами кадмия(II) двумя мостиковыми и одной хелатно-мостиковой карбоксильными группами, тогда как в IX(Er) центральные ионы РЗЭ связаны между собой двумя мостиковыми и двумя хелатно-мостиковыми карбоксильными группами, а с терминальными ионами кадмия(II) – мостиковой и двумя хелатно-мостиковыми карбоксильными группами.
В упаковке комплексов VII, VIII(Ho) молекулы Phen задействованы в межмолекулярных π–π-взаимодействиях между ароматическими фрагментами N-донорных лигандов и анионами кислоты двух соседних молекул комплекса (расстояния между центрами взаимодействующих частиц и углы между плоскостями 3.57 Å и 0.00°, 3.71 Å и 6.00° соответственно (VII(Nd)); 3.58 Å и 0.00°, 3.71 Å и 6.03° соответственно (VII(Pr)); 3.56 Å и 0.00°, 3.69 Å и 6.66° соответственно (VII(Sm)); 3.56 Å и 0.00°, 3.71 Å и 6.36°, соответственно (VIII(Ho)). Напротив, в случае комплекса IX(Eu) наблюдаются только внутримолекулярные π–π-взаимодействия между двумя парами CF3bnz-анионов (расстояния между центрами взаимодействующих частиц и углы между плоскостями составляют 3.72 Å и 4.61° соответственно).
Фотофизические свойства комплексов VII–IX были изучены для твердых образцов при комнатной температуре. На спектрах эмиссии соединений VII(Nd), VII(Pr), VIII(Ho) в ближней ИК-области присутствуют полосы, характерные для переходов ионов Nd3+, Pr3+ и Ho3+. В видимой области спектра присутствуют интенсивные полосы, соответствующие люминесценции d10-блока, что свидетельствует о неполной передаче энергии с триплетного уровня на ион лантанида. При исследовании люминесцентных свойств комплекса VII(Sm) было показано, что на спектре эмиссии присутствует очень интенсивная полоса в области 370–420 нм, отвечающая за внутрилигандный переход d10-блока, тогда как интенсивность полос, соответствующих переходам иона Sm3+ очень низкая, что свидетельствует о неэффективной передаче энергии с триплетного уровня d10-блока на ион редкоземельного элемента.
При возбуждении УФ-излучением, образцы IX(Eu), IX(Tb) демонстрируют характерную для ионов Eu3+ и Tb3+, соответственно, металл-центрированную люминесценцию. Переход 5D0 → 7F0 в спектре люминесценции представленединственной симметричной полосой, что свидетельствует об одинаковом координационном окружении обоих ионов Eu3+ в молекуле. Это также подтверждается одноэкспоненциальным характером затухания люминесценции Eu3+ в исследуемом комплексе (τнабл = 1.8 мс). Отношение интегральных интенсивностей переходов 5D0 → 7F2 и 5D0 → 7F1 для комплекса IX(Eu) равно 5.54, что согласуется с отсутствием центра инверсии координационного окружения Eu3+.
Внутренний квантовый выход люминесценции в видимой области спектра комплекса IX(Eu) равен 81%, что свидетельствует об эффективности процесса люминесценции иона Eu3+ в данной матрице и отсутствии тушителей люминесценции в ближайшем окружении иона, например высокочастотных осцилляторов O–H и C–H [69], тогда как значения абсолютного квантового выхода люминесценции имеют низкие значения (13 и 7% для IX(Eu) и IX(Tb) соответственно). По-видимому, низкий абсолютный квантовый выход люминесценции связан с неэффективным переносом энергии от d10-блока к центральному иону. На низкую эффективность транспортировки энергии также указывают широкие полосы в диапазоне длин волн 310–440 нм в спектрах люминесценции комплексов IX(Eu) и IX(Tb), относящиеся к излучательным переходам d10-блока в основное состояние.
Комплексы Ln(III)−Cd(II) с анионами 3,5-ди-трет-бутилбензойной кислоты. В случае комплексов с 3,5-ди-трет-бутилбензойной кислотой (H(Dtbbnz)) наблюдается существенное ограничение конформационной подвижности металлоостова вследствие стерических затруднений двух объемных трет-бутильных заместителей в Dtbbnz–, что делает возможным получение достаточно жесткого металлокаркаса. Это позволяет замещать различные нейтральные лиганды в составе комплекса без заметных изменений геометрических параметров карбоксилатного металлофрагмента. Реакции [Cd3(EtOH)3(H2O)(Dtbbnz)6] · EtOH с Ln(NO3)3 · 6H2O или полученным in situ {Ln(Dtbbnz)3} (Ln3+ = Eu, Tb) [69]) привели к образованию гетерометаллических комплексов на основе фрагментов {Ln(NO3)Cd2(Dtbbnz)6} или {LnCd2(Dtbbnz)7} (X–XXVII). Координация дополнительного нитрат- или карбоксилат-аниона на ионе РЗЭ зависит от выбора исходного соединения лантанида: при использовании нитрата он входит в состав координационной сферы РЗЭ, при введении же {Ln(Dtbbnz)3} в качестве исходного соединения лантанид достраивает свое окружение за счет атомов О хелатно координированного карбоксилат-аниона [42, 44, 45, 70].
Схема 2 .
Центральный ион Ln3+ находится в окружении восьми атомов кислорода, из которых два принадлежат хелатно координированному нитрат- или карбоксилат-аниону, а шесть – карбоксилатным мостиковым анионам, связывающим его с периферийными ионами Cd2+. Координационное окружение ионов Cd2+ и Ln3+ соответствует искаженному октаэдру и додекаэдру c треугольными гранями соответственно.
По результатам исследования комплексов с Dtbbnz-анионом обнаружена возможность введения в структуру гетерометаллических соединений Ln−Cd2 монодентатных, мостиковых и хелатирующих лигандов, в том числе лигандов со стерически нагруженными заместителями как с частичным, так и с полным замещением координированных молекул растворителя при сохранении геометрии трехъядерного металлоостова и координационных полиэдров металлов (табл. 1).
Таблица 1.
Состав комплексов I–XXXIV
| L | Комплекс | Литература |
|---|---|---|
| H2O | [LnCd2(H2O)2(Piv)7]n ∙ nMeCN (I(Sm), I(Eu), I(Tb), I(Dy), I(Ho), I(Er) I(Yb)) | [32] |
| H2O | [Eu2Cd(H2O)(DMF)(CH3COOO)(Piv)7]n (II(Eu)) | [38] |
| Phen, H2O | [ErCd(H2O)(Phen)(Bnz)5] (III(Er)) | [39] |
| Phen | [Ho2Cd3(Phen)2(Bnz)12] (IV(Ho)) | [39] |
| Phen | [EuCd2(Phen)2(Bnz)7] (V(Eu)) | [39] |
| Bipy, EtOH | [Eu2(NO3)2Cd2(Bipy)2(EtOH)2(Bnz)10] (VI(Eu)) | [43] |
| Phen | [Ln2Cd2(Phen)2(Mebnz)10] (VII(Nd), VII(Pr), VII(Sm)) | [65] |
| Phen | [Ho2Cd2(Phen)2(Clbnz)10] (VIII(Ho)) | [65] |
| Bipy | [Ln2Cd2(Bipy)2(CF3bnz)10] (IX(Eu), IX(Tb)) | [43] |
| H2O, EtOH | [EuCd2(H2O)2(EtOH)2(Dtbbnz)7] · 3EtOH (X(Eu)) | [45] |
| H2O, EtOH | [TbCd2(H2O)(EtOH)3(Dtbbnz)7] · 2EtOH · 2.7H2O (XI(Tb)) | [45] |
| MeCN, THF | [Eu(NO3)Cd2(MeCN)2(THF)2(Dtbbnz)6] · 2EtOH (XII(Eu)) | [44] |
| Py | [Ln(NO3)Cd2(Py)4(Dtbbnz)6] ∙ 1.5MeCN (XIII(Eu), XIII(Tb)) | [45] |
| 2,4-Lut | [Eu(NO3)Cd2(2,4-Lut)2(EtOH)2(Dtbbnz)6] (XIV(Eu)) | [70] |
| 2,4-Lut | [LnCd2(2,4-Lut)4(Dtbbnz)7] (XV(Eu), XV(Tb)) | [70] |
| Phtd | 3[EuCd2(Phtd)2(H2O)2(Dtbbnz)7] . 4Phtd (XVI(Eu)) | [70] |
| Cdpy | [EuCd2(Cdpy)(EtOH)3(Dtbbnz)7] (XVII(Eu)) | [70] |
| Акридин (Acr) | 2[EuCd2(EtOH)4(Dtbbnz)7] · Acr (XVIII(Eu)) | [70] |
| Bipy | [EuCd2(Bipy)2(H2O)(Dtbbnz)7] · MeCN . 2THF · 3H2O (XIX(Eu)) | [45] |
| Bipy | [TbCd2(Bipy)2(H2O)(Dtbbnz)7] (XX(Tb)) | [45] |
| Phen | [EuCd2(Phen)(EtOH)2(Dtbbnz)7] (XXI(Eu)) | [42] |
| Phen | [Tb(NO3)Cd2(Phen)2(Dtbbnz)6] . MeCN (XXII(Tb)) | [42] |
| Pz | [Eu(NO3)Cd2(Pz)(H2O)2(Dtbbnz)6]n (XXIII(Eu)) | [44] |
| Pz | [Eu(NO3)Cd2(Pz)2(EtOH)2(Dtbbnz)6] (XXIV(Eu)) | [44] |
| 4,4'-Bipy | [EuCd2(4,4`-Bipy)(H2O)2(Dtbbnz)7]n (XXV(Eu)) | [44] |
| Bpe | [EuCd2(Bpe)(H2O)2(Dtbbnz)7]n (XXVI(Eu)) | [44] |
| Ampy | [EuCd2(Ampy)2(EtOH)(H2O)(Dtbbnz)7] (XXVII(Eu)) | [44] |
| Py | [Eu2Cd2(Py)4(Pfbnz)10] (XXVIII(Eu)) | [71] |
| Phpy, MeCN | [Eu2Cd2(Phpy)2(MeCN)2(Pfbnz)10] · 5MeCN (XXIX(Eu)) | [71] |
| Etypy, H2O | [Eu2Cd(Etypy)(H2O)2(Pfbnz)8]n · 3n(MeCN) · n(Etypy) (XXX(Eu)) | [71] |
| Bipy | [Eu(NO3)Cd2(Bipy)2(Pfbnz)6] (XXXI(Eu)) | [42] |
| Phen | [Ln2Cd2(Phen)2(Pfbnz)10]n · 3nMeCN (XXXII(Eu), XXXII(Gd), XXXII(Tb), XXXII(Dy)) | [31] |
| Phen | [Tb2Cd2(Phen)2(Pfbnz)10] (XXXIII(Tb)) | [31] |
При введении в реакционную смесь X(Eu), XI(Tb), XII(Eu) стехиометрических количеств монодентатных лигандов (Py, 2,4-Lut, фенантридин (Phtd)) в этаноле образуются кристаллы соединений X(Eu), XI(Tb), XII(Eu), не содержащие молекул N-донорного лиганда, что связано с существующей в реакционной смеси конкуренцией между молекулами лиганда и координирующего растворителя.
Аналогичные трехъядерные соединения {Ln-(NO3)Zn2(MeCN)2(Piv)6} и {Ln(NO3)Co2(MeCN)2- (Piv)6} (Piv = анион пивалиновой кислоты) формируются при взаимодействии пивалата переходного металла с Ln(NO3)3 · xH2O в ацетонитриле, однако, каждый атом переходного металла связывает только одну молекулу растворителя, тогда как в структуре соединений X(Eu), XI(Tb), XII(Eu) каждый атом кадмия(II) достраивает свое окружение координацией двух молекул растворителя [24, 52].
Использование 3–5-кратного избытка 2,4-Lut, 2,3-циклододеценопиридин (Сdpy), Phtd приводит к получению комплексов [Eu(NO3)Cd2(2,4-Lut)2- (EtOH)2(Dtbbnz)6] (XIV(Eu)), [EuCd2(Cdpy)(EtOH)3- (Dtbbnz)7] (XVII(Eu)), 3[EuCd2(Phtd)2(H2O)2- (Dtbbnz)7] · 4Phtd (XVI(Eu)), в структуре которых к каждому иону Cd2+ координирована только одна молекула N-донорного лиганда и Cd2+ достраивает свое окружение связыванием молекулы растворителя. Тогда как использование 10-кратного избытка 2,4-лутидина или пиридина позволило полностью заместить координированные молекулы растворителя на молекулы N-донорных лигандов с формированием соедиений XIII(Eu), (XV(Eu)) и (XV(Tb)).
На примере [LnCd2(2,4-Lut)4(Dtbbnz)7] (XV(Eu)), (XV(Tb)) в гетерометаллическом карбоксилатном комплексе впервые зафиксирована координация двух молекул α-замещенного пиридина к одному иону металла (рис. 7). Комплексы, аналогичные по строению XV, для 3d-элементов неизвестны. Для биядерных и линейных трехъядерных карбоксилатных комплексов этих металлов сообщалось о примерах связывания с одним атомом металла только одной молекулы лутидина или другого α‑замещенного пиридина [72–74], что связано с меньшим, по сравнению с атомом кадмия(II), ионным радиусом и большей ролью стерических затруднений, создаваемых α-заместителями в случае координации двух молекул N-донорного лиганда. При этом атомы 3d-элементов находятся в искаженном тетраэдрическом окружении, которое часто дополнено до искаженного тригонально-бипирамидального более длинной связью М–О. Однако в ряде случаев Cd2+ проявляет и небольшие координационные числа, образуя аналоги соединений 3d-металлов [39, 75–77].
Большой избыток монодентатных N-донорных лигандов, необходимый для замещения координированных молекул растворителя, свидетельствует об устойчивости и заметно большей инертности комплексов кадмия(II) по сравнению с соединениями 3d-элементов. Получение продуктов с разным соотношением координированных молекул N-донорного лиганда и молекул растворителя, вероятно, позволяет говорить о ступенчатом протекании реакции замещения лигандов.
В случае хелатирующих лигандов (Bipy, Phen) для полного замещения координированных молекул растворителя было достаточно стехиометрического количества реагентов.
При связывании мостиковых лигандов (пиразина (Pz), 4,4'-дипиридина (4,4'-Bipy), 1,2-ди-(2-пиридил)этилена (Bpe), 4-метил-2-аминопиридина (Ampy)) происходит образование цепочечных зигзагообразных (Pz) (XXIII(Eu)) или линейных (4,4'-Bipy, Bpe) (XXV(Eu), XXVI(Eu)) координационных полимеров на основе указанных гетерометаллических фрагментов или молекулярных комплексов с монодентатной координацией N-донорных лигандов (XXIV(Eu), XXVII(Eu)).
Особенностью синтеза координационных полимеров, рассмотренных в данной работе, является необходимость использования значительного избытка пиразина для его связывания с ионом Cd2+. Использование стехиометрического количества лиганда приводит к выделению молекулярного комплекса [Eu(NO3)Cd2(MeCN)2(THF)2- (Dtbbnz)6] · 2EtOH (XII(Eu)) с координированными к иону Cd2+ молекулами растворителя. Использование восьмикратного избытка Pz позволяет заместить половину молекул растворителя в трехъядерном фрагменте {LnCd2} и приводит к кристаллизации 1D-полимера [Eu(NO3)Cd2(Pz)- (H2O)2(Dtbbnz)6]n (XXIII(Eu)), где молекулы пиразина связывают трехъядерные фрагменты в зигзагообразные цепи (угол Eu(1)Eu(1)Eu(1) между ионами металлов трех соседних фрагментов {EuCd2} цепи составляет 112.9°). Дальнейшее увеличение количества пиразина до 15-кратного избытка приводит к координации второй молекулы Pz к гетерометаллическому фрагменту {EuCd2}, но не за счет замещения координированных молекул растворителя, а вследствие разрушения полимерной структуры. В результате формируется молекулярный комплекс [Eu(NO3)Cd2(Pz)2(EtOH)2(Dtbbnz)6] (XXIV(Eu)), в котором молекулы Pz координированы только одним атомом азота.
Были изучены люминесцентные свойства соединений X(Eu), XI(Tb), XII(Eu), XIII, XV(Eu), XV(Tb), XIX(Eu), XX(Tb), XXII(Tb), XXIII(Eu), XXIV(Eu), XXV(Eu), XXVI(Eu) (табл. 2). На спектрах эмиссии комплексов наблюдаются характерные полосы электронных переходов: 5D0 → 7FJ, J = 0–4 для иона Eu3+ и 5D4 → 7FJ, J = 6–3 в случае Tb3+. Полосы 5D4 → 7FJ, J = 2–0 имеют ожидаемо низкую интенсивность. Спектры возбуждения представляют набор широких полос, обусловленных передачей энергии от d10-блока на РЗЭ, а также узких линий f–f-переходов, интенсивность которых сопоставима с поглощением органических лигандов, что свидетельствует о неэффективной сенсибилизации металлоцентрированной люминесценции окружением лиганда.
Таблица 2.
Значения времен жизни (τнабл, внутренние $(Q_{{{\text{Ln}}}}^{{{\text{Ln}}}})$ и общие $(Q_{{\text{L}}}^{{{\text{Ln}}}})$ квантовые выходы комплексов
| Комплекс | λвозб, нм |
τнабл, мс |
$Q_{{{\text{Ln}}}}^{{{\text{Ln}}}}$, % |
$Q_{{{\text{Ln}}}}^{{\text{L}}}$, % |
Комплекс | λвозб, нм |
τнабл, мс |
$Q_{{{\text{Ln}}}}^{{{\text{Ln}}}}$, % |
$Q_{{{\text{Ln}}}}^{{\text{L}}}$, % |
|---|---|---|---|---|---|---|---|---|---|
| X(Eu) | 450 | 1.31 | 56 | 2.5 | XIX(Eu) | 440 | 1.36 | 60 | 14 |
| XI(Tb) | 1.21 | XX(Tb) | 1.59 | 14.5 | |||||
| XII(Eu) | 440 | 1.04 | 46 | 1 | XXII(Tb) | 1.63 | 13 | ||
| XIII(Eu) | 445 | 17 | XXIII(Eu) | 480 | 0.85 | 41 | 7 | ||
| XIII(Tb) | 1.76 | 26 | XXIV(Eu) | 320 | 2.05 | 66 | 7 | ||
| XV(Eu) | 360 | 10 | XXV(Eu) | 415 | 1.58 | 65 | 11 | ||
| XV(Tb) | 24 | XXVI(Eu) | 355 | 2.33 | 93 | 1 |
В спектрах люминесценции присутствуют широкие полосы в диапазоне 340–450 нм, связанные с излучательными переходами в d10-блоке. Наличие этих полос свидетельствует о присутствии нежелательных каналов потери энергии. Наблюдаемые времена жизни комплексов XIII(Eu), XX-IV(Eu) и XXVI(Eu) достаточно велики (>2 мс) и близки к значениям для свободных ионов Eu3+ в отсутствие тушителей. Интересно отметить, что удаление молекул воды или этанола из координационной сферы ионов Cd2+ способствует увеличению общего квантового выхода с 2.5 до 14%. Замена же Bipy на Phen или 4,4'-Bipy сказывается на величине квантового выхода незначительно.
Комплексы Ln(III)–Cd(II) с анионами пентафторбензойной кислоты. Мы обратили внимание на известные системы органических соединений, в которых сочетаются перфторированные и нефторированные ароматические фрагменты. Для таких систем типично параллельное расположение всех ароматических циклов и их сближение на расстояния примерно до 3.4–3.6 Å. Например, в кристаллических упаковках бензола и гексафторбензола присутствует одинаковый “лестничный” мотив кристаллической упаковки, тогда как их сокристаллизат C6H6 · C6F6 имеет слоистую плотную упаковку [78]. Данный эффект подробно изучен для органических фторзамещенных и незамещенных ароматических молекул [78–80]. Галогензамещенные органические лиганды активно используются при синтезе соединений с фотолюминесцентными свойствами, поскольку отсутствие связей C–H положительно сказывается на люминесцентных свойствах за счет отсутствия эффекта тушения [9]. Кроме того, проявление в кристаллической упаковке множественных нековалентных взаимодействий (π…π, C–H…Hal, Hal…Hal, С–Hal…π) приводит к формированию соединений необычного строения и также положительно влияет на фотолюминесцентные свойства [28]. С целью изучения возможности связывания фрагментов комплекса между собой в кристаллической решетке для синтеза полимерных структур мы использовали пентафторбензоатные комплексы Ln−Cd и пиридин или его производные в качестве ароматических N-донорных лигандов.
Взаимодействие пентафторбезоатов кадмия(II) и европия(III) в присутствии пиридина (Cd : L = 1 : 2) или 2-фенилпиридина (Phpy, Cd : L = 1 : 10) приводит к кристаллизации линейных тетраядерных комплексов близкого строения [Eu2Cd2(Py)4- (Pfbnz)10] (XXVIII(Eu), рис. 8) и [Eu2Cd2(Phpy)2- (MeCN)2(Pfbnz)10] · 5MeCN (XXIX(Eu)) [71]. Попытки синтеза гетерометаллических пентафторбензоатных комплексов Ln−Cd с 2,4-лутидином, изохинолином, 7,8-бензохинолином и 2,2'-бихинолином привели к кристаллизации только гомометаллических комплексов [71].
В структурах XXVIII(Eu) и XXIX(Eu) ионы Eu3+ связаны между собой двумя мостиковыми и двумя хелатно-мостиковыми Pfbnz-анионами. Периферийные ионы Cd2+ связаны с ионами Eu3+ одним мостиковым и двумя хелатно-мостиковыми Pfbnz-анионами в XXVIII(Eu) и одним хелатно-мостиковым и двумя мостиковыми Pfbnz-анионами в XXIX(Eu). В XXVIII(Eu) ион Cd2+ координирует две молекулы Py, достраивая свое окружение (CdO5N2) до пентагонально-бипирамидального, в XXIX(Eu) окружение иона Cd2+ (CdO4N2) достраивается до октаэдрического координацией атомов N молекулы Phpy и MeCN. По-видимому, присутствие объемного фенильного заместителя в молекуле Phpy в α-положении препятствует координации второй молекулы Phpy и в координационную сферу Cd2+ входит более компактная молекула MeCN. Основной вклад в стабилизацию кристаллической упаковки комплексов XXVIII(Eu) и XXIX(Eu) вносят внутри- и межмолекулярные взаимодействия С–H…F, С–F…π и F…F.
В отличие от 3,5-ди-трет-бутилбензоатных комплексов Ln−Cd2 XIII, где для полного замещения координированных молекул растворителя необходимо вводить в реакционную смесь десятикратный избыток пиридина, в случае пентафторбензоатных соединений достаточно стехиометрического количества лиганда, а избыток пиридина (Cd : L = 1 : 10) вызывает деструкцию гетерометаллического металлоостова и формирование моноядерного комплекса [Cd(Py)3(Pfbnz)2]. Такое действие избытка пиридина было очень неожиданным. Многочисленные примеры из литературы показывают, что гетерометаллические карбоксилатные комплексы, в которых с атомами 3d-металлов сочетаются атомы лантанидов, лития, магния или щелочноземельных элементов достаточно устойчивы и могут сохранять гетерометаллический металлоостов даже при действии избытка хелатирующих N-донорных лигандов [81, 82].
Использование избытка 3-этинилпиридина (Etypy, Cd : L=1 : 6) приводит к образованию 1D-полимера [Eu2Cd(Etypy)(H2O)2(Pfbnz)8]n · 3n(MeCN) · · n(Etypy) [71] (XXX(Eu), рис. 9). Полимерная цепь XXX(Eu) построена из трехъядерных фрагментов {Eu2Cd}, связанных двумя μ3κ1κ2κ1– и двумя мостиковыми Pfbnz-анионами. В структуре трехъядерного металлоостова {Eu2Cd} центральный ион Cd2+ связан с каждым ионом Eu3+ одним мостиковым Pfbnz-анионом и одним мостиковым атомом кислорода карбоксильной группы μ3κ1κ2κ1-аниона. В молекуле XXX(Eu) один μ3κ1κ2κ1-анион пентафторбензойной кислоты связывает центральный ион кадмия(II) с двумя ионами европия(III), а также периферийные ионы европия(III) между собой. Однако в структуре полимерной цепи XXX(Eu) также можно выделить четырехъядерные фрагменты {Ln2Cd2}, наблюдаемые в комплексах XXVIII(Eu) и XXIX(Eu), однако каждый ион кадмия(II) в полимерной цепи входит одновременно в два соседних фрагмента {Ln2Cd2}.
В упаковке комплекса XXX(Eu) наблюдаются π–π-взаимодействия между координированными и сольватными молекулами Etypy соседних полимерных цепей, а также между Pfbnz-фрагментами внутри одной полимерной цепи. Атомы водорода ацетиленового фрагмента и пиридинового кольца координированных и сольватных молекул Etypy участвуют во взаимодействиях С–H…F с атомами фтора Pfbnz-анионов внутри одной или между соседними полимерными цепями.
В отличие от молекулярных комплексов XXVIII(Eu), XXIV(Eu) для полимера XXX(Eu) наблюдается значительное отклонение геометрии металлоостова от линейного (углы CdEuEu составляют 110.85° и 111.45° для XXX(Eu), 172.80° для XXVIII(Eu) и 168.37° для XXIV(Eu)). По-видимому, наличие внутри- и межмолекулярных π–π-взаимодействий приводит к искажению геометрии металлоостова XXX(Eu), в то время как в кристаллах близких к линейным соединений XXVIII(Eu), XX-IV(Eu) π–π-взаимодействия не наблюдаются.
По данным КБСД, аналогичные полимерные комплексы {Ln2M} (M = атом переходного металла) с анионами монокарбоновых кислот и N-донорными ароматическими лиганадами не описаны, но синтезирован ряд полимерных комплексов {Ln2M} без ароматических N-донорных лигандов, где мостиковую функцию выполняют карбоксилат-анионы состава [Ln2Zn(H2O)2(Fur)8]n (Fur = анион 2-фуранкарбоновой кислоты) [13, 83] и [Ln2Mn(H2O)4- (CH3COO)8] [84, 85].
При взаимодействии Cd(NO3)2 · 4H2O, Eu(NO3)3 · · 6H2O, KPfbnz и Bipy был получен трехъядерный комплекс [Eu(NO3)Cd2(Bipy)2(Pfbnz)6] (XXXI(Eu)) строение которого аналогично [EuCd2(Bipy)2- (H2O)(Dtbbnz)7] · MeCN · 2THF · 3H2O (XIX(Eu)). Атомы водорода координированных молекул B-ipy участвуют в формировании контактов C–H…F с атомами фтора Pfbnz-анионов соседних молекул комплекса.
При анализе люминесценции комплексов XIX(Eu) и XXXI(Eu) показано, что замена аниона 3,5-ди-трет-бутилбензойной кислоты в XIX(Eu) на анион пентафторбензойной кислоты в XXXI(Eu) приводит к двукратному росту квантового выхода от 14 до 25% и времени жизни от 1360 до 2150 мкс. Возможно, причиной такого эффекта является более подходящий по энергии триплетный уровень Pfbnz-аниона (ET = 22 000 см–1) [86], что делает более эффективным перенос энергии от лиганда на люминесцирующие уровни иона металла (JD0).
Для увеличения вероятности формирования внутри- и межмолекулярных взаимодействий в кристалле комплексов мы вводили Phen, поскольку отмечается большая тенденция его участия в π–π-взаимодействиях по сравнению с 2,2'-дипиридилом [28].
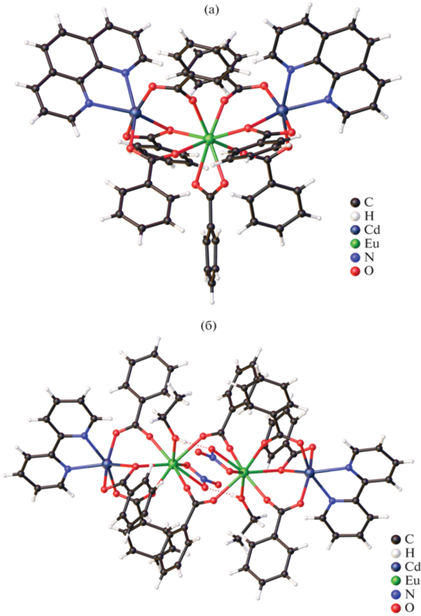
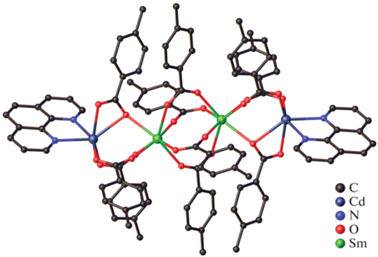
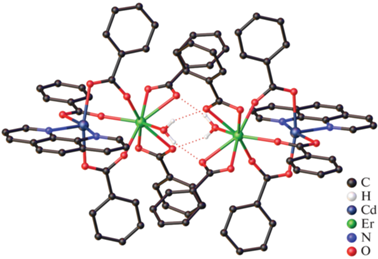
Реакция между пентафторбензоатами кадмия(II) и лантанидов(III) в присутствии Phen в MeCN при комнатной температуре привела к получению серии 1D-координационных полимеров [Ln2Cd2(Phen)2(Pfbnz)10]n · 3nMeCN, Ln = Eu (XXXII(Eu)), Gd (XXXII(Gd)), Tb (XXXII(Tb), рис. 10а), Dy (XXXII(Dy)). Было обнаружено, что повышение температуры синтеза и кристаллизации до 75°C приводит к выделению молекулярного комплекса [Tb2Cd2(Phen)2(Pfbnz)10] (XXXIII(Tb), рис. 10б) [31], изоструктурного комплексам Zn(II).
Рис. 10.
Строение комплексов XXXII(Tb) (а) и XXXIII(Tb) (б). Атомы водорода и сольватные молекулы не показаны.
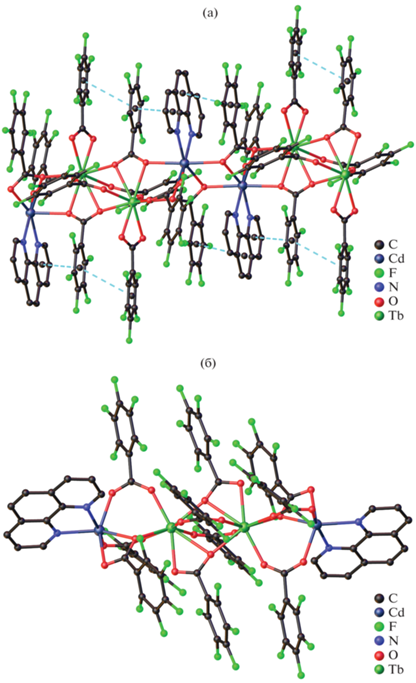
Полимерные цепи XXXII построены из тетраядерных цепочечных фрагментов {Ln2Cd2}, в которых, как и в молекулярных комплексах Ln2–Cd2, ионы кадмия(II) являются периферийными, а ионы лантанидов(III) – центральными. С каждым ионом металла XXXII один из пентафторбензоатных анионов связан хелатно, при этом один из атомов кислорода данного аниона обеспечивает мостиковое связывание с ионом лантанида(III) “своего” четырехъядерного фрагмента {Ln2Cd2}, а второй атом кислорода координируется ионом кадмия(II) соседнего фрагмента {Ln2Cd2}. Поскольку фрагменты эквивалентные и центросимметричные, то они при таком строении оказываются связаны между собой двумя мостиковыми атомами кислорода двух карбоксилатных анионов. Каждый ион кадмия(II) достраивает свое окружение до пентагональной бипирамиды (CdO5N2) координацией двух атомов N молекулы Phen и атомов О одного мостикового, одного μ3κ1κ2κ1- и одного μ3κ1κ1κ1-Pfbnz-анионов. Ионы Ln(III) достраивают свое координационное окружение до девятивершинного полиэдра (LnO9) координацией двух атомов O хелатирующего Pfbnz-аниона и атомов О одного мостикового, двух μ3κ1κ2κ1- и одного μ3κ1κ1κ1-Pfbnz-анионов.
Строение молекулярного комплекса XXXIII(Tb) подобно структуре {Ln2M2} островных соединений XXVIII(Eu), XXIX(Eu), где центральные ионы металлов связаны между собой двумя мостиковыми и двумя хелатно-мостиковыми Pfbnz-анионами. Периферийные ионы кадмия(II) связаны с мостиковым РЗЭ и двумя хелатно-мостиковыми Pfbnz-анионами. Координационное окружение ионов кадмия(II) соответствует октаэдру (CdO4N2).
На примере соединений XXXII(Tb) и XXXIII(Tb) мы экспериментально зафиксировали и молекулярную и полимерную формы для одного и того же состава. При этом строение тетраядерного гетерометаллического фрагмента {Tb2Cd2(Phen)2- (Pfbnz)10} полимера XXXII(Tb) и молекулярного комплекса XXXIII(Tb) существенно различается. В XXXIII(Tb) ионы металлов расположены практически на одной линии. В тетраядерном фрагменте полимера {Ln2Cd2(Phen)2(Pfbnz)10} наблюдается мотив сплющенного строения, описанный для полимерного комплекса XXX(Eu). В результате происходит сближение ароматических фрагментов и зигзагообразное расположение ионов металлов (угол CdLnLn в тетраядерных фрагментах по сравнению с молекулярными соединениями XXVIII(Eu), XXIX(Eu) и XXXIII(Tb) изменяется с ~172° до 115°).
По-видимому, стабилизация полимерной структуры связана с внутримолекулярными взаимодействиями π…π, C–H…F, F…F, F…π, что обуслoвливает близкое к параллельному расположению всех пентафторфенильных заместителей карбоксилатных анионов и координированных молекул Phen полимерной цепи и обеспечивает разблокирование металлоцентра, необходимое для полимеризации. В структуре же молекулярного комплекса XXXIII(Tb) пентафторбензоатные анионы задействованы только во взаимодействиях C–H…F.
По данным КБСД, все остальные известные гетерометаллические комплексы Ln−M, где M – переходный металл, с анионами монокарбоновых кислот и молекулами 1,10-фенантролина или его замещенными аналогами (описано 55 соединений) являются молекулярными.
Замена кадмия(II) на цинк(II) и вариация температуры синтеза и кристаллизации от 25 до 80°С показали, что в этих условиях кристаллизуется только один продукт – молекулярные тетраядерные комплексы [Ln2Zn2(Phen)2(Pfbnz)10] · 2MeCN (Ln = Eu, Gd, Tb, Dy). Система с ионами цинка(II) демонстрирует индифферентность к варьированию температуры, что, по-видимому, обуслoвливается меньшим радиусом ионов цинка(II) по сравнению с ионом кадмием(II), препятствующим координации карбоксилатных групп соседней молекулы комплекса.
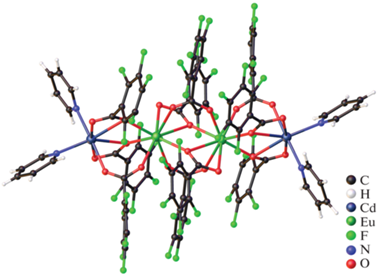
Попытка синтеза гетерометаллического соединения Ln2−Cd2 в присутствии пентафторбензоата цинка(II) привела к кристаллизации комплекса [Eu2Cd2(Phen)4(Pfbnz)10] · 4MeCN (XXXIV(Eu), рис. 11). В структуре XXXIV(Eu) формируется более ‘рыхлый’ тетраядерный металлоостов, где ионы металлов связаны только мостиковыми Pfbnz-анионами, что приводит к увеличению расстояния Cd…Ln по сравнению с тетраядерным молекулярным комплексом XXXIII(Tb), а каждый ион металла координирует хелатно связанную молекулу Phen. Координационное окружение Eu3+ соответствует квадратной антипризме (EuO7N2), а атом кадмия(II) достраивает свое окружение до тригональной призмы координацией хелатирующего Pfbnz-аниона (CdO4N2). По данным КБСД, не удалось найти примеров гетерометаллических комплексов РЗЭ с переходными металлами и анионами монокарбоновых кислот, где к каждому атому металла была бы координирована молекула N-донорного хелатирующего лиганда.
Фотофизические свойства комплексов XXXII(Eu), XXXII(Tb) и XXXIII(Tb) были изучены для твердых образцов при комнатной температуре. Для европий(III)- и тербий(III)-содержащих комплексов были выявлены большие времена затухания люминесценции, сравнимые с временами для свободных ионов европия(III) и тербия(III), что свидетельствует о незначительном вкладе лигандного окружения в процессы деактивации возбужденных состояний ионов лантанидов.
Значения квантовых выходов люминесценции для [Eu2Cd2(Phen)2(Pfbnz)10]n · 3nMeCN (XXXII(Eu)), [Tb2Cd2(Phen)2(Pfbnz)10]n · 3nMeCN (XXXII(Tb)), [Tb2Cd2(Phen)2(Pfbnz)10] (XXXIII(Tb)), составляющие 39, 63, 45% соответственно, оказались достаточно высокими по сравнению со значениями квантовых выходов для изученных нами ранее гетерометаллических комплексов Ln−Cd. Выявлено, что квантовый выход и время жизни люминесценции полимерного Tb3+-содержащего комплекса XXXII(Tb) превосходит значения для молекулярного комплекса XXXIII(Tb) аналогичного состава. Также наблюдается увеличение времени жизни возбужденного состояния и эффективности сенсибилизации (η = 58%) для [Eu2Cd2(Phen)2- (Pfbnz)10]n · 3nMeCN (XXXII(Eu)) по сравнению с ранее синтезированным гомометаллическим комплексом европия(III) [Eu2(Phen)2(H2O)2(Pfbnz)6] [87]. Более низкое значение эффективности сенсибилизации может быть связано с тушением люминесценции вибрационными колебаниями молекулы воды, координированной ионом Eu3+. Сравнение квантовых выходов для XXXII и полимера [Ln(H2O)(Pfbnz)3]n [88] показало более низкиe значения Q в случае гомометаллических комплексов в ~3.6 и ~1.7 раза для европий- и тербий-содержащих соединений соответственно, что может быть обусловлено присутствием молекул воды в составе комплексов [Ln(H2O)(Pfbnz)3]n и большим количеством лигандов-антенн в пересчете на один атом Ln(III) в [Eu2Cd2(Phen)2(Pfbnz)10]n · · 3nMeCN (XXXII(Eu)).
В заключение отметим, что представленный обзор данных о строении и условиях получения гетерометаллических соединений показывает ряд существенных особенностей, которые наблюдаются в комплексах Ln(III)−Cd(II), но не характерны для близких по составу и строению соединений Ln(III)−M(II) с атомами 3d-металлов (M2+ = Co, Ni, Cu, Zn). Гетерометаллическим составам {LnM2(L)2(OOCR)7}, {LnM2(L)2(NO3)(OOCR)6}, {Ln2M2(L)2(OOCR)10} и {Ln2M2(L)2(NO3)2(OOCR)8} (M2+ = Co, Ni, Cu, Zn и Cd; L = N-донорный гетероциклический монодентатный или хелатирующий лиганд) в случае 3d-металлов соответствуют устойчивые молекулярные комплексы. Отмечается, что для систем Ln(III)–Cd(II) также могут быть получены изоструктурные комплексам 3d-металлов соединения.
Способность гетерометаллических комплексов кадмия(II) формировать координационные полимеры при составах, типичных для молекулярных комплексов 3d-металлов с ароматическими N‑донорными гетероциклическими монодентатными или хелатирующими лигандами, обнаружена и для гетерометаллических пентафторбензоатных комплексов. Составам {Ln2Cd2(Phen)2-(C6F5COO)10} и {Ln2Cd2(Phen)2(NO3)2-(C6F5COO)8} могут соответствовать 1D координационные полимеры.
Для всех перечисленных гетерометаллических соединений возможно достраивание координационного окружения кадмия(II) молекулами растворителя с образованием островных структур. Большие кооординационные числа кадмия(II) и формирование более длинных его связей с донорными атомами способствуют увеличению “рыхлости” лигандного окружения гетерометаллических металлофрагментов. В результате становится возможным достраивание молекулами растворителя координационного окружения не только атомов кадмия(II), но и атомов лантанидов(III).
Обнаруженная в комплексах Ln(III)−Cd(II) тенденция достраивания координационного окружения атомов лантанидов(III) дополнительными молекулами растворителя ярко реализуется в случае соединения XXXIV(Eu), в котором атомы лантанидов(III) хелатно связывают молекулы Phen, присутствующего в большом избытке в реакционной смеси (Cd2+ : Рhen = 1 : 10). Отметим, что возможность связывания молекул растворителей атомами лантанида позволяет рассматривать их влияние на фотофизические свойства соединений, делая комплексы Ln(III)−Cd(II) перспективными для детектирования находящихся в реакционной массе молекул.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Phukan N., Goswami S., Lipstman S. et al. // Cryst. Growth Des. 2020. V. 20. № 5. P. 2973.
Dey A., Kalita P., Chandrasekhar V. // ACS Omega. 2018. V. 3. № 8. P. 9462.
Hasegawa Y., Kitagawa Y., Nakanishi T. // NPG Asia Materials. 2018. V. 10. P. 52.
Peng G., Chena Y., Li B. // New J. Chem. 2020. V. 44. P. 7270.
Pugh T., Tuna F., Ungur L. et al. // Nat. Commun. 2015. V. 6. P. 7492.
Bovkunova A.A., Bazhina E.S., Evstifeev I.S. et al. // Dalton Trans. 2021. V. 50. № 35. P. 12275.
Babeshkin K.A., Gavrikov A.V., Petrosyants S.P. et al. // Eur. J. Inorg. Chem. 2020. V. 46. P. 4380.
Sidorov A.A., Gogoleva N.V., Bazhina E.S. et al. // Pure Appl. Chem. 2020. V. 92(7). P. 1093.
Уточникова В.В., Кузьмина Н.П. // Коорд. химия. 2016. Т. 42. С. 640 (Utochnikova V.V., Kuzmina N.P. // Russ. J. Coord. Chem. 2016. V. 42. № 10. P. 679). https://doi.org/10.1134/S1070328416090074
Елисеева С.В. Дис. … канд. хим. наук. 2006. С. 171.
Latva M., Mukkala V. et al. // J. Lumin. 1997. V. 75. P. 149.
Yin M., Sun J. // J. Coord. Chem. 2005. V. 58. P. 335.
Yin M., Lei X., Sun J. et al. // J. Phys. Chem. Solids. 2006. V 67. № 7. P. 1372. https://doi.org/10.1016/j.jpcs.2006.01.110
Miroslaw B., Cristóvão B. Hnatejko Z. // Molecules. 2018. V. 23. № 7. P. 1761.
Pushkarev A.P., Balashova T.V., Kukinov A.A. et al. // Dalton Trans. 2017. V. 46. P. 10408.
Khan A., Akhtar M.N. Lan Y. // Inorg. Chim. Acta. 2021. V. 524. P. 120437.
Nikolaevskii S.A., Petrov P.A., Sukhikh T.S. et al. // Inorg. Chim. Acta. 2020. V. 508. P. 119643.
Li L., Zou J.-Y., You S.-Y. et al. // Dalton Trans. 2017. V. 46. P. 16432.
Wang Y.-M., Wang Y., Wang R.-X. et al. // J. Phys. Chem. Solids. 2017. V. 104. P. 221.
Yang J.-W., Tian Y.-M., Tao J. et al. // Inorg. Chem. 2018. V. 57. P. 8065.
Patrascu A.A., Briganti M., Soriano S. et al. // Inorg. Chem. 2019. V. 58. P. 13090.
Li Y., Zhang C., Yu J.-W. et al. // Inorg. Chim. Acta. 2016. V. 445. P. 110.
Kiskin M.A., Dobrokhotova Zh.V., Bogomyakov A.S. et al. // Russ. Chem. Bull. 2016. V. 65. № 6. P. 1488.
Egorov E.N., Mikhalyova E.A., Kiskin M.A. et al. // Russ. Chem. Bull. 2013. V. 62. № 10. P. 2141.
Kiskin M.A., Varaksina E.A., Taydakov I.V., Eremenko I.L. // Inorg. Chim. Acta. 2018. V. 482. P. 85.
Boyle T.J., Raymond R., Boye D.M. et al. // Dalton Trans. 2010. V. 39. P. 8050.
Kiraev S.R., Nikolaevskii S.A., Kiskin M.A. et al. // Inorg. Chim. Acta. 2018. V. 477. P. 15.
Goldberg A., Kiskin M., Nikolaevskii S. et al. // Chem. Asian J. 2016. V. 11. P. 604.
Zhang L., Zhao L., Zhang P. et al. // Inorg. Chem. 2015. V. 54. № 23. P. 11535.
Stavgianoudaki N., Siczek M., Lis T. et al. // Chem. Commun. 2016. V. 52. № 2. P. 343.
Shmelev M.A., Kiskin M.A., Voronina J.K. et al. // Materials. 2020. V. 13. № 5689.
Shmelev M.A., Polunin R.A., Gogoleva N.V. et al. // Molecules. V. 26. № 14. P. 4296.
Zhou L.-X., Xu J.-Q., Zheng Y.-Q. et al. // J. Coord. Chem. 2017. V. 70. P. 3379.
Liu Q., Ge S.-Z., Zhong J.-C. et al. // Dalton Trans. 2013. V. 42. № 18. P. 6314.
Ma Y., Yang X., Shi D. et al. // Inorg. Chem. 2020. V. 59. № 23. P. 16809.
Niu M., Yang X., Ma Y. et al. // Inorg. Chem. 2021. V. 60. P. 5764.
Niu M., Yang X., Ma Y. et al. // J. Phys. Chem. A. 2021. V. 125. P. 251.
Jiang M., Yu L., Zhou Y.-C. et al. // Z. Anorg. Allg. Chem. 2020. V. 646. P. 268.
Chi Y., Liu Y., Hu X., X. et al. // Z. Anorg. Allg. Chem. 2016. V. 642. P. 73.
Chi Y., Niu S., Wang Z. et al. // Eur. J. Inorg. Chem. 2008. V. 2008. P. 2336.
Chi Y., Niu S., Wang Z. et al. // Chem. J. Chin. Univ. 2008. V 29. P. 1081.
Шмелев М. А., Гоголева Н. В., Сидоров А.А. и др. // Коорд. химия. 2020. Т. 46. № 1. С. 3 (Shmelev M.A., Gogoleva N.V., Sidorov A.A. et al. // Russ. J. Coord. Chem. 2020. V. 46. № 1. P. 1). https://doi.org/10.1134/S1070328420010078
Шмелев М.А., Гоголева Н.В., Сидоров А.А. и др. // Коорд. химия. 2020. Т. 46. № 7. С. 437 (Shmelev M.A., Gogoleva N.V., Sidorov A.A. et al. // Russ. J. Coord. Chem. 2020. V. 46. № 7. P. 493). https://doi.org/10.1134/S1070328420070076
Shmelev M.A., Gogoleva N.V., Sidorov A.A. et al. // Inorg. Chim. Acta. 2021. V. 515. P. 120050.
Shmelev M.A., Gogoleva N.V., Sidorov A.A. et al. // ChemistrySelect. 2020. V. 5. P. 8475.
Шмелев М.А., Гоголева Н.В., Кузнецова Г.Н. и др. // Коорд. химия. 2020. Т. 46. № 8. С. 497 (Shmelev M.A., Gogoleva N.V., Kuznetsova G.N. et al. // Russ. J. Coord. Chem. 2020. V. 46. № 8. P. 557). https://doi.org/10.1134/S1070328420080060
Zhu Yue, Lu Wei-Min, Chen Fang et al. // Acta Crystallogr. E. 2004. V. 60. P. m963.
Кембриджский банк структурных данных. № 2120404. http://www.ccdc.cam.ac.uk/data_request/cif
Nikolaevskii S.A., Yambulatov D.S., Voronina J.K. et al. // ChemistrySelect. 2020. V. 5. P. 12829.
Sap’yanik A.A., Lutsenko I.A., Kiskin M.A. et al. // Russ. Chem. Bull. 2016. V. 65. P. 2601.
Burkovskaya N.P., Orlova E.V., Kiskin M.A. et al. // Russ. Chem. Bull. 2011. P. 2442.
Kiskin M., Zorina-Tikhonova E., Kolotilov S. et al. // Eur. J. Inorg. Chem. 2018. P. 1356.
Шмелев М.А., Кузнецова Г.Н., Долгушин Ф.М. и др. // Коорд. химия. 2021. Т. 47. № 2. С. 92 (Shmelev M.A., Kuznetsova G.N., Dolgushin F.M. et al. // Russ. J. Coord. Chem. 2021. V. 47. № 2. P. 127). https://doi.org/10.1134/S1070328421020068
Sapianik A.A., Dudko E.R., Samsonenko D.G. et al. // Inorg. Chim. Acta. 2021. V. 517. P. 120216.
Fomina I.G., Dobrokhotova Z.V., Kazak V.O. et al. // Eur. J. Inorg. Chem. 2012. V. 2012. P. 3595.
Carter K.P., Thomas K.E., Pope S.J.A. et al. // Inorg. Chem. 2016. V. 55. № 14. P. 6902.
Inomata Y., Sunakawa T., Howell F.S. // J. Mol. Struct. 2003. V. 648. P. 81.
Cherkasova E.V., Pervukhina N.V., Kuratieva N.V. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 5. P. 626.
Maeda M., Hino S., Yamashita K. et al. // Dalton Trans. 2012. V. 41. P. 13640.
Theppitak C., Kielar F., Dungkaew W. et al. // RSC Adv. 2021. V. 11. P. 24709.
Herder J.A., Walusiak B.W., Cahill C.L. // J. Chem. Crystallogr. 2021. V. 51. P. 317.
Du D.-D., Ren N., Zhang J.-J. // J. Solid State Chem. 2021. V. 300. Article122198.
Wang T.-T., Su Y.-M., Jiao C.-Q. et al. // New J. Chem. 2018. V. 42. P. 1235.
Ridenour J.A., Cartera K.P., Cahill C.L. // CrystEngComm. 2017. V.19. P. 1190.
Zheng K., Liu Z., Jiang Y. et al. // Dalton Trans. 2018. V. 47. P. 17432.
You L.-X., Xie S.-Y., Xia C.-C. et al. // CrystEngComm. 2019. V. 21. P. 1758.
Li Y.Y., Ren N., He S.M. et al. // Appl. Organometal. Chem. 2019. V. 33. P. e5212.
Chi Y., Niu S., Jin J. et al. // Dalton Trans. 2009. V. 37. P. 7653.
Beeby A., Clarkson I.M., Dickins R.S. et al. // Perkin Trans. 1999. V. 2. P. 493.
Shmelev M.A., Voronina Y.K., Gogoleva N.V. et al. // Russ. Chem. Bull. 2020. V. 69. № 8. P. 1544.
Шмелев М.А., Гоголева Н.В., Кузнецова Г.Н. и др. // Коорд. химия. 2020. Т. 46. № 8. С. 497 (Shmelev M.A., Gogoleva N.V., Kuznetsova G.N. et al. // Russ. J. Coord. Chem. 2020. V. 46. № 8. P. 557). https://doi.org/10.1134/S1070328420080060
Kumar U., Thomas J., Thirupathi N. // Inorg. Chem. 2010. V. 49. P. 62.
Gol’dberg A.E., Kiskin M.A., Sidorov A.A., Eremenko I.L. // Russ. Chem. Bull. 2011. V. 60. P. 829.
Goldberg A.E., Kiskin M.A., Nikolaevskii S.A. et al. // Russ. J. Coord.Chem. 2015. V. 41. P. 163.
Zhu H.-L., Qu Y., You Z.-L. et al. // Acta Crystallogr. E. 2003. V. 59. P. m1028.
Chi Y., Liu Y., Hu X. et al. // Z. Anorg. Allg. Chem. 2016. V. 642. P. 73.
Yang Y.Q., Chen Z.M., Li W. et al. // Z. Kristallogr. 2011. V. 226. P. 112.
Cockcroft J.K., Rosu-Finsen A., Fitch A.N., Williams J.H. // CrystEngComm. 2018. V. 20. P. 6677.
Bhandary S., Chopra D. // Cryst. Growth Des. 2018. V. 18. P. 3027.
Cockcroft J.K., Li J.G.Y., Williams J.H. // CrystEngComm. 2019. V. 21. P. 5578.
Goldberg A.E., Nikolaevskii S.A., Kiskin M.A. et al. // Russ. J. Coord. Chem. 2015. V. 41. P. 707.
Dobrokhotova Z., Emelina A., Sidorov A. et al. // Polyhedron. 2011. V. 30. P. 132.
Yin M.-C., Li M., Yuan L.-J., Sun J.-T. // Chin. J. Lumin. 2005. V. 26. P. 448.
Pan Y.-Y., Yang Y., Long L.-S. et al. // Inorg. Chem. Front. 2014. V. 1. P. 649.
Zhang C., Chen Y., Ma H. et al. // New J. Chem. 2013. V. 37. P. 1364.
Kong Y.-J., Li P., Han L.-J. et al. // Acta Crystrallogr. C. 2017. V. 73. P. 424.
Han L.-J., Kong Y.-J., Sheng N., Jiang X.-L. // J. Fluorine Chem. 2014. V. 166. P. 122.
Kalyakina A.S., Utochnikova V.V., Bushmarinov I.S. et al. // Chem. Eur. J. 2015. V. 21. P. 17921.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия