Координационная химия, 2022, T. 48, № 9, стр. 534-542
Синтез и кристаллическое строение новых трехъядерных фторокарбоксилатных комплексов кобальта(II) и никеля(II)
Д. С. Терещенко 1, Т. Ю. Глазунова 1, *, М. Е. Бузоверов 1, Э. Х. Лермонтова 2, В. Е. Гончаренко 1
1 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
2 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: ctpayc@mail.ru
Поступила в редакцию 12.12.2021
После доработки 14.03.2022
Принята к публикации 15.03.2022
- EDN: EUITFK
- DOI: 10.31857/S0132344X22090079
Аннотация
Синтезированы и кристаллографически изучены три новых комплекса, относящихся к семейству фторокарбоксилатометаллатов 3d-металлов. Изотипные комплексные соединения K[Co3(μ3-F) (CF3COO)6(CH3COOH)3](CH3COOH) (I) и K[Ni3(μ3-F)(CF3COO)6(CH3COOH)3](CH3COOH)0.6- (CF3COOH)0.4 (II) являются аналогами фторотрифторацетатометаллатов(II) калия, в которых аксиальные лиганды заменены на молекулы уксусной кислоты. Комплекс NH4[Ni3(μ3-F)(CH3COO)6- (CH3COOH)3](CH3COOH)6 (III) – первый пример фторокарбоксилата с ацетатными мостиковыми лигандами. Присутствие уксусной кислоты в реакционной системе приводит к увеличению координационного числа щелочного металла и, за счет образования развитой системы водородных связей, – к увеличению размерности структуры от цепочечной в изученных ранее аналогах до слоистой. Строение комплексного фторокарбоксилатного аниона в III схоже с фторотрифторацетатными аналогами I, II, сохраняется характер взаимодействия комплексного аниона с однозарядным катионом, структура реализована в виде гофрированных слоев, образованных цепями, связанными между собой водородными связями с сольватными молекулами уксусной кислоты (CCDC № 2124887 (I), 2124888 (II), 2127163 (III)).
Настоящее исследование является продолжением цикла работ, посвященных изучению и выявлению критериев существования фторокарбоксилатометаллатных комплексов, содержащих трехъядерный фрагмент [М3(μ3-F)(RCOO)6(L)3]. В предыдущих работах мы сообщали об открытии нового семейства фторотрифторацетатных комплексов, последующее развитие данного направления привело к получению и структурной характеризации более 15 фторотрифторацетатных комплексов переходных металлов общей формулы M'[M3(µ3-F)(CF3COO)6(L)3] (М' = Li–Cs, NH4; M = Mn, Fe, Co, Ni, Zn; L = CF3COO–, CF3COOH, H2O) [1]. На настоящий момент эти данные являются наиболее систематическим изучением строения и свойств указанного семейства карбоксилатов. Все изученные нами комплексы образованы однозарядными анионами [M3(µ3-F)(CF3COO)6(L)3]–, в которых три атома переходного металла, находящиеся в вершинах практически правильного треугольника, планарно координируют тридентатный атом фтора. Каждая пара атомов 3d-металла связана между собой двумя бидентатными трифторацетатными группами. Координационное окружение атома 3d-металла дополняют до октаэдрического атомы кислорода аксиальных лигандов. Нами описана возможность замены аксиальных лигандов и, соответственно, изменения состава комплексов варьированием условий синтеза, что может приводить к изменению размерности структуры [2]. Противоионами к комплексным анионам являются однозарядные катионы щелочного металла, аммония или нитрозония [1, 3]. В зависимости от состава комплексного аниона и размера катиона в состав соединений могут входить молекулы растворителя, участвующие в формировании структуры.
Фторокарбоксилатные комплексы, содержащие трехъядерный фрагмент [М3(μ3-F)(RCOO)6(L)3], оказываются устойчивыми и могут быть структурными блоками для получения каркасных структур при использовании двухосновных карбоновых кислот. Примерами могут служить металл-органические каркасы (MOFs) на базе кадмиевых изо-никотинатных комплексов [Cd3(μ3-F)(Ina)4- (4-Рic)3] · BF4, [Cd3(μ3-F)(Ina)3(4,4'-Bipy)2(4-Pic)2] · · 2BF4 · (4,4'-Bipy) · 2H2O, [Cd3(μ3-F)(Ina)3(4,4'-BiSpy)3] · 2BF4 · (4,4'-Bipy) · 2H2O, где Ina – изоникотинат, 4,4'-Bipy – 4,4'-бипиридин, 4-Pic – 4Hметилпиридин [4], металл-органический каркас [H1.1F0.5Na0.3K0.1][Mn3(μ3-F)(Tcpep)2(DMF)-(H2O)2] · 9H2O · 2DMF, где Tcpep – трис(пара-карбоксифенилэтинил)фосфин (P{C≡CC6H5-4-CO2H}3) [5], MOFs на основе комплексов кобальта и никеля с 4-(4,4'-бипиридиний)-бензойной кислотой и классическими каркасообразующими двухосновными кислотами, такими как терефталевая кислота и ее производные, бифенилдикарбоновая и стильбендикарбоновая кислоты [6].
Фторокарбоксилатные комплексы, содержащие трехъядерный фрагмент [М3(μ3-F)(RCOO)6- (L)3] могут быть образованы как p-металлами, например в трехъядерном трифторацетатном комплексе магния [Mg3(μ3-F)(TFA)6(OCH3)2(Py)] · · 4(PyH) · OMe [7], так и различными атомами металла, как в гетерометаллических гетеровалентных пивалатных комплексах [Ni2Cr(μ3-F)(Piv)6(HPiv)3], [Ni2Cr(μ3-F)(Piv)6(Py)3] и [Ni2Cr(μ3-F)(Piv)6(4-CH3-Py)3] [8]. Изучение магнитных свойств данных соединений делает их популярным объектом для исследования.
В настоящей работе мы продолжаем систематическое изучение семейства фторокарбоксилатометаллатов 3d-металлов, основанное на выявлении критериев его существования. Основное внимание уделено возможности получения представителей данного семейства соединений при использовании уксусной кислоты, формированию комплексов в смеси уксусной и трифторуксусной кислот. Описываются впервые полученные комплексные соединения K[Co3(μ3-F)(CF3COO)6- (CH3COOH)3](CH3COOH) (I), K[Ni3(μ3-F)(CF3COO)6- (CH3COOH)3](CH3COOH)0.6(CF3COOH)0.4 (II), NH4[Ni3(μ3-F)(CH3COO)6(CH3COOH)3](CH3COOH)6 (III). Обсуждается строение треугольных трехъядерных анионов, координационное окружение катионов щелочного металла, а также особенности упаковки анионов и катионов в указанных структурах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных реагентов использовали CoCO3 · nCo(OH)2 · mH2O (“ч.”), NiCO3 (“ч. д. а.”), KHF2 (“ос. ч.”), NH4F (“ч. д. а.”), CH3COOH (ледяная “ч.”), CF3COOH (99.9% “ч.”).
Для синтеза соединений I–III готовили растворы исходных соединений в ледяной уксусной кислоте и оставляли их для концентрирования в эксикаторе над P4O10 при комнатной температуре. Тетрагидраты трифторацетатов кобальта и никеля M(CF3COO)2(Н2O)4 (M = Co, Ni), используемые при синтезе, получали по методике [1]. Во всех случаях через 7–9 сут начиналась кристаллизация неустойчивых на воздухе соединений. Пригодные для РСА пластинчатые монокристаллы соединений I–III отбирали из маточного раствора соответствующих соединений. Через 2 нед. поликристаллические соединения I–III отфильтровывали от маточного раствора и сушили в токе аргона. Однофазность полученных соединений во всех случаях подтверждали методом РФА (Huber G670 Guinier camera, Ge (111) монохроматор, CuKα1).
Синтез K[Co3(μ3-F)(CF3COO)6(CН3COOН)3]- (CН3COOН) (I). К раствору 3.570 г (10 ммоль) Co(TFA)2(H2O)4 в 15 мл ледяной уксусной кислоты добавляли 0.260 г (3.3 ммоль) KHF2. Выход I 64%.
Синтез K[Ni3(μ3-F)(CF3COO)6(CH3COOH)3]- (CH3COOH)0.6(CF3COOH)0.4 (II). К раствору 3.570 г (10 ммоль) Ni(TFA)2(H2O)4 в 15 мл 99% уксусной кислоте добавляли 0.260 г (3.3 ммоль) KHF2. Выход II 76%.
Синтез NH4[Ni3(μ3-F)(CН3COO)6(CН3COOH)3]- (CН3COOH)6 (III). К раствору 2.488 г (10 ммоль) Ni(OAc)2(H2O)4 в 25 мл ледяной уксусной кислоты добавляли 0.122 г (3.3 ммоль) NH4F. Выход III 58%.
РСА. Сбор данных для соединений I и II проходил с использованием дифрактометра Bruker D8 Quest c детектором Photon III при температуре 100(2) К, излучение MoKα (λ = 0.71073 Å), режим φ и ω-сканирования, для соединения III cбор экспериментальных данных проведен на автоматическом дифрактометре Bruker SMART APEX II (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор) при температуре 150 К в режиме ω-сканирования. Учет поглощения введен по измерениям интенсивностей эквивалентных отражений [9]. Структуры расшифрованы прямыми методами и уточнены полноматричным анизотропным МНК по F 2 с использованием программных пакетов SHELXTL и Olex2 [10–12]. Атомы водорода помещены в рассчитанные позиции и уточнены с помощью модели “наездника”. Заселенности разупорядоченных CF3-групп уточнены с использованием свободных переменных. Кристаллографические данные, параметры эксперимента и уточнения структуры приведены в табл. 1.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур I–III
| Параметр | Значение | ||
|---|---|---|---|
| I | II | III | |
| Брутто-формула | C20H16F19O20KCo3 | C20H16F19O20KNi3 | C30H58FNO30Ni3 |
| М | 1153.22 | 1174.15 | 1107.90 |
| Температура, K | 100(2) | 100(2) | 150(2) |
| Размер кристалла, мм | 0.133 × 0.129 × 0.038 | 0.154 × 0.133 × 0.046 | 0.600 × 0.300 × 0.080 |
| Сингония | Моноклинная | Моноклинная | Моноклинная |
| Пр. группа | P21/c | P21/c | P21/n |
| a, Å | 10.2799(4) | 10.3517(9) | 13.0632(2) |
| b, Å | 22.9727(7) | 22.7966(18) | 14.2954(2) |
| c, Å | 17.0025(6) | 16.9531(15) | 26.9907(4) |
| β, град | 96.993(2) | 97.464(3) | 101.8180(10) |
| V, Å3 | 3985.4(2) | 3966.8(6) | 4933.50(13) |
| Z | 4 | 4 | 4 |
| ρ(выч.), г/см3 | 1.922 | 1.966 | 1.492 |
| μ, мм–1 | 1.500 | 1.683 | 1.227 |
| F(000) | 2268 | 2318 | 2312 |
| Диапазон θ, град | 2.15–26.00 | 1.98–26.00 | 2.099–27.00 |
| Диапазон индексов | –12 ≤ h ≤ 12, –23 ≤ k ≤ 28, –20 ≤ l ≤ 20 |
–12 ≤ h ≤ 12, –27 ≤ k ≤ 28, –20 ≤ l ≤ 20 |
–16 ≤ h ≤ 16, –18 ≤ k ≤ 18, –34 ≤ l ≤ 34 |
| Всего отражений | 30 671 | 30T268 | 56898 |
| Независимых отражений (Rint) | 7820 (0.0659) | 7790 (0.0763) | 10T764 (0.0424) |
| Полнота данных по θ, % | 99.9 | 100 | 99.9 |
| Число параметров/ограничений | 555/45 | 589/94 | 647/37 |
| GООF | 1.035 | 1.040 | 1.011 |
| R1 (I > 2σ(I)) | 0.0693 | 0.0668 | 0.0346 |
| wR2 (по всем данным) | 0.1817 | 0.1728 | 0.0828 |
| Δρmax/Δρmin, e/Å3 | 1.980/–1.356 | 1.751/–1.698 | 0.523/–0.574 |
Координаты атомов, длины связей, валентные углы и параметры теплового смещения депонированы в Кембриджском банке структурных данных (CCDC № 2124887 (I), 2124888 (II), 2127163 (III)).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Синтез соединений K[Co3(μ3-F)(CF3COO)6- (CH3COOH)3](CH3COOH) (I) и K[Ni3(μ3-F)- (CF3COO)6(CH3COOH)3](CH3COOH)0.6(CF3COOH)0.4 (II) осуществляли взаимодействием тетрагидрата трифторацетата никеля или кобальта с избытком концентрированной уксусной кислоты в присутствии кислого фторида калия. Уксусная кислота, как более слабая, присутствовала в системе преимущественно в недиссоциированном виде и вошла в кристаллическую структуру комплекса в качестве нейтрального лиганда.
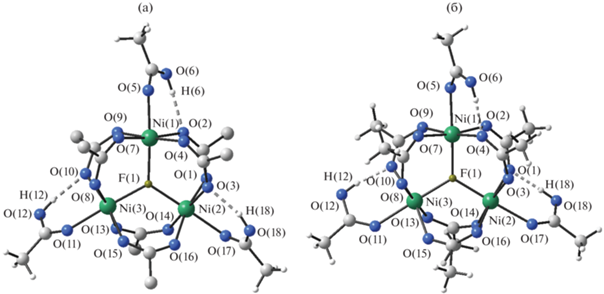
При использовании в качестве исходного соединения ацетата никеля впервые получен фтороацетатоникелат(II) аммония NH4[Ni3(μ3-F)(CН3COO)6(CН3COOH)3](CН3COOH)6 (III). Соединения I–III построены из трехъядерных комплексных анионов общей формулы [M3(μ3-F)(RCOO)6(CН3COOH)3]– (R = CF3 (I, II) или CH3 (III) и катионов калия (I, II) или аммония (III). Атомы d-металла, образующие комплексный анион расположены по вершинам практически правильного треугольника, тридентатный атом фтора располагается в плоскости треугольника, каждая пара атомов металла связана между собой двумя карбоксилатными группами (трифторацетатной в I, II или ацетатной в III). Координационное окружение атома металла дополняет до октаэдрического карбонильный атом кислорода молекулы уксусной кислоты, выступающей в качестве нейтрального лиганда.
При сравнении комплексных анионов в структурах I и II при переходе от Co к Ni наблюдается уменьшение длин связей в координационном окружении атомов переходного металла, обусловленное уменьшением ионного радиуса атома-комплексообразователя. Как видно из табл. 2, наиболее чувствительными к изменению ионного радиуса оказываются связи M–Oэкв с атомами кислорода мостиковых трифторацетатных групп, тогда как длины связей M–F и M–Oакс изменяются не так значительно. При переходе от Co к Ni изменение средних длин связей M–Oэкв составляет 0.044 Å, что несколько меньше разницы в ионных радиусах Co2+ и Ni2+ с координационным числом 6, составляющей 0.055 Å [13]. Связи M M–Oэкв F и M M–Oэкв Oaкс в среднем укорачиваются лишь на 0.027 Å. Уменьшение длин связей в координационном окружении атома переходного металла приводит к уменьшению размеров комплексного аниона в целом. Средние расстояния М…М в I и II составляют 3.51 и 3.46 Å соответственно.
Таблица 2.
Расстояния (Å) и углы (град) в координационном окружении атомов металла в структурах I–III
| Связь | d, Å | Угол | ω, град | ||||
|---|---|---|---|---|---|---|---|
| I | II | III | I | II | III | ||
| M(1)–F(1) | 2.032(3) | 2.008(3) | 1.9696(11) | F(1)M(1)O(2) | 92.5(1) | 92.9(1) | 95.38(5) |
| M(1)–O(2) | 2.103(4) | 2.050(4) | 2.0555(15) | F(1)M(1)O(4) | 90.3(1) | 91.1(1) | 92.46(6) |
| M(1)–O(4) | 2.081(4) | 2.042(4) | 2.0369(15) | F(1)M(1)O(7) | 93.5(1) | 93.6(1) | 92.62(6) |
| M(1)–O(7) | 2.065(4) | 2.017(4) | 2.0250(16) | F(1)M(1)O(9) | 89.2(1) | 90.9(1) | 93.59(5) |
| M(1)–O(9) | 2.084(4) | 2.025(4) | 2.0439(15) | F(1)M(1)O(5) | 174.5(1) | 176.3(1) | 178.08(6) |
| M(1)–O(5) | 2.078(4) | 2.060(4) | 2.0880(15) | O(4)M(1)O(2) | 87.9(2) | 88.7(2) | 90.59(7) |
| O(7)M(1)O(4) | 90.3(2) | 88.6(2) | 89.27(7) | ||||
| O(7)M(1)O(9) | 92.6(2) | 93.8(2) | 91.06(7) | ||||
| O(9)M(1)O(2) | 89.2(2) | 88.8(2) | 88.24(6) | ||||
| M(2)–F(1) | 2.014(3) | 1.990(3) | 1.9734(12) | F(1)M(2)O(1) | 96.5(1) | 96.3(1) | 90.90(6) |
| M(2)–O(1) | 2.076(4) | 2.037(4) | 2.0674(15) | F(1)M(2)O(3) | 88.7(1) | 89.8(1) | 94.23(6) |
| M(2)–O(3) | 2.099(4) | 2.057(4) | 2.0384(15) | F(1)M(2)O(14) | 92.6(1) | 93.0(1) | 91.56(6) |
| M(2)–O(14) | 2.084(4) | 2.036(4) | 2.0139(15) | F(1)M(2)O(16) | 95.7(1) | 96.1(1) | 94.82(6) |
| M(2)–O(16) | 2.049(4) | 2.017(4) | 2.0303(15) | F(1)M(2)O(17) | 178.0(1) | 178.6(1) | 178.38(6) |
| M(2)–O(17) | 2.105(4) | 2.084(4) | 2.1179(16) | O(1)M(2)O(3) | 89.9(2) | 89.9(2) | 90.68(6) |
| O(1)M(2)O(14) | 86.1(2) | 86.5(2) | 89.55(6) | ||||
| O(16)M(2)O(3) | 91.4(2) | 90.8(2) | 86.12(6) | ||||
| O(16)M(2)O(14) | 92.4(2) | 92.3(2) | 93.08(6) | ||||
| M(3)–F(1) | 2.033(3) | 1.998(3) | 1.9792(12) | F(1)M(3)O(8) | 93.7(1) | 93.6(1) | 89.40(6) |
| M(3)–O(8) | 2.055(4) | 2.014(4) | 2.0565(15) | F(1)M(3)O(10) | 92.8(1) | 93.5(1) | 93.88(5) |
| M(3)–O(10) | 2.089(4) | 2.041(4) | 2.0720(16) | F(1)M(3)O(13) | 91.1(1) | 91.2(1) | 89.86(5) |
| M(3)–O(13) | 2.049(4) | 2.022(4) | 2.0387(15) | F(1)M(3)O(15) | 95.5(1) | 95.3(1) | 98.13(6) |
| M(3)–O(15) | 2.072(4) | 2.030(4) | 2.0172(15) | F(1)M(3)O(11) | 177.2(1) | 176.4(1) | 178.68(6) |
| M(3)–O(11) | 2.099(4) | 2.058(4) | 2.0908(15) | O(8)M(3)O(10) | 90.7(2) | 91.6(2) | 89.59(6) |
| O(8)M(3)O(15) | 87.9(2) | 87.9(2) | 88.78(6) | ||||
| O(13)M(3)O(10) | 85.7(2) | 85.8(2) | 89.82(6) | ||||
| O(13)M(3)O(15) | 94.9(2) | 94.0(2) | 91.96(6) | ||||
| M–F* | 2.026 | 1.999 | 1.974 | M(1)F(1)M(3) | 119.9(1) | 119.4(2) | 120.65(6) |
| M–Oэкв** | 2.076 | 2.032 | 2.041 | M(2)F(1)M(3) | 117.7(1) | 118.6(2) | 117.96(6) |
| M–Oакс*** | 2.094 | 2.067 | 2.099 | M(2)F(1)M(1) | 122.3(1) | 122.0(2) | 121.30(6) |
Уместно рассмотреть влияние замены лигандов на изменение геометрии комплексного аниона в ряду [Ni3(µ3-F)(CF3COO)6(CF3COOH)3]– [3], [Ni3(µ3-F)(CF3COO)6(AcOH)3]– (II) и [Ni3(µ3-F)- (AcO)6(AcOH)3]– (III). При введении в качестве аксиальных лигандов молекул уксусной кислоты вместо трифторуксусной наблюдается закономерное уменьшение средних длин связей M–Oaкс (2.118 Å в [3] и 2.067 Å в II), обусловленное увеличением донорной способности лиганда. При замене трифторацетатных групп на ацетатные в роли мостиковых лигандов вместо ожидаемого уменьшения длин связей M–Oэкв наблюдается увеличение средних расстояний M–Oaкс (2.067 Å в II и 2.099 Å в III) и уменьшение расстояний M–F (1.999 Å в II и 1.976 Å в III), приводящее к более сильному искажению октаэдрического окружения атомов никеля (табл. 2). При этом средние расстояния Ni…Ni в рассматриваемом ряду составляют 3.44 [3], 3.46 (II) и 3.42 (III) Å соответственно.
В структурах I–III комплексные анионы за счет образования контактов с катионами связаны в бесконечные цепи, объединенные в слои различного строения посредством системы водородных связей с участием сольватных молекул уксусной кислоты.
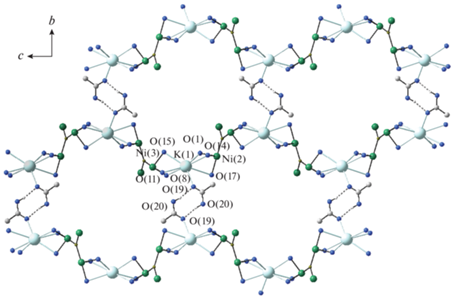
В I и II атомы кислорода мостиковых трифторацетатных групп O(1), O(14), карбонильный атом кислорода O(17) аксиальной молекулы уксусной кислоты и атом фтора F(15) трифторметильной группы образуют контакты с атомом калия, который, в свою очередь, связан с соседним трехъядерным анионом посредством контактов с атомами кислорода O(8), O(15) мостиковых трифторацетатных групп, карбонильным атом кислорода O(11) аксиальной молекулы уксусной кислоты и атомом фтора F(10) (рис. 1). Кроме того, атом калия образует контакт с карбонильным атомом кислорода O(19) сольватной молекулы уксусной кислоты. При этом корректно ограничить координационный полиэдр атома калия представляется затруднительным. Так, расстояния K…O находятся в интервалах 2.729(4)–3.122(4) (средн. 2.85 Å) в структуре I и 2.728(4)–3.128(5) Å (средн. 2.85 Å) в структуре II, расстояния K…F составляют 2.86(3)–3.119(19) Å (средн. 3.00 Å) в структуре I и 2.842(16)–3.152(19) (средн. 2.97 Å) в структуре II.
Посредством атомов калия трехъядерные анионы связаны в бесконечные зигзагообразные цепи вдоль оси с. Сольватные молекулы уксусной кислоты объединены между собой в димеры посредством водородных связей, соединяя цепи в слои, параллельные плоскости {bc} (рис. 2). Интересно отметить, что в структуре II сольватные молекулы уксусной кислоты частично статистически замещены молекулами трифторуксусной кислоты с заселенностями 0.6/0.4 соответственно. При этом молекулы трифторуксусной кислоты располагаются таким образом, что водородная связь образуется не с сольватной молекулой уксусной кислоты соседней цепи, а с атомом кислорода O(17), принадлежащим той же цепи. В структуре I такого разупорядочения не наблюдается. Таким образом, в структуре II цепи оказываются связаны между собой слабее, чем в структуре I. Параметры водородных связей для структур I, II приведены в табл. 3.
Таблица 3.
Геометрические парамeтры водородных связей для кoмплексов I–III
| D–H···A | Расстояние, Å | Угол D–H···A, град |
||
|---|---|---|---|---|
| D–H | H···A | D···A | ||
| I | ||||
| O(6)–H(6)…O(2) | 0.840(5) | 1.853(5) | 2.695(6) | 163.1 |
| O(12)–H(12)…O(10) | 0.840(5) | 1.865(5) | 2.687(6) | 167.0 |
| O(18)–H(18)…O(3) | 0.839(5) | 1.804(5) | 2.636(6) | 165.5 |
| O(20)–H(20)…O(19) | 0.840(5) | 1.939(6) | 2.678(8) | 163.5 |
| II | ||||
| O(6)–H(6)…O(2) | 0.840(5) | 1.881(5) | 2.670(7) | 163.4 |
| O(12)–H(12)…O(10) | 0.840(5) | 1.862(5) | 2.683(6) | 164.5 |
| O(18)–H(18)…O(3) | 0.841(5) | 1.815(4) | 2.617(7) | 162.2 |
| O(20)–H(20)…O(19) | 0.840(5) | 1.861(5) | 2.768(12) | 168.7 |
| O(21)–H(21)…O(17) | 0.840(5) | 2.263(5) | 2.888(15) | 144.5 |
| III | ||||
| O(6)–H(6)…O(4) | 0.840(3) | 1.740(2) | 2.568(2) | 168.1 |
| O(12)–H(12)…O(10) | 0.840(2) | 1.723(2) | 2.549(2) | 167.2 |
| O(18)–H(18)…O(1) | 0.840(2) | 1.700(2) | 2.526(2) | 167.0 |
| O(24)–H(24)…O(22) | 0.840(3) | 1.801(3) | 2.605(3) | 159.4 |
| O(23)–H(23)…O(8) | 0.840(2) | 1.786(2) | 2.621(2) | 171.5 |
| O(21)–H(21)…O(13) | 0.840(2) | 1.785(2) | 2.603(2) | 164.1 |
| O(26)–H(26)…O(11) | 0.840(2) | 2.295(2) | 3.046(3) | 148.5 |
| O(26)–H(26)…O(15) | 0.840(2) | 2.241(2) | 2.888 | 134.0 |
| O(29)–H(29)…O(20) | 0.840(2) | 2.265(3) | 2.687(4) | 169.4 |
| O(30)–H(30)…O(31) | 0.840(2) | 2.265(3) | 2.653 | 175.7 |
| N(1)–H(1A)…O(2) | 0.958(2) | 2.141(2) | 2.883 | 133.4 |
| N(1)–H(1B)…O(9) | 0.969(2) | 1.953(2) | 2.823(3) | 148.2(17) |
| N(1)–H(1C)…O(25) | 0.959(2) | 2.416(2) | 2.802(3) | 174.0(18) |
| N(1)–H(1D)…O(3) | 0.959(2) | 2.443(2) | 3.028(3) | 147.4(16) |
| N(1)–H(1D)…O(16) | 0.959(2) | 1.955(2) | 2.816(3) | 125.5(15) |
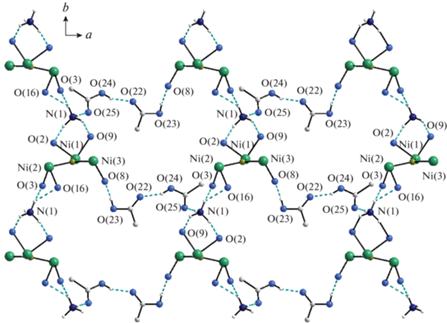
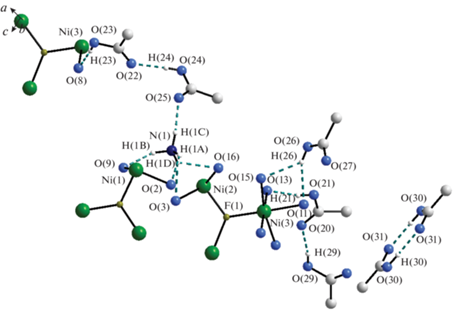
В структуре III анионы связаны между собой в спиральные цепи, расположенные вдоль оси b, посредством образования водородных связей с катионами аммония N(1)–H(1А)…O(2), N(1)–H(1В)…O(9), N(1)–H(1D)…O(3), N(1)–H(1D)…O(16) (рис. 3, табл. 3). Цепи сшиты между собой в гофрированные слои, параллельные плоскости {0, 0, 1}, системой водородных связей с участием катиона аммония, двух сольватных молекул уксусной кислоты и атома кислорода О(8) бидентатной ацетатной группы. Так, атом водорода катиона аммония Н(1С) образует водородную связь N(1)–H(1С)…O(25) с карбонильным атомом кислорода сольватной молекулы уксусной кислоты, гидроксильная группа которой образует водородную связь О(24)–H(24)…O(22) с карбонильным атомом кислорода второй сольватной молекулы уксусной кислоты, гидроксильная группа которой, в свою очередь, связана водородной связью О(23)–H(23)…O(8) с атомом кислорода О(8), принадлежащему соседней цепи.
Атомы кислорода из координационного окружения атома Ni(3) принимают участие в образовании еще одной системы водородных связей с тремя сольватными молекулами уксусной кислоты (рис. 4). Так, атомы кислорода O(11) и O(15) образуют вилочковую водородную связь О(26)–Н(26)…(О11, О15) с гидроксильной группой одной сольватной молекулы уксусной кислоты. Атом кислорода О(13) образует водородную связь О(21)–Н(21)…О(13) с гидроксильной группой другой молекулы уксусной кислоты, карбонильный атом которой, в свою очередь, образует водородную связь О(29)–Н(29)…О(20) с гидроксильной группой третьей молекулы уксусной кислоты. В структуре также присутствуют свободные димеры уксусной кислоты, расположенные между слоями и связанные с остальной структурой ван-дер-ваальсовыми взаимодействиями.
В заключение отметим, что впервые синтезированный комплекс NH4[Ni3(μ3-F)(CH3COO)6- (CH3COOH)3](CH3COOH)6 (III) показывает принципиальную возможность существования трехъядерных фтороацетатных комплексов переходных металлов. Получение комплексов K[Co3(μ3-F)(CF3COO)6(CH3COOH)3](CH3COOH) (I) и K[Ni3(μ3-F)(CF3COO)6(CH3COOH)3](CH3COOH)0.6- (CF3COOH)0.4 (II) при использовании в качестве исходных соединений фактически смеси уксусной и трифторуксусной кислот свидетельствует о типичных конкурирующих реакциях замены лигандов, происходящих при формировании каркаса комплексного аниона. При этом замена лигандов, формирующих комплексный анион, приводит к изменению размера самого комплексного аниона.
Вне зависимости от природы карбоновой кислоты, участвующей в образовании комплексного аниона, катионы щелочного металла и аммония связывают комплексные анионы в цепи. Увеличение размерности структуры за счет образования большого числа водородных связей достигается введением уксусной кислоты в состав соединения.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Морозов И.В., Карпова Е.В., Глазунова Т.Ю. и др. // Коорд. химия. 2016. Т. 42. № 10. С. 609 (Morozov I.V., Karpova E.V., Glazunova T.Y. et al. // Russ. J. Coord. Chem. 2016. V. 42. P. 647). https://doi.org/10.1134/S107032841610002X
Глазунова Т.Ю., Терещенко Д.С., Бузоверов М.Е. и др. // Коорд. химия. 2021. Т. 47. № 5. С. 307 (Glazunova T.Y., Tereshchenko D.S., Buzoverov M.E. et al. // Russ. J. Coord. Chem. 2021. V. 47. P. 347). https://doi.org/10.1134/S1070328421040023
Терещенко Д.С., Морозов И.В., Болталин А.И. и др. // Журн. неорган. химии. 2004. Т. 49. № 6. С. 919 (Tereshchenko D.S., Morozov I.V., Boltalin A.I. et al. // Russ. J. Inorg. Chem. 2004. V. 49. № 6. P. 836).
Zai-Lai Xie, Mei-Ling Feng, Bin Tan, Xiao-Ying Huang // Cryst. Eng. Commun. 2012. V. 14. P. 4894. https://doi.org/10.1039/C2CE25169H
Reynolds III J.E., Walsh K.M., Li B. et al. // Chem. Commun. 2018. V. 54. P. 9937. https://doi.org/10.1039/C8CC05402A
Aulakh D., Islamoglu T., Bagundes V.F. et al. // Chem. Mater. 2018. V. 30. P. 8332. https://doi.org/10.1021/acs.chemmater.8b03885
Noack J., Fritz C., Flügel C. et al. // Dalton Trans. 2013. V. 42. P. 5706. https://doi.org/10.1039/C3DT32652G
Walsh J.P.S., Meadows S.B., Ghirri A. et al. // Inorg. Chem. 2015. V. 54. P. 12019. https://doi.org/10.1021/acs.inorgchem.5b01898
Sheldrick G.M. SADABS. Program for Scaling and Correction of Area Detector Data. Göttingen (Germany): Univ. of Göttingen, 1997.
Sheldrick G.M. // Acta Crystallogr. A. 2015. V. 71. P. 3. https://doi.org/10.1107/S2053273314026370
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3. https://doi.org/10.1107/S2053229614024218
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. App-l. Cryst. 2009. V. 42. P. 339. https://doi.org/10.1107/S0021889808042726
Shannon R.D. // Acta Crystallogr. A. 1976. V. 32. P. 751. https://doi.org/10.1107/S0567739476001551
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия