Кристаллография, 2019, T. 64, № 6, стр. 906-911
Результаты рентгеноструктурного анализа бактериальной наноцеллюлозы, синтезированной продуцентом Мedusomyces Gisevii Sa-12 на ферментативных гидролизатах мискантуса
Л. А. Алешина 1, *, Е. К. Гладышева 2, В. В. Будаева 2, **, Д. С. Голубев 2, 3, Е. А. Скиба 2, Г. В. Сакович 2
1 Петрозаводский государственный университет
Петрозаводск, Россия
2 Институт проблем химико-энергетических технологий СО РАН
Бийск, Россия
3 Бийский технологический институт (филиал) ФГБОУ ВО “Алтайский государственный
технический университет им. И.И. Ползунова”
Бийск, Россия
* E-mail: alkftt@mail.ru
** E-mail: budaeva@ipcet.ru
Поступила в редакцию 30.01.2019
После доработки 30.01.2019
Принята к публикации 25.02.2019
Аннотация
Представлены результаты рентгеноструктурного анализа бактериальной наноцеллюлозы, синтезированной продуцентом Мedusomyces gisevii Sa-12 на ферментативных гидролизатах мискантуса. Определены характеристики надмолекулярной структуры кристаллической составляющей образцов: степень кристалличности, размеры и форма элементарных фибрилл. Проведена оценка соответствия атомной структуры известным моделям строения целлюлозы и установлено, что синтезированная бактериальная наноцеллюлоза является целлюлозой Iα. Определены периоды и углы триклинной элементарной ячейки. Установлено, что состав питательных сред ферментативных гидролизатов мискантуса оказывает влияние на форму и размер элементарных фибрилл и не оказывает влияния на степень кристалличности и содержание алломорфа Іα. Использование продуцента Мedusomyces gisevii Sa-12 позволяет получить бактериальную наноцеллюлозу с высокой степенью кристалличности в диапазоне 86–93% и с преимущественным содержанием алломорфа Іα.
ВВЕДЕНИЕ
Известно, что индекс кристалличности целлюлозы и соотношение кристаллических фаз Іα и Іβ в природной целлюлозе зависят от ее происхождения, видов последующей обработки, степени полимеризации, а также от молекулярных водородных связей внутри и между цепями биополимера [1–3]. Бактериальная наноцеллюлоза (БНЦ), секретируемая различными бактериями родов Acetobacter, Acanthamoeba и Achromobacter spp., отличается от растительной целлюлозы высокой степенью чистоты, ультратонкой структурой микрофибрилл с высокой степенью кристалличности и в то же время содержит в своей структуре равномерно распределенную воду, образуя устойчивый гидрогель в процессе биосинтеза. Как и растительная целлюлоза, БНЦ относится к целлюлозе І, в которой два целлобиозных фрагмента расположены параллельно (или антипараллельно) в элементарной ячейке, но в отличие от растительной она преимущественно содержит алломорф Іα [1, 4].
В связи с повышением спроса на БНЦ в различных отраслях промышленности [5] исследователи в мировых научных центрах ищут подходы к удешевлению стоимости питательной среды за счет замены синтетической среды для биосинтеза БНЦ гидролизатами дешевого целлюлозосодержащего сырья [6, 7]. Результаты исследования методом рентгеноструктурного анализа показывают, что замена среды для биосинтеза приводит к изменению структурных характеристик БНЦ [8–12], так что в каждом конкретном случае необходим контроль структурного состояния получаемого объекта. Целью настоящей работы было определение структурных характеристик БНЦ, синтезированной продуцентом Мedusomyces gisevii Sa-12 на ферментативных гидролизатах энергетического растения – мискантуса.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Мискантус сорта Сорановский, выращенный на экспериментальной плантации ИПХЭТ СО РАН (Бийск), подвергался химической обработке в стандартном емкостном оборудовании объемом 250 л при атмосферном давлении в опытном производстве ИПХЭТ СО РАН по авторским методикам [13–17]. В качестве химических реактивов использовали разбавленные 4%-ные растворы азотной кислоты и гидроксида натрия. Химическую обработку осуществляли четырьмя способами. Применяли: одностадийную обработку азотной кислотой с получением продукта азотнокислой обработки (ПАО) [13, 14]; дальнейшую обработку ПАО гидроксидом натрия с получением технической целлюлозы азотнокислым способом (ТЦ АС) [15]; одностадийную обработку гидроксидом натрия с получением продукта щелочной делигнификации (ПЩД) [16, 17]; дальнейшую обработку ПЩД азотной кислотой с получением технической целлюлозы комбинированным способом (ТЦ КС) [17].
Продукты, полученные после химической обработки мискантуса, подвергались ферментативному гидролизу, условия которого были одинаковы для четырех видов субстратов и подробно описаны в [18]. Полученные ферментативные гидролизаты стандартизировали по глюкозе путем разбавления их водой до содержания глюкозы 20–25 г/л, обеспечивающей наибольший выход БНЦ. Гидролизаты, отфильтрованные от остатков субстратов, были использованы в качестве экстрагентов черного байхового чая. Черный байховый чай вносили при 100°С в количестве 10 г/л для получения готовых питательных сред с концентрацией экстрактивных веществ чая 3.2 г/л [19]. Готовые питательные среды отфильтровывали от остатков чая и использовали для биосинтеза БНЦ.
Биосинтез БНЦ на полученных питательных средах проводился в оптимальных условиях, установленных в [19]: температура 27°С, продолжительность 7 сут, стационарные условия. В качестве продуцента использовали симбиотическую культуру Мedusomyces gisevii Sa-12, доза инокулята составила 10%.
Промывку образцов БНЦ от компонентов питательной среды и клеток осуществляли поэтапно, обрабатывая раствором 2%-ного гидроксида натрия и 0.1%-ным раствором разбавленной соляной кислоты с последующей промывкой дистиллированной водой. Гель-пленки БНЦ высушивали в развернутом состоянии при комнатной температуре.
Таким образом, были синтезированы образцы БНЦ четырех типов: ферментативный гидролизат ПАО мискантуса (образец 1), ферментативный гидролизат ТЦ АС мискантуса (образец 2), ферментативный гидролизат ПЩД мискантуса (образец 3), ферментативный гидролизат ТЦ КС мискантуса (образец 4).
Дифрактограммы образцов БНЦ получены в геометрии на отражение и прохождение (просвет) на дифрактометре ДРОН-6 в интервале углов рассеяния 3°–145° (монохроматическое FeKα-излучение, монохроматор – кристалл пиролитического графита, установленный на пути первичного пучка).
Подробно методика расчета размеров областей кристалличности (блоков мозаики, областей когерентного рассеяния (ОКР)), индекса кристалличности и методика полнопрофильного анализа описаны в [3, 20].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рис. 1 представлены дифрактограммы образцов БНЦ, синтезированных на средах ферментативных гидролизатов мискантуса, полученные в геометрии на отражение и просвет. Зарегистрированные в геометрии на отражение дифрактограммы характерны для БНЦ [21, 22]. В геометрии на просвет наиболее типичными являются дифрактограммы образцов 1 и 4 (рис. 1д, 1з) [23].
Рис. 1.
Дифрактограммы образцов БНЦ 1 (а, д), 2 (б, е), 3 (в, ж), 4 (г, з), снятые в геометрии на отражение (а–г) и просвет (д–з).

Различие дифрактограмм, полученных в геометрии на отражение и просвет, объясняется анизотропией структуры БНЦ. Анизотропия структуры характерна для пленочных объектов и наблюдалась ранее для образцов, полученных на средах ферментативных гидролизатов плодовых оболочек овса [3].
На рис. 2 сравниваются дифрактограммы образца 1, снятые в геометрии на отражение и на просвет, с дифрактограммами, рассчитанными по данным для двух моделей – целлюлозы Iα [24–26] и Iβ [24, 25, 27] с параллельным расположением целлобиозных остатков в элементарной ячейке. Как следует из рис. 2, расстояния между тремя основными отражениями на дифрактограмме образца БНЦ ближе к данным, рассчитанным по характеристикам целлюлозы Iα: a = 6.74, b = 5.93, c = 10.36 Å, α = 117.0°, β = 113.0°, γ = 81.0° [24]. Результаты расчета полученных в геометрии на отражение дифрактограмм методом полнопрофильного анализа показали, что структура всех исследованных образцов соответствует алломорфу Iα.
Рис. 2.
Дифрактограмма образца 1 (1), снятая в геометрии на отражение (а, б) и на просвет (в, г) в сравнении с рентгенограммами, рассчитанными для моделей целлюлозы Iα (2) и целлюлозы Iβ (3).

В табл. 1 представлены уточненные значения периодов (a, b, c) и объема (V) элементарной ячейки, значения весового профильного (Rwp) и профильного (Rp) факторов недостоверности, фактора надежности (Goff), а также параметр текстуры T и индексы оси текстуры (преимущественной ориентации кристаллитов) 〈uvw〉.
Таблица 1.
Кристаллографические характеристики и факторы недостоверности, достигнутые в результате расчета методом Ритвельда по снятым на отражение дифрактограммам
| Образец | a, Å | b, Å | c, Å | α, град | β, град | γ, град | V, Å3 | Rwp, % | Rp, % | Goff | Т | $\left\langle {u{v}w} \right\rangle $ |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 6.74(5) | 5.99(8) | 10.30(3) | 118.0(2) | 113.0(1) | 82.0(5) | 340.0(1) | 8.0 | 5.6 | 0.9 | 1.0 | – |
| 2 | 6.82(2) | 6.00(6) | 10.46(1) | 117.2(2) | 114.1(1) | 81.0(5) | 347.1(2) | 8.8 | 6.8 | 1.0 | 0.7 | 100 |
| 3 | 6.78(1) | 5.96(6) | 10.36(1) | 116.6(1) | 114.0(1) | 81.3(1) | 343.0(4) | 8.7 | 6.3 | 0.8 | 0.4 | 100 |
| 4 | 6.74(4) | 5.93(8) | 10.36(8) | 117.0(3) | 113.0(05) | 81.0(1) | 339.0(3) | 10.3 | 8.2 | 1.4 | 2.3 | 100 |
Рассчитанные для образцов БНЦ, синтезированных на средах ферментативных гидролизатов мискантуса, размеры элементарных ячеек соответствуют ранее опубликованным результатам для образцов БНЦ, синтезированных на синтетической питательной среде и на средах ферментативных гидролизатов плодовых оболочек овса [3], а также данным, приведенным в [24, 25, 28, 29] для целлюлозы Iα. Отметим, что в образце 1 текстура отсутствует, а для всех остальных образцов ось текстуры одна и та же: 〈100〉.
Преобладание в образцах БНЦ триклинной модификации целлюлозы Iα хорошо согласуется с литературными данными, свидетельствующими о том, что в отличие от растительной целлюлоза примитивных организмов характеризуется высоким содержанием триклинной модификации [1, 30].
Результаты расчета размеров областей и индексов кристалличности по дифрактограммам, снятым на отражение и просвет, приведены в табл. 2. Индексы hkl указаны для целлюлозы Iα.
Таблица 2.
Результаты расчета индекса кристалличности (ИК) и размеров блоков кристалличности для целлюлозы Iα
| Образец | 1 | 2 | 3 | 4 | ||||
|---|---|---|---|---|---|---|---|---|
| Геометрия | отр | пр | отр | пр | отр | пр | отр | пр |
| ИK ±5% | 86 | 94 | 94 | 92 | 88 | 89 | 85 | 92 |
| hkl | ||||||||
| 100 | 47 | 89 | 46 | 79 | 47 | * | 46 | 165 |
| 010 | 87 | 86 | 61 | 88 | 64 | 108 | 87 | 88 |
| 110 | 61 | 77 | 47 | 62 | 48 | 95 | 47 | 87 |
| 11$\bar {4}$ | * | 161 | * | 94 | * | 140 | * | 159 |
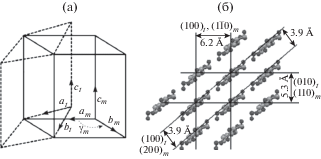
На рис. 3а показана связь между моноклинной и триклинной элементарными ячейками целлюлозы Iβ и Iα соответственно [22, 31], а на рис. 3б – расположение цепочек целлюлозы I в плоскости, перпендикулярной оси с, т.е. оси фибриллы. С направлением оси фибриллы совпадают направления [$11\bar {4}$] в триклинной и [001] в моноклинной решетках целлюлозы I. Из рис. 3 следует, что линейные размеры и форма поперечного сечения элементарных фибрилл определяются по размерам кристаллитов в направлениях [100], [010] и [110] кристаллической решетки целлюлозы Iα, размер ОКР вдоль элементарной фибриллы – по размеру кристаллитов в направлении [$11\bar {4}$]. В решетке целлюлозы Iβ этим направлениям, как указано на рис. 3 и в [31], соответствуют оси [$11\bar {0}$], [110], [100] и [001].
Рис. 3.
Взаимная ориентация в решетке целлюлозы I: а – моноклинной (m) и триклинной (t) элементарных ячеек; б – цепочек, перпендикулярных плоскости рисунка. Указаны межплоскостные расстояния и плоскости.
На рис. 4 схематически изображены формы поперечного сечения элементарных фибрилл, построенные на основе данных табл. 2 с учетом размеров и проекции элементарной ячейки целлюлозы Iα на плоскость ab. Использована программа Mercury. Поперечное сечение элементарных фибрилл БНЦ из мискантуса – искаженный шестиугольник. Все фибриллы имеют разную форму и размеры. Предположительно, это связано с разным составом питательных сред, используемых для биосинтеза БНЦ.
Рис. 4.
Схемы поперечного сечения элементарных фибрилл образцов: 1 (а, д), 2 (б, е), 3 (в), 4 (г, ж), исследованных в геометрии на отражение (а–г) и просвет (д–е). Масштаб в ангстремах соответствует данным табл. 2. На схеме поперечного сечения образца 1 показана базисная плоскость элементарной ячейки целлюлозы Iα.

Сравнение полученных и литературных данных показало, что поперечные размеры элементарных фибрилл, определенные в настоящей работе, согласуются с моделями, предложенными в [32] на основе рентгеновского и нейтронографического экспериментов, и данными атомно-силовой спектроскопии для целлюлозы Валония со структурой Iα [33] и для волокон кукурузы [34]. Отметим, что поперечные размеры элементарных фибрилл исследованной БНЦ, лежащих в плоскости пленки, заметно больше, чем фибрилл, перпендикулярных поверхности (рис. 4).
Из дифрактограмм, зарегистрированных в геометрии на отражение, нельзя сделать выводы о длине ОКР вдоль оси фибриллы, так как отражение $11\bar {4}$ лучше выявляется на дифрактограммах, полученных на просвет. То есть самые длинные фибриллы располагаются параллельно поверхности образца. Это явление характерно не только для БНЦ [20, 29]. Поэтому в табл. 1 расчеты длины области кристалличности выполнены по дифрактограммам, снятым в геометрии на просвет. Полученные результаты свидетельствуют о высоких индексах кристалличности: от 86 до 94%. Индекс кристалличности образцов БНЦ, синтезированных продуцентом Мedusomyces gisevii Sa-12 на синтетической питательной среде и на средах ферментативных гидролизатов плодовых оболочек овса, находится в том же диапазоне и составляет от 86 до 93% [3].
Основываясь на полученных данных для образцов БНЦ, синтезированных на синтетической питательной среде и на ферментативных гидролизатах плодовых оболочек овса и мискантуса, можно утверждать, что при использовании продуцента Мedusomyces gisevii Sa-12 состав питательной не оказывает влияния на индекс кристалличности и содержание алломорфа Іα. Синтезированные образцы БНЦ являются высококристалличными и преимущественно состоят из целлюлозы триклинной фазы Іα.
Настоящие исследования важны для определения области применения БНЦ. Например, изучение гемостатической активности БНЦ, синтезированной Мedusomyces gisevii Sa-12, показало, что время остановки кровотечения и масса кровопотери при использовании БНЦ в 7 раз меньше, чем в случае марлевого тампона [35]. Таким образом, установлена самостоятельная гемостатическая активность БНЦ. Полученные результаты можно объяснить уникальной структурой образцов БНЦ, что, в свою очередь, связано с преобладанием триклинной модификации Іα и расположением наиболее крупных элементарных фибрилл и элементарных фибрилл с наиболее длинными ОКР вдоль оси фибриллы параллельно поверхности пленки.
ЗАКЛЮЧЕНИЕ
Установлено, что состав питательных сред ферментативных гидролизатов мискантуса оказывает влияние на форму и размер элементарных фибрилл и не оказывает влияния на степень кристалличности и содержание алломорфа Іα. Показано, что использование продуцента Мedusomyces gisevii Sa-12 позволяет получить БНЦ с высокой степенью кристалличности в диапазоне 86–93% и с преимущественным содержанием алломорфа Іα вне зависимости от используемой питательной среды.
Исследование выполнено за счет гранта Российского научного фонда (проект № 17-19-01054).
Список литературы
Heinze T., El Seoud O.A., Koschella A. Cellulose Derivatives. Synthesis, Structure, and Properties. Switzerland: Springer, 2018. 552 p.
Baklagina Y.G., Klechkovskaya V.V., Kononova S.V. et al. // Crystallogr. Rep. 2018. V. 63. № 3. P. 303.
Aleshina L.A., Gladysheva E.K., Budaeva V.V. et al. // Crystallogr. Rep. 2018. V. 63. № 6. P. 955.
Kuila A., Sharma V. Principles and Applications of Fermentation Technology. Beverly: Scrivener Publishing, 2018. 480 p.
Barud H., Silva R.R., Barud H. et al. // Carbohyd. Polym. 2016. V. 153. P. 406.
Islam U.M., Ullah M.W., Khana S. et al. // Int. J. Biol. Macromol. 2017. V. 102. P. 1166.
Gama M., Dourado F., Bielecki S. Bacterial Nanocellulose from Biotechnology to Bio-Economy. Amsterdam: Elsevier, 2016. 240 p.
Luo M.T., Zhao C., Huang C. et al. // Indian. J. Microbiol. 2017. V. 57. № 4. P. 393.
Velasquez-Riano M., Bojaca V. // Cellulose. 2017. V. 24. P. 2677.
Vazquez A., Foresti M.L., Cerrutti P., Galvagno M. // J. Polym. Environ. 2013. V. 21. № 2. P. 545.
Molina-Ramírez C., Castro C., Zuluaga R., Gañán P. // J. Polym. Environ. 2018. V. 26. № 2. P. 830.
Mohammadkazemi F. // Am. J. Appl. Indr. Chem. 2017. V. 1. № 1. P. 10.
Budaeva V.V., Skiba E.A., Baibakova O.V. et al. // Catal. Industry. 2016. V. 8. № 1. P. 81.
Skiba E.A., Budaeva V.V., Baibakova O.V. et al. // Catal. Industry. 2016. V. 8. № 2. P. 168.
Gismatulina Y.A., Budaeva V.V. // Ind. Crop. Prod. 2017. V. 109. P. 227.
Байбакова О.В., Скиба Е.А., Будаева В.В., Золотухин В.Н. // Ползуновский вестн. 2016. Т. 1. № 4. С. 147.
Budaeva V.V., Makarova E.I., Gismatulina Yu.A. // Key Eng. Mater. 2016. V. 670. P. 202.
Denisova M.N., Makarova E.I., Pavlov I.N. et al. // Biotechnol. Appl. Biochem. 2016. V. 178. № 6. P. 1196.
Gladysheva E.K., Skiba E.A., Zolotukhin V.N., Sako-vich G.V. // Appl. Biochem. Microbiol. 2018. V. 54. № 2. P. 179.
Torlopov M.A., Mikhaylov V.I., Udoratina E.V. et al. // Cellulose. 2018. V. 25. № 2. P. 1031.
Chandrasekaran P.T., Bari N.K., Sinha S. // Cellulose. 2017. V. 24. P. 4367.
Khandelwal M., Windle A.H., Hessler N. // J. Mater. Sci. 2016. V. 5. P. 4839.
Faria-Tischer P.C.S., Tischer C.A., Heux L. et al. // Mat. Sci. Eng. C-Bio. S. 2015. V. 51. № 1. P. 167.
Sugiyama J., Vuong R., Chanzy H. // Macromolecules. 1991. V. 24. P. 4168.
French A.D. // Cellulose. 2014. V. 21. P. 885.
Nishiyama Y., Sugiyama J., Chanzy H., Langan P. // J. Am. Chem. Soc. 2003. V. 125. P. 14300.
Nishiyama Y., Langan P., Chanzy H. // J. Am. Chem. Soc. 2002. V. 124. P. 9074.
Poma A.B., Chwastyk M., Cieplak M. // Cellulose. 2016. V. 23. № 3. P. 1573.
Алешина Л.А., Глазкова С.В., Луговская Л.А. и др. // Химия растительного сырья. 2001. № 1. С. 5.
Cheng K., Catchmark J., Demirci A. // J. Biol. Eng. 2009. V. 3. № 12. P. 1.
Moon R.J., Martini A., Nairn J. et al. // Chem. Soc. Rev. 2011. V. 40. P. 3941.
Thomas L.H., Forsyth V.T., Šturcová A. et al. // Plant Physiol. 2013. V. 161. P. 465.
Baker A.A., Helbert W., Sugiyama J. et al. // Biophys. J. 2000. V. 79. P. 1139.
Ding S.-Y., Shuai S., Yining Y. // Cellulose. 2014. V. 2. P. 863.
Патент № 2624242 (РФ). Раневое покрытие с гемостатическим действием и способ его получения / ФГБУ ГНИ Минздрава РФ, ООО Фирма “Технология-Стандарт”, ИПХЭТ СО РАН. Савченко В.Г., Белозерская Г.Г., Макаров В.А. и др. // заявл. 10.08.2016; опубл. 03.07.2017, Бюл. № 19. 19 с.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография


