Кристаллография, 2019, T. 64, № 6, стр. 992-998
Синтез кристаллов халькогенидов K, Zr, Hf, Hg и некоторых других элементов в галоидных расплавах в стационарном температурном градиенте
Д. А. Чареев 1, 2, 3, *, О. С. Волкова 4, 2, Н. В. Герингер 5, П. В. Евстигнеева 6, Н. А. Згурский 5, А. В. Кошелев 4, 2, 1, А. Н. Некрасов 1, В. О. Осадчий 4, 1, Е. Г. Осадчий 1, О. Н. Филимонова 6
1 Институт экспериментальной минералогии РАН
Черноголовка, Россия
2 Уральский федеральный университет
Екатеринбург, Россия
3 Казанский федеральный университет
Казань, Россия
4 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
5 Государственный университет “Дубна”
Дубна, Россия
6 Институт геологии рудных месторождений, петрографии, минералогии и геохимии РАН
Москва, Россия
* E-mail: chareev@iem.ac.ru
Поступила в редакцию 29.05.2018
После доработки 09.12.2018
Принята к публикации 11.12.2018
Аннотация
Исследование посвящено получению кристаллов металлов, сплавов, халькогенидов и пниктидов в расплавах галогенидов щелочных металлов в условии стационарного температурного градиента. Описано получение кристаллов с участием элементов, которые не были затронуты в предыдущих исследованиях: ртути, циркония, гафния, германия, натрия, калия, рения и осмия. Выдвинуты предположения о формах переноса элементов в солевых расплавах и показано, что большинство кристаллов получаются из ионов, в которых необходимые элементы находятся только в самых распространенных для них степенях окисления.
ВВЕДЕНИЕ
В настоящее время интенсивно изучаются кристаллы халькогенидов (соединения с S, Se и Te) и пниктидов (соединения с P, As, Sb и Bi) металлов, что объясняется их полупроводниковыми и люминесцентными свойствами, интересными для фундаментальной науки, а также широкими перспективами их применения в качестве сверхпроводников, магнетиков, топологических изоляторов, катализаторов и других функциональных материалов. Кроме того, в природе сульфиды являются основной составляющей многих полиметаллических руд – важного источника цветных металлов. Для объяснения свойств данных соединений необходимо проведение экспериментов на высококачественных халькогенидных и пниктидных кристаллах.
Для получения кристаллов халькогенидов и пниктидов довольно широко используются методы газового транспорта и гидротермальный. Также широко используется раствор-расплавный метод, представляющий собой постепенное охлаждение многокомпонентного расплава, довольно часто приводящее к образованию зональных кристаллов. Этого позволяет избежать модификация метода, когда шихта постепенно растворяется в выбранном растворителе, затем диффундирует и образует кристалл в другой части реакционного сосуда при более низкой температуре. Температурное поле в любой точке системы практически не меняется во времени. Фиксация температуры роста кристаллов позволяет минимизировать изменение активности компонентов расплава и поэтому минимизировать колебания состава и свойств полученных кристаллов.
Несмотря на простоту и воспроизводимость, идея использования стационарного температурного градиента в раствор-расплавном методе и попытки реализации этой идеи на практике (1960–1970 гг.) до недавнего времени ограничивались единичными экспериментами для очень узкого спектра соединений, температур и состава расплавов. Так, известна только одна работа, посвященная получению кристаллов халькогенида (ZnS) в расплаве галогенида щелочного металла (KCl) [1]. Кроме того, недавно был описан метод лабораторного получения различных химических соединений в легкоплавких металлах в градиентных условиях [2].
СИНТЕЗ КРИСТАЛЛОВ ХАЛЬКОГЕНИДОВ, ПНИКТИДОВ И ИНТЕРМЕТАЛЛИДОВ В ГАЛОИДНЫХ РАСПЛАВАХ В СТАЦИОНАРНОМ ТЕМПЕРАТУРНОМ ГРАДИЕНТЕ
В [3–5] описан универсальный метод синтеза монокристаллов халькогенидов, пниктидов, интерметаллидов, сплавов и металлов на основе раствор-расплавной кристаллизации в стационарном горизонтальном температурном градиенте в расплавах галогенидов щелочных металлов и алюминия. Было показано, что в используемых солевых расплавах переносятся и могут образовывать кристаллы простых, бинарных и более сложных соединений следующие элементы: P, S, Fe, Co, Ni, Cu, Zn, Ga, As, Se, Rb, Pd, Ag, Cd, In, Sn, Sb, Te, Cs, La, Pt, Au, Pb и Bi. В некоторых случаях кристаллы могут образовываться с участием O, Al, Si, Cl, Cr, Mn и Br. Не удалось перенести и получить кристаллы с участием Li, Mg, Ti, V, Nb, Mo, Ru, Ta и W. Перенос остальных элементов не изучался в силу их недоступности, высокой стоимости или токсичности.
Перенос вещества в солевых расплавах осуществляется в виде соответствующих комплексных ионов, в которых элементы шихты находятся в наиболее предпочтительных степенях окисления. Металлы переносятся обычно в виде галогенидных комплексов ${\text{MeY}}_{{\text{n}}}^{{1 - }}$, а халькогены (Х) в виде различных ионов ${\text{X}}_{m}^{{k - }}$. Растворение, перенос вещества и образование кристаллов в солевом расплаве невозможны, если не существует соответствующей комбинации катионов и анионов, в виде которых растворяется вещество с сохранением баланса заряда. Если такой благоприятной комбинации не существует, то растворению и образованию кристаллов может способствовать инертный проводник электронов, соединяющий шихту и место кристаллизации. В качестве проводника удобно использовать платиновую проволоку. В ряде случаев переносу может способствовать пространственное разделение потоков разных химических элементов, предотвращающее их взаимодействие [6].
Все комбинации галогенидов щелочных металлов эвтектического состава могут применяться в качестве растворителя для получения кристаллов в определенном температурном интервале. Наиболее легкоплавкими получаются смеси, если за основу брать хлорид или бромид алюминия. Все соли растворяются в воде, поэтому их легко отделить от полученных кристаллов. Cоли с Cs или Rb могут отдавать свои катионы для образования твердого вещества, но анионы всегда остаются в расплаве и не встраиваются в структуру растущих кристаллов.
Добавление в расплав небольшого количества элементарного галогена может менять свойства галоидного расплава. Например, это приводит к повышению концентрации металла шихты в солевом расплаве, что увеличивает скорость переноса и роста кристаллов. Также это позволит избежать образования кристаллов с участием тяжелых щелочных металлов.
СТРУКТУРА СОЛЕВЫХ РАСПЛАВОВ
Для улучшения понимания процессов растворения шихты в солевых расплавах и обратных процессов – процессов образования кристалла – необходима информация о структуре расплава. В первую очередь интересны предпочтительные степени окисления и варианты координации растворенных в расплаве элементов, входящих в состав шихты.
Солевые расплавы являются классическим примером ионных жидкостей, в которых компоненты несут на себе заряды, кратные заряду электрона. Энергия взаимодействия в ионных расплавах на несколько порядков больше, чем в обычных молекулярных жидкостях [7]. Очевидно, что простейшими ионными жидкостями являются используемые в данной работе расплавы галогенидов щелочных металлов. К настоящему моменту благодаря различным спектроскопическим, дифракционным, магнитным и нейтронографическим исследованиям для солевых расплавов известно строение основных структурных элементов, но пока не известно о возможности супрамолекулярной организации.
Структура солевых расплавов, в частности геометрическое строение комплексных частиц, изучается обычно с помощью колебательной спектроскопии – ИК-спектроскопии и спектроскопии комбинационного рассеяния. Работу несколько облегчает тот факт, что многие комплексные частицы, например ${\text{CoCl}}_{{\text{4}}}^{{2 - }}$, присутствуют и в водных растворах, и в расплавах хлоридов, и в расплавах с участием других, не галоидных солей [8]. В настоящий момент изучение солевых расплавов возможно с помощью синхротронного излучения. В частности, было показано, что в расплавах CsCl/NaCl/KCl в присутствии окислителя (Na2S2O8) золото и платина переносятся в виде ${\text{AuCl}}_{{\text{2}}}^{ - }$ (линейный комплекс) [9] и ${\text{PtCl}}_{{\text{4}}}^{{{\text{2}} - }}$ (плоско-квадратный комплекс) [10].
В солевых расплавах могут наблюдаться и более сложные комплексные анионы. Например, в используемых расплавах на основе хлорида алюминия основными частицами являются ионы щелочного металла и ${\text{A}}{{{\text{l}}}_{{\text{2}}}}{\text{Cl}}_{{\text{7}}}^{ - }$. При уменьшении содержания хлорида алюминия в расплаве начинают появляться частицы ${\text{AlCl}}_{{\text{4}}}^{ - }$. В расплавах на основе хлорида алюминия 3d-металлы обычно имеют октаэдрическое окружение из ионов хлора и могут образовывать частицы Me(Al2Cl7) [11].
Халькогены должны растворяться в галоидных расплавах в виде X2–. Если основной частью расплава является хлорид алюминия, то возможно взаимодействие халькоген-иона с ионом ${\text{A}}{{{\text{l}}}_{{\text{2}}}}{\text{Cl}}_{{\text{7}}}^{ - }$ по реакциям ${{{\text{X}}}^{{{\text{2}} - }}} + {\text{3A}}{{{\text{l}}}_{{\text{2}}}}{\text{Cl}}_{{\text{7}}}^{ - }$ = ${\text{AlXCl}} + {\text{5AlCl}}_{{\text{4}}}^{ - }$ (кислотный расплав, содержание AlCl3 больше эквимолярного) или ${{{\text{X}}}^{{2 - }}} + {\text{2A}}{{{\text{l}}}_{{\text{2}}}}{\text{Cl}}_{{\text{7}}}^{ - }{\text{\;}}$ = ${\text{AlXCl}}_{{\text{2}}}^{ - } + {\text{3AlCl}}_{{\text{4}}}^{ - }$ (щелочной расплав, содержание AlCl3 меньше эквимолярного). Кроме того, халькогены могут образовывать и другие анионы, например ${\text{S}}_{{\text{2}}}^{ - }$ или ${\text{S}}_{{\text{3}}}^{ - }$ [12–14], и катионы, например ${\text{SCl}}_{{\text{3}}}^{{\text{ + }}}$ [15]. Также можно предположить наличие в расплавах частицы ${\text{S}}_{{\text{2}}}^{{{\text{2}} - }}$.
Полуметаллы могут присутствовать в расплавах как в окисленной, так и в восстановленной форме и могут образовывать различные димеры, например ${\text{Bi}}_{{\text{2}}}^{{{\text{2 + }}}}$, и частицы более сложного строения.
ПЕРЕНОС И ОБРАЗОВАНИЕ КРИСТАЛЛОВ ХАЛЬКОГЕНИДОВ
В [3, 4] основное внимание было уделено получению кристаллов халькогенидов 3d-металлов, в особенности железа, кобальта и никеля. В качестве ростовой среды чаще всего использовалась смесь CsCl/KCl/NaCl. Температура, при которой растворялась шихта, составляла обычно 650°С, температура, при которой росли кристаллы, была на 80–100°С ниже. В результате исследований была показана возможность получения кристаллов большинства монохалькогенидов, например FeS, FeSe1 – δ, NiS и др. Также была показана возможность получения кристаллов соединений, более богатых халькогеном – Fe2Se3, FeTe2, дисульфидов или диселенидов железа, кобальта и никеля и др.
Кристаллы, в которых количество металла было больше, чем количество халькогена, например хизлевудит Ni3S2, напротив, никогда не получались без применения проводника электронов (платиновой проволоки). Невозможность получения данных кристаллов объясняется выполнением условия электронейтральности, принимая во внимание, что солевой расплав является электролитом, т.е. не содержит свободных электронов.
Растворение шихты и затем образование кристаллов монохалькогенидов Fe, Co или Ni в галоидных расплавах описываются реакцией с участием галогенидных комплексов металлов со степенью окисления металла +2 и с помощью ионов халькогена со степенью окисления –2. Например, реакция растворения FeS в хлоридном расплаве может быть записана
(1)
${\text{FeS}} + {\text{4C}}{{{\text{l}}}^{ - }} = {\text{FeCl}}_{{\text{4}}}^{{{\text{2}} - }} + {{{\text{S}}}^{{{\text{2}} - }}}.$Очевидно, что реакция образования кристалла обратна реакции растворения.
Если количество халькогена в растущем кристалле превышает количество металла, реакция растворения (кристаллизации) содержит частицы${\text{\;X}}_{m}^{{k - }}$. Так, при переносе FeS2 сера должна переноситься или в виде комбинации ионов S2– и ${\text{S}}_{{\text{2}}}^{ - }$, или с помощью образования частицы ${\text{S}}_{{\text{2}}}^{{{\text{2}} - }}$, существование которой не доказано:
(2)
${\text{Fe}}{{{\text{S}}}_{{\text{2}}}} + {\text{4C}}{{{\text{l}}}^{ - }} = {\text{FeCl}}_{{\text{4}}}^{{{\text{2}} - }} + {\text{S}}_{{\text{2}}}^{{{\text{2}} - }}.$Монохалькогениды хрома, напротив, получались с большим трудом, что может объясняться малой устойчивостью комплексов Cr2+ в расплавах. Таким образом, реакцию растворения и образования кристаллов, например полученного добреелита FeCr2S4 (рис. 1а), можно записать как
(3)
${\text{FeC}}{{{\text{r}}}_{{\text{2}}}}{{{\text{S}}}_{{\text{4}}}} + {\text{16C}}{{{\text{l}}}^{ - }} = {\text{FeCl}}_{{\text{4}}}^{{{\text{2}} - }} + {\text{2CrCl}}_{{\text{6}}}^{{{\text{3}} - }} + {\text{4}}{{{\text{S}}}^{{{\text{2}} - }}}.$Рис. 1.
Электронные фотографии кристаллов FeCr2S4 (а), ZrS3 на кристалле ZrS2 (б), ZrSe2 (в), HfS2 (г), HfS3 (д), VSe2 (е), Ge (ж), FeAs (з), KFe3S4 (и).

Кристаллы, в которых металла больше, чем халькогена, можно получить только с помощью проводника электронов, соединяющего место растворения шихты и место кристаллизации. Предположительная реакция растворения, таким образом, может быть записана как
(4)
${\text{N}}{{{\text{i}}}_{{\text{3}}}}{{{\text{S}}}_{{\text{2}}}} + {\text{12C}}{{{\text{l}}}^{ - }} = {\text{3NiCl}}_{{\text{4}}}^{{{\text{2}} - }} + {\text{2}}{{{\text{S}}}^{{{\text{2}} - }}} + {\text{2e}}_{{{\text{проволока}}}}^{ - }.$Видно, что для переноса и образования кристаллов подобных химических соединений необходимо или обеспечить перенос электронов по проводящему контуру, или, в случае переноса без контура, допустить образование частиц с неправдоподобными степенями окисления металла и халькогена.
В [4] было сказано о неудаче в получении кристаллов TiS, NbS2 и NbSe2. Это может быть объяснено малой устойчивостью Ti2+ и Nb4+ в солевых расплавах. Напротив, в ходе дальнейших исследований в солевом расплаве CsCl/KCl/NaCl были получены кристаллы TiS2, TiSe2 и NbS3. Растворение, перенос и образование кристаллов, например NbS3, могут быть описаны реакцией с участием ниобия со степенью окисления +5:
(5)
${\text{3Nb}}{{{\text{S}}}_{{\text{3}}}} + {\text{18C}}{{{\text{l}}}^{ - }} = {\text{3NbCl}}_{{\text{6}}}^{ - } + {\text{7}}{{{\text{S}}}^{{{\text{2}} - }}} + {\text{S}}_{{\text{2}}}^{ - }.$Аналогичным образом в солевом расплаве на основе хлорида цезия получены дихалькогениды циркония и гафния: ZrS2 (рис. 1б), ZrSe2 (рис. 1в), HfS2 (рис. 1г), HfSe2. Очевидно, что перенос металлов осуществлялся с помощью хлоридных комплексов, в которых металл находился в степени окисления +4. В тех же условиях кристаллы монохалькогенидов гафния не были получены из-за неустойчивости галогенидных комплексов с двухвалентным гафнием. Аналогично были получены кристаллы, содержащие бóльшее количество халькогена – HfS3 (рис. 1д), ZrS3, (рис. 1б) и ZrSe3.
Халькогениды ванадия V2S3 и VSe2 (рис. 1е) были получены при аналогичных температурах в аналогичных солевых расплавах. Очевидно, что перенос V2S3 осуществлялся с помощью комплекса ${\text{VCl}}_{{\text{6}}}^{{{\text{3}} - }}$. Принимая во внимание, что у ванадия наиболее предпочтительными степенями окисления являются +3 и +5, возможно несколько реакций переноса VSe2 с участием галогенидных комплексов с V3+ и V5+, с участием только комплекса с V4+ или с участием V3+ и ${\text{Se}}_{{\text{2}}}^{{{\text{2}} - }}{\text{\;(или\;Se}}_{{\text{2}}}^{ - }$).
Получены кристаллы и на основе других элементов, в частности кристаллы твердого раствора Zn1 – xHgxS со структурой сфалерита, а также более сложные твердые растворы с участием сульфидов цинка, ртути, железа, марганца и кадмия со структурой сфалерита и вюрцита. Попытка вырастить кристаллы ZnS, легированные германием, не увенчалась успехом. Тем не менее германий может переноситься в солевых расплавах и образовывать кристаллы металлического германия (рис. 1ж). Рост кристаллов германия осуществлялся с помощью химически инертного проводника электронов – платиновой проволоки, соединяющей шихту и место кристаллизации [5]. Получение кристаллов халькогенидов германия в солевых расплавах при аналогичных температурах нецелесообразно, так как их образование возможно методом сублимации.
Совместная перекристаллизация FeS2 и сульфидов рения или осмия показала возможность переноса Re и Os и образования микроскопических кристаллов ReS2, OsS2 и тройной фазы с участием Os, Fe и S.
Ядовитость ртути и дороговизна рения и осмия не позволили получить другие кристаллы с их участием.
ПЕРЕНОС И ОБРАЗОВАНИЕ КРИСТАЛЛОВ ПНИКТИДОВ
В [16] показано, что в расплаве Bi + BiCl3, т.е. в восстановительных условиях, висмут сопропорционирует с образованием Bi+ и ${\text{Bi}}_{4}^{{4 + }}$. В расплавах AlCl3/NaCl/BiCl3, AlBr3/NaBr/BiBr3 и ZnCl2/KCl/BiCl3, т.е. в окислительных условиях, кроме Bi3+ существуют такие субсоединения, как Bi+, ${\text{Bi}}_{5}^{{3 + }}$ и ${\text{Bi}}_{8}^{{2 + }}$. Таким образом, в окислительных и восстановительных условиях висмут в солевых расплавах находится в окисленной форме, что приводит к относительной легкости получения кристаллов халькогенидов висмута (Bi2S3, Bi2Se3, Bi2Te3) и невозможности получения соединений висмута с переходными металлами (висмутидов) – тех веществ, в которых висмут находится в отрицательной степени окисления. Аналогичные рассуждения можно применить и для сурьмы.
Мышьяк, напротив, хорошо переносится в виде анионов и образует кристаллы таких фаз, как FeAs2, FeAsS, CoAs2, InAs и т.д. Некоторые фосфиды были получены в ходе предыдущих исследований [4]. Работы по получению кристаллов халькогенидов мышьяка не велись из-за их низкой температуры устойчивости.
Перенос арсенопирита FeAsS и леллингита FeAs2 осуществляется, вероятно, с помощью частиц ${\text{As}}_{{\text{2}}}^{{{\text{2}} - }}$:
(6)
${\text{FeAsS}} + {\text{4C}}{{{\text{l}}}^{ - }} = {\text{FeCl}}_{{\text{4}}}^{{{\text{2}} - }} + {\text{1/2As}}_{{\text{2}}}^{{{\text{2}} - }} + {\text{1/2S}}_{{\text{2}}}^{{{\text{2}} - }},$(7)
${\text{FeA}}{{{\text{s}}}_{{\text{2}}}} + {\text{4C}}{{{\text{l}}}^{ - }} = {\text{FeCl}}_{{\text{4}}}^{{{\text{2}} - }} + {\text{As}}_{{\text{2}}}^{{{\text{2}} - }}.$Ион ${\text{A}}{{{\text{s}}}^{{{\text{3}} - }}}$, вероятно, не присутствует в солевых расплавах в достаточном количестве. В [4] показано получение небольших кристаллов InAs из шихты аналогичного состава, тогда как кристаллы FeAs удалось получить только при использовании платинового проводящего контура (рис. 1з). Формально эти два факта входят в противоречие, так как в обеих реакциях должен присутствовать ион As3-. Противоречия можно избежать, если предположить, что арсенид индия растворяется, например, по реакции
(8)
${\text{2InAs}} = {\text{In}}_{{\text{2}}}^{{{\text{4 + }}}} + {\text{As}}_{{\text{2}}}^{{{\text{4}} - }}$(9)
${\text{2InAs}} = {\text{2I}}{{{\text{n}}}^{{\text{ + }}}} + {\text{As}}_{{\text{2}}}^{{{\text{2}} - }}.$Таким образом, при растворении халькогенидной или пниктидной шихты элементы переходят в расплав в наиболее предпочтительных степенях окисления. Невозможность растворения в наиболее предпочтительных степенях окисления может помешать образованию кристаллов. В ряде случаев переходу вещества в галогенидный расплав в наиболее предпочтительных степенях окисления может способствовать электронпроводящий контур, соединяющий место растворения шихты и место кристаллизации.
ПОЛУЧЕНИЕ КРИСТАЛЛОВ ХАЛЬКОГЕНИДОВ, СОДЕРЖАЩИХ ЩЕЛОЧНЫЕ МЕТАЛЛЫ
В [3, 4] показано, что при перекристаллизации халькогенидов переходных металлов в расплавах на основе CsCl и RbCl цезий и рубидий часто переходят в растущий кристалл. Так, были получены кристаллы Cs0.8Fe2Se2, CsFe2Se3, RbGa5S8 и др. Переход тяжелых щелочных металлов из расплава в растущий кристалл при охлаждении солевых расплавов часто использовался для получения кристаллов новых химических соединений [17]. Литий, натрий и калий в проводимых экспериментах, напротив, всегда оставались в расплаве.
Для получения кристаллов халькогенидов с участием легких щелочных металлов была сухим способом синтезирована шихта KFenSm и NaFenSm с различными соотношениями элементов.
Шихта, содержащая калий, была перекристаллизована в примерно эквимолярной солевой смеси KCl/KBr/KI в условии стационарного температурного градиента. Температура горячего конца составляла 711°С, холодного – 650°С. В результате из шихты состава K2Fe5S6 получены плоские тетрагональные кристаллы примерного состава KFe3S4 (рис. 1и).
Аналогично шихта NaFe2S2 была перекристаллизована в смеси NaCl/NaBr/NaI при температуре горячего конца 750°С и холодного ~680°С. В данном случае в холодной части ампулы найдены небольшие кристаллические образования примерного состава NaxFeS1 + x/2, где x ~ 0.2, и большое количество кристаллического Na2Si4O9. В аналогичных условиях перекристаллизация NaFe2S3 или шихты без участия натрия не приводила к заметному взаимодействию с материалом ампулы из кварцевого стекла.
Если шихта с участием щелочного металла, например натрия, перекристаллизовывалась в расплаве с участием галогенидов лития, то взаимодействие с материалом кварцевой ампулы было сильнее. Напротив, если шихта не содержала щелочного металла, то солевые расплавы с участием солей лития не разрушали ампулу. Таким образом, получение кристаллов с участием лития в любых солевых расплавах в ампулах из кварцевого стекла сильно затруднено. С другой стороны, использование солей с участием хлорида лития для получения халькогенидов переходных металлов вполне безопасно и было описано в [4].
ПЕРЕНОС И ОБРАЗОВАНИЕ КРИСТАЛЛОВ СВЕРХПРОВОДЯЩЕГО FeSe1 – δ
Несмотря на то что получение кристаллов халькогенидов 3d-металлов, в которых металла больше, чем халькогена, затруднено, в [18] были получены высококачественные кристаллы сверхпроводящего FeSe1 – δ. Величина параметра нестехиометрии, по мнению разных авторов, составляет от 0.01 до 0.04 ([18] с цитированной литературой). Рост происходил при низких температурах в солевых расплавах на основе безводного хлорида алюминия, например AlCl3/KCl/NaCl.
Реакция растворения, переноса и роста кристаллов FeSe1 – δ без учета нестехиометрии может быть записана как
(10)
${\text{FeSe}} + {\text{8AlCl}}_{{\text{4}}}^{ - } = {\text{FeCl}}_{{\text{4}}}^{{{\text{2}} - }} + {\text{S}}{{{\text{e}}}^{{{\text{2}} - }}} + {\text{4A}}{{{\text{l}}}_{{\text{2}}}}{\text{Cl}}_{{\text{7}}}^{ - }.$Недостаток селена в структуре кристалла FeSe1 ‒ δ не позволяет железу и селену растворяться только в виде ионов со степенью окисления +2 и –2 соответственно и предполагает наличие в расплаве частиц с необычными степенями окисления или свободных электронов, что является маловероятным. Это также может быть объяснено изначальным наличием в безводном хлориде алюминия нескольких сотых процента Fe3+, который при растворении шихты сопропорционирует с формально одновалентным железом в шихте FeSe1 – δ и вновь образуется при росте кристалла:
По-видимому, перенос вещества осуществляется в двух противоположных направлениях: ионы, содержащие Fe2+ и Se2–, мигрируют от горячего конца к холодному, а ионы, содержащие Fe3+, – от холодного конца к горячему. Можно допустить не прямую диффузию трехвалентного железа от холодного конца к горячему, а передачу электрона от двухвалентного железа к трехвалентному по эстафетному механизму.
ВЫВОДЫ
Представлены дополнительные исследования кристаллообразования халькогенидов и пниктидов в галогенидах щелочных металлов в температурном градиенте. Благодаря прогнозированию форм переноса металлов, халькогенов и пниктогенов удалось показать, что перенос шихты в солевых расплавах происходит с помощью ионов, в которых элементы находятся в наиболее предпочтительных степенях окисления.
В используемых солевых расплавах переносятся и могут образовать кристаллы простых, бинарных и более сложных соединений следующие элементы: P, S, K, Ti, V, Fe, Co, Ni, Cu, Zn, Ga, As, Se, Rb, Zr, Pd, Ag, Cd, In, Sn, Sb, Te, Cs, La, Hf, Re, Pt, Au, Hg, Pb и Bi. В некоторых случаях кристаллы могут образовываться с участием O, Na, Al, Si, Cl, Cr, Mn, Ge, Br, Nb и Os. Не удалось перенести и получить кристаллы с участием Li, Mg, Mo, Ru, Ta и W. Перенос остальных элементов не изучался в силу их недоступности, высокой стоимости или токсичности. На рис. 2 показаны элементы, которые в большинстве случаев могут переноситься в солевых расплавах и образовывать кристаллы различных химических соединений с другими элементами. Подобные элементы представлены белым цветом на черном фоне. Элементы, перенос которых наблюдался только в некоторых случаях, показаны белым цветом на сером фоне. Элементы, которые к настоящему моменту не удалось перенести, на рис. 2 показаны черным цветом на сером фоне. Белый фон имеют элементы, работы с которыми не проводились. Таблица несколько отличается от таблицы, приведенной в [3].
Рис. 2.
Фрагмент таблицы Менделеева, в котором обозначены группы элементов в зависимости от возможности переноса в солевых расплавах в температурном градиенте.
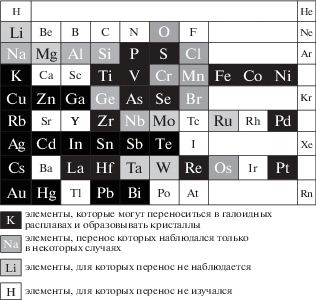
Для анализа возможности получения кристаллов тех или иных халькогенидов следует учесть не только рис. 2, но и предположить степени окисления элементов при растворении и переносе в солевых расплавах. Так, для металлов, которые обычно находятся в растворенном состоянии со степенью окисления +2 (Me2+), можно получить только кристаллы MeXn, где n не меньше единицы. Аналогично для металлов со стандартной степенью окисления +4 можно получить кристаллы, где n не меньше двух.
Единственным исключением, найденным в ходе работы, является получение кристаллов тетрагонального FeSe1 – δ. Растворение стало возможным, вероятно, благодаря изначальному присутствию в расплаве трехвалентного железа, которое сопропорционировало с формально одновалентным железом в FeSe1 – δ. Подобный процесс должен сопровождаться переносом ионов Fe3+ от места кристаллизации к месту растворения – в сторону, противоположную основному потоку вещества.
Вследствие большого разнообразия форм переноса пниктогенов подобных закономерностей при получении пниктидов металлов выявить не удалось, хотя и там можно предположить необходимость присутствия частиц только с наиболее предпочтительными степенями окисления.
Отчасти переносу веществ, которые растворяются в солевых расплавах с образованием ионов с непредпочтительными степенями окисления, может помочь проводник электронов, соединяющий зону растворения и зону кристаллизации.
В отличие от степени окисления количество лигандов у растворенных элементов не должно оказывать влияния на принципиальную возможность растворения, переноса и образования кристаллов. Так, некоторые ионы металлов могут находиться в солевых расплавах и в тетраэдрической, и в октаэдрической координации [16]. С другой стороны, вероятно, координация комплексных ионов может влиять на скорость диффузии элементов в солевых расплавах.
Исследование выполнено при поддержке Правительства Российской Федерации (Программа 211, соглашение № 02.A03.21.0006; Программа повышения конкурентоспособности Казанского федерального университета) и Российского фонда фундаментальных исследований (проект № 17-05-00738 А).
Список литературы
Parker S.G., Pinnell J.E. // J. Cryst. Growth. 1968. V. 3. P. 490.
Yan J.Q., Sales B.C., Susneret M.A. et al. // Phys. Rev. Mater. 2017. V. 1. № 2. P. 023402.
Чареев Д.А. // Кристаллография. 2016. Т. 61. № 3. С. 475.
Чареев Д.А., Волкова О.С., Герингер Н.В. и др. // Кристаллография. 2016. Т. 61. №. 4. С. 652.
Chareev D.A. // J. Cryst. Growth. 2015. V. 429. P. 63.
Chareev D.A., Ovchenkov Y.A., Shvanskaya L.V. et al. // Cryst. Eng. Commun. 2018. V. 20. № 17. P. 2449.
Кириллов С.А. // Электрохимия. 2007. Т. 43. № 8. С. 949.
Волков С.В. // Тез. докл. Первой конференции социалистических стран по химии и электрохимии расплавленных солей, Смоленице, 24–26 ноября 1975. С. 819.
Tagirov B.R., Filimonova O.N., Trigub A.L. et al. // Geochim. Cosmochim. Acta. 2019. V. 254. P. 86.
Tagirov B.R., Trigub A.L., Filimonova O.N. et al. // ACS Earth Space Chem. 2019. V. 3. № 2. P. 240.
Welch B.J., Osteryoung R.A. // J. Electroanal. Chem. Interfacial Electrochem. 1981. V. 118. P. 455.
Greenberg J., Sundheim B.R., Gruen D.M. // J. Chem. Phys. 1958. V. 29. № 2. P. 461.
Giggenbach W. // Inorg. Chem. 1971. V. 10. № 6. P. 1308.
Gruen D.M., McBeth R.L., Zielen A.J. // J. Am. Chem. Soc. 1971. V. 93. № 24. P. 6691.
Robinson J., Gilbert B., Osteryoung R.A. // Inorg. Chem. 1977. V. 16. № 12. P. 3040.
Волков С.В., Яцимирский К.Б. Спектроскопия расплавленных солей. Киев: Наукова думка, 1977. 224 с.
Kanatzidis M.G. // Chem. Mater. 1990. V. 2. № 4. P. 353.
Chareev D.A., Osadchii E.G., Kuzmicheva T.E. et al. // Cryst. Eng. Commun. 2013. V. 15. № 10. P. 1989.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография



