Кристаллография, 2020, T. 65, № 1, стр. 129-136
Влияние параметров спиновых центров на фотоактивность нанокристаллического диоксида титана в видимой области спектра
Е. А. Константинова 1, 2, 3, В. Б. Зайцев 1, А. А. Миннеханов 2, Н. Т. Ле 4, П. К. Кашкаров 1, 2, 3, *
1 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
2 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
3 Московский физико-технический институт
Долгопрудный, Россия
4 Учебный центр “СТЕК”
Москва, Россия
* E-mail: kashkarov_pk@nrcki.ru
Поступила в редакцию 16.07.2019
После доработки 16.07.2019
Принята к публикации 22.08.2019
Аннотация
Методами оптической спектроскопии и электронного парамагнитного резонанса изучены образцы нанокристаллического TiO2, полученные способами золь-гель и сверхкритических флюидов (СКФ). Установлено, что основным типом спиновых центров в СКФ-образцах являются центры Ti3+/кислородная вакансия и электроны проводимости. В образцах, легированных азотом и углеродом, зарегистрированы радикалы (${\text{N}}{\kern 1pt} \bullet $, ${\text{N}}{\kern 1pt} {\text{O}}{\kern 1pt} \bullet $) и (${\text{C}}{\kern 1pt} \bullet $) соответственно. Определено положение энергетических уровней дефектов в запрещенной зоне исследуемых структур. Показано, почему образцы с близкими размерами нанокристаллов, удельной площадью поверхности и концентрацией дефектов резко отличаются фотокаталитической активностью в видимом диапазоне спектра. Установлено, что для получения образцов с наиболее высокой скоростью фотокатализа необходимо внедрение в TiO2 примесных центров с энергетическими уровнями вблизи середины запрещенной зоны полупроводника. Открыты новые возможности для разработки энергоэффективных (без УФ-облучения) фотокатализаторов.
ВВЕДЕНИЕ
В последние несколько десятилетий внимание исследователей привлекают нанокристаллические материалы на основе диоксида титана (TiO2), обладающие рядом уникальных свойств [1–6]. Например, развитая удельная площадь поверхности и, как следствие, высокая адсорбционная чувствительность позволяют использовать TiO2 в газовых сенсорах [7]. Также на его основе разработаны солнечные батареи инжекционного типа [5]. Однако наиболее перспективной областью применения TiO2 является фотокатализ – химическое разложение на поверхности TiO2 органических примесей, в том числе токсичных [8–10]. Отметим, что функциональные характеристики (фотоактивность, реакционная способность и т.д.) TiO2 определяются его физико-химическими свойствами. Действительно, диоксид титана является широкозонным полупроводником с шириной запрещенной зоны от 3.2 до 3.4 эВ, и для генерации реакционно-активных электронов и дырок требуется УФ-излучение [7]. Многочисленными исследованиями показано, что легирование ионами металлов или неметаллами, такими как углерод и азот, приводит к увеличению коэффициента поглощения света в видимой области спектра, что влияет на фотоэлектронные свойства TiO2 [11–15]. В последние годы активно исследуются фотокаталитические гетероструктуры, образованные большим числом дискретных наногетеропереходов типа “оксид/оксид”, одним из которых является нанокристаллический диоксид титана благодаря своей высокой фотоактивности [16, 17]. Было показано, что такие системы обладают способностью накопления фотоиндуцированных носителей заряда, поэтому даже после прекращения освещения на их поверхности в течение нескольких часов происходит генерация активных форм кислорода [16, 17]. Однако для фотовозбуждения указанных наногетероструктур требуется УФ-излучение, что ограничивает область их применения.
Таким образом, специфика синтеза диоксида титана, в том числе легирование наночастиц TiO2 различными примесями, создание гетеросистем, варьирование удельной площади поверхности, определяет природу и свойства дефектов в его структуре, а значит и фотокаталитические свойства. Большое количество работ посвящено установлению взаимосвязи между условиями синтеза, структурными параметрами, скоростью фотокатализа и характеристиками дефектов в материалах на основе TiO2. Однако в современной литературе присутствует значительная эклектичность относительно характера взаимосвязи между величиной удельной площади поверхности образцов, концентрацией дефектов, коэффициентом поглощения в видимой области спектра и скоростью фотокаталитических реакций на поверхности нанокристаллов оксида титана. Можно предположить, что причина заключается в тонкой специфике свойств дефектов: в литературе нет единого подхода к анализу особенностей поведения спиновых центров (СЦ) в TiO2 и структурах на его основе.
Цель настоящей работы – выявить, какие параметры дефектов в структуре диоксида титана определяют скорость фотокаталитических реакций на поверхности. Решение этой проблемы имеет первостепенное значение для практических приложений в области экологии, например при разработке фотокаталитических фильтров нового поколения на основе TiO2 c определенной дефектной структурой, обеспечивающей высокую скорость фотокаталитических реакций при освещении в видимом диапазоне спектра. Для решения поставленной задачи исследованы образцы TiO2, синтезированные двумя принципиально разными методами (сверхкритических флюидов (СКФ) и золь-гель), но имеющие примерно одинаковые удельные площади поверхности и размеры нанокристаллов. Для исследования полученных структур наряду с комплексом стандартных методов применен разработанный авторами уникальный метод определения положения энергетических уровней дефектов в запрещенной зоне полупроводниковых наноматериалов на основе спектроскопии электронного парамагнитного резонанса (ЭПР) [18].
МЕТОДИКА ЭКСПЕРИМЕНТА
Метод СКФ выбран одним из способов формирования нанокристаллического диоксида титана благодаря возможности получения наноматериалов с высокой степенью гомогенности [19–22]. В процессе синтеза вместо углекислого газа [23] применяли 2-пропанол. Существенным преимуществом данного способа является то, что все используемые насосы охлаждаются, тем самым не изменяется температура в процессе синтеза. Кроме того, синтез осуществляется в непрерывном режиме, что дает возможность получать серии наночастиц с высокой степенью гомогенности при полном контроле параметров синтеза. Последнее, в свою очередь, позволяет получать наночастицы с размерами в диапазоне от 5 до 30 нм [19, 20]. В настоящей работе в реактор подавался раствор пропанол-2 : H2O (19:1), доведенный до сверхкритического состояния (tc = 235.6°С, Pc = = 53.7 бар), и 0.1 М раствор изопропоксида титана (ACROS 98%) в пропаноле-2. Скорость подачи реагентов удерживалась постоянной и составляла 20 мл/мин. Параметры образцов TiO2, полученных методом СКФ (далее TiO2-СКФ), представлены в табл. 1.
Таблица 1.
Концентрации спиновых центров в исследуемых образцах
| Образец | Размер наночастиц, нм | Удельная площадь поверхности, м2/г | Тип СЦ | Концентрация СЦ, спин/г | |
|---|---|---|---|---|---|
| в темноте | при освещении | ||||
| TiO2-СКФ25 | 25 ± 3 | 65 ± 7 | Ti3+, e– | (6.6 ± 0.7) × 1017 | (6.6 ± 0.7) × 1017 |
| TiO2-СКФ12 | 12 ± 2 | 130 ± 13 | Ti3+, e– | (6.5 ± 0.7) × 1017 | (6.5 ± 0.7) × 1017 |
| N-TiO2 | 12 ± 2 | 120 ± 12 | ${\text{N}}{\kern 1pt} \bullet $ | (9.3 ± 0.9) × 1015 | (1.9 ± 0.2) × 1016 |
| ${\text{N}}{\kern 1pt} {\text{O}}{\kern 1pt} \bullet $ | (2.0 ± 0.2) × 1017 | (1.5 ± 0.2) × 1017 | |||
| С-TiO2 | 22 ± 3 | 73 ± 8 | ${\text{C}}{\kern 1pt} \bullet $ | (3.3 ± 0.3) × 1017 | (7.3 ± 0.7) × 1017 |
Для приготовления легированных образцов диоксида титана использован наиболее распространенный ввиду относительной простоты и дешевизны золь-гель-метод формирования нанооксидов. Так, образцы с примесью углерода (C-TiO2) получены путем гидролиза тетрахлорида титана с гидроксидом тетрабутиламмония с последующим отжигом в течение 1 ч при 450°C, 1 ч при 350°C и 2 ч при 200°С. Легированный азотом диоксид титана (N-TiO2) получен путем осаждения гидроксида титана из раствора TiCl4 (0.25 моль/л) при pH = 5 с добавлением аммиака. После выдерживания суспензии в течение суток осадок отфильтровывали и высушивали на воздухе при температуре 80°C. Затем осадок измельчали и прокаливали в муфельной печи при температуре 400°C на протяжении 5 ч и затем при 200°C на протяжении 1 ч. Параметры полученных образцов легированного TiO2 представлены в таблице 1.
Размер полученных наночастиц и удельную площадь поверхности образцов определяли методом БЭТ (Брунауэр, Эммет, Теллер) с использованием прибора Chemisorb 2750 (Micromeritics).
Спектры диффузного рассеяния света от полученных образцов регистрировали с помощью спектрографа LS-55 Perkin Elmer, работающего в спектральном диапазоне 200–900 нм со спектральной шириной щели от 2.5 до 20 нм.
Регистрацию спектров ЭПР проводили на ЭПР-спектрометре Bruker (Германия) ELEXSYS 500 (рабочая частота 9.5 ГГц – X-диапазон, чувствительность 5 × 1010 спин/Гс). Образцы помещали в кварцевые ампулы диаметром 4 мм. Для проведения экспериментов в циклах темновые условия – освещение – темновые условия использовали оптический резонатор. Освещение образцов осуществляли непосредственно в резонаторе спектрометра с помощью ртутной лампы высокого давления Bruker ELEXSYS ER 202 UV (мощность 50 Вт). Для выделения видимой области спектра использовали cut-off-фильтры. Для облучения образцов квантами света с заданной длиной волны применяли монохроматор МДР-3. Интенсивность фотовозбуждения образцов составляла приблизительно 15 мВт/см2. Измерения проводили в интервале температур 30–300 K. Для предварительной оценки g-факторов использовали эталонный MgO, содержащий ионы Mn++. Для определения числа СЦ сигналы ЭПР от исследуемого образца сравнивали со спектрами эталона CuCl2⋅2H2O. Теоретическую обработку спектров ЭПР проводили при помощи программного обеспечения MatLab с надстроенным плагином EasySpin [24].
Для определения фотокаталитической активности (окислительной способности) образцов использована реакция фотодеградации красителя родамин 6Ж. Для этого краситель в количестве 4 × 10–8 М/см2 наносился на поверхность диоксида титана из водного раствора. За изменением поверхностной концентрации красителя при облучении (либо в темноте) следили по величине диффузного отражения R на длине волны 530 нм (соответствует максимуму поглощения адсорбированного красителя), которая пересчитывалась в величину, пропорциональную поверхностной концентрации (∼(1 − R)2/2R), по формуле Кубелки–Мунка [25].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Методами СКФ и золь-гель были синтезированы образцы TiO2 с близкими значениями размеров наночастиц и удельной площади поверхности (табл. 1), поскольку именно эти параметры в наибольшей степени определяют фотокаталитическую активность диоксида титана.
На рис. 1а приведен характерный вид спектров диффузного рассеяния света от образцов наночастиц TiO2-СКФ в диапазоне от 250 до 700 нм.
Рис. 1.
Спектры диффузного рассеяния света порошков TiO2-СКФ с различным размером наночастиц (а); определение ширины запрещенной зоны на примере образцов TiO2-СКФ12 (б).
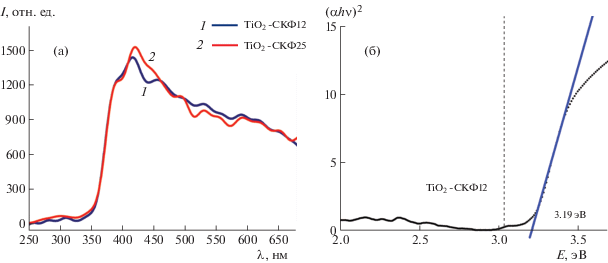
Из рис. 1а видно, что края поглощения (области λ от 350 до 380 нм) для исследуемых образцов практически идентичны, что косвенно свидетельствует о близких значениях ширины запрещенной зоны Eg этих структур. Значение Eg для исследуемых нанопорошков TiO2-СКФ определено путем построения зависимости коэффициента поглощения от длины волны с использованием двухкомпонентной теории Кубелки и Мунка [25] (в предположении, что диффузно отраженное излучение является изотропным, а облучающий свет – монохроматическим). Согласно данной теории диффузное отражение R образца зависит только от отношения коэффициентов поглощения α и рассеяния S, а не отдельно от коэффициента рассеяния или коэффициента поглощения:
где F(R) – функция Кубелки–Мунка.Для определения ширины запрещенной зоны экспериментальные данные представлены в виде следующей зависимости (рис. 1б):
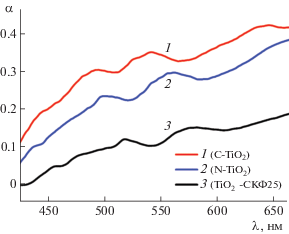
где A – константа, h – постоянная Планка, ν – частота излучения. Ширина запрещенной зоны Eg определялась точкой пересечения линейной экстраполяции данной зависимости с осью абсцисс. Согласно выполненным расчетам величина ширины запрещенной зоны для всех образцов TiO2-СКФ составляет 3.19 ± 0.05 эВ.Аналогичные измерения выполнены для образцов диоксида титана, синтезированных золь-гель-методом и легированных азотом и углеродом. На рис. 2 представлены спектры поглощения указанных структур и для сравнения показан спектр образца TiO2-СКФ25. Как видно из данного рисунка, в видимой области спектра золь-гель-образцы обладают наиболее эффективным поглощением. Согласно выполненным расчетам величина ширины запрещенной зоны для N-TiO2 и С-TiO2 составляет 3.14 ± 0.05 эВ и 3.23 ± 0.05 эВ соответственно.
Рис. 2.
Коэффициент поглощения света в видимой области спектра для порошков TiO2 с различным химическим составом, синтезированных методами золь-гель и СКФ.
Перейдем к обсуждению экспериментальных результатов, полученных методом спектроскопии ЭПР. На рис. 3а представлены экспериментальные и теоретические спектры ЭПР образцов TiO2-СКФ25, зарегистрированные при комнатной температуре.
Рис. 3.
Экспериментальные и теоретические спектры ЭПР образцов TiO2-СКФ25 (а) и СКФ12 (б). Секстет узких линий – спектр ЭПР эталона (MgO с ионами Mn++). T = 300 K.
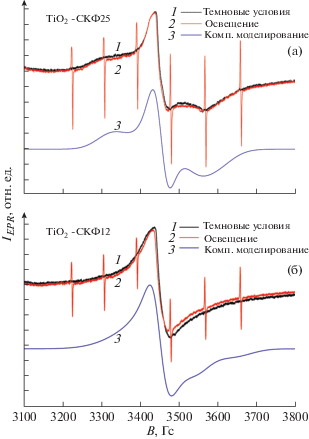
Как видно из рис. 3а, сигнал ЭПР представляет собой асимметричную линию. Моделирование показало, что спектр представляет собой суперпозицию двух сигналов со следующими параметрами: 1 – g1 = 1.985, H1 = 80 Гс, g2 = 1.938, H2 = = 110 Гс и 2 – g1 = 2.001, H1 = 40 Гс, g2 = 1.999, H2 = = 50 Гс. На основе анализа данных [26] эти сигналы могут быть приписаны: 1 – СЦ типа Ti3+/кислородная вакансия, 2 – электронам в зоне проводимости, образующимся вследствие тепловой ионизации вакансий кислорода в TiO2. Обычно сигнал ЭПР от центров типа Ti3+/кислородная вакансия в TiO2 регистрируется при низких температурах (120 K и ниже) и, как правило, в условиях вакуума или после вакуумного отжига образцов (для увеличения концентрации вакансий). Необходимость низких температур обусловлена короткими временами релаксации СЦ. Наблюдаемое замедление процесса спин-решеточной релаксации, по-видимому, обусловлено изменением фононного спектра образцов, синтезированных методом СКФ. Как следует из рис. 3а, освещение образца не приводит к образованию новых СЦ и к перезарядке уже существующих. Это свидетельствует о том, что энергетические уровни Ti3+-центров расположены вблизи дна зоны проводимости и что данные центры практически все ионизованы при комнатной температуре (т.е. являются парамагнитными).
На рис. 3б представлены спектры ЭПР образцов TiO2-СКФ с размером наночастиц 12 нм (TiO2-СКФ12), зарегистрированные при температуре 300 K. Спектр ЭПР в данном случае представляет собой также асимметричную линию со следующими параметрами: 1 – g1 = 1.993, H1 = 80 Гс, g2 = 1.932, H2 = 110 Гс и 2 – g1 = 2.005, H1 = 41 Гс, g2 = 1.999, H2 = 80 Гс. По аналогии с предыдущим случаем указанные сигналы могут быть приписаны центрам типа Ti3+/кислородная вакансия (1) и электронам в зоне проводимости (2).
Отметим, что, как и в случае образцов TiO2-СКФ25, никаких изменений в спектре ЭПР при освещении выявлено не было (рис. 3а и 3б).
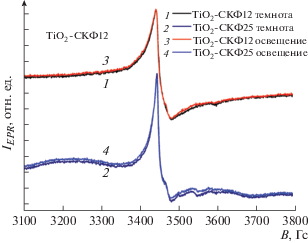
Также выполнены измерения при температуре 30 K с целью обнаружения дополнительных СЦ, не детектируемых при 300 K вследствие коротких времен релаксации (рис. 4). Как показал эксперимент, каких-либо новых дефектных центров при низких температурах не наблюдалось.
Рис. 4.
Экспериментальные и теоретические спектры ЭПР образцов TiO2-СКФ в темновых условиях и при освещении, T = 30 K.
Перейдем к анализу данных по образцам, синтезированным с помощью золь-гель-метода. На рис. 5 представлены спектры ЭПР образцов N-TiO2, зарегистрированные при температуре 300 (а) и 30 K (б) в темновых условиях и при освещении. На вставках к рисункам показаны теоретические спектры ЭПР, полученные путем компьютерного моделирования.
Рис. 5.
Спектры ЭПР образцов N-TiO2, зарегистрированные при температурах 300 (а) и 30 К (б). На вставках показаны теоретические спектры ЭПР.
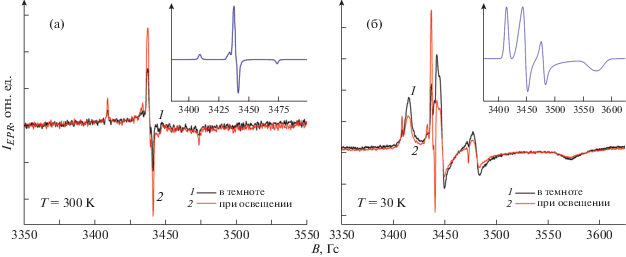
Из рис. 5 видно, что при низких температурах наблюдается суперпозиция сигналов ЭПР – сигнал, который имел место при 300 K, становится едва различим на фоне нового сигнала. Для определения природы детектируемых СЦ проведено компьютерное моделирование. Установлены следующие параметры линий ЭПР. При 300 K: g-тензор – g1 = 2.0085, g2 = 2.0041, g3 = 2.0039, ширины линии ЭПР – ΔH1 = 1.44, ΔH2 = 0.4, ΔH3 = 2.3 Гс, константы сверхтонкого взаимодействия (СТВ) – A1 = 1.54, А2 = 1.09, А3 = 21.8 Гс; при 30 K: g1 = = 2.0039, g2 = 1.999, g3 = 1.928, ΔH1 = 18.5, ΔH2 = = 9.3, ΔH3 = 22.7 Гс, A1 = 0.5, A2 = 21, A3 = 6 Гс. Следовательно, сигналы ЭПР с такими параметрами согласно [18, 26, 27] можно отнести к атомам азота ${\text{N}}{\kern 1pt} \bullet $ (ядерный спин I = 1) с некомпенсированным спином электрона, которые были внедрены в TiO2 в процессе синтеза, и к радикалам моноокиси азота (${\text{N}}{\kern 1pt} {\text{O}}{\kern 1pt} \bullet $) [14, 26, 27].
Отметим, что освещение приводило к росту плотности ${\text{N}}{\kern 1pt} \bullet $-радикалов в 2 раза, одновременно с этим концентрация NO•-центров уменьшалась в 1.3 раза (рис. 5). Эффект освещения был обратим, что свидетельствует о перезарядке СЦ в нанокристаллах TiO2 в цикле темновые условия – освещение – темновые условия, которая может происходить по следующему механизму: N– + + hν → ${\text{N}}{{{\kern 1pt} }^{ \bullet }}$ + e– (в зону проводимости); NO– + + hν → NO+ + e– (в зону проводимости). Первая фотоиндуцированная реакция объясняет рост концентрации ${\text{N}}{\kern 1pt} \bullet $-радикалов при освещении, а вторая – уменьшение концентрации ${\text{N}}{\kern 1pt} {\text{O}}{\kern 1pt} \bullet $-центров.
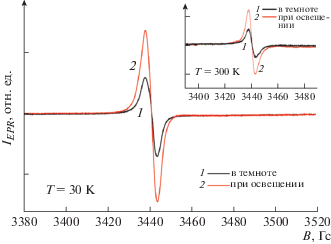
На рис. 6 представлены спектры ЭПР образцов С-TiO2, измеренные при температуре Т = 30 K в темновых условиях и при освещении. На вставке к рисунку показаны спектры ЭПР при 300 K. Видно, что спектр ЭПР не претерпевает изменений при понижении температуры от 300 до 30 K и представляет собой одиночную симметричную линию с g-фактором, равным 2.0033, и шириной линии ∆Н = 6 Гс. Сигнал ЭПР с такими параметрами в соответствии с [28, 29] можно отнести к радикалам углерода ${\text{C}}{\kern 1pt} \bullet $, внедренным в кристаллическую решетку TiO2 при синтезе образцов. Отметим, что освещение приводило к росту плотности ${\text{C}}{\kern 1pt} \bullet $-радикалов примерно в 2 раза (рис. 6). Как и в случае N-TiO2, эффект освещения обратим и может быть объяснен перезарядкой СЦ в нанокристаллах TiO2 в цикле темновые условия – освещение – темновые условия, протекающей по следующему механизму: C– + hν → ${{{\text{C}}}^{ \bullet }}$ + e– (в зону проводимости). Указанная фотоиндуцированная реакция объясняет рост концентрации ${\text{C}}{\kern 1pt} \bullet $-радикалов при освещении.
Рис. 6.
Спектры ЭПР образцов C-TiO2, зарегистрированные при температурах 30 и 300 K (на вставке) в темноте и при освещении.
Рассчитанные значения концентрации СЦ для всех исследуемых образцов представлены в таблице 1. Видно, что для TiO2-СКФ указанные величины не зависят ни от удельной площади поверхности образцов, ни, как указывалось выше, от освещения. Это интересный экспериментальный результат; для его объяснения применена разработанная авторами оригинальная методика на основе ЭПР-спектроскопии по определению положения уровней СЦ в запрещенной зоне наноструктурированных полупроводниковых оксидов [18].
Облучение TiO2-СКФ монохроматическим светом с различной длиной волны (энергией) в широком диапазоне (∆λ = 350–900 нм) не приводило к росту амплитуды соответствующего сигнала ЭПР. Таким образом, можно предположить, что уровни СЦ (Ti3+-центров) расположены в непосредственной близости от края зоны проводимости, практически все ионизованы уже при комнатной температуре (электроны в зоне проводимости), и данные СЦ могут быть лишь центрами рекомбинации фотовозбужденных носителей заряда.
Результаты экспериментов по облучению N-TiO2 монохроматическим светом представлены на рис. 7а и 7б. Из рисунка видно, что резкий скачок амплитуды сигнала ЭПР для ${\text{N}}{\kern 1pt} \bullet $-радикалов наблюдается при длине волны 650 нм, что соответствует энергии 1.9 эВ (рис. 7а). Поэтому можно предположить, что уровни энергии ${\text{N}}{\kern 1pt} \bullet $-радикалов в запрещенной зоне расположены на 1.9 эВ ниже дна зоны проводимости.
Рис. 7.
Зависимость амплитуды сигнала ЭПР для радикалов ${\text{N}}{\kern 1pt} \bullet $ (а), ${\text{N}}{\kern 1pt} {\text{O}}{\kern 1pt} \bullet $ (б) и ${\text{C}}{\kern 1pt} \bullet $ (в) от длины волны света для образцов N-TiO2 (а, б) и C-TiO2 (в), синтезированных методом золь-гель.
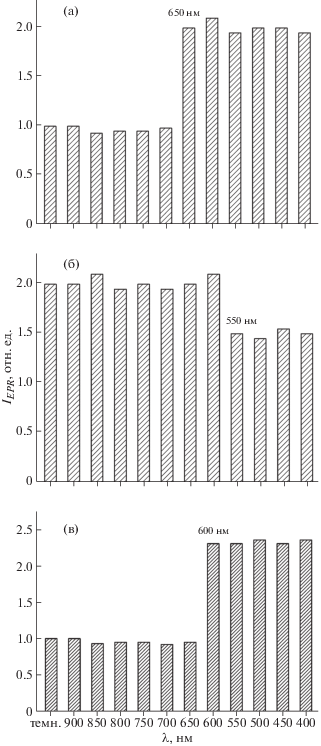
Зависимость амплитуды сигнала ЭПР для ${\text{N}}{\kern 1pt} {\text{O}}{\kern 1pt} \bullet $-радикалов от длины волны света приведена на рис. 7б. Видно, что уменьшение амплитуды сигнала происходит при длине волны света, приблизительно равной 550 нм (2.3 эВ). Это свидетельствует о том, что уровни энергии ${\text{N}}{\kern 1pt} {\text{O}}{\kern 1pt} \bullet $-радикалов расположены в запрещенной зоне на 2.3 эВ ниже дна зоны проводимости.
Зависимость амплитуды наблюдаемого в образцах С-TiO2 сигнала ЭПР от длины волны света показана на рис. 7в. Из рисунка видно, что при λ = 600 нм (2.1 эВ) амплитуда сигнала ЭПР растет. Аналогично случаю для ${\text{N}}{\kern 1pt} \bullet $ и ${\text{N}}{\kern 1pt} {\text{O}}{\kern 1pt} \bullet $-СЦ можно сделать вывод, что уровни энергии ${\text{C}}{\kern 1pt} \bullet $-радикалов расположены в запрещенной зоне на 2.1 эВ ниже дна зоны проводимости.
Полученные данные согласуются с результатами оптических измерений: в видимой области спектра сигнал поглощения в случае СКФ-образцов слабее, чем в случае золь-гель-структур. Действительно, в TiO2-СКФ отсутствуют дефекты, имеющие глубокие энергетические уровни в запрещенной зоне TiO2 и обеспечивающие поглощение в данном спектральном диапазоне.
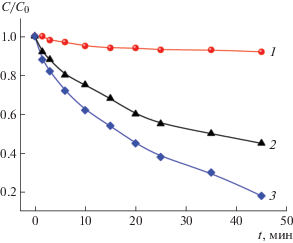
Поскольку для практических применений фотокатализаторов важно, чтобы образцы имели высокую фоточувствительность в видимой области спектра, были проведены измерения кинетик фотокатализа с использованием изучаемых структур TiO2 при облучении их светом в диапазоне длин волн ∆λ = 400–750 нм. В качестве тестовой реакции использовалась реакция фотодеградации красителя родамин 6Ж (рис. 8). Как следует из рисунка, наибольшей фотокаталитической активностью обладают образцы C-TiO2, в то время как СКФ-структуры имеют очень низкую скорость фотокатализа. Хотя концентрации дефектов в СКФ и C-TiO2 примерно одинаковы, в образцах, легированных углеродом, им соответствуют уровни энергии вблизи середины запрещенной зоны, которые и дают вклад в поглощение света в видимой области спектра. Напротив, энергетические уровни СЦ в СКФ-образцах, соответствующие Ti3+-центрам, расположены вблизи зоны проводимости и не участвуют в поглощении света в диапазоне длин волн 400–750 нм. Образцы N-TiO2 также характеризуются высокой фотокаталитической активностью в видимом диапазоне спектра, но уступают C-TiO2, что можно объяснить более высокой концентрацией примесных дефектов в последних.
Рис. 8.
Кинетики фотокатализа образцов TiO2-СКФ12 (1), N-TiO2 (2) и C-TiO2 (3), измеренные при фотовозбуждении образцов в диапазоне длин волн ∆λ = 400–750 нм.
Отметим, что концентрация СЦ не менялась в процессе хранения СКФ и золь-гель-образцов с момента приготовления (5 мес). Кроме того, в течение указанного периода все образцы характеризовались стабильными фотокаталитическими свойствами.
ЗАКЛЮЧЕНИЕ
Проведено сравнительное исследование природы и основных параметров точечных дефектов (спиновых центров), а также оптических и фотокаталитических свойств образцов нанокристаллического TiO2, синтезированного различными методами, но с близкими размерами наночастиц и величинами удельной площади поверхности образцов. Методом ЭПР установлено, что основным типом спиновых центров в СКФ-образцах являются центры типа Ti3+/кислородная вакансия и электроны в зоне проводимости, образующиеся вследствие тепловой ионизации вакансий. В легированных азотом и углеродом нанокристаллах TiO2 зарегистрированы ${\text{N}}{\kern 1pt} \bullet $-, ${\text{N}}{\kern 1pt} {\text{O}}{\kern 1pt} \bullet $- и ${\text{C}}{\kern 1pt} \bullet $-радикалы соответственно. Концентрация указанных примесных центров менялась при освещении образцов.
Применение для исследования СКФ и золь-гель-образцов разработанного авторами оригинального метода определения положения энергетических уровней дефектов в запрещенной зоне полупроводниковых оксидов позволило дать ответ на важный вопрос, почему образцы с близкими величинами удельной площади поверхности и концентраций дефектов резко различаются фотоактивностью, в том числе фотокаталитической, в видимом диапазоне света. В результате анализа экспериментальных данных установлено, что для получения образцов с высокой фотокаталитической активностью в видимой области спектра необходимо внедрить в кристаллическую структуру TiO2 примесные центры, энергетические уровни которых будут расположены глубоко в запрещенной зоне полупроводника. Описанные свойства проявляют легированные образцы C-TiO2 и N-TiO2. Обнаружено, что дальнейший рост скорости фотокаталитического разложения красителя обеспечивается увеличением концентрации указанных примесных центров в образцах. Таким образом, впервые показано, что на скорость фотокаталитических реакций на поверхности нанокристаллов TiO2 при освещении в видимой области спектра влияют примесные центры, внедренные в кристаллическую решетку диоксида титана в результате легирования, а не собственные дефекты в структуре TiO2. Полученные данные вносят важный вклад в разработку фоточувствительных и энергоэффективных (не требующих УФ-излучения) фотокаталитических материалов на основе нанокристаллического оксида титана.
Авторы выражают благодарность Б. Иверсену (Орхусский университет, Орхус, Дания) за помощь в синтезе СКФ-образцов.
Исследование выполнено при финансовой поддержке Российского фонда фундаментальных исследований (проект № 18-29-23051).
Список литературы
Liu D., Zi W., Sajjad S.D. et al. // ACS Catal. 2015. V. 5. P. 2632.
Schneider J., Matsuoka M. // Chem. Rev. 2014. V. 114. P. 9919.
Sasan K., Zuo F. // Nanoscale. 2015. V. 7. P. 13369.
Oluwafunmilola O., Maroto-Valer M. // J. Photochem. Photobiol. C. 2015. V. 24. P. 16.
O’Regan B., Gratzel M. // Nature. 1991. V. 335. P. 737.
Mills A., Hunte S. // J. Photochem. Photobiol. A. 1997. V. 108. P. 1.
Chen X., Mao S. // Chem. Rev. 2007. V. 107. P. 2891.
Serpone N., Pelizzetti E. Photocatalysis: Fundamentals and Applications. New York: Wiley, 1989. 214 p.
Hoffmann M.R., Martin S.T., Choi W. et al. // Chem. Rev. 1995. V. 95. P. 69.
Fujishima A., Rao T.N., Tryk D.A. // J. Photochem. Photobiol. C. 2000. V. 1. P. 1.
Rupa A.V., Divakar D., Sivakumar T. // Catal. Lett. 2009. V. 132. P. 259.
Asahi R., Morikawa T., Ohwaki T. et al. // Science. 2001. V. 293. P. 269.
Barbieriková Z., Pližingrová E., Motlochová M. et al. // Appl. Catal. B: Environ. 2018. V. 232. P. 397.
Minnekhanov A.A., Le N.T., Konstantinova E.A. et al. // Appl. Magn. Reson. 2017. V. 48. P. 335.
Miyamoto N.S., Miyamoto R., Giamello E. et al. // Res. Chem. Intermed. 2018. V. 44. P. 4577.
Sviridova T.V., Sadovskaya L.Yu., Shchukina E.M. et al. // J. Photochem. Photobiol. A: Chem. 2016. V. 327. P. 44.
Sviridova T.V., Sadovskaya L.Yu., Konstantinova E.A. et al. // Catal. Lett. 2019. V. 149. P. 1147.
Konstantinova E.A., Minnekhanov A.A., Kokorin A.I. et al. // J. Phys. Chem. C. 2018. V. 122. P. 10248.
Татаренко К.А., Лазарев А.В. // Сверхкритические флюиды: теория и практика. 2015. Т. 10. № 4. С. 4.
Aymonier C., Loppinet-Serani A., Reveròn H., Supercrit J. // Fluids. 2006. V. 38. P. 242.
Camarillo R.,Tostón S., Martínez F. et al. // J. Chem. Technol. Biotechnol. 2017. V. 92. P. 1710.
Camarillo R., Rizaldos D., Jiménez C. et al. // J. Supercrit. Fluids. 2019. V. 147. P. 70.
Кротова Л.И., Миронов А.В., Попов В.К. // Сверхкритические флюиды: теория и практика. 2013. Т. 8. № 1. С. 36.
Stoll S., Schweiger A. // J. Magn. Reson. 2006. V. 178. P. 42.
Wedland W., Hecht H. // Reflectance Spectroscopy. New York: Intersci. Publ., 1966. 187 p.
Kokorin A.I., Bahnemann D.W. // Chemical Physics of Nanostructured Semicontuctors / Eds. Kokorin A.I., Bahnemann D.W. Utrecht, Boston: VSP-Brill Acad. Publ., 2003. P. 203.
Livraghi S., Czoska A.M., Paganini M.C. et al. // J. Solid State Chem. 2009. V. 182. P. 160.
Minnekhanov A.A., Deygen D.M., Konstantinova E.A. et al. // Nanoscale Res. Lett. 2012. 7:333.
Shimizu T., Kumeda M., Kiriyama Y. // Solid State Commun. 1981. V. 37. P. 699.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография


