Кристаллография, 2020, T. 65, № 3, стр. 395-401
Синтез и in vitro-исследование устойчивости к биоразложению магнитных наночастиц, предназначенных для исследования вязкоэластичных свойств цитоплазмы
А. Ю. Юреня 1, 3, *, Р. Р. Габбасов 1, А. А. Никитин 2, 3, В. М. Черепанов 1, М. А. Поликарпов 1, М. А. Чуев 4, М. А. Абакумов 2, А. Г. Мажуга 5, В. Я. Панченко 1, 3
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
2 Национальный исследовательский технологический университет “МИСиС”
Москва, Россия
3 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
4 Физико-технологический институт им. К.А. Валиева РАН
Москва, Россия
5 Российский химико-технологический университет им. Д.И. Менделеева
Москва, Россия
* E-mail: antonyurenya@gmail.com
Поступила в редакцию 20.05.2019
После доработки 20.09.2019
Принята к публикации 15.10.2019
Аннотация
Разработан подход к изучению внутриклеточного движения с наносекундным временным разрешением, основанный на мессбауэровском исследовании частиц, внедренных в клетки. Изучена возможность применения магнитных наночастиц в качестве зондов для исследований свойств цитоплазмы in vitro. Синтезированы два типа водных коллоидов наночастиц, обогащенных изотопом 57Fe, исследована их цитотоксичность и устойчивость к биодеградации в условиях живых клеток на примере клеточной линии рака молочной железы. Установлено, что частицы за 120 ч инкубации внутри клеток практически не претерпевают характерных для процессов биодеградации изменений, хотя отмечается внутриклеточное окисление двухвалентного железа в составе частиц. Данный результат свидетельствует о возможности использования полученных частиц в мессбауэровских исследованиях in vitro.
ВВЕДЕНИЕ
Исследование и моделирование многих внутриклеточных процессов, таких как процессы транспорта, диффузия макромолекул и т.п., затруднены в связи с недостатком экспериментальных данных о свойствах внутриклеточной жидкости живых клеток. Более ста лет назад работы Эйнштейна продемонстрировали, что движение субмикронных наночастиц (НЧ) в простых растворах определяется принципами броуновского движения [1]. Данная парадигма оказалась непригодной в попытках описания движения макромолекул в комплексных биологических средах [2, 3]. Биологические жидкости, которыми наполнены все клетки, а также полости их органелл, представляют собой водные растворы, содержащие высокие концентрации биомолекул. Белки, углеводы, липиды, нуклеиновые кислоты могут занимать от 5 до 40% объема, что приводит к явлению “макромолекулярного краудинга” (МК) [4, 5]. Ряд исследований последних лет продемонстрировал наличие ряда аномальных явлений, связанных с движением макромолекул в клетках [2, 6–9]. На сегодняшний день существует несколько упрощенных моделей, описывающих МК. Такие модели основаны на результатах исследования модельных растворов [10, 11]. Создание достоверной модели, описывающей динамику в условиях МК биологических сред, невозможно ввиду отсутствия соответствующих экспериментальных данных [12].
В последние годы был успешно реализован ряд исследований, направленных на изучение вязкоэластичных свойств цитоплазмы in vitro [13]. Методом корреляционной спектроскопии изображений (ICS), способным исследовать перемещение молекул во внутриклеточном пространстве по трем измерениям, исследована подвижность отдельных белков [14]. Путем наблюдения за движением наночастицы-зонда, введенной в клетку, были исследованы вязкоэластичные свойства биологических сред [15–17]. Таким образом, все существующие подходы основаны на оптических измерениях, существенным недостатком которых является ограниченная разрешающая способность. Наиболее точные результаты исследования броуновского движения макромолекул и НЧ в реальных биологических средах были получены с пространственным и временным разрешением порядка 100 нм и 1 мкс соответственно [13].
Разрабатывается новый подход к изучению свойств цитоплазмы клеток, который заключается в исследовании внедренных в клетку НЧ оксидов железа методами мессбауэровской спектроскопии. В основе данного подхода лежит анализ броуновского движения НЧ различного размера в жидких средах посредством мессбауэровской спектроскопии [18]. Ранее была развита методика анализа сверхтонкой структуры мессбауэровских спектров, учитывающая разделение вкладов магнитной релаксации и диффузионного движения НЧ в жидких средах [19]. Также была продемонстрирована возможность получения достоверных мессбауэровских спектров НЧ на основе оксидов железа, диспергированных в вязкой модельной среде, имитирующей клеточную цитоплазму [20]. Таким образом, представляется возможным исследование динамических свойств биологических жидкостей, основанное на анализе методом ядерной гамма-резонансной спектроскопии броуновского движения железосодержащих НЧ, доставленных в живые клетки. Основным преимуществом разрабатываемого подхода должно стать беспрецедентное временное разрешение менее 100 нс, определяемое временем жизни возбужденного состояния ядра 57Fe.
Для успешной реализации разрабатываемого подхода применительно к in vitro-исследованиям необходимо создание нанозондов на основе железа. Исследование НЧ в вязких средах сопряжено со значительным снижением вероятности эффекта резонансного поглощения, что затрудняет получение спектров удовлетворительного качества. Использование при изготовлении наночастиц-зондов-прекурсоров, обогащенных изотопом 57Fe, позволит скомпенсировать низкое содержание НЧ в последующих in vitro-исследованиях.
В отличие от модельных жидкостей, в которых изменение формы спектральных линий частиц определяется магнитной релаксацией и диффузией, при исследовании биологических объектов необходимо учитывать изменения в мессбауэровских спектрах частиц-зондов, обусловленные их взаимодействием с клетками. Известно, что практически все типы НЧ подвергаются активной биодеградации после попадания в живой организм [21]. В результате взаимодействия с биологической средой в той или иной степени происходит разрушение как органического стабилизирующего покрытия частиц, так и их неорганического “ядра”. Так, в условиях, сходных с условиями внутриклеточных лизосом, в которых локализуется основная масса частиц, может происходить интенсивное разложение “ядра” НЧ на основе оксидов железа вплоть до полного растворения [22]. Процессы, связанные со взаимодействием частиц с биологическими средами, приводят к изменению формы мессбауэровских спектров частиц в составе биологических образцов в сравнении с контрольными спектрами исходных частиц. Такие изменения наблюдались в ряде работ по исследованию биодеградации магнитных НЧ в организме млекопитающих [23, 24].
В настоящей работе синтезированы два типа наночастиц-зондов на основе оксида железа из прекурсоров, обогащенных по изотопу 57Fe. В ходе работы исследована биосовместимость полученных частиц и методами мессбауэровской спектроскопии проанализирована устойчивость к биодеградации обоих типов частиц при их инкубации в клеточных культурах в течение нескольких дней.
ЭКСПЕРИМЕНТ
Синтез магнитных наночастиц-зондов (МНЗ). Синтезированы и исследованы два типа МНЗ: меньшего размера (МНЗ-1), полученные методом совместного осаждения солей железа Fe3+ и Fe2+, и крупного размера (МНЗ-2), полученные методом термического разложения олеатного комплекса железа(III).
Получение водного коллоида МНЗ-1. Смесь 0.0356 г FeCl2 и 0.0975 г 57FeCl3 растворяли в 2 мл деионизированной воды и перемешивали на магнитной мешалке в течение 10 мин, барботируя аргоном. Далее раствор нагревали до 95°С, при непрерывном перемешивании в него вводили 500 мкл 28%-ного раствора NH4OH. Полученную смесь интенсивно перемешивали в течение часа при температуре 95°С, далее 0.041 г лимонной кислоты в 500 мкл деионизированной воды добавляли в реакционную смесь и полученный раствор выдерживали при 95°С еще 2 ч с последующим охлаждением до комнатной температуры. Далее смесь центрифугировали (7000 об./мин–1, 10 мин), полученный осадок диспергировали в 20 мл раствора лимонной кислоты (20 мг·мл–1) при помощи УЗ-гомогенизатора в течение 20 мин. Процедуру с этапа центрифугирования повторили дважды. Для отделения крупных НЧ полученный раствор центрифугировали в течение 10 мин при 7000 об./мин–1, надосадочный раствор собирали и доводили его значение pH до 7.4, добавляя 1 М раствор NaOH. Полученный раствор подвергали диализу в течение 48 ч в диализном мешке с размером пор 12–14 кДа. Расчетное содержание изотопа 57Fe в МНЗ-1 составило не менее 65%.
Получение водного коллоида МНЗ-2. Для получения олеатного комплекса 57Fe(III) 1.294 ммоль олеата натрия растворяли в смеси 10 мл деионизированной воды, 10 мл этанола и 20 мл гексана. Затем 0.432 ммоль 57FeCl3 добавили к раствору. Полученную реакционную смесь нагревали до кипения и удерживали при данной температуре при интенсивном перемешивании в течение 4 ч. Далее раствор охлаждали, нижний слой отделяли с помощью делительной воронки и трижды промывали деионизированной водой (50 мл). Остатки растворителя удаляли на роторным испарителе.
Для получения НЧ оксида железа смесь 0.432 ммоль комплекса олеата 57Fe(III), 0.05 г олеиновой кислоты, 0.05 г олеата натрия и 5 мл 1-октадецена помещали в трехгорлую колбу 50 мл, снабженную термометром, подводом инертного газа (аргона) и обратным холодильником. Смесь нагревали до 140°C в токе аргона при непрерывном перемешивании (4000 об./мин–1) на магнитной мешалке и удерживали при данной температуре в течение 1 ч. Далее реакционную смесь нагревали до температуры кипения со скоростью 4°C/мин–1 и удерживали при данной температуре в течение 30 мин. К полученному раствору после охлаждения до комнатной температуры добавляли 20 мл изопропанола, после чего НЧ отделяли от раствора при помощи ультрацентрифугирования (14 000 об./мин–1) и диспергировали в гексане. Для получения стабильного водного коллоида частиц их поверхность модифицировали сополимером Pluronic F-127. 1 мл раствора НЧ в гексане с концентрацией по железу [57Fe] = 4.0 мг мл–1 смешивали с 4 мл водного раствора Pluronic F-127 (4 мг мл–1) и обрабатывали ультразвуком 30 мин. Частицы, покрытые Pluronic F-127, выделяли из образовавшейся эмульсии при помощи ультрацентрифугирования (14 000 об./мин–1 в течение 20 мин) и ресуспендировали в деионизированной воде. Описанную процедуру повторяли трижды для полной очистки НЧ. Расчетное содержание изотопа 57Fe в МНЗ-2 составило не менее 96%.
Характеризация МНЗ. Морфология и размер неорганического “ядра” полученных частиц устанавливали с использованием метода просвечивающей электронной микроскопии. Исследования проводили на микроскопе JEOL JEM-1400. Средний размер НЧ устанавливали с использованием программного обеспечения ImageJ. После стабилизации синтезированных образцов МНЗ измеряли их гидродинамический размер методом динамического светорассеяния с использованием прибора Malvern Zetasizer Nano ZS. Цитотоксичность синтезированных МНЗ в форме коллоидов проанализировали на клеточной линии рака молочной железы мыши.
Исследование биодеградации. Исследования проводили на клеточной линии 4T1, на которой ранее была проведена оценка цитотоксичности полученных МНЗ. Клетки культивировали в среде RPMI-1640 с добавлением 10% FBS и 2 ммоль L-глютамина при 37°С во влажной камере при 5%-ной CO2-атмосфере. Клеточные образцы с МНЗ-1 и МНЗ-2 были подготовлены в ходе аналогичной процедуры, описанной далее. Клетки высевали в Т74 культуральные матрасы в концентрации 60 000 клеток/мл и культивировали 48 ч. После этого культуральную среду сливали из матрасов и заменяли новой порцией, содержащей обогащенные по изотопу 57Fe частицы в концентрации 60 мкг/мл. Затем клетки инкубировали в течение 72 ч при 37°С и 5%-ной CO2-атмосфере с наложением слабого магнитного поля под матрасом (0.2 кЭ) с целью повышения эффективности поглощения частиц клетками в результате клеточного захвата [27]. После инкубации клетки открепляли с применением TrypLE, тщательно промывали PBS 4–5 раз, каждый раз центрифугируя с целью удаления частиц-зондов, не попавших в клетки. После этого клетки собирали, высушивали с помощью вакуумного роторного испарителя и размещали в ампулы для дальнейших исследований на спектрометре. В качестве контрольных образцов были подготовлены ампулы с порошком высушенных на испарителе МНЗ обоих типов. Полученные клеточные образцы с частицами-зондами и контрольные образцы частиц исследовали методами мессбауэровской спектроскопии.
Мессбауэровская спектроскопия. Мессбауэровские спектры всех образцов измеряли при комнатной температуре и температуре жидкого азота в геометрии движущегося поглотителя на спектрометре MС-1104Em. Среднее время набора спектров составляло около суток. Для проверки стабильности измерений на другом канале регистрации измеряли эталонный поглотитель α-Fe. В качестве источника гамма-квантов использовали 57Co(Rh) активностью 2 мКи. Изомерные сдвиги определяли относительно линии поглощения α-Fe. Анализ всех мессбауэровских спектров проводили в рамках многоуровневой модели релаксации, разработанной для случая двух подрешеток с обменным взаимодействием ферримагнитного типа, каждой из которых соответствует свой парциальный спектр, а также с учетом комбинированного магнитного дипольного и электрического квадрупольного сверхтонкого взаимодействия [19, 25, 26].
РЕЗУЛЬТАТЫ
Из полученных микрофотографий был сделан вывод, что синтезированные МНЗ-2 в значительной степени обладают стержневидной формой, что говорит о высокой полидисперсности образца, в то время как образец МНЗ-1 обладает узким распределением по размеру. Средний размер “ядра” частиц составил для МНЗ-1 и МНЗ-2 порядка 12 ± 1.5 и 21 ± 10 нм соответственно. Значение среднего гидродинамического размера составило для МНЗ-1 порядка 50 нм. Средний гидродинамический размер НЧ в водном растворе после покрытия сополимером Pluronic F-127 составил 140 нм. Такое высокое значение гидродинамического размера обусловлено тем, что данный сополимер относится к мицеллообразующим. По результатам цитотоксического исследования установлены следующие допустимые концентрации нанозондов: 180 мкг/мл для МНЗ-1 и не менее 70 мкг/мл для более крупных МНЗ-2.
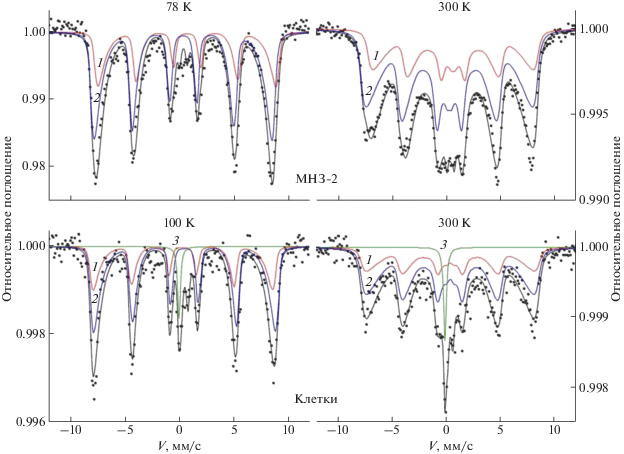
Основная часть работы связана с изучением возможной биодеградации МНЗ в in vitro-исследовании. Для полученных МНЗ-1 и МНЗ-2 были исследованы изменения формы их мессбауэровских спектральных линий в результате пребывания частиц внутри живых клеток в течение 5 дней. На рис. 1 представлены результаты исследования частиц-зондов, стабилизированных цитрат-ионами. Сверху представлены порошковые спектры частиц, измеренные при температуре жидкого азота и при комнатной температуре. Ниже представлены спектры образца лиофилизированных 4Т1 клеток, которые 120 ч инкубировались с данным типом частиц. Спектры измерены в аналогичных условиях. Форма линий спектров качественно отражает стандартное поведение ансамбля НЧ оксида железа с магнитной анизотропией. Анализ спектров показывает, что длительное (120 ч) пребывание частиц внутри клеточной культуры практически не повлияло на форму спектральных линий МНЗ-1 (табл. 1). Схожая картина наблюдается в случае МНЗ-2, спектры которого представлены на рис. 2, однако с некоторыми отличиями – появление ярко выраженного синглета в образце частиц, прошедших этап инкубации в клетках. Данный синглет фигурирует как в низкотемпературном спектре, так и в спектре при комнатной температуре. Характерный химический сдвиг порядка –0.1 мм/с при комнатной температуре и характер синглета, не свойственный биологическим формам железа, дают основание полагать, что в клеточный образец с МНЗ-2 могла попасть посторонняя примесь, например стружка нержавеющей стали, имеющая схожие мессбауэровские параметры с наблюдаемым синглетом. Окончательная природа данного синглета не установлена. Тем не менее как в случае МНЗ-1, так и в случае МНЗ-2 не наблюдается трансформаций спектра, характерных для изменений, связанных с процессами биодеградации НЧ в организме. Так, ранее наблюдались заметные изменения в спектрах частиц, стабилизированных декстраном, уже через час после их введения в организм млекопитающих [23, 28]. По всей видимости, столь быстрые изменения свойств ансамбля частиц связаны с изменением характера межчастичного взаимодействия вследствие разрушения полимерного стабилизирующего покрытия частиц, поскольку в случае НЧ, покрытых декстраном, они локально связаны дипольным взаимодействием. В процессе биодеградации покрытие разрушается, что приводит к высвобождению отдельных частиц и повышению частоты релаксации вектора намагниченности. В результате в спектрах, измеренных при комнатной температуре, наблюдается характерная трансформация секстета в дублет [27]. При этом в силу своей суперпарамагнитной природы, при достаточно низких температурах компонента спектра отдельных НЧ восстанавливает свою сверхтонкую структуру. Другой механизм трансформации сверхтонкой структуры спектральных линий НЧ в живых организмах связан с непосредственной биодеградацией неорганического ядра и образованием в результате парамагнитных форм эндогенного железа, преимущественно железосодержащих белков [21, 24]. Для данного процесса также характерна трансформация в спектре частиц секстета в дублет, который сохраняет свою форму при температурах 300 и 78 K. В случае биодеградации частиц в организмах млекопитающих интенсивность дублета нарастает со временем и становится значительной уже после нескольких дней их пребывания в организме.
Рис. 1.
57Fe-мессбауэровские спектры МНЗ-1 на основе оксида железа, стабилизированных цитрат-ионами. Представлены спектры исходных частиц и частиц после их 5-дневной in vitro-инкубации в клетках линии 4Т1; 1, 2 – парциальные секстеты от магнитных подрешеток А и В.
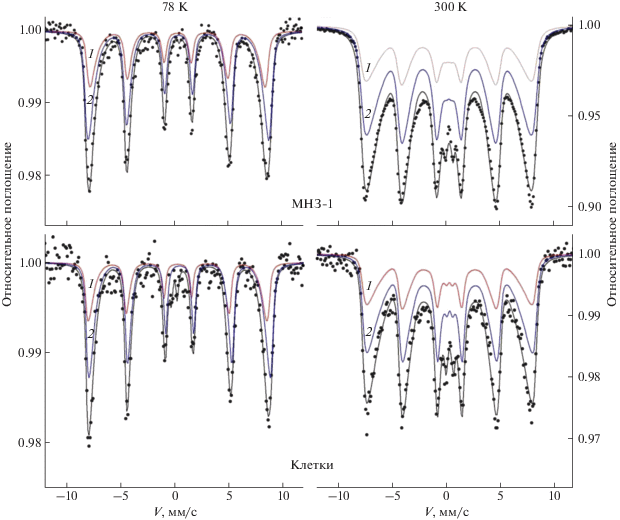
Таблица 1.
Параметры сверхтонкого взаимодействия исходных образцов МНЗ-1 и образцов МНЗ-1 после их пятидневной инкубации в клеточной культуре
| Образец | МНЗ-1 | Клетки | |||
|---|---|---|---|---|---|
| Температура | T, K | 296 | 78 | 296 | 78 |
| Секстет 1 (подрешетка А) |
δ1, мм/с | 0.66 ± 0.02 | 0.72 ± 0.01 | 0.5 ± 0.1 | 0.58 ± 0.06 |
| q1, мм/с | 0.16 ± 0.03 | 0.22 ± 0.02 | 0.16 ± 0.04 | 0.14 ± 0.08 | |
| Hhf1, T | 49.2 ± 0.1 | 53.2 ± 0,2 | 51.6 ± 0.9 | 54.2 ± 0.9 | |
| Секстет 2 (подрешетка В) |
δ2, мм/с | 0.291 ± 0.006 | 0.366 ± 0.006 | 0.24 ± 0.04 | 0.39 ± 0.03 |
| Hhf2, T | 50.98 ± 0.06 | 53.2 ± 0.1 | 51.7 ± 0.5 | 54.3 ± 0.7 | |
| KV, K | 598 ± 3 | 560 ± 2 | 540 ± 20 | 670 ± 20 | |
Рис. 2.
57Fe-мессбауэровские спектры МНЗ-2. Представлены спектры исходных частиц и частиц после их 5-дневной in vitro-инкубации в клетках линии 4Т1; 1, 2 – парциальные вклады от ферримагнитных подрешеток А и В, 3 – синглет неустановленной природы.
Таким образом, в случае обоих образцов полученных частиц в клеточных спектрах не наблюдается значительных изменений, в том числе характерных для процессов биодеградации. Несмотря на то что МНЗ-2, стабилизированные Pluronic F-127, образуют мицеллярные структуры и поэтому должны быть связаны дипольным взаимодействием, их длительное пребывание в клетках не привело к характерной релаксационной трансформации спектра. Это может объясняться как крупным размером ядра данного типа частиц, так и устойчивостью к in vitro-биодеградации покрытия Pluronic F-127. В спектрах обоих типов частиц также отсутствует дублет, характерный для парамагнитных форм эндогенного железа. Следовательно, на уровне отдельных клеток процессы биодеградации магнитных частиц практически не протекают, либо протекают в значительно более низком темпе, чем в организме млекопитающего.
Тем не менее отметим заметный признак взаимодействия МНЗ-2 с клеточной культурой (табл. 2). Мессбауэровские спектры клеток после введения МНЗ-2 демонстрируют незначительное содержание двухвалентного железа, что выражается в малом химическом сдвиге компоненты B-подрешетки и форме линий спектра, близкой к симметричной (не считая синглета). Такой эффект может быть объяснен активным окислением двухвалентного железа в составе частиц магнетита внутри клеток в результате реакции Фентона [29].
Таблица 2.
Параметры сверхтонкого взаимодействия исходных образцов МНЗ-2 и образцов МНЗ-2 после их пятидневной инкубации в клеточной культуре
| Образец | МНЗ-2 | Клетки | |||
|---|---|---|---|---|---|
| Температура | T, K | 296 | 78 | 296 | 100 |
| Секстет 1 (подрешетка А) |
δ1, мм/с | 0.34 ± 0.01 | 0.28 ± 0.008 | 0.3 ± 0.02 | 0.3 ± 0.04 |
| q1, мм/с | 0.19 ± 0.01 | 0.14 ± 0.03 | 0.22 ± 0.02 | 0.1 ± 0.08 | |
| Hhf1, T | 51.25 ± 0.05 | 53.54 ± 0.03 | 50.5 ± 0.9 | 53.3 ± 0.9 | |
| Секстет 2 (подрешетка В) |
δ2, мм/с | 0.35 ± 0.05 | 0.526 ± 0.004 | 0.34 ± 0.09 | 0.5 ± 0.02 |
| Hhf2, T | 51.17 ± 0.04 | 54.13 ± 0.05 | 50.5 ± 0.5 | 54.3 ± 0.7 | |
| KV, K | 793 ± 3 | 694 ± 8 | 710 ± 6 | 824 ± 8 | |
Также отметим, что вероятность эффекта резонансного поглощения на клеточном образце с более мелкими МНЗ-1 превосходит вероятность эффекта на образце клеток с МНЗ-2, имеющими гидродинамический размер порядка 140 нм, при том, что на этапе инкубации частиц в клетках они были добавлены в одинаковой исходной концентрации. По всей видимости, это связано с тем, что крупные частицы с меньшим успехом способны попадать внутрь клеток в ходе эндоцитоза, в результате чего в клетки с образцом МНЗ-2 проникло меньшее количество экзогенного изотопа 57Fe.
ЗАКЛЮЧЕНИЕ
Синтезированы два типа магнитных НЧ различного размера с измененным изотопным составом по 57Fe. Данные частицы были проанализированы in vitro на предмет биосовместимости и устойчивости к биодеградации в клеточной культуре. Установлено, что оба типа частиц в условиях инкубации с клетками за 120 ч практически не претерпевают характерных для процессов биодеградации изменений, что позволяет говорить об устойчивости полученных частиц к разложению в in vitro. Таким образом, оба типа частиц являются пригодными для использования в качестве зондов для мессбауэровских исследований живых организмов. В ходе исследования на примере МНЗ-2 было установлено, что НЧ магнетита, даже покрытые полимерным стабилизирующим покрытием, активно окисляются в клетках.
Работа выполнена при частичной поддержке Российского фонда фундаментальных исследований (грант № 18-32-20166, 19-02-00966) в части синтеза; в рамках Государственного задания ФТИАН им. К.А. Валиева РАН Минобрнауки РФ по теме №0066-2019-0004.
Список литературы
Einstein A. // Annalen der physik. 1905. V. 322. № 8. P. 549.
Höfling F., Franosch T. // Reports on Prog. Phys. 2013. V. 76. № 4. P. 046602.
Dix J.A., Verkman A.S. // Annu. Rev. Biophys. 2008. V. 37. P. 247.
Fulton A.B. // Cell. 1982. V. 30. № 2. P. 345.
Ellis R.J., Minton A.P. // Nature. 2003. V. 425. № 6953. P. 27.
Saxton M.J. // J. Chem. Phys. 2002. V. 116. № 1. P. 203.
Weiss M. // Phys. Rev. E. 2003. V. 68. № 3. P. 036213.
Weiss M., Nilsson T. // Trends Cell Biology. 2004. V. 14. № 5. P. 267.
Schnell S., Turner T.E. et al. // Progress Biophys. Mol. Biol. 2004. V. 85(2-3). P. 235.
Ando T., Skolnick J. // Proc. Nat. Ac. Sci. 2010. V. 107. № 43. P. 18457.
Novak I.L., Kraikivski P., Slepchenko B.M. et al. // Biophys. J. 2009. V. 97. № 3. P. 758.
Minton A.P. // J. Cell Sci. 2006. V. 119. № 14. P. 2863.
Norregaard K., Metzler R., Ritter C. M. et al. // Chem. Rev. 2017. V. 117. № 5. P. 4342.
Di Rienzo C., Piazza V., Gratton E. et al. // Nature Commun. 2014. V. 5. P. 5891.
Yamada S., Wirtz D., Kuo S. C. et al. // Biophys. J. 2000. V. 78. № 4. P. 1736.
Tseng Y., Lee J.S., Kole T.P. et al. // J. Cell Sci 2004. V. 117. № 10. P. 2159.
Guigas G., Kalla C., Weiss M. et al. // Biophys. J. 2007. V. 93. № 1. P. 316.
Landers J., Salamon S., Remmer H. et al. // Nano Lett. 2016. V. 16. № 2. P. 1150.
Чуев М.А., Черепанов В.М., Поликарпов М.А. и др. // Письма в ЖЭТФ. 2018. Т. 108. С. 57.
Dziedzic-Kocurek K., Fornal P., Stanek J. // Nukleonika. 2015. V. 60. P. 19.
Feliu N., Docter D., Heine M. et al. // Chem. Soc. Rev. 2016. V. 45. № 9. P. 2440.
Lévy M., Lagarde, Maraloiu V. A. et al. // Nanotechnology. 2010. V. 21. № 39. P. 395103.
Polikarpov D., Cherepanov V., Chuev M. et al. // Hyp. Int. 2014. V. 226(1–3) P. 421.
Polikarpov D., Gabbasov R., Cherepanov V. et al. // J. Magn. Magn. Mater. 2015. V. 380. P. 78.
Jones D.H., Srivastava K.K.P. // Phys. Rev. B. 1986. V. 34. P. 7542.
Chuev M.A. // JETP. 2012. V. 114. № 4. P. 609.
Mykhaylyk O., Antequera Y.S., Vlaskou D., Plank C. // Nature Protocols. 2007. V. 2. № 10. P. 2391.
Mischenko I.N., Chuev M.A., Cherepanov V.M. et al. // Hyp. Int. 2012. V. 206 (1–3). P. 105.
Gabbasov R.R., Polikarpov M.A. Cherepanov V.M. et al. // Hyp. Int. 2012. V. 206. P. 71.
Klein S., Sommer A., Distel L. et al. // Biochem. Biophys. Res. Comun. 2012. V. 425. № 2. P. 393.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография


