Кристаллография, 2021, T. 66, № 3, стр. 494-502
Рост из растворов и поверхностные свойства кристаллов антрацена
В. А. Постников 1, *, А. А. Кулишов 1, М. С. Лясникова 1, **, А. А. Островская 1, А. С. Степко 1, П. В. Лебедев-Степанов 1
1 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
* E-mail: postva@yandex.ru
** E-mail: mlyasnikova@yandex.ru
Поступила в редакцию 13.07.2020
После доработки 14.09.2020
Принята к публикации 16.09.2020
Аннотация
Представлены исследования влияния различных растворителей на рост из растворов кристаллов антрацена и их морфологическое качество. Методом висячей капли установлена зависимость поверхностного натяжения растворов антрацена в толуоле от концентрации антрацена в условиях, близких к условиям роста кристаллов на межфазной границе раствор–воздух в атмосфере, насыщенной парами растворителя и осадителя. Значения поверхностной энергии граней (100), (010) и (001) кристалла антрацена рассчитаны методом атомного силового поля OPLS, основываясь на структурных данных. Экспериментально с помощью измерения контактного угла смачивания каплей воды наиболее развитой грани (001) кристаллов получена оценка поверхностной энергии ${{\sigma }}_{{001}}^{V}$ на границе с воздухом. На основе полученных данных о поверхностной энергии проведен термодинамический анализ параметров зародышеобразования кристаллов антрацена на межфазной границе раствор–воздух.
ВВЕДЕНИЕ
Развитие методов роста кристаллических пленок или пластин на основе органических сопряженных молекул представляет большой интерес для органической электроники и фотоники [1]. Для получения крупных монокристаллических образцов наиболее привлекательными с точки зрения простоты и обеспечения визуального контроля в ходе эксперимента являются методы роста кристаллов из растворов [2–5]. Также растворные техники роста перспективны для развития технологии формирования ультратонких монокристаллических пленок больших размеров на основе сопряженных полупроводниковых молекул непосредственно на подложках в условиях медленного высыхания растворителя [5, 6]. Как показывают многочисленные исследования, склонность к формированию тонкопленочных кристаллов или пластин на межфазной границе раствор–воздух – особенность, присущая линейным сопряженным молекулам, кристаллы которых сформированы в виде стопки молекулярных монослоев с “паркетно-елочным” типом упаковки [4, 7–11]. Между данными мономолекулярными слоями имеет место наиболее слабое когезионное взаимодействие, определяющее минимум поверхностной энергии соответствующей грани, а в конечном счете характерную 2D-анизотропию роста кристаллов [12]. Качество поверхности кристаллических пленок или пластин играет решающую роль при разработке оптоэлектронных устройств, таких как полевой транзистор [13]. Для кристаллических пленок, формируемых на границе раздела раствор–воздух, морфология поверхности определяется контактной средой: верхняя грань, контактирующая в процессе роста с паровой фазой (не смачиваемая раствором), как правило, более гладкая в отличие от противоположной грани, смачиваемой раствором [4, 8]. Как показывают исследования, применение того или иного растворителя также может оказывать серьезное влияние на морфологию выращиваемых органических кристаллов [3, 9, 14, 15]. Однако влияние природы растворителя на качество поверхности формируемых органических кристаллов в целом вопрос еще малоизученный.
Антрацен известен как хороший органический сцинтиллятор, монокристаллы которого обладают высоким световыходом и поэтому используются в качестве люминесцентного стандарта [16–18]. Высокая прозрачность и широкая запрещенная зона (3.1 эВ) кристаллов представляют интерес для разработки нелинейных оптоэлектронных приложений [19]. Доступность и термическая стабильность антрацена при комнатных температурах позволяют тщательно изучить его физико-химические свойства, а также задействовать в качестве модельного объекта в исследованиях роста кристаллов как в нормальных условиях [3, 15, 20], так и в сверхкритическом состоянии растворителя [21]. Высокая симметрия молекул антрацена и наглядная картина кристаллической упаковки способствуют развитию обстоятельных модельных представлений об энергетике межмолекулярных взаимодействий и поверхностных свойствах кристаллов [22, 23].
В данной работе представлены результаты исследований особенностей роста из растворов кристаллов антрацена в ряде растворителей и их поверхностные свойства. Получена оценка поверхностной энергии граней кристалла антрацена методом атомного силового поля OPLS [24, 25]. Известно несколько работ [22, 26–28] о моделировании поверхностных свойств кристалла антрацена. Отметим, что значения поверхностной энергии соответствующих граней в представленных работах серьезно разнятся между собой. На основе полученных сведений о поверхностных свойствах кристалла антрацена и его насыщенного раствора в толуоле проведен анализ изменения свободной энергии Гиббса при образовании кристаллического зародыша на границе раздела фаз раствор–воздух [7]. Подобные исследования для кристаллов п-терфенила представлены в [10].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы. Для выращивания кристаллов использован антрацен производства Sigma-Aldrich (99%). В качестве растворителей использовали толуол (ОСЧ), бензол (ЧДА), н-гексан (ОСЧ), а в качестве осадителей – сольватофобные спирты: метанол (ХЧ), этанол (ХЧ), изопропанол (ЧДА) и бутанол-1 (ЧДА).
Рост кристаллов. Для получения кристаллических пластинок антрацена применяли метод роста из раствора “растворитель–осадитель”, в котором обеспечивается условие медленной диффузии осадителя из паровой фазы через границу раздела фаз в раствор [3, 4, 7]. Рост кристаллов происходил как на межфазной границе жидкость–воздух, так и на дне сосуда. В процессе приготовления растворов для полного растворения вещества применяли обработку в ультразвуковой ванне ПСБ-2835-05. После охлаждения до комнатной температуры раствор фильтровали с помощью одноразового ПТФЭ-фильтра (ПТФЭ – политетрафторэтилен) с порами диаметром 0.45 мкм и заливали в стеклянный мерный стакан объемом 50 мл, который далее размещали внутри герметичной стеклянной ростовой камеры с предварительно налитым на дно осадителем. Затем камеру с раствором антрацена выдерживали в термостате при 20°С и по окончании ростового периода в объеме раствора обнаруживали несколько крупных кристаллических пластинок (рис. 1а).
Рис. 1.
Кристаллы антрацена под УФ-освещением (а) и их конфокальные изображения поверхности (б–г): б – краевой участок с гладкой поверхностной морфологией, в – ямки травления на краевом участке кристалла, г – ростовой холмик конической формы.

Оптическая микроскопия. Морфологию кристаллических пленок и их толщину изучали с помощью лазерного сканирующего конфокального микроскопа Olympus LEXT OLS 3100.
Рентгеноструктурный анализ. Структуру крупных монокристаллических пластинок антрацена исследовали на порошковом рентгеновском дифрактометре Miniflex 600 (Rigaku, Япония). Излучение CuKα, λ = 1.54178 Å. Скорость записи 2 град/мин. Предварительно кристаллические образцы были приклеены на кварцевую подложку, и рентгенодифракционное отражение фиксировалось от плоской поверхности кристаллов.
Поверхностные свойства растворов и кристалла. Исследования поверхностного натяжения растворов и краевого угла смачивания проведены на оптическом приборе OCA 15EC при 20°С. Поверхностное натяжение насыщенного раствора антрацена в толуоле определяли методом висячей капли. Во избежание интенсивного испарения каплю раствора объемом 4–5 мкл выдавливали внутрь небольшой герметичной кварцевой кюветы с прозрачными стенками. Поверхностное натяжение капли насыщенного раствора было также определено в условиях атмосферы, насыщенной парами изопропилового спирта, который предварительно наливали на дно кварцевой кюветы. Определение поверхностной энергии ${{\sigma }}_{{001}}^{V}$ проведено на ряде кристаллов только для наиболее развитой грани (001) с помощью модифицированного уравнения Юнга с использованием экспериментально измеренных значений краевого угла смачивания θ001 дистиллированной водой [29]:
(1)
$\cos {{\theta }_{{001}}} = - 1 + 2{{(\sigma _{{001}}^{V}\sigma _{W}^{d})}^{{1/2}}}{\text{/}}{{\sigma }_{W}},$МЕТОДИКА РАСЧЕТА ПОВЕРХНОСТНОЙ ЭНЕРГИИ КРИСТАЛЛА
Поверхностную энергию граней кристалла антрацена рассчитывали методом атомного силового поля OPLS [10, 24, 25]. В расчетах использовали рентгеноструктурные данные [31] о взаимном расположении молекул в кристалле, а также о положении атомов в молекуле, на основе чего были построены параллельные молекулярные бислои, лежащие в одной из трех кристаллографических плоскостей (001), (010) или (100), содержащие по нескольку десятков молекул. Определяли полную ван-дер-ваальсову энергию ориентированного бислоя Uhkl, далее аналогично вычисляли энергию идентичных монослоев, составляющих бислой, U1hkl. Энергия связи бислоев равна ΔUhkl = = Uhkl – 2U1hkl. В модели принято, что положительно определенная энергия когезии равна –ΔUhkl, а поверхностная энергия равна отношению энергии когезии к удвоенной площади монослоя [30]:
РЕЗУЛЬТАТЫ
Рост кристаллов из растворов и их поверхностная морфология. Проведена серия опытов по выращиванию кристаллов из растворов с использованием ряда растворителей и осадителей (табл. 1). Ростовые характеристики кристаллов представлены в табл. 1. При выращивании из растворов толуола и бензола образование и рост кристаллов происходили на границе раздела раствор–воздух, но по мере увеличения размеров кристаллы проседали и формировались на дне ростового сосуда. В процессе роста кристаллы в течение нескольких суток достигали размеров, сравнимых с диаметром кристаллизатора. Средняя скорость роста, как правило, была наибольшей при использовании низкокипящих осадителей – метанола и этанола (табл. 1), однако морфологическое качество у таких кристаллов не высоко: округленная форма граней и множество паразитных кристаллов на поверхности, контактирующей в процессе роста с раствором. Кристаллы антрацена с наилучшим морфологическим качеством (гладкая поверхность, отсутствие мелких кристалликов – паразитов, наличие огранки) получены из растворов толуола с использованием осадителей изопропанола и бутанола-1 (рис. 1а, 1б). На рис. 1а представлены образцы пластинчатых кристаллов, выращенные из толуола в парах изопропанола в течение 9 сут. Значения внутренних углов между боковыми гранями кристаллов в основном составляют ~109.5° и 125.5°. Размер наибольшего образца достигал 29 мм в длину и 600 мкм в толщину. Для данных кристаллов в целом характерно наличие сравнительно гладкой поверхности, как, например, можно видеть на конфокальном изображении на рис. 1б. Однако на определенных участках можно было наблюдать систему ямок травления, плотность которых при переходе от края кристалла к центральной части стремительно снижается. В качестве примера на рис. 1в представлено конфокальное изображение краевого участка, на котором в области края (пунктирный квадрат 1) плотность ямок nD ~ 1 × 109 м–2, а в области, выделенной пунктирным квадратом 2, – nD ~ 0.3 × 109 м–2. Можно отметить наличие на поверхности кристаллов крупных единичных холмиков роста конической формы (рис. 1г). Наличие ямок травления и холмиков роста на поверхности грани (001) указывает на дислокационный механизм роста кристаллов.
Таблица 1.
Характеристики роста кристаллов антрацена из растворов и краевой угол смачивания θ грани (001)
| Растворитель | Осадитель | T, сут | С0, г/л | Lm, мм | Hm, мкм | V(010), мм/ч | Λ | θ, град |
|---|---|---|---|---|---|---|---|---|
| Толуол | Метанол | 1 | 10 | 12 | 60 | 0.50 | + | |
| Этанол | 2 | 10 | 17 | 150 | 0.35 | + | 99.4 ± 0.4 | |
| Изопропанол | 9 | 10 | 29 | 600 | 0.13 | + | 89.7 ± 0.3 | |
| Бутанол-1 | 2 | 10 | 10 | 130 | 0.21 | + | ||
| Испарение растворителя | 10 | 12 | 5 | 0.02 | ||||
| Бензол | Метанол | 2 | 10 | 8 | 190 | 0.17 | + | 98.5 ± 0.2 |
| Этанол | 2 | 10 | 22 | 230 | 0.46 | + | 100 ± 1 | |
| Бутанол-1 | 2 | 10 | 7 | 125 | 0.15 | + | 97.4 ± 0.2 | |
| н-гексан | Этанол | 1 | 1 | 2 | 10 | 0.08 | ||
| Бутанол-1 | 1 | 1 | 0.5 | 6 | 0.02 |
Из раствора н-гексана образования кристаллов на поверхности раздела фаз не наблюдалось. В данном случае мелкие кристаллы низкого качества в значительном количестве формировались на дне раствора.
Также для сравнения проведены исследования по росту кристаллов из раствора толуола методом медленного изотермического испарения растворителя через тонкое отверстие (~1 мм) в крышке ростовой виалы. В процессе роста на стенках сосуда и на дне отмечается образование большого количества кристалликов. В данном случае средняя скорость роста наиболее крупных кристаллов, как видно из табл. 1, была наименьшей. Кристаллические образцы формировались ограненными, однако на их поверхности наблюдалось большое количество мелких паразитных кристалликов.
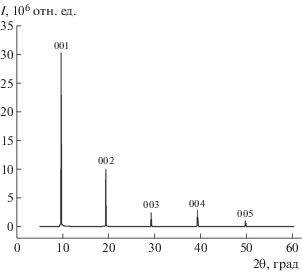
Рентгеноструктурный анализ и кристаллическая структура. Рентгеновская дифрактограмма монокристаллической пластинки, полученная при отражении от основной грани кристалла, приведена на рис. 2. Спектр дифракционных рефлексов представляет собой набор узких пиков, положение которых приблизительно кратно положению первого максимума при 2θ1 ≈ 9.64°. Согласно данным монокристального эксперимента [31] наблюдаемая дифракционная картина соответствует отражению от семейства плоскостей (00l). Расчет межплоскостного расстояния по уравнению Вульфа–Брэгга для первого максимума дает значение толщины мономолекулярного слоя h001 = 0.917 нм в ориентации (001).
Кристаллическая структура антрацена состоит из стопки эквивалентных монослоев в ориентации (001), внутри которых молекулы упакованы в “паркетно-елочном” порядке (рис. 3а). Анизотропия роста кристаллов обусловлена анизотропией межмолекулярных связей. Наиболее сильные связи соответствуют боковым взаимодействиям между молекулами внутри монослоев (00l) в направлениях [100], [010], [110]. В данных направлениях скорость роста кристаллов антрацена наиболее высокая. Взаимодействие между соседними монослоями (00l) осуществляется за счет более слабых торцевых контактов между молекулами. Таким образом, среди плоскостей с низкими индексами поверхностная энергия грани (001) в кристалле является минимальной, что обусловливает наиболее низкую нормальную скорость роста кристаллов в данном направлении. Между геометрией упаковки молекул внутри “паркетно-елочных” слоев и габитусом кристаллов антрацена не трудно установить соответствие. Выделим внутри монослоя (001) компактный шестиугольный кластер молекул, ограниченный плоскостями (100), (110), ($\bar {1}$10), ($\bar {1}$00), ($\bar {1}$$\bar {1}$0) и (1$\bar {1}$0) (рис. 3а). Внутренние углы между гранями данного кристаллического прообраза имеют значения 125.12° и 109.76°. Таким образом, опираясь на схематическую структурную модель на рис. 3а, по известным внутренним углам кристаллических образцов можно установить кристаллографическую ориентацию боковых граней (рис. 3б).
Рис. 3.
Схематическая модель компактного кластера молекул антрацена в кристалле внутри слоя (001) (а) и оптическое изображение фрагмента кристалла антрацена (б).

Поверхностные свойства. На рис. 4 представлены экспериментальные значения поверхностного натяжения ${{{{\sigma }}}_{{LV}}}$ растворов антрацена с различной концентрацией в толуоле, измеренные методом висячей капли, выдавливаемой внутрь кварцевой герметичной кюветы. Черными точками отмечены значения ${{{{\sigma }}}_{{LV}}}$ для атмосферы, насыщенной только парами толуола, а полыми точками – значения поверхностного натяжения в атмосфере, насыщенной кроме того парами изопропанола, что приблизительно соответствует условию среды на границе раздела раствор–воздух в методе роста “растворитель–осадитель”. В сравнении с соответствующими значениями, определенными для открытой капли (табл. 2), поверхностное натяжение капель толуола в небольшом объеме, насыщенном собственным паром, заметно ниже. Как видно из рис. 4, наличие паров изопропанола в атмосфере кюветы приводит к снижению величины ${{{{\sigma }}}_{{LV}}}$ в пределах 4% от исходных значений. Крайние справа точки на графике соответствуют концентрации насыщенного раствора при 20°С (С0 = 12 г/л).
Рис. 4.
Зависимость поверхностного натяжения капли раствора антрацена в толуоле в насыщенных парах толуола (черные точки) и смеси насыщенных паров толуола и изопропанола (полые точки) (20°С).
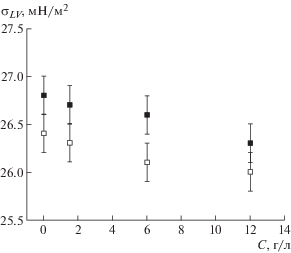
Таблица 2.
Поверхностные свойства растворов толуола и кристалла антрацена (20°С)
| ${{\sigma }}_{1}^{{}}$ | ${{\sigma }}_{2}^{{}}$ | ${{\sigma }}_{{LV}}^{1}$ | ${{\sigma }}_{{LV}}^{2}$ | ${{\sigma }}_{{100}}^{V}$ | ${{\sigma }}_{{010}}^{V}$ | ${{\sigma }}_{{001}}^{V}$ | |
|---|---|---|---|---|---|---|---|
| эксп. | эксп. | эксп. | эксп. | расч. | расч. | расч. | эксп. |
| 29.1 | 21.8 | 26.3 | 25.9 | 74.9 | 80.4 | 70.9 | 49 ± 7 |
| 28.5 [32] | 21.7 [32] | 111–120 [21] | 129–151 [21] | 81.5–96.9 [21] | |||
| 100 [26] | 115 [26] | 81 [26] | |||||
| 65.6 [27] | 91.2 [27] | 52.8 [27] | |||||
| 88 [28] | 117.5 [28] | 75.7 [28] | |||||
Примечание. ${{\sigma }}_{1}^{{}}$ и ${{\sigma }}_{2}^{{}}$ – поверхностное натяжение (мДж/м2) чистого толуола и изопропанола соответственно (измерение проведено на открытых каплях); ${{\sigma }}_{{LV}}^{1}$ и ${{\sigma }}_{{LV}}^{2}$ – поверхностное натяжение насыщенного раствора толуола в воздухе, насыщенном парами толуола и смеси паров толуола и изопропанола соответственно; поверхностная энергия ${{\sigma }}_{{hkl}}^{V}$ граней кристалла антрацена (мДж/м2), рассчитанная методом OPLS и определенная экспериментально для ${{\sigma }}_{{001}}^{V}$.
В табл. 2 представлены данные по поверхностным свойствам растворов и расчетные значения поверхностной энергии граней кристалла антрацена вместе с данными [22, 26–28, 32]. Как видно из табл. 2, определенные в настоящей работе значения поверхностной энергии ${{\sigma }}_{{hkl}}^{V}$ по методу OPLS коррелируют с литературными данными относительно максимального и минимального значений для граней (010) и (001) соответственно. В ходе экспериментов установлено, что на поверхности кристаллов антрацена капля насыщенного раствора толуола практически полностью растекается (контактный угол смачивания θ ≈ 0). Для грани (001) также представлено среднее значение поверхностной энергии ${{\sigma }}_{{001}}^{V}$, определенное по методу контактного угла смачивания каплей воды с помощью выражения (1) (значения контактных углов смачивания θ для грани (001) кристаллов, выращенных в различных условиях, приведены в табл. 1). Как видно из табл. 2, экспериментальное значение поверхностной энергии ${{\sigma }}_{{001}}^{V}$ реального кристалла значительно ниже, чем рассчитанное для идеальной кристаллической структуры по методу OPLS, но наиболее близко к значению, полученному в [27].
Модель образования зародыша кристалла. Рассмотрим модель плоского кристалла антрацена, образующегося на межфазной границе раствор–воздух при наличии движущей силы кристаллизации в области границы раздела фаз (рис. 5). Для упрощения будем считать, что зародыш представляет собой прямоугольный параллелепипед с толщиной h и квадратным основанием со стороной l. Боковые грани зародыша имеют кристаллографическую ориентацию (100) и (010), а верхняя и нижняя – (001) (рис. 5). Для обеспечения флотации зародыша на поверхности жидкой фазы необходимо, чтобы его верхняя грань (001) не смачивалась (контакт с газовой средой). При этом боковые грани смачиваются раствором. В соответствии с рассматриваемой геометрией кристаллического зародыша запишем изменение свободной энергии Гиббса при его образовании на границе раздела раствор–воздух [7, 10]:
(2)
$\begin{gathered} \Delta G = - \left( {\frac{{l_{{}}^{2}h}}{\Omega }} \right)\Delta {{\mu }} + ({{\sigma }}_{{001}}^{V} + {{\sigma }}_{{001}}^{{SL}} - {{{{\sigma }}}_{{LV}}})l_{{}}^{2} + \\ \, + 2({{\sigma }}_{{100}}^{{SL}} + {{\sigma }}_{{010}}^{{SL}})lh, \\ \end{gathered} $(3)
$\frac{h}{l} = \frac{{({{\sigma }}_{{001}}^{V} + {{\sigma }}_{{001}}^{{SL}} - {{{{\sigma }}}_{{LV}}})}}{{{{\sigma }}_{{100}}^{{SL}} + {{\sigma }}_{{010}}^{{SL}}}}.$(4)
$\begin{gathered} {{l}_{c}} = \frac{{2\Omega }}{{\Delta {{\mu }}}}({{\sigma }}_{{100}}^{{SL}} + {{\sigma }}_{{010}}^{{SL}}), \\ {{h}_{c}} = \frac{{2\Omega }}{{\Delta {{\mu }}}}({{\sigma }}_{{001}}^{V} + {{\sigma }}_{{001}}^{{SL}} - {{{{\sigma }}}_{{LV}}}). \\ \end{gathered} $(5)
${{\sigma }}_{{hkl}}^{{SL}} = {{\sigma }}_{{hkl}}^{V} - {{{{\sigma }}}_{{LV}}}\cos {{{{\theta }}}_{{hkl}}},$(6)
$\frac{{{{h}_{{}}}}}{l} = \frac{{2({{\sigma }}_{{001}}^{V} - {{{{\sigma }}}_{{LV}}})}}{{{{\sigma }}_{{100}}^{V} + {{\sigma }}_{{010}}^{V} - 2{{{{\sigma }}}_{{LV}}}}},$(7)
$\begin{gathered} {{l}_{c}} = \frac{{2\Omega }}{{\Delta {{\mu }}}}({{\sigma }}_{{100}}^{V} + {{\sigma }}_{{010}}^{V} - 2{{{{\sigma }}}_{{LV}}}), \\ {{h}_{c}} = \frac{{4\Omega }}{{\Delta {{\mu }}}}({{\sigma }}_{{001}}^{V} - {{{{\sigma }}}_{{LV}}}). \\ \end{gathered} $Рис. 6.
Зависимость критических размеров зародыша от относительного пересыщения ξ раствора толуола при 20°С (линейные размеры в единицах толщины монослоя h001 = 0.917 нм).

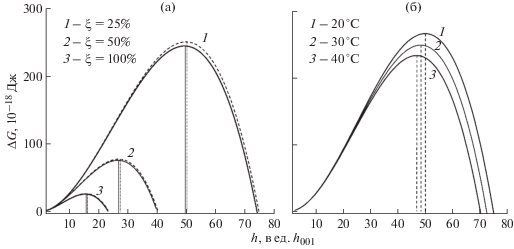
На рис. 7а представлены графики изменения свободной энергии Гиббса в зависимости от толщины зародыша (с учетом соотношения (6)) при различных пересыщениях ξ раствора толуола при 20°С. Максимум функции ΔG определяет работу образования и размеры критического зародыша, устойчивого к дальнейшему росту. Как видно, при увеличении пересыщения от 25 до 100% энергетический барьер для образования зародыша уменьшается почти в 10 раз, а его толщина снижается в 3 раза: от 48 до 16 монослоев (001). Пунктирные кривые на рис. 7a – расчет величин ΔG для поверхностного натяжения ${{\sigma }}_{{LV}}^{2}$ насыщенного раствора толуола в атмосфере со смесью насыщенных паров толуола и изопропанола (табл. 2). Как видно из рисунка, максимум кривых ΔG для соответствующих значений ξ увеличивается относительно исходных значений до 2.5%. На рис. 7б представлены графики зависимости ΔG = f(h) для ξ = 25% при температурах 20, 30 и 40°С. С повышением температуры ростовой среды заметно снижается работа образования зародыша, что означает рост скорости зародышеобразования и, как следствие, ухудшение качества формирующихся кристаллов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Согласно проведенным экспериментам наиболее качественные кристаллы с точки зрения поверхностной морфологии (наличие четкого габитуса, гладкая поверхность граней) формируются в условиях роста из растворов толуола в насыщенных парах изопропанола и бутанола-1. По-видимому, это может быть связано с более низкой скоростью диффузионных процессов паров данных веществ в сравнении с остальными низкокипящими растворителями (бензол, н-гексан) и осадителями (метанол, этанол), что обеспечивает снижение скорости пересыщения раствора и тем самым способствует формированию более совершенной кристаллической структуры.
Как видно из табл. 2, для литературных данных по моделированию поверхностной энергии граней кристалла антрацена имеется значительный разброс значений величин ${{\sigma }}_{{hkl}}^{V}$. При этом для грани (001) полученная в настоящей работе методом OPLS на основе рентгеноструктурных данных величина поверхностной энергии (70.9 мДж/м2) находится приблизительно в середине интервала значений, рассчитанных другими методами (52.8–96.9 мДж/м2), т.е. в неплохом согласии с ними.
Полученная экспериментальная оценка значения ${{\sigma }}_{{001}}^{V}$ наиболее развитой грани (001) кристаллических пластинок методом определения контактного угла смачивания каплей дистиллированной воды в сравнении с модельными данными находится на нижнем пределе расчетных значений и в пределах погрешности соответствует результатам [27]. Отметим, что используемая экспериментальная оценка является чувствительной к морфологии исследуемой поверхности, о чем говорит разброс значений контактного угла смачивания θ внутри серии различных кристаллов антрацена (табл. 1), и поэтому более справедлива для сравнительного анализа энергии реальных поверхностей.
Представленный термодинамический анализ изменения свободной энергии Гиббса при образовании зародыша кристалла на границе раздела жидкой и паровой фаз с учетом анизотропии поверхностной энергии и поверхностного натяжения насыщенного раствора толуола позволяет количественно охарактеризовать минимальные размеры кристаллических агрегатов в данных условиях в зависимости от пересыщения, поверхностных свойств и температуры среды. В силу ограничения применимости термодинамических допущений на уровне нескольких кристаллических монослоев (рис. 6, 7) полученные выражения для критических размеров lc и hc (6), (7) могут быть полезны для сравнительных исследований влияния условий среды (пересыщение, различные типы растворителей, температура) на образование органических кристаллов. В частности, полученный результат о повышении работы образования кристаллического зародыша антрацена при диффузии паров изопропанола в раствор может служить объяснением отсутствия формирования пояса паразитных кристалликов на стенках ростового сосуда на границе с раствором, а также заметного снижения числа образуемых спонтанным образом кристаллов в сравнении с ростом по методу изотермического испарения растворителя. Данный эффект можно отнести и к факторам, способствующим улучшению морфологического качества формирующихся в растворе первичных кристаллов.
ЗАКЛЮЧЕНИЕ
Исследования по росту кристаллов антрацена методом диффузии паров осадителя в раствор при комнатной температуре позволили установить, что наиболее высокое морфологическое качество кристаллических образцов достигается при использовании высококипящих растворителей (толуол, изопропанол, бутанол-1) с более низкой скоростью диффузии паров, что обеспечивает более умеренную скорость пересыщения маточной фазы. Полученные теоретические оценки в совокупности с экспериментальными данными для поверхностных свойств кристалла и раствора в условиях роста позволяют проанализировать термодинамическую модель образования анизотропного кристаллического зародыша в области границы раздела фаз. Рассмотренная модель дает представление о размере образуемых в растворе кристаллических зародышей в зависимости от пересыщения, поверхностного натяжения раствора и температуры. Согласно представленной модели в условиях роста из раствора в атмосфере, дополнительно насыщенной парами осадителя – изопропанола, имеет место повышение работы образования зародыша. Данный эффект, по-видимому, является причиной предотвращения формирования пояса паразитных кристаллов на стенках ростового сосуда на границе с раствором и способствует формированию крупных монокристаллов в сравнении с методом медленного изотермического испарения растворителя.
Работа выполнена при поддержке Министерства науки и высшего образования РФ в рамках выполнения работ по Государственному заданию ФНИЦ “Кристаллография и фотоника” РАН c использованием оборудования ЦКП ФНИЦ “Кристаллография и фотоника” при поддержке Минобрнауки.
Список литературы
Wang C., Dong H., Jiang L., Hu W. // Chem. Soc. Rev. 2018. V. 47. P. 422. https://doi.org/10.1039/c7cs00490g
Inada Y., Yamao T., Inada M. et al. // Synth. Met. 2011. V. 161. P 1869. https://doi.org/10.1016/j.synthmet.2011.06.026
Shang H., Wang H., Gao N. et al. // Cryst. Eng. Commun. 2012. V. 14. P. 869. https://doi.org/10.1039/c1ce05989k
Postnikov V.A., Odarchenko Y.I., Iovlev A.V. et al. // Cryst. Growth Des. 2014. V. 14. P. 1726. https://doi.org/10.1021/cg401876a
Bruevich V.V., Glushkova A.V., Poimanova O.Yu. et al. // ACS Appl. Mater. Interfaces. 2019. V. 11. № 6. P. 6315. https://doi.org/10.1021/acsami.8b20700
Vladimirov I., Kellermeier M., Gebner T. et al. // Nano Lett. 2018. V. 18. № 1. P. 9. https://doi.org/10.1021/acs.nanolett.7b03789
Постников В.А., Чертопалов С.В. // Кристаллография. 2015. Т. 60. № 4. С. 651.
Постников В.А., Сорокина Н.И., Алексеева О.А. и др. // Кристаллография. 2018. Т. 63. № 1. С. 152.
Постников В.А., Сорокина Н.И., Алексеева О.А. и др. // Кристаллография. 2018. Т. 63. № 5. С. 801.
Постников В.А., Кулишов А.А., Островская А.А. и др. // ФТТ. 2019. Т. 61. Вып. 12. С. 2432.
Postnikov V.A., Sorokina N.I., Lyasnikova M.S. et al. // Crystals. 2020. V. 10. P. 363. https://doi.org/10.3390/cryst10050363
Постников В.А., Лясникова М.С., Кулишов А.А. и др. // ФТТ. 2019. Т. 61. Вып. 12. С. 2322.
Kudryashova L.G., Kazantsev M.S., Postnikov V.A. et al. // ACS Appl. Mater. Interfaces. 2016. V. 8. № 16. P. 10088. https://doi.org/10.1021/acsami.5b11967
Borecka B., Lipinski A. // Cryst. Res. Technol. 1983. V. 18. P. 755.
Madhurambal G., Anbu Srinivasan P. // Cryst. Res. Technol. 2006. V. 41. № 3. P. 231. https://doi.org/10.1002/crat.200510565
Birks B., Fry D.W., Costrell L., Kandiah K. The Theory and Practice of Scintillation Counting. London: Pergamon Press Ltd, 1964.
Красовицкий Б.М., Болотин Б.М. Органические люминофоры. М.: Химия, 1984. 336 с.
Katoh R., Suzuki K., Furube A. et al. // J. Phys. Chem. C. 2009. V. 113. P. 2961. https://doi.org/10.1021/jp807684m
Nawar A.M., Yahia I.S. // Opt. Mater. 2017. V. 70. P. 1. https://doi.org/10.1016/j.optmat.2017.05.006
Thirupugalmani K., Shanmugam G., Kannan V., Brahadeeswaran S. // J. Cryst. Growth. 2015. V. 413. P. 67. https://doi.org/10.1016/j.jcrysgro.2014.12.009
Sarve A., George J., Agrawal S. et al. // RSC Adv. 2020. V. 10. P. 22480. https://doi.org/10.1039/d0ra03706k
Massaro F.R., Moret M., Bruno M., Aquilano D. // Cryst. Growth Des. 2012. V. 12. P. 982. https://doi.org/10.1021/cg201458g
Sancho-García J.C., Aragó J., Ortí E., Olivier Y. // J. Chem. Phys. 2013. V. 138. P. 204304. https://doi.org/10.1063/1.4806436
Jorgensen W.L., Tirado-Rives J. // J. Am. Chem. Soc. 1988. V. 110. 6. P. 1657. https://doi.org/10.1021/ja00214a001
Jorgensen W.L., Maxwell D.S., Tirado-Rives J. // J. Am. Chem. Soc. 1996. V. 118. P. 11225. https://doi.org/10.1021/ja9621760
Puschnig P., Nabok D., Ambrosch-Draxl C. Interface Controlled Organic Thin Films. Springer Proceedings in Physics 129 / Eds. Rubahn H.-G. et al. Springer, 2009. P. 3.
Northrup J.E. // Phys. Rev. B. 2002. V. 66. P. 121404. https://doi.org/10.1103/PhysRevB.66.121404
Kitaigorodsky A.I., Ahmed N.A. // Acta Cryst. A 1972. V. 28. P. 207.
Щукин Е.Д., Перцов А.В., Амелина Е.А. Коллоидная химия. М.: Высшая школа, 2004. 445 с.
Джейкок М., Парфит Д. Химия поверхностей раздела фаз. М.: Мир, 1984. 269 с.
Brock C.P., Dunitz J.D. // Acta Cryst. B. 1990. V. 46. P. 795. https://doi.org/10.1107/S0108768190008382
Yaws C.L. Thermophysical Properties of Chemicals and Hydrocarbons. Beaumont; TX: William Andrew Inc., 2008.
Рабинович В.Я., Хавин З.Я. Краткий химический справочник. Л.: Химия, 1991. 432 с.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография