Кристаллография, 2022, T. 67, № 3, стр. 404-410
Структура и свойства 9,10-бис(триизопропилсилилэтинил)антрацена
Д. А. Жеребцов 1, *, Н. В. Сомов 2, С. А. Найферт 1, М. А. Полозов 1, Ч. П. Сактхи Дхаран 1, К. Раджакумар 1
1 Южно-Уральский государственный университет
Челябинск, Россия
2 Нижегородский государственный университет им. Н.И. Лобачевского
Нижний Новгород, Россия
* E-mail: zherebtsov_da@yahoo.com
Поступила в редакцию 19.11.2021
После доработки 20.12.2021
Принята к публикации 23.12.2021
- EDN: YETSDS
- DOI: 10.31857/S0023476122030286
Аннотация
Описана кристаллическая структура 9,10-бис(триизопропилсилилэтинил)антрацена при 100 и 295 K, а также его спектры в видимой и ИК-области, приведены данные фотолюминесценции и термического анализа. Кристаллическая структура соединения при 100 K описывается пр. гр. Pbca с параметрами элементарной ячейки a = 14.841(2), b = 1 4.207(2), c = 30.765(5) Å, тогда как при нагревании до 295 K симметрия структуры повышается с уменьшением числа уникальных атомов углерода. При 295 K структура описывается пр. гр. Pbcm с параметрами a = 15.1829(5), b = 15.1981(4), c = 15.1129(7) Å. Между двумя кристаллическими формами можно ожидать существования фазового перехода II рода в интервале 250–295 K. В структуре отсутствуют π–π-взаимодействия ароматических ядер.
ВВЕДЕНИЕ
Полициклические ароматические соединения приобретают важное значение благодаря уникальным свойствам, позволяющим использовать их в качестве компонентов органических светодиодов [1] и транзисторов [2–5]. Одним из известных полициклических соединений является ярко флуоресцирующий 9,10-бис(триизопропилсилилэтинил)антрацен (I), отличающийся наличием устойчивых к гидролизу триизопропилсилильных групп. До настоящего времени была известна лишь структура низкотемпературной модификации, причем без информации о тепловых эллипсоидах [6].
В работе исследована кристаллическая структура I при 100 и 295 K, а также оптические спектры в видимой и ИК-области, приведены данные фотолюминесценции и термического анализа.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Соединение I синтезировано аналогично [1, 3, 4, 7]. Для синтеза использовали антрахинон (4.16 г, 20 ммоль) и триизопропилсилилацетилен (9.2 г, 50 ммоль). Предварительно из бромбензола и лития в диэтиловом эфире был приготовлен фениллитий, с помощью которого получено литиевое производное триизопропилсилилацетилена. К его раствору в тригидрофуране (ТГФ) был добавлен раствор антрахинона в ТГФ, полученную смесь перемешивали в течение 4 ч при комнатной температуре до образования оранжевого раствора. Его добавили к раствору SnCl2 (10 мас. %) в HCl (15 мас. %), после чего оранжевый продукт экстрагировали несколькими порциями хлороформа, промыли водой и упарили на роторном испарителе. Выход составил 4.52 г, или 63%.
Монокристаллы вырастили из раствора I в хлороформе при испарении растворителя при 20°С в течение 4 сут. Оранжевые игольчатые кристаллы имели линейные размеры до 1 мм в длину и 0.1 мм в ширину.
Рентгеновские исследования. Структурное исследование монокристалла I проводили на дифрактометре Rigaku XtaLAB Pro MM003 (излучение MoKα, λ = 0.71073 Å) при T = 295 и 100 K (фазы 1 и 2 соответственно). Структуры фаз 1 и 2 решены прямыми методами и уточнены методом наименьших квадратов по |F|2 в анизотропном приближении тепловых параметров всех атомов, кроме водорода, с использованием программных комплексов SHELX [8] и WinGX [9]. Атомы водорода помещены в геометрически рассчитанные положения и уточнены в приближении модели наездника с длиной связи C–H, равной 0.95 Å, и Uiso(H) = 1.5Ueq(C).
Спектроскопические исследования. ИК-спектр соединения I, диспергированного в KBr, получили с помощью спектрометра Shimadzu IRAffinity-1S. Спектры диффузного отражения в УФ-видимой области и спектры пропускания соединения I были измерены с помощью спектрофотометра Shimadzu UV-2700 в диапазоне длин волн 200–850 нм.
Термический анализ. Дифференциальную сканирующую калориметрию (ДСК) и термогравиметрию (ТГ) проводили с помощью синхронного термического анализатора Netzsch STA 449C Jupiter. Образец нагревали в корундовом тигле в атмосфере аргона со скоростью 10 град/мин.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Кристаллографические характеристики, данные эксперимента и результаты уточнения структуры приведены в табл. 1. Сведения о кристаллических структурах депонированы в Кембриджский банк структурных данных (CCDC № 2105584, 2105586).
Таблица 1.
Кристаллографические характеристики, данные экспериментов и результаты уточнения структур фаз 1 и 2
| Фаза | 1 | 2 |
|---|---|---|
| Формула | C36H50Si2 | C36H50Si2 |
| M | 538.94 | 538.94 |
| Сингония, пр. гр., Z | Ромбическая, Pbcm, 4 | Ромбическая, Pbca, 8 |
| T, K | 295(2) | 100(2) |
| a, b, c, Å | 15.1829(5), 15.1981(4), 15.1129(7) | 14.8406(2), 14.2073(2), 30.7647(5) |
| V, Å3 | 3487.3(2) | 6486.58(16) |
| Dx, г см–3 | 1.026 | 1.104 |
| μ, мм–1 | 0.122 | 0.131 |
| Tmin, Tmax | 0.57646, 1 | 0.4498, 1 |
| F(000) | 1176 | 2352 |
| Размер кристалла, мм | 0.391 × 0.255 × 0.102 | 0.391 × 0.255 × 0.102 |
| Дифрактометр | Rigaku XtaLab MM003 P200K | |
| Излучение; λ, Å | MoKα; 0.71073 Å | |
| Тип сканирования | ω | |
| θ, град | 2.683–26.362 | 2.386–26.372 |
| Пределы hkl | –17 ≤ h ≤ 18, –18 ≤ k ≤ 8, –18 ≤ l ≤ 18 | –8 ≤ h ≤ 18, –17 ≤ k ≤ 17, –38 ≤ l ≤ 34 |
| Количество рефлексов измеренных/независимых (N1)/с I > 2σ(I) (N2), Rint | 9149/3666/1993, 0.0276 | 16 984/6595/5603, 0.0229 |
| Число уточняемых параметров | 222 | 525 |
| R1/wR2 по N1 | 0.1346/0.326 | 0.0476/0.1072 |
| R1/wR2 по N2 | 0.088/0.2798 | 0.0392/0.1022 |
| S | 1.1 | 1.038 |
| Δρmin/Δρmax, э·Å–3 | –0.276/0.41 | –0.274/0.446 |
| CCDC | 2105586 | 2105584 |
Отличием структур обеих фаз соединения I является отсутствие π–π-взаимодействия между антраценовыми ядрами (рис. 1а) вследствие слишком большого объема триизопропилсилильной группы, препятствующей упаковке плоских ароматических ядер в стопки. Вместо этого плоскости соседних молекул ориентированы друг относительно друга под углом ∼70°. Данная особенность подобна особенности структуры 7,14-бис(триэтилсилил-этинил)-дибензо[b,def]хризена [4]. В обоих случаях между молекулами в кристалле образуются только слабые ван-дер-ваальсовы связи, что сказывается, например, на относительно низкой температуре плавления соединения I и его хорошей растворимости в органических растворителях.
Рис. 1.
Кристаллическая структура соединения I при температуре 100 (а, б) и 295 K (в). Атомы водорода и изопропильные радикалы опущены для ясности.
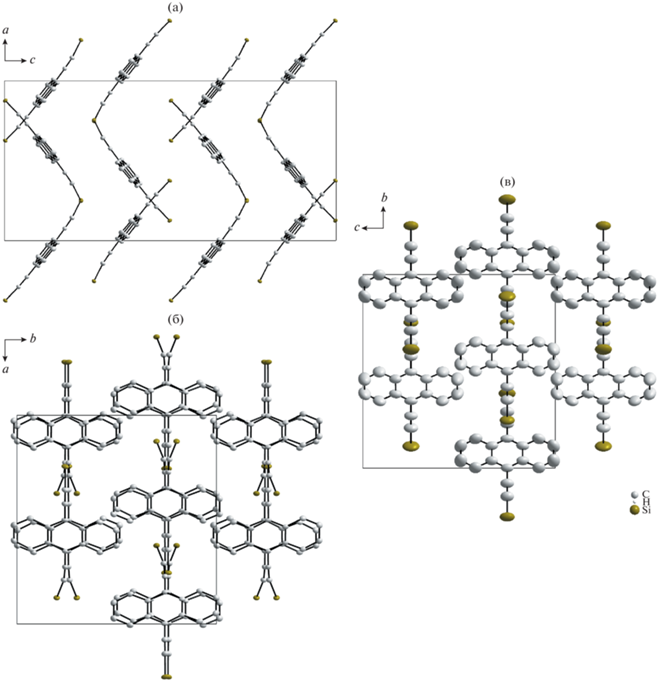
Атомная структура фазы 2 при температуре 100 K инвариантна относительно пр. гр. Pbca. Нагревание до 295 K приводит к повышению симметрии структуры: группа симметрии меняется на Pbcm, объем элементарной ячейки уменьшается в 2 раза (табл. 1). Структурный фазовый переход обусловлен тем, что положения нескольких атомов, занимающих при низких температурах общие положения (рис. 1б), становятся частными при более высоких температурах (рис. 1в). Так, два бензольных кольца антраценового ядра становятся зеркально симметричными относительно плоскости, проходящей через положения 9 и 10 антрацена. Также симметричными относительно этой плоскости становятся триизопропильные радикалы.
Опубликованные ранее результаты рентгеноструктурного анализа соединения I при температуре 250 K [6] по параметрам элементарной ячейки наиболее близки к результатам, полученным в настоящей работе при температуре 100 К (рис. 2). Можно предполагать, что температура превращения из низкотемпературной в высокотемпературную форму находится между 250 и 295 K. Данное превращение не приводит к разрушению монокристалла, его можно отнести к переходу порядок–беспорядок.
Рис. 2.
Разупорядочение атомов в структуре соединения I при 100 (а), 250 [6] (б) и 295 K (в). Позиции атомов с меньшей заселенностью и соответствующие связи показаны полупрозрачными. Атомы водорода опущены для ясности. При 100 и 250 K пр. гр. Pbca, при 295 K – Pbcm.
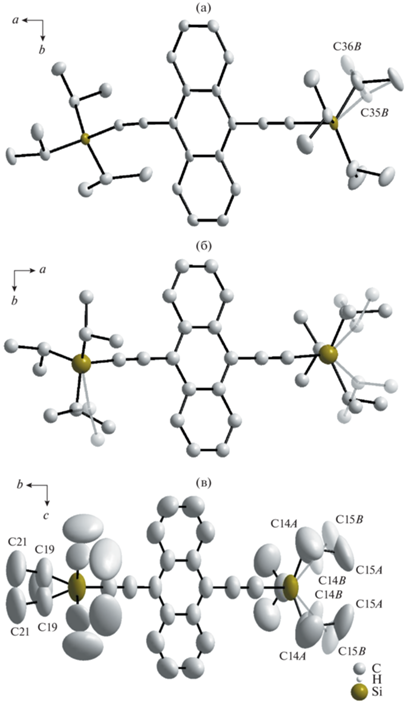
В определенной ранее при 250 K структуре [6] все атомы учтены в изотропном приближении параметров смещений и сильно разупорядочены (рис. 2б). Так, позиции C17, C18, C19 и C17', C18', C19' частично заселены в соотношении 0.847 : 0.153, а позиции C28, C29, C30, C34, C35, C36 и C28', C29', C30', C34', C35', C36' частично заселены в соотношении 0.744 : 0.256.
Атомные структуры при 100 и 295 K содержат меньше разупорядоченных позиций. В структуре 1 при 295 K позиции C14A, C15A и C14B, C15B разупорядочены с соотношением заселенностей 0.59 : 0.41, позиции C19 и C21 – 0.5 : 0.5 (рис. 2в). В структуре при 100 К разупорядочены всего два атома (рис. 2а): позиции C35A, C36A и C35B, C36B частично заняты в соотношении 0.785 : 0.215.
Порошковая дифрактограмма получена с помощью дифрактометра Rigaku Ultima IV (излучение CuKα) и хорошо совпадает с дифрактограммой, рассчитанной из данных для монокристалла при 295 K.
ИК-спектр соединения I (рис. 3) получен на спектрометре Shimadzu IRAffinity-1S с использованием таблеток KBr. В спектре наблюдаются две сильные полосы поглощения, относящиеся к тройным связям, а также серия полос поглощения валентных колебаний С–Н-связей: алифатических 2863 (оч. сильн.), 2889 (средн.), 2922 (сильн.), 2941 (оч. сильн.), 2962 (сильн.) и ароматических 3061 см–1 (слаб.). Существование двух полос поглощения тройных связей согласуется с кристаллографической неидентичностью двух этинильных групп. Длины двух тройных связей составляют 1.197 и 1.192 Å, что, очевидно, соответствует полосам 2122 (средн.) и 2147 см–1 (средн.). Кроме этих полос следует отметить ряд полос, трудно интерпретируемых: 420 (слаб.), 446 (средн.), 463 (средн.), 489 (средн.), 505 (средн.), 569 (сильн.), 615 (слаб.), 646 (оч. сильн.), 665 (оч. сильн.), 677 (оч. сильн.), 769 (оч. сильн.), 801 (оч. сильн.), 883 (сильн.), 920 (слаб.), 940 (слаб.), 968 (средн.), 997 (сильн.), 1013 (средн.), 1043 (сильн.), 1072 (средн.), 1148 (слаб.), 1242 (средн.), 1291 (слаб.), 1365 (сильн.), 1377 (оч. сильн.), 1437 (средн.), 1460 (сильн.), 1600 (средн.), 1622 (средн.), 1630 см–1 (средн.).
Видимый спектр кристалла I в диапазоне длин волн 185–850 нм получен в режиме диффузного отражения от таблетки в смеси с BaSO4, а также в растворе в хлороформе (рис. 4). Интенсивность линий поглощения в растворе монотонно возрастает в ряду 370.5, 390.5, 412.5 и 437.5 нм, причем у самого сильного пика есть плечо около 431.0 нм, а в области более длинных волн наблюдаются слабые уширенные пики около 471 и 504.5 нм. Спектр поглощения в твердом состоянии в целом подобен спектру в растворе, но хуже разрешен и несколько отличается по интенсивности. Можно отметить линии около 371, 393, 412, 437, 495 и 526 нм. Это хорошо совпадает с данными [2, 7]. Край поглощения находится около 624 нм, что соответствует ширине запрещенной зоны кристалла 1.99 эВ.
Рис. 4.
Спектры соединения I: поглощения в твердом состоянии (1), поглощения в растворе в хлороформе (2), фотолюминесценции в растворе в ортодихлорбензоле (3).
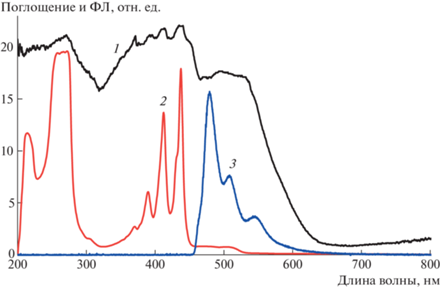
Спектры фотолюминесценции возбуждали He–Cd-лазером с длиной волны 325 нм. Интенсивность линий фотолюминесценции быстро убывает в ряду 479, 508, 544 нм зеркально симметрично спектру поглощения (рис. 4).
На кривой ДСК соединения I не наблюдаются тепловые эффекты в твердом состоянии вплоть до плавления при 203°С (рис. 5). Теплота плавления составляет 48 или 26 кДж/моль. На кривой ТГ при 280°С выявляется потеря массы 1.3 мас. %, что свидетельствует о высокой устойчивости соединения I к термолизу и испарению как в твердом, так и в расплавленном состоянии. По литературным данным точка плавления соответствует 203–205°С [10].
Работа Н.В. Сомова выполнена при поддержке Министерства науки и высшего образования РФ (госзадание № 0729-2020-0058), С.А. Найферта и М.А. Полозова при поддержке Российского фонда фундаментальных исследований (гранты № 20-33-90094 и 20-33-90095). Элементный и фазовый анализы и микроскопические исследования проведены в научно-образовательном центре “Нанотехнологии” ЮУрГУ.
Список литературы
Odom S.A., Parkin S.R., Anthony J.E. // Org. Lett. 2003. V. 5. № 23. P. 4245.
Dai G., Chang J., Luo J. et al. // Angew. Chem. Int. Ed. 2016. V. 55. P. 2693.
Winzenberg K.N., Kemppinen P., Fanchini G. et al. // Chem. Mater. 2009. V. 21. P. 5701.
Shu Y., Collis G.E., Dunn C.J. et al. // J. Mater. Chem. C. 2013. V. 1. P. 6299.
Sirven A.M., Garbage R., Qiao Y. et al. // Chem. Eur. J. 2015. V. 21. № 42. P. 15013.
Anthony J.E., Parkin S. 2016. CSD Private Communication. CCDC 962668.
Payne M.M., Parkin S.R., Anthony J.E. // J. Am. Chem. Soc. 2005. V. 127. P. 8028.
Sheldrick G.M. // Acta Cryst. A. 2015. V. 71. P. 3.
Farrugia L.J. // J. Appl. Cryst. 1999. V. 32. P. 837.
Jiang X., Rodríguez-Molina B., Nazarian N., Garcia-Garibay M.A. // J. Am. Chem. Soc. 2014. V. 136. P. 8871.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография




