Кристаллография, 2022, T. 67, № 5, стр. 801-817
Распределенный центр ядерной медицины НИЦ “Курчатовский институт”: история, современное состояние и перспективы развития
М. В. Ковальчук 1, О. С. Нарайкин 1, К. А. Сергунова 1, Ю. А. Дьякова 1, А. Н. Черных 1, *, Р. А. Алиев 1, В. И. Максимов 2, С. В. Иванов 3, Н. Е. Тюрин 3, А. П. Солдатов 3, Г. И. Кленов 1, В. С. Хорошков 1
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
2 Петербургский институт ядерной физики Национального исследовательского центра “Курчатовский институт”
Гатчина, Россия
3 Институт физики высоких энергий Национального исследовательского центра “Курчатовский институт”
Протвино, Россия
* E-mail: Chernykh_AN@nrcki.ru
Поступила в редакцию 18.04.2022
После доработки 18.04.2022
Принята к публикации 21.04.2022
- EDN: ULBSGY
- DOI: 10.31857/S0023476122050113
Аннотация
Высокотехнологичное оборудование на основе ядерно-физических методов является неотъемлемой частью современной онкологической службы. Комплексный подход к развитию ядерной медицины и лучевой терапии в российской системе здравоохранения позволит не только увеличить доступность ядерных и ускорительных технологий для нашей страны, но и повысить их эффективность и безопасность. Настоящий обзор посвящен роли НИЦ “Курчатовский институт” в развитии ядерно-физических методов, применяемых в медицине, а также новым возможностям и перспективам, открывающимся в результате создания Научно-образовательного медицинского центра ядерной медицины НИЦ “Курчатовский институт”. Подробно рассмотрены состав и основные технические характеристики пяти разрабатываемых комплексов медицинской радиологии, включая комплекс по наработке радионуклидов и четыре комплекса адронной лучевой терапии.
ОГЛАВЛЕНИЕ
Введение
1. Медицинская радиология в России
2. Курчатовский комплекс ядерно-физических установок
2.1. Реакторный комплекс
2.2. Ускорительный комплекс
2.3. Генераторы радионуклидов
2.4. Производство и контроль качества радиофармацевтических лекарственных препаратов
3. Установки Курчатовского научно-образовательного медицинского центра ядерной медицины
3.1. Комплекс по наработке радионуклидов на базе циклотрона Ц-80
3.2. Комплекс протонной лучевой терапии
3.3. Онкоофтальмологический комплекс протонной лучевой терапии на базе циклотрона Ц-80
3.4. Экспериментально-клинический комплекс ионной лучевой терапии на базе действующего ускорительного комплекса У-70
3.5. Прототип типового комплекса ионной лучевой терапии
4. Реализация кластерного подхода в области ядерной медицины на базе научно-технологической инфраструктуры НИЦ “Курчатовский институт”
Заключение
ВВЕДЕНИЕ
Современную систему здравоохранения сложно представить без высокотехнологичного оборудования на основе генерирующих источников ионизирующего излучения (гамма-, электронного, протонного, ионного излучения и т.п.), а также ядерных технологий с использованием радиоизотопов, в том числе применяемых при создании радиофармацевтических лекарственных препаратов (РФЛП) (рис. 1).
Представленные ядерно-физические методы, лежащие в основе и относящиеся к области медицинской радиологии, нашли широкое применение в диагностике и лечении не только злокачественных новообразований, но и сердечно-сосудистых, неврологических, эндокринологических и онкоофтальмологических заболеваний.
Текущее направление развития современной радиологии связано не только с усовершенствованием технологий ранней диагностики заболеваний, позволяющих своевременно и правильно определять дальнейший объем лечения, но и с внедрением современных методов лечения, включая комбинированную таргетную терапию, адронную терапию, тераностику, способствующих повышению качества и увеличению продолжительности жизни, что является одной из стратегических целей, определенных Указом Президента Российской Федерации от 21 июля 2020 г. № 474.
Однако в отличие от международной лечебной практики отечественная медицина до сих пор испытывает дефицит современных мощностей для лечения злокачественных новообразований, которые наряду с сердечно-сосудистыми заболеваниями занимают ведущее место среди причин смерти во всем мире, в том числе в России. По данным Росстата в 2020 г. от болезней систем кровообращения умерли 938.5 тыс. человек (43.9%) и от злокачественных новообразований – 295.9 тыс. человек (13.8%) [1].
1. МЕДИЦИНСКАЯ РАДИОЛОГИЯ В РОССИИ
Сегодня в России в области медицинской радиологии активно применяются методы с использованием рентгеновского, электронного и гамма-излучения, что обусловлено в первую очередь наличием значительного парка соответствующего оборудования, включающего в себя рентгеновские аппараты, линейные ускорители, гамма-ножи и кобальтовые установки.
В последние годы в мировой практике широкое развитие получили методы адронной терапии с использованием ускоренных пучков протонов (протонная лучевая терапия (ПЛТ)) и тяжелых ионов углерода (ионная лучевая терапия (ИЛТ)), а также относительно новый подход в области персонализированной медицины (тераностика).
В основе тераностики лежит адресная (таргетная) доставка РФЛП, которые являются одновременно и средством ранней диагностики, и терапевтическим агентом, избирательно связывающимся с определенной мишенью. Это позволяет не только осуществлять направленное воздействие, но и контролировать эффективность лечения.
Преимущество методов ПЛТ и ИЛТ заключается в способности максимально точно локализовать лучевое воздействие в области заданного объема за счет реализации эффекта пика Брэгга, что значимо снижает частоту и выраженность радиоиндуцированных реакций по сравнению с фотонной терапией. Кроме того, одним из основных достоинств ИЛТ является высокая эффективность воздействия на радиорезистивные (радиоустойчивые) опухоли.
В настоящее время в мире насчитывается порядка 100 центров ПЛТ, сосредоточенных в основном в США, Японии, Европе и Китае, а также четыре центра низкоэнергетической протонной терапии для лечения заболеваний глаз. Кроме того, в Японии, Европе и Китае базируется 13 установок ИЛТ.
В России сегодня функционируют лишь три современных центра ПЛТ в Санкт-Петербурге, Димитровграде и Обнинске, два из которых оснащены циклотронами зарубежного производства. Последний оборудован отечественным комплексом ПЛТ “Прометеус”, предусматривающим облучение только опухолей головного мозга, головы и шеи [2]. Отечественная промышленность ПЛТ серийно не производит.
Кроме того, российское здравоохранение использует крайне ограниченный спектр РФЛП, применяемых в ядерной медицине – не более 15 радионуклидов, на основе которых зарегистрировано 53 РФЛП, в то время как в лечебной практике используются более 100 радиоизотопов.
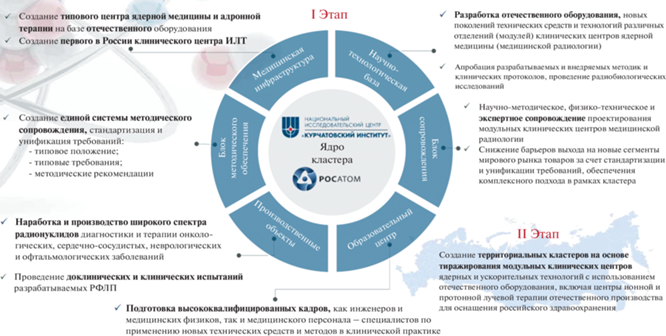
Решение задач развития ядерной медицины предусмотрено мероприятиями Федеральной научно-технической программы (ФНТП) развития синхротронных и нейтронных исследований и исследовательской инфраструктуры на 2019–2027 гг., утвержденной постановлением Правительства Российской Федерации от 16 марта 2020 г. № 287. Программой предусмотрено создание пяти комплексов медицинской радиологии, входящих в состав будущего Научно-образовательного медицинского центра ядерной медицины (НОМЦ ЯМ) Национального исследовательского центра “Курчатовский институт” (НИЦ “Курчатовский институт”), а именно (рис. 2):
Рис. 2.
Научно-образовательный медицинский центр ядерной медицины Национального исследовательского центра “Курчатовский институт”.
− распределенный комплекс по наработке радионуклидов и синтезу РФЛП;
− комплекс протонной лучевой терапии (ПЛТ);
− онкоофтальмологический комплекс ПЛТ;
− экспериментально-клинический комплекс ионной лучевой терапии (ЭКК ИЛТ) на действующем ускорительном комплексе У-70;
− прототип типового комплекса ИЛТ для типового клинического центра ионной (углеродной) лучевой терапии.
Создание НОМЦ ЯМ на базе НИЦ “Курчатовский институт” позволит решить не только обозначенные выше задачи, но и обеспечить развитие современных ядерных центров в других субъектах Российской Федерации при организационно-методической поддержке НИЦ “Курчатовский институт”.
2. КУРЧАТОВСКИЙ КОМПЛЕКС ЯДЕРНО-ФИЗИЧЕСКИХ УСТАНОВОК
Отметим, что родоначальником развития перспективных и многообещающих ядерно-физических методов в нашей стране стал НИЦ “Курчатовский институт” (рис. 3). Первые технологии, положившие основу современной отечественной ядерной медицины и адронной терапии, появились практически сразу после назначения 10 марта 1943 г. Игоря Васильевича Курчатова научным руководителем работ по использованию атомной энергии в СССР и создания им Лаборатории № 2 АН СССР, в дальнейшем переименованной в НИЦ “Курчатовский институт”. Прежде всего это первый советский циклотрон М-1, запущенный в 1944 г., а также первый на Евразийском континенте ядерный реактор Ф-1, пуск которого состоялся 25 декабря 1946 г. Именно они стали прародителями современных отечественных циклотронных и реакторных комплексов сегодняшнего НИЦ “Курчатовский институт”.
Кроме того, в послевоенный период в связи с новыми задачами по использованию атомной энергии в мирных целях основными направлениями стало изучение патогенеза, клиники, профилактики и лечения лучевой болезни, разработка методов применения радиоактивных изотопов и других видов ионизирующих излучений для диагностики и лечения. Для изучения влияния радиации на человека и разработки средств защиты в 1946 г. по инициативе И.В. Курчатова в системе Академии наук СССР была создана радиационная лаборатория, позже переименованная в Институт биофизики, которому было поручено изучение биологического действия радиации. Это направление в дальнейшем было продолжено в радиобиологическом отделе филиала Физико-технического института им. А.Ф. Иоффе АН СССР в Гатчине, позднее преобразованного в НИЦ “Курчатовский институт” – ПИЯФ, где в 1964 г. была открыта лаборатория радиационной генетики, а позже общей радиобиологии, молекулярной биологии, органического синтеза. Особое внимание уделялось обеспечению биологических экспериментов на биоканале реактора ВВР-М, запущенного в том же институте в 1959 г. Именно такой междисциплинарный подход и слаженная работа ученых и инженерных кадров позволили руководителю отдела молекулярной биологии С.Е. Бреслеру создать новое направление и специальность “биофизика”. Сегодня на базе этого отдела создан и достаточно успешно функционирует центр доклинических и клинических исследований Курчатовского института, который стал первой в Российской Федерации специализированной площадкой для доклинических исследований РФЛП.
Третьим направлением, в развитии которого важную роль сыграл атомный проект, стала адронная терапия. Запущенные в 60–70-е годы в Институте теоретической и экспериментальной физики (ИТЭФ), Институте физики высоких энергий (ИФВЭ) и Петербургском институте ядерной физики (ПИЯФ) протонные синхротроны У-7 и У-70 и синхроциклотрон СЦ-1000 послужили толчком для начала комплексных биомедицинских и физико-дозиметрических исследований в области протонной и ионной терапии, а также внедрения их в клиническую практику. Сегодня в России НИЦ “Курчатовский институт” обладает самым большим опытом в области адронной терапии: с 1969 г. совместно с семью крупнейшими клиниками Москвы и Санкт-Петербурга было пролечено более 5000 пациентов, что составляет около 80% от российского клинического опыта [3, 4].
Безусловно, основой для создания технологий адронной терапии нового поколения, а также разработки новых технологий наработки перспективных радионуклидов является технологическая база.
Как правило, для производства радиоактивных изотопов медицинского назначения используются стабильные изотопы-мишени. Например, реакторные изотопы 98Мо–99Мо, 176Yb–177Lu или циклотронные 124Xe–123I. Практически все технологии разделения стабильных изотопов были разработаны в Курчатовском институте. В настоящее время НИЦ “Курчатовский институт” имеет два электромагнитных сепаратора, основным продуктом которых является изотоп Иттербия-176, каскад газовых центрифуг для производства изотопов ксенона и фотохимическую установку для производства изотопов ртути. Сегодня на базе НИЦ “Курчатовский институт” создан и функционирует комплекс уникальных ядерно-физических установок, включающий в себя три реакторных комплекса (ИР-8, АРГУС и ПИК) и ряд ускорительных комплексов (СЦ-1000, Ц-80, У-150, У-70, Siemens Eclipse), позволяющих нарабатывать обширный спектр актуальных радионуклидов. Уже сегодня в НИЦ “Курчатовский институт” реализуется производство РФЛП на базе изотопа 18F, осуществляется поставка 123I в медицинские организации. Кроме того, в Курчатовском институте осуществляется наработка целого ряда наиболее перспективных терапевтических радионуклидов – это 67Cu, 47Sc, 177Lu, 212Pb, 225Ac, 213Bi, 149Tb, 155Tb, 161Tb, 186Re, 230U и другие (табл. 1) [5, 6].
Таблица 1.
Примеры технологий наработки перспективных радионуклидов, разрабатываемых и внедренных на базе НИЦ “Курчатовский институт”
| Радионуклид | Период полу-распада T1/2 | Назначение | Тип распада |
Уравнение реакции | Техно-логия полу-чения |
Лите-ратура | |
|---|---|---|---|---|---|---|---|
| Значе-ние | Размер-ность | ||||||
| Диагностические радионуклиды | |||||||
| 18F | 110 | мин | ПЭТ | ε+β+ (100%) | 18O(p, n) 18F | Ц | |
| 68Ga генератор 68Ge/68Ga | 68.3 | мин | ПЭТ | ε+β+ (100%) | 69Ga(p, 2n) 68Ge → 68Ga | Ц, Г | |
| 82Rb генератор 82Sr/82Rb | 1.3 | мин | ПЭТ | ε+β+ (100%) | natRb(p, x) 82Sr → 82Rb | Ц, Г | |
| 89Zr | 78.4 | час | ПЭТ, оже-терапия | ε+β+ (100%) | 89Y(d, 2n) 89Zr | Ц | [1] |
| 99mTc | 6.05 | час | ОФЭКТ | IT (99.9%) β- (0.003%) | 100Мо(р, 2n) 99mTc | Ц | |
| 123I | 13.3 | час | ОФЭКТ | ε+β+ (100%) | 124Xe(p, 2n)123Cs → 123Xe → → 123I | Ц | |
| 124Xe(p, pn) 123Xe → 123I | |||||||
| 132La | 4.8 | час | ПЭТ, оже-терапия | ε+β+ (100%) | natBa(α, x) 132La | Ц | |
| 135La | 19.5 | час | ПЭТ, оже-терапия | ε+β+ (100%) | natBa(α, x) 135La | Ц | |
| 149Tb | 4.118 | час | ПЭТ, α-терапия, | εβ+ (83.3%) α (16.7%) |
151Eu(3He, 5n) 149Tb | Ц | [2, 3] |
| 152Tb | 17.5 | час | ПЭТ, оже-терапия | ε+β+ (100%) | 151Eu(α, 4n) 152Tb | Ц | [4] |
| 155Tb | 5.32 | день | ОФЭКТ, оже-терапия | ε | natGd(α, x) 155Dy → 155Tb | Ц | [5] |
| 201Tl | 3.04 | день | ОФЭКТ | ε | 203Tl(p, 3n) 201Pb → 201Tl | Ц | |
| 203Pb | 2.16 | день | Сцинтиграфия | ε | natTl(p, x) 203Pb | Ц | |
| Терапевтические радионуклиды | |||||||
| 103Ru | 39.26 | день | Бета-терапия | β | 100Th(4He, x) 103Ru | Ц | |
| 119Sb | 38.19 | час | Оже-терапия | ε | natSn(α, x) 119Te(16.03 ч) 119Sb | Ц | |
| 131I | 8 | день | Бета-радиотерапия (тераностика) | β- | 130Te(n, γ) 131Te → 131I 235U(n, f) 131I |
Р | |
| 161Tb | 6.89 | день | Бета-радиотерапия | β- | 160Gd (n, γ) 161Gd (3.66 мин) → 161Tb | Р | |
| 161Ho | 2.48 | час | Оже-терапия | ε | natDy(α, x) 161Er → 161Ho | Ц | |
| 167Tm | 9.25 | день | Оже-терапия | ε | natEr(α, 2n) 167Yb(17.5 мин) 167Tm 165Ho(α, 2n)167Tm | Ц | [9, 10] |
| 165Er | 10.36 | час | Оже-терапия | ε | 165Ho(α, 4n) 165Tm (30.06 ч) → 165Er(10.36 ч) | Ц | |
| 177Lu | 6.6443 | дн | β-терапия | β- | 176Yb(n, γ) 177Ybβ → 177Lu | Р | |
| Р | |||||||
| 186Re | 3.7183 | день | Бета-радиотерапия, тераностика | β- (7.47%) ε (92.53%) |
186W(d, 2n) 186Re | Ц | [6–8] |
| 188Re | 3.7183 | день | Бета-радиотерапия (тераностика) | β- (7.47%) ε (92.53%) |
186W(2n, γ) 188W → 188Re | Р | |
| 211At | 7.2 | час | Альфа-радиотерапия | Ε (58.2%) α (41.8%) |
209Bi(α, 2n)211At | Ц | |
| 212Pb | 10.64 | час | Бета-радиотерапия | β- | 232Th(p, x)228Th(_ч) → 212Pb | Ц | |
| 233U(50 лет) → 228Th/212Pb | – | ||||||
| 223U | 55 | мкс | Альфа-радиотерапия | α | 232Th(1H, 3n)230 Pa → 223U | Ц | |
| 225Ac | 45.6 | мин | Терапия, тераностика | β- | 232Th(p, 2p xn)225Ac | Ц | |
2.1. Реакторный комплекс
Ядерным реакторам НИЦ “Курчатовский институт” всегда отводилась значимая роль, связанная не только с наработкой радиоактивных изотопов, в том числе применяемых для медицинских целей, но и отработкой и усовершенствованием технологий их получения.
На реакторах проводилась наработка 198Au и 51Cr для последующего производства РФЛП на заводе “Медрадиопрепарат”, а также нарабатывался широкий спектр других радионуклидов медицинского назначения. В 1980-х годах на основе стабильного изотопа 98Mo, полученного центрифужным методом, в Институте атомной энергии им. И.В. Курчатова была разработана и внедрена в Институте геохимии и аналитической химии им. В.И. Вернадского АН СССР технология производства 99Mo и генератора 99mTc большой активности. Пертехнетат натрия, производившийся по этой технологии, поступал в большинство московских отделений радионуклидной диагностики. Сегодня РФЛП, меченные 99mTc, применяются примерно в 80% всех диагностических процедур однофотонной эмиссионной компьютерной томографии. Поэтому разработка новых эффективных методов получения технеция-99m с использованием реакторов и циклотронов является важной задачей в области ядерной медицины.
С помощью ядерного реактора ИР-8 налажено производство радионуклидов для медицинского применения 152Eu, 198Au, 127Xe, 99mTc, 191Os, 186Re, 197Hg, 153Sm, 51Cr.
Сегодня реактор ИР-8 имеет 12 горизонтальных экспериментальных каналов для вывода нейтронных пучков и 29 вертикальных каналов в активной зоне и отражателе. Максимальная плотность потока тепловых нейтронов в экспериментальном канале активной зоны ~1.5 × 1014 с–1 см–2, отражателя ~2.0 × 1014 с–1 см–2. Максимальная плотность потока быстрых нейтронов (E ≥ 0.5 МэВ) в экспериментальном канале активной зоны ~1.1 × × 1014 с–1 см–2, отражателя ~4.8 × 1013 с–1 см–2.
Наиболее перспективной представляется наработка лютеция-177 (177Lu). Этот изотоп является одним из наиболее востребованных терапевтических бета-излучающих радионуклидов для терапии рака, обладает удобным периодом полураспада (T1/2 = 6.71 сут), приемлемой энергией β-частиц (Eмакс = 0.497 МэВ), мягким сопутствующим γ-излучением (Eγ = 113 кэВ (6.4%) и 208 кэВ (11%)). Небольшая длина пробега β-частицы 177Lu в биологических тканях (1–3 мм) обеспечивает избирательное уничтожение опухоли при минимальном повреждении окружающих тканей.
В результате совместной работы сотрудников НИЦ “Курчатовский институт”, Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН и ООО “Технологии медицинских полимеров” были созданы два РФЛП на основе искусственного адресного полипептида ZHER2, специфичного к опухолевому маркеру HER2/neu, и радиоизотопов 177Lu (ZHER2-ЧСА-хелатор-177Lu) и 212Pb (ZHER2-ЧСА-хелатор-212Pb).
Помимо 177Lu на ИР-8 можно нарабатывать такие радионуклиды, как 161Tb, 67Cu и многие другие.
В НИЦ “Курчатовский институт” ведутся разработки малоотходных технологий производства осколочных радионуклидов медицинского назначения в растворных реакторах. Для проведения указанных работ имеется необходимая экспериментальная база – исследовательский растворный мини-реактор “Аргус” тепловой мощностью 20 кВт, успешно эксплуатируемый с 1981 г., радиохимическое оборудование и специализированные помещения для работы с радионуклидами.
Агрегатное состояние топлива – водного раствора уранилсульфата UO2SO4 – открывает уникальную возможность селективно отбирать целевые радиоизотопы 89Sr, 99Mo, 131I, 133Xe из топливного раствора, не затрагивая ни 235U, ни основную группу осколочных элементов. Это приведет к резкому снижению расхода делящихся материалов в технологическом процессе и выхода высокоактивных отходов. Оценки показывают, что растворный реактор тепловой мощностью ~50 кВт может обеспечить значительную долю современных потребностей РФ в таких важнейших медицинских радиоизотопах, как 89Sr и 99Mo, при резком снижении их себестоимости.
2.2. Ускорительный комплекс
Уникальные возможности НИЦ “Курчатовский институт” в области ускорительных технологий позволяют решать широкий спектр фундаментальных и прикладных исследований, связанных с наработкой диагностических и терапевтических радионуклидов.
Изохронный циклотрон НИЦ “Курчатовский институт” (Циклотрон У-150) работает с 1947 г. и является единственной в Российской Федерации универсальной циклотронной установкой, предназначенной для получения ускоренных пучков заряженных частиц от ионов водорода до ионов кремния. Основные характеристики циклотрона У-150 приведены в табл. 2.
Таблица 2.
Основные характеристики циклотрона У-150
| Тип ионов | Максималь-ная энергия, МэВ | Интенсивность (максимальная), мкА |
|---|---|---|
| Протоны (H+) | 35 | 30 (50) |
| Дейтроны (2H+) | 20 | 30 (30) |
| Ионы гелия-3 (3He+2) | 70 | 20 (30) |
| α-частицы (4He+2) | 60 | 15 (40) |
При таких параметрах циклотрона можно производить практически все наиболее востребованные в ядерной медицине циклотронные радионуклиды.
На сегодня на циклотроне У-150 реализованы следующие технологии производства радионуклидов:
− производство 201Tl из 203Tl (твердотельная мишень);
− производство 123I из 124Xe (газовая мишень).
Также проводятся научно-исследовательские работы, связанные с наработкой следующих изотопов: 149Tb, 152Tb, 155Tb, 211At, 67Cu, 186Re, 89Zr, 111In, 67Ga, 47Sc, 117mSn, 119Sb, 64Cu, 68Ge, 124I, 68Y, 82Sr, 44Ti [7–10].
На базе ускорителя У-150 проведены исследования различных ядерных реакций, приводящих к образованию инновационных радионуклидов, таких как 167Tm, 165Er, 169Yb [11–13].
Также предложены новые способы получения трех изотопов тербия – 149Tb, 152Tb, 155Tb. Сочетание компетенций в области ядерной физики и радиохимии позволило установить оптимальные условия производства этих радионуклидов и разработать методики их радиохимического выделения.
Изотопы тербия (149Tb, 152Tb, 155Tb, 161Tb) представляют особый интерес, так как наличие разных типов излучений и различие в периодах полураспада позволяют создать линейку радиофармпрепаратов, направленных на диагностику и лечение различных видов рака. Сегодня НИЦ “Курчатовский институт” совместно с Московским государственным университетом им. М.В. Ломоносова и Санкт-Петербургским политехническим университетом Петра Великого ведет разработку отечественного инновационного тераностического препарата на основе изотопов тербия для проведения радиоиммунной терапии злокачественных новообразований различного гистологического типа.
Кроме того, 152Tb может быть использован как изотопная пара к 177Lu. Благодаря позитронному излучению 152Tb можно методом позитронно-эмиссионной томографии (ПЭТ) выявить пациентов, имеющих отклик к терапевтическому препарату на основе 177Lu и рассчитать необходимую дозировку препарата [14]. Таким образом, применение новых радионуклидов и их комбинаций позволяет реализовать концепцию персонализированной медицины.
Кроме того, Курчатовский циклотрон У-150 является единственным поставщиком медицинского изотопа 123I для производства радиофармпрепаратов для клиник г. Москвы и Московского региона. Важно отметить высокую социальную значимость РФЛП на основе 123I при диагностике онкологических заболеваний у детей, в том числе характеризующихся агрессивным клиническим течением, таких как нейробластомы. Кроме того, разработанный научным коллективом У-150 в 2021 г. метод облучения мишени 124Xe позволил сегодня увеличить в ~2–3 раза производительность получения 123I.
В НИЦ “Курчатовский институт” также установлен автоматизированный компактный ускоритель отрицательных ионов Eclipse HP Cyclotron (энергия до 11 МэВ) для производства ПЭТ-радионуклидов 18F, 11C, 13N, 15O. Регулярно проводится облучение жидкостных мишеней для производства РФЛП, меченных 18F. Циклотрон является базовой установкой ПЭТ-центра, функционирующего на московской площадке Курчатовского института.
Еще один изохорный циклотрон Ц-80 с энергией выведенного протонного пучка 40–80 МэВ и интенсивностью до 100 мкА расположен в г. Гатчина, Ленинградская область. Его запуск был проведен в 2017 г., сегодня ведутся работы по его модернизации с целью создания на базе Ц-80 радиоизотопного комплекса, позволяющего обеспечить производство широкого спектра медицинских циклотронных радионуклидов для лечения целого ряда онкологических, кардио-сосудистых, неврологических и офтальмологических заболеваний.
2.3. Генераторы радионуклидов
Одним из способов получения альфа-излучателей для точечной радиоиммунотерапии является радиохимическое выделение из долго выдержанного сырьевого материала 233U. По совокупности ядерно-физических и медико-биологических параметров наиболее перспективными альфа-излучателями считаются 213Bi и 225Ас. 213Bi является продуктом распада цепочки радионуклидов, начальный элемент которой 229Th может быть получен, например, из старых запасов 233U. Специалистами Курчатовского института совместно с сотрудниками Объединенного института ядерных исследований разработаны генераторные способы получения 225Ас из 229Th, 213Bi из 225Ас и 212Pb из 228Th.
2.4. Производство и контроль качества радиофармацевтических лекарственных препаратов
Со дня основания в НИЦ “Курчатовский институт” реализуется междисциплинарный подход, нацеленный на замкнутый цикл: от проведения фундаментальных исследований до внедрения конечных технологий.
Сегодня в Курчатовском институте на базе циклотрона Eclipse HP создано производство серии РФЛП для диагностики злокачественных заболеваний методом ПЭТ на основе 18F. Это 18F-фтордезоксиглюкоза, 18F-PSMA-1007, 18F-фторхолин. Для получения РФЛП используются автоматические модули синтеза, установленные в защитных боксах. Препарат производится постоянно и применяется в медицинских учреждениях Москвы. Производство и контроль качества осуществляются в соответствии с требованиями GMP (Good Medical Practice).
Создание новых РФЛП невозможно без проведения полноценных доклинических исследований на животных. Сегодня на базе НИЦ “Курчатовский институт” – ПИЯФ успешно функционирует исследовательский комплекс отделения молекулярной и радиационной биофизики, имеющий в своем составе центр доклинических и клинических исследований (ЦДКИ) – опытно-производственную научную лабораторию мирового уровня, включающую в себя экспериментально-биологическую клинику и радиофармакологический блок. ЦДКИ позволяет проводить полный цикл фундаментальных, скрининговых и доклинических исследований лекарственных препаратов различных фармакологических групп и их компонентов (за исключением работ с особо опасными инфекциями и наркотическими и психотропными соединениями), средств ядерной медицины (2 класс работ с источниками ионизирующего излучения) с их последующим внедрением в клиническую практику в соответствии с принципами Good Laboratory Practice, национальными и международными стандартами.
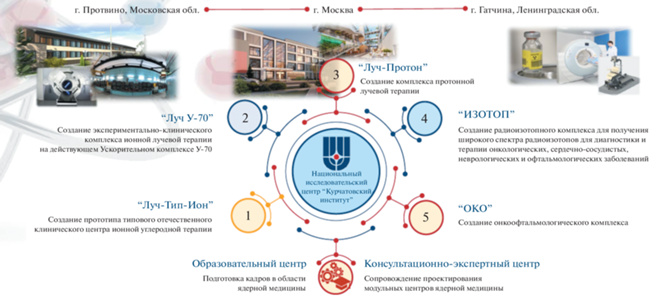
В рамках реализации ФНТП планируется расширение имеющегося потенциала в рамках реализации проектов “ОКО”–“ИЗОТОП” – модернизация циклотрона Ц-80, на базе которого будет создан типовой радиохимический комплекс по наработке радионуклидов с последующим синтезом РФЛП на их основе, а также запланировано создание четырех комплексов адронной терапии, входящих в состав НОМЦ ЯМ НИЦ “Курчатовский институт”, а именно:
– комплекс протонной лучевой терапии НИЦ “Курчатовский институт”, г. Москва (проект “Луч-Протон”);
– онкоофтальмологический комплекс ПЛТ на базе циклотрона Ц-80 НИЦ “Курчатовский институт” – ПИЯФ, г. Гатчина (проект “ОКО”);
– экспериментально-клинический комплекс ионной лучевой терапии на базе действующего ускорительного комплекса У-70 НИЦ “Курчатовский институт” – ИФВЭ, г. Протвино (проект “Луч У70”);
– прототип типового комплекса ионной лучевой терапии в составе типового клинического центра ионной (углеродной) лучевой терапии с целью последующего тиражирования в регионах РФ НИЦ “Курчатовский институт” – ИФВЭ, г. Протвино (проект “Луч-Тип-Ион”).
3. УСТАНОВКИ КУРЧАТОВСКОГО НАУЧНО-ОБРАЗОВАТЕЛЬНОГО МЕДИЦИНСКОГО ЦЕНТРА ЯДЕРНОЙ МЕДИЦИНЫ
3.1. Комплекс по наработке радионуклидов на базе циклотрона Ц-80
Создание инновационного радиоизотопного комплекса на базе действующего циклотрона Ц-80 (“ИЗОТОП”), расположенного на территории НИЦ “Курчатовский институт” – ПИЯФ, предназначено для наработки широкого спектра медицинских радионуклидов, используемых при диагностике и терапии онкологических заболеваний. Основные параметры протонного пучка, используемого для наработки радионуклидов, приведены в табл. 3. Радионуклиды, планируемые к получению в рамках реализации проекта “ИЗОТОП”, представлены в табл. 4 и 5.
Таблица 3.
Параметры протонного пучка
| Параметр | Значение |
|---|---|
| Энергия протонов, МэВ | 40–80 |
| Максимальная интенсивность, мкА | 100 |
| Диаметр на входе в мишень, мм | 20–50 |
| Неравномерность плотности тока по сечению, % | не более ±3 |
| Максимальное время облучения в непрерывном режиме, ч | 300 |
Таблица 4.
Радионуклиды, планируемые к получению
| Наименование | T1/2 | Активность (Ки) |
|---|---|---|
| 68Ge | 270.8 дн. | 2 |
| 82Sr | 25.55 дн. | 14 |
| 99Тс | 6.0 ч | 8 |
| 64Cu | 12.4 дн. | 26 |
| 67Cu | 2.58 дн. | 8 |
| 212Bi | 1.01 ч | 0.45 |
Таблица 5.
Радионуклиды, планируемые к получению изотопически чистыми (с использованием масс-сепаратора)
| Наименование | T1/2 | Активность (Ки) |
|---|---|---|
| 111In | 2.8 дн. | 14 |
| 123I | 13.27 ч | 25 |
| 124I | 4.17 дн. | 60 |
| 149Tb | 4.1 ч | 3 |
| 223Ra | 11.4 дн. | 3 |
| 224Ra | 3.66 дн. | 0.45 |
| 225Ac | 10.0 дн. | 0.12 |
Создаваемый радиоизотопный комплекс будет иметь в своем составе следующее новое оборудование и системы:
− инновационная масс-сепараторная мишенная станция;
− мишенная станция для высокотемпературного выделения целевых радионуклидов;
− мишенная станция для радиохимического выделения целевых радионуклидов.
План расположения основных узлов технологического оборудования схематически представлен на рис. 4.
Подобный уникальный комплекс позволит обеспечить наработку как генераторных радионуклидов 82Sr и 68Ge, так и альфа-эмиттеров высокой частоты 225Ac для терапии злокачественных образований на ранней стадии. Кроме того, подобный комплекс позволит получать широкий спектр радионуклидов, включая 212Pb, 223Ra, 224Ra, а в перспективе создать инновационную GMP-лабораторию для организации замкнутого цикла по разработке и производству РФЛП.
Назначение инновационного радиоизотопного комплекса на базе действующего циклотрона Ц-80 не ограничивается получением широкого спектра радиоизотопов и изотопически чистых медицинских радионуклидов с использованием инновационного масс-сепараторного метода. Планируется многолетнее использование комплекса для разработки перспективных методов получения радионуклидов для диагностики и терапии различных онкологических и других заболеваний, проведение образовательных программ и подготовка высококвалифицированных кадров.
3.2. Комплекс протонной лучевой терапии
Создание комплекса протонной лучевой терапии (“Луч-Протон”), размещаемого на территории НИЦ “Курчатовский институт”, предназначено для многолетних разработок оборудования и технологий ПЛТ новых поколений и подготовки кадров (медицинских физиков и клиницистов).
Основные параметры комплекса протонной лучевой терапии (Комплекс ПЛТ) НИЦ “Курчатовский институт” приведены в табл. 6.
Таблица 6.
Основные характеристики комплекса “Луч-Протон”
| Наименование параметра установки | Значение | |
|---|---|---|
| 1 | Ускорительный комплекс | |
| 1.1 | Ускоритель | Протонный синхротрон |
| 1.2 | Энергия ускоренных протонов | 70–250 МэВ |
| 1.3 | Интенсивность | 5 × 1010 протонов в секунду |
| 2 | Лучевая установка Гантри | |
| 2.1 | Энергия протонов | 70–250 МэВ |
| 2.2 | Поворот протонного пучка | ±185° |
| 2.3 | Система формирования дозового распределения | активно/пассивная |
| 2.4 | Максимальный размер дозового распределения | 25 × 25см2 |
| 2.5 | Система позиционирования | 2D- и 3D-система рентгеновского позиционирования |
| 2.6 | Позиционер | 6D-стол позиционер |
| 2.7 | Локализации | – голова, шея; – новообразования абдоминальной области |
| 3 | Лучевая установка с фиксированным направлением протонного пучка | |
| 3.1 | Энергия протонов | 70–250 МэВ |
| 3.2 | Система формирования дозового распределения | пассивная |
| 3.3 | Максимальный размер дозового распределения | 25 × 25см2 |
| 3.4 | Система позиционирования | 2D-система рентгеновского позиционирования |
| 3.5 | Позиционер | кресло позиционер |
| 3.6 | Локализации | – голова, шея; – внутриглазные новообразования; – новообразования орбиты глаза |
Концепцией создания комплекса “Луч-Протон” предусмотрены разработка и оснащение комплекса тремя основными элементами оборудования – ускоритель с каналами транспортировки протонных пучков в два процедурных помещения, лучевая установка гантри для многопольного облучения пациента в положении лежа и лучевая установка с фиксированным в горизонтальной плоскости направлением протонного пучка для облучения пациента в положении сидя.
В качестве ускорителя для Комплекса ПЛТ НИЦ “Курчатовский институт” будет разработан протонный синхротрон, позволяющий осуществлять выбор энергии выводимых из него пучков протонов в диапазоне от 70 до 250 МэВ и изменять ее от одного цикла ускорения к другому. Таким образом, вывод протонов не при максимальной, как в циклотроне, а при требуемой для конкретного пациента энергии и высокая эффективность вывода делают протонный синхротрон более удобной машиной в эксплуатации и более безопасной в радиационном смысле.
Отметим, что гибкая конфигурация Комплекса “Луч-Протон” (рис. 5) предлагает комплексное и настраиваемое решение для ПЛТ, позволяет оснащать как однокабинные, так и многокабинные центры в соответствии с клиническими и исследовательскими задачами. Возможные варианты процедурных кабинетов включают в себя гантри полного (на 360°) поворота протонного пучка, кабинета с фиксированным направлением протонного пучка для проведения терапии пациентов с новообразованиями глаза, головы и шеи в положении сидя, исследовательские кабинеты для неклинического применения пучка протонов.
Оборудование и технологии ПЛТ в последние три десятилетия во всем мире постоянно совершенствуются, предлагаются и отрабатываются новые, зачастую принципиальные решения, которые затем внедряются в рутинную практику лечения. В соответствии с этой общемировой тенденцией назначение Комплекса ПЛТ НИЦ “Курчатовский институт” не ограничивается созданием опытного образца типового клинического центра ПЛТ. Планируется долговременное многолетнее использование Комплекса ПЛТ НИЦ “Курчатовский институт” для развития проблемы – разработки и испытаний новых аппаратных средств и технологий ПЛТ, а также подготовки кадров.
3.3. Онкоофтальмологический комплекс протонной лучевой терапии на базе циклотрона Ц-80
Создание онкоофтальмологического комплекса на базе действующего циклотрона Ц-80, размещаемого на территории НИЦ “Курчатовский институт” – ПИЯФ (“ОКО”), предназначено для обеспечения высокотехнологичными средствами лечения пациентов со сложными онкоофтальмологическими заболеваниями Северо-Западного региона России и частично из других регионов страны. Основные параметры онкоофтальмологического комплекса на базе действующего циклотрона Ц-80 приведены в табл. 7.
Таблица 7.
Основные характеристики комплекса “ОКО”
| Наименование | Значение |
|---|---|
| Энергия протонов | 70 МэВ |
| Интенсивность | 1.0–1.5 мкА |
| Диаметр | 60 мм |
| Расходимость | не более 3 мрад |
| Неравномерность плотности тока по сечению | не более ±3% |
| Высота оси пучка относит пола процедурного кабинета | 1500 мм |
| Система формирования дозового распределения | пассивная |
| Система позиционирования | 2D-система рентгеновского позиционирования |
| Позиционер | кресло позиционер |
| Локализации | – внутриглазные новообразования; – новообразования орбиты глаза |
Создаваемый онкоофтальмологический комплекс будет иметь в своем составе следующее новое оборудование и системы:
− инновационное кресло-позиционер с системой управления;
− устройство транспортировки терапевтического протонного пучка от ускорителя к лучевой установке (ЛУ);
− устройства формирования дозового поля;
− система мониторинга пучка и поглощенной дозы;
− система позиционирования пациента;
− программно-аппаратный комплекс (ПАК), интегрированный в автоматизированную систему управления технологическим процессом и лучевой установкой (АСУ ТП и АСУ ЛУ);
− помещение для подготовки пациентов к процедуре.
Предполагаемый план расположения основных узлов технологического оборудования схематически представлен на рис. 6.
В результате реализации проекта северо-западный регион России будет обеспечен высокотехнологичными медицинскими средствами лечения сложных онкоофтальмологических заболеваний: внутриглазных новообразований, новообразований орбиты и придаточного аппарата глаза.
3.4. Экспериментально-клинический комплекс ионной лучевой терапии на базе действующего ускорительного комплекса У-70
Создание экспериментально-клинического комплекса ионной лучевой терапии (Комплекс ИЛТ) на базе действующего ускорительного комплекса У-70 (“Луч У-70”), размещаемого на территории НИЦ “Курчатовский институт” – ИФВЭ, предназначено для отработки технологии лечения пучком ионов углерода пациентов с радиорезистентными онкологическими новообразованиями. В дальнейшем данный центр будет также использоваться для многолетних разработок оборудования и технологий ИЛТ новых поколений и подготовки кадров (медицинских физиков и клиницистов).
Основные параметры экспериментально-клинического комплекса ионной лучевой терапии на базе действующего ускорительного комплекса У-70 НИЦ “Курчатовский институт” – ИФВЭ приведены в табл. 8.
Таблица 8.
Основные параметры экспериментально-клинического комплекса ионной лучевой терапии
| Наименование | Значение |
|---|---|
| Кинетическая энергия ионов 12C6+ МэВ на нуклон | 150–450 |
| Пробег в воде максимальный | 280 мм в мишени |
| Пробег в воде минимальный | 50 мм |
| Точность подстройки пробега | 1 мм |
| Средняя мощность дозы | 2 Гр/мин |
| Размер поля облучения | 200 × 200 мм2 |
| Максимальный облучаемый объем | 2 л |
| Равномерность дозы | ±2.5% |
| Система вывода пучков из ускорителя | медленный вывод, синхронный с дыханием пациента |
| Количество процедурных кабин | ≥3 |
| Предполагаемые направления пучков, направляемых на мишень |
2 горизонтальных (0°) 1 наклонное (до 45°) |
| Время укладки пациента | 30 мин |
| Время облучения пациента | 2–3 мин |
В качестве ускорителя для экспериментально-клинического комплекса ионной лучевой терапии будет использована действующая ускорительная инфраструктура У-70 НИЦ “Курчатовский институт” – ИФВЭ.
Создаваемый экспериментально-клинический комплекс будет иметь в своем составе следующее новое оборудование и системы:
− комплекты магнитооптического оборудования для формирования и транспортировки углеродного пучка в три медицинские кабины;
− растровые системы формирования полей облучения для лечения по двум методикам: облучение “широким” и “узким” (карандашным) пучками;
− сертифицированные комплекты оборудования для дозиметрического (верификация дозы облучения) и рентгеновского (верификация зон облучения) сопровождения терапии;
− три медицинские кабины с комплексом медицинского оборудования;
− прецизионный шестикоординатный стол для позиционирования пациента (в каждой медицинской кабине) согласно рис. 7.
Конфигурация комплекса представлена на рис. 8.
Назначение Комплекса “Луч У-70” не ограничивается клинической апробацией технологий лечения онкологических новообразований с использованием ИЛТ. Планируются многолетнее использование Комплекса для разработки протоколов лечения онкологических новообразований различных нозологий, устойчивых к другим видам излучений, используемым в лучевой терапии, проведение образовательных программ и подготовка высококвалифицированных кадров.
3.5. Прототип типового комплекса ионной лучевой терапии
Создание прототипа типового комплекса ионной лучевой терапии (“Луч-Тип-Ион”), размещаемого на территории НИЦ “Курчатовский институт” – ИФВЭ, предназначено для освоения и отработки технологии поточного лечения пучком ионов углерода радиорезистентных онкологических новообразований с целью дальнейшего тиражирования.
Основные параметры синхротрона для прототипа типового комплекса ионной лучевой терапии НИЦ “Курчатовский институт” – ИФВЭ приведены в табл. 9.
Таблица 9.
Основные параметры синхротрона для прототипа типового комплекса ионной лучевой терапии
| Наименование | Значение |
|---|---|
| Кинетическая энергия ионов 12C6+МэВ на нуклон | 150–430 |
| Максимальная магнитная жесткость Bρ, Тл м | 6.62 |
| Максимальное поле в поворотных магнитах B, Тл | 1.3–1.4 |
| Радиус кривизны орбиты в поворотных магнитах ρ, м | 5.10 |
| Длина орбиты Π, м | 79.92 |
| Средний радиус орбиты R = Π/2π, м | 12.7 |
| Отношение длины магнитной дорожки к периметру орбиты, 2πρ/Π = ρ/R | 0.4 |
| Количество суперпериодов магнитной структуры | 6 |
| Количество поворотных магнитов D (15°) | 24 |
| Структура фокусировки | FODO (π/2) |
| Количество квадрупольных линз, из них: | 36 |
| фокусирующих QF, | 18 |
| дефокусирующих QD | 18 |
Концепцией создания комплекса “Луч-Тип-Ион” предусмотрены разработка и оснащение комплекса следующим новым оборудованием и системами:
− специализированный углеродный синхротрон для лучевой терапии;
− комплекты магнитооптического оборудования формирования и транспортировки углеродного пучка в три медицинские кабины;
− растровые системы формирования дозового поля облучения для лечения по методике сканирования опухоли “узким” (карандашным) пучком;
− сертифицированные комплекты оборудования для дозиметрического (верификация дозы облучения) и рентгеновского (верификация зон облучения) сопровождения терапии;
− прецизионный шестикоординатный стол для позиционирования пациента (в каждой медицинской кабине).
Компоновку комплекса предполагается реализовать аналогичной уже действующим ионным комплексам The Heidelberg Ion Therapy Center (HIT) и The Marburg Particle Therapy Center (MIT) в Германии и применить отечественные апробированные технические решения, такие как источник ионов, инжектор, линейный ускоритель и другие системы синхротрона.
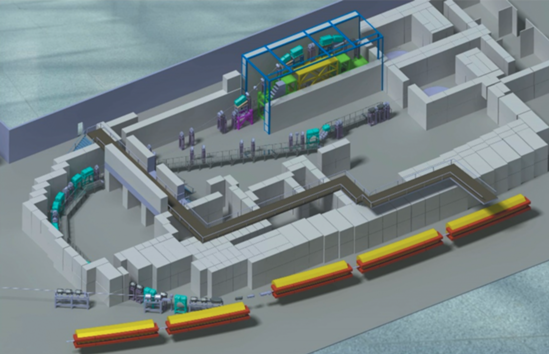
На рис. 9 показано компоновочное решение, которое реализуется при проектировании.
Рис. 9.
Вид ионного лучевого терапевтического комплекса с тремя горизонтальными пучками и одним пучком 45o в вертикальной плоскости.

Система каналов транспортировки обеспечивает доставку пучка ионов углерода от синхротрона к трем медицинским процедурным кабинам.
Две процедурные кабины предполагается использовать для облучения пациентов горизонтальными пучками (0°), а третью – горизонтальным пучком и наклонным пучком с углом наклона 45° в вертикальной плоскости.
Оборудование и технологии ИЛТ в последние три десятилетия во всем мире постоянно совершенствуются, предлагаются и отрабатываются новые, зачастую принципиальные решения, которые затем внедряются в рутинную практику лечения. В соответствии с этой общемировой тенденцией назначение Комплекса ИЛТ “Луч-Тип-Ион” не ограничивается созданием опытного образца типового клинического центра ИЛТ. Планируется многолетнее использование Комплекса ИЛТ “Луч-Тип-Ион” для поточного лечения пациентов и развития проблемы – разработки протоколов лечения онкологических новообразований различных нозологий, устойчивых к другим видам излучений, используемым в лучевой терапии, а также подготовки кадров.
4. РЕАЛИЗАЦИЯ КЛАСТЕРНОГО ПОДХОДА В ОБЛАСТИ ЯДЕРНОЙ МЕДИЦИНЫ НА БАЗЕ НАУЧНО-ТЕХНОЛОГИЧЕСКОЙ ИНФРАСТРУКТУРЫ НИЦ “КУРЧАТОВСКИЙ ИНСТИТУТ”
Уже сегодня проекты, реализуемые на базе НИЦ “Курчатовский институт”, позволяют говорить об активном развитии в стране направления ядерной медицины и внедрении единого кластерного подхода, позволяющего сформировать междисциплинарную платформу для введения полного цикла создания ядерных и ускорительных технологий от научно-исследовательских и опытных разработок до их внедрения и применения в клинической практике, а также снижения барьеров выхода на новые сегменты рынка товаров за счет стандартизации и унификации требований, обеспечения комплексного подхода в рамках кластера.
В рамках реализации ФНТП подобный кластер будет сформирован на основе описанного выше НОМЦ ЯМ НИЦ “Курчатовский институт” (рис. 10), представляющего собой научную и физико-техническую базу для разработки и создания отечественного типового клинического модульного (с возможностью вариабельности структуры и состава отделений) центра ядерной медицины для субъектов Российской Федерации.
В Курчатовском НОМЦ ЯМ с привлечением при необходимости профильных научных, образовательных и медицинских организаций будет проводиться не только разработка, но и клиническая апробация и отработка современных методов диагностики и лечения пациентов, основанных на применении ядерных технологий и соответствующего отечественного оборудования.
Учитывая имеющий место кадровый дефицит российского здравоохранения, подобный центр, оснащенный широким спектром современной радиологической аппаратуры и располагающий высококвалифицированными специалистами, будет, несомненно, обладать высоким потенциалом для организации образовательной деятельности. В качестве образовательной базы будет использоваться уже имеющаяся инфраструктура НИЦ “Курчатовский институт” и создаваемая в рамках ФНТП, а также клиническая база медицинских организаций – партнеров.
Кроме того, подобная инфраструктура позволит обеспечить научно-методическое, физико-техническое и экспертное сопровождение при проектировании модульных клинических центров ядерной медицины.
Таким образом, возможность тиражирования и оснащения российского здравоохранения подобными типовыми центрами ядерной медицины позволит существенно повысить доступность высокотехнологичной медицинской помощи в стране и внесет существенный вклад в достижение национальных целей, определенных Указом Президента Российской Федерации от 21 июля 2020 г. № 474 “О национальных целях развития Российской Федерации на период до 2030 года”.
ЗАКЛЮЧЕНИЕ
Современное развитие ядерной медицины и медицинской радиологии неразрывно связано с применением междисциплинарных подходов, обеспечением доступности широкого спектра нового оборудования и методов, а также оперативным внедрением соответствующих инновационных технологий и методик в медицинскую практику.
Основоположник развития ядерной медицины и лучевой терапии в нашей стране НИЦ “Курчатовский институт” на сегодня представляет собой место консолидации трех ключевых составляющих, необходимых для создания новых поколений оборудования и методов в области ядерной медицины и лучевой терапии: знания и компетенции в области создания и внедрения ядерных и ускорительных технологий, уникальная ядерно-физическая инфраструктура и высококвалифицированные специалисты, обладающие богатым междисциплинарным опытом работы.
Создание НОМЦ ЯМ позволит значительно расширить имеющийся потенциал за счет разработки и внедрения современного оборудования отечественного производства, а также создания прототипа типового клинического центра ядерной медицины. Кроме того, реализация кластерного подхода в рамках данного проекта позволит сформировать междисциплинарную платформу для внедрения полного цикла создания ядерных и ускорительных технологий: от научно-исследовательских и опытных разработок до применения их в клинической практике.
Таким образом, возможность тиражирования и оснащения российского здравоохранения подобными типовыми центрами ядерной медицины на базе отечественного оборудования позволит существенно повысить доступность высокотехнологичной медицинской помощи в стране и внесет существенный вклад в достижение национальных целей.
Список литературы
Агеева Л.И., Александрова Г.А., Голубев Н.А. и др. // Росстат. 2021. С. 37.
Gordon K.B., Smyk D.I., Gulidov I.А. // Современные технологии в медицине. 2021. Т. 13. № 4. С. 70. https://doi.org/10.17691/stm2021.13.4.08
Забелин М.В., Климанов В.А., Галяутдинова Ж.Ж. и др. // Исследования и практика в медицине. 2018. Т. 5. № 1. С. 82. https://doi.org/10.17709/2409-2231-2018-5-1-10
Клёнов Г.И., Хорошков В.С. // Успехи физ. наук. 2016. Т. 186. № 8. С. 891.
Aliev R.A., Zagryadskiy V.A., Kormazeva E.S. et al. // Atomic. Energy.2021 V. 130. P. 36. https://doi.org/10.1007/s10512-021-00770-3
Moiseeva A.N., Aliev R.A., Kormazeva E.S. et al. // Appl. Radiat. Isot. 2021. V. 609–170. P. 109.
Kazakov A.G., Aliev R.A., Ostapenko V.S. et al. // J. Radioanal. Nucl. Chem. 2018. V. 605–11. P. 317.
Moiseeva A.N., Aliev R.A., Unezhev V.N. et al. // Sci. Rep. 2020. V. 10. P. 508.
Aliev R.A., Zagryadskiy V.A., Latushkin S.T. et al. // At. Energy. 2021. V. 326–8. P. 129.
Moiseeva A.N., Aliev R.A., Furkina E.B. et al. // Nucl. Med. Biol. 2021. V. 106–107. P. 52.
Kormazeva E.S., Khomenko I.A., Unezhev V.N., Aliev R.A. // Appl. Radiat. Isot. 2021. V. 177. P. 109.
Алиев Р.А., Кормазева Е.С., Фуркина Е.Б. и др. // Российские нанотехнологии. 2020. Т. 15. С. 451.
Aliev R.A., Khomenko I.A., Kormazeva E.S. // J. Radioanal. Nucl. Chem. 2021. V. 983–989. P. 329. https://doi.org/10.1007/s10967-021-07865-y
Moiseeva A.N., Aliev R.A., Unezhev V.N. et al. // Nucl. Instrum. Methods. B . 2021. V. 497. P. 59.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография