Кристаллография, 2022, T. 67, № 6, стр. 949-955
Компьютерное моделирование сложной границы твердооксидного топливного элемента: трехслойная гетеросистема Zr0.8Sc0.2O1.9|Ce0.9Gd0.1O1.95|Pr2CuO4
И. Ю. Готлиб 1, А. К. Иванов-Шиц 2, 3, *, И. В. Мурин 1
1 Санкт-Петербургский государственный университет, Институт химии
Санкт-Петербург, Россия
2 МГИМО МИД России
Москва, Россия
3 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
* E-mail: alexey.k.ivanov@gmail.com
Поступила в редакцию 29.03.2022
После доработки 06.04.2022
Принята к публикации 06.04.2022
- EDN: WNPPWG
- DOI: 10.31857/S002347612206008X
Аннотация
Трехслойная гетеросистема Zr0.8Sc0.2O1.9/Ce0.9Gd0.1O1.95/Pr2CuO4 изучена методом молекулярной динамики в расчетной ячейке размером ∼110 × 110 × 470 Å3. Показано, что для всех слоев сохраняются основные кристаллографические характеристики. Из анализа парных корреляционных функций следует, что в гетеросистеме во всех оксидных фазах наблюдается разупорядоченность кислородной подрешетки, что особенно ярко проявляется в оксидах циркония и церия. Рассчитанные значения послойных коэффициентов диффузии кислорода, а также энергии активации диффузии сравниваются с данными как прямых физических, так и компьютерных экспериментов. Прослежены индивидуальные пути перескоков анионов кислорода через межфазные границы Zr0.8Sc0.2O1.9/Ce0.9Gd0.1O1.95 и Ce0.9Gd0.1O1.95/Pr2CuO4.
ВВЕДЕНИЕ
Для решения глобальных энергетических и экологических задач большая роль отводится топливным элементам, которые преобразуют химическую энергию топлива и окислителя непосредственно в электрическую [1–3]. Однако технологические и экономические требования диктуют необходимость улучшения рабочих характеристик указанных устройств, в частности для твердооксидных топливных элементов (ТОТЭ) требуются снижение температуры рабочей области, повышение стабильности и надежности функционирования основных узлов топливных элементов. Например, для конструирования так называемых среднетемпературных ТОТЭ (СТ-ТОТЭ) рабочую температуру требуется понизить до 500–800°C: в этом случае можно использовать стандартную техническую керамику, уменьшить деградацию компонентов и снизить механические напряжения, вызванные температурными градиентами [4–7].
В свою очередь снижение рабочей температуры требует решения ряда задач, связанных с выбором материалов твердого электролита и катода, обладающих необходимыми характеристиками в интервале рабочих температур: высокая ионная проводимость электролита, минимальные поляризационные потери на границах электрод/электролит, высокие скорости обмена кислорода на катоде, отсутствие химического взаимодействия материалов, термическая совместимость материалов ТОТЭ. Одним из перспективных электролитов для СТ-ТОТЭ является оксид циркония, стабилизированный оксидом скандия Zr$_{{1--x}}$ScxO$_{{2--\delta }}$ (ScSZ) [8, 9], ионная проводимость (σ) которого при 500°С несколько выше аналогичной величины для стабилизированного оксидом иттрия диоксида циркония Zr$_{{1--x}}$YxO$_{{2--\delta }}$ (YSZ): 2.5 × 10–3 См см–1 против 1.1 × 10–3 См см–1). Отметим, что в ScSZ при снижении температуры до 500–700°С возможен фазовый переход из высокопроводящей кубической фазы в низкопроводящую ромбоэдрическую [3]. В результате этого перехода могут ухудшиться не только транспортные свойства электролита (σ снижается примерно на порядок), но и возникнуть механические напряжения в результате скачкообразного изменения объема элементарной ячейки. Для “подавления” этого перехода можно использовать введение в матрицу ScSZ небольшой концентрации допантов CeO2, Y2O3, CaO, Bi2O3 [10, 11].
В температурной области 500–800°С на границе катод/твердый электролит возрастает поляризационное сопротивление: например, для традиционного катодного материала манганита лантана–стронция, La$_{{1--x}}$SrxMnO3 (LSM), сопротивление увеличивается в сотни раз [12]. Поэтому существенная роль в улучшении характеристик СТ-ТОТЭ отводится поиску и исследованию новых электродных материалов среди проводников смешанного типа, которые обладают как высокой электронной, так и значительной кислород-ионной проводимостью [13, 14]. Легированные стронцием и кобальтом ферриты лантана и бария (La(Ba)$_{{1--x}}$SrxCo$_{{1--y}}$FeyO$_{{3--\delta }}$, LSCF и BSCF) благодаря своим высоким электролитическим характеристикам и хорошей стабильности рассматривались в качестве перспективных катодных материалов [15]. К сожалению, материал катода LSCF (и аналогичных оксидов на основе лантана–стронция) реагирует с электролитом из стабилизированного оксида циркония, образуя непроводящие цирконатные фазы (La2Zr2O7 или SrZrO3) на границе раздела катод–электролит [16]. Кроме того, катодные материалы типа LSM, LSCF, BSCF подвержены явлению “хромового отравления”, которое существенно ухудшает рабочие характеристики топливного элемента [16]. C целью улучшения кинетики поверхностного обмена кислорода и транспорта анионов кислорода в объеме материала рассматривались материалы со структурой двойного перовскита серии LnBaCo2O$_{{5 + \delta }}$ (Ln = = Pr, Ga, Nd) [18, 19]. Однако оксиды перовскита на основе кобальта термодинамически нестабильны, часто имеют высокие значения коэффицента термического расширения (КТР), что ограничивает их дальнейшее применение [15].
Поэтому внимание было обращено на поиск катодных материалов, не содержащих кобальт, но обладающих хорошей каталитической активностью [20]. С этой целью были изучены никель- и медьсодержащие оксиды с общей формулой А2МО4 (М = Ni, Cu), обладающие перовскитоподобными слоистыми структурами [21, 22].
Купраты на основе Ln2CuO4 (Ln – редкоземельный элемент) также рассматриваются как перспективные катодные материалы, причем наилучшие характеристики показывает Pr2CuO4 [23–26]. Легирование материала редкоземельными элементами позволяет улучшить транспортные характеристики (ионную и электронную проводимость, диффузию кислорода) и химическую устойчивость [27, 28]. Рассматривались различные способы конструирования катода: в виде композита Pr2CuO4–Ce0.9Gd0.1O1.95, нанесенного трафаретной печатью на электролит [29]; высокотекстурированные тонкие пленки чистого, а также допированного Ce и Sr, купрата празеодима, нанесенные на монокристаллические подложки YSZ [30]; пористый катод из микроволокон [31], композит Pr2CuO4–Pr6O11 [32].
Для того чтобы избежать протекания нежелательных химических реакций между оксидами катода и электролита, было предложено вводить дополнительный барьерный слой из допированного оксида церия. Таким образом удается предотвратить [33–37] несколько “вредных” процессов: образование плохопроводящих твердых фаз на границе катодов в процессе формирования элемента; диффузию катионов через границу и образование дополнительных нежелательных фаз в процессе эксплуатации топливного элемента.
Настоящее исследование является продолжением серии работ по компьютерному моделированию межфазных границ в топливных элементах [38–40]. Однако если ранее изучались двухслойные гетерофазные системы типа Ce$_{{1--x}}$GdxO$_{{2--\delta }}$/ScSZ, то сейчас рассматривается сложная граница электролит/электрод с дополнительным буферным слоем. В качестве твердоэлектролитной мебраны выбран стабилизированный скандием оксид циркония, купрат празеодима выполняет роль катода, а буферный слой между этими материалами представляет собой пленку оксида церия, стабилизированного гадолинием.
Такая система не только отвечает реально используемым в ТОТЭ электродам, но и позволяет изучить особенности ионного транспорта в наноструктурированных сложноорганизованных материалах.
МЕТОДЫ И ПОДХОДЫ
Моделирование гетеросистемы Zr0.8Sc0.2O1.9/ Ce0.9Gd0.1O1.95/Pr2CuO4 проводили следующим образом. Изучаемая трехслойная система состояла из слоя Zr0.8Sc0.2O1.9 толщиной ∼153 Å, слоя Ce0.9Gd0.1O1.95 (GDC) толщиной 166–167 Å и слоя Pr2CuO4 толщиной ∼150 Å, т.е. в целом ячейка имела толщину, которая варьировалась от ∼469.5 Å при 1200 K до ∼471 Å при 1700 K. Кристаллографические оси для флюоритоподобных кубических фаз ScSZ и GDC параллельны осям координат x, y, z; границы между фазами параллельны плоскости xy. Для фазы Pr2CuO4 (пр. гр. I4/mmm) оси a и c параллельны границе раздела (идут вдоль координатных осей x и y соответственно), а перпендикулярно ей (вдоль координатной оси z) направлена ось b. Исходная конфигурация строилась из 21 × 21 × 30 ячеек ScSZ, 20 × 20 × 30 ячеек GDC и 28 × 9 × 38 ячеек Pr2CuO4 (цифры показывают число ячеек вдоль координатных осей x, y и z соответственно). Ионы допанта (скандия в ScSZ, гадолиния в GDC) располагались в решетке случайным образом. На ячейку накладывались стандартные “орторомбические” периодические граничные условия.
Модельный потенциал строился путем комбинации ранее использовавшихся потенциалов для системы ScSZ/GDC [38, 39] и Pr2CuO4 [41]. Потенциальная энергия взаимодействия между ионами $U({{r}_{{ij}}})$ принималась равной сумме электростатического (кулоновского) и короткодействующего потенциала:
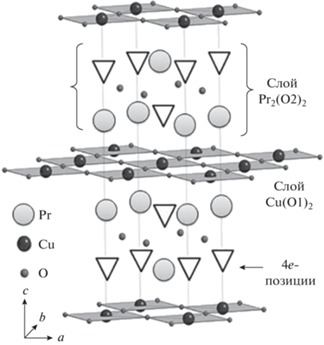
В фазе Pr2CuO4 различаются два типа ионов кислорода, O1 и O2, занимающие разное положение в решетке (рис. 1).
Рис. 1.
Кристаллическая структура Pr2CuO4 (треугольниками показаны дополнительные аксиальные позиции кислорода 4е).
Поэтому для двух типов ионов кислорода взаимодействие с ионами меди описывается разными короткодействуюшими параметрами [41]. Параметры всех остальных взаимодействий предполагаются одними и теми же для всех ионов кислорода в системе. Короткодействующую составляющую потенциала принимали отличной от нуля лишь для взаимодействий катион–анион и анион–анион. Значения параметров потенциала приведены в табл. 1 [38, 39, 41].
Таблица 1.
Значения параметров модельного потенциала
| Пары i–j | Zr–O | Sc–O | Ce–O | Gd–O | Pr–O | Cu–O1 | Cu–O (кроме Cu–O1) |
O–O |
|---|---|---|---|---|---|---|---|---|
| Aij, эВ | 1234.73 | 1575.85 | 1809.68 | 1885.75 | 2055.35 | 3950 | 460 | 2000 |
| ρij, Å | 0.358 | 0.3211 | 0.3547 | 0.3399 | 0.3438 | 0.228 | 0.353 | 0.284 |
| Cij, эВ Å6 | 0 | 0 | 20.4 | 20.34 | 23.95 | 0 | 0 | 100 |
Исходя из требований единообразного описания кулоновских взаимодействий с участием ионов кислорода и электронейтральности системы в целом, заряды катионов в фазах ScSZ и GDC были пропорционально изменены по сравнению с формальными значениями. Модельные заряды ионов показаны в табл. 2.
Таблица 2.
Модельные заряды катионов
| i | Zr | Sc | Ce | Gd | Pr | Cu | O |
|---|---|---|---|---|---|---|---|
| qi, e | 3.85 | 2.8875 | 3.85 | 2.8875 | 3.0 | 1.7 | –1.925 |
Расчеты проводили методом молекулярной динамики (МД) в анизотропном NpT-ансамб-ле при температурах 1200–1700 K и давлении 1000 атм. с использованием программного пакета DL_POLY [42]. Временной шаг при расчетах составлял 0.25 фс. В работе использовали процедуру высокотемпературного отжига расчетной системы с последующей перекристаллизацией, поскольку такой подход показал хорошие результаты при анализе двухслойной системы GDC/ScSZ [40]. После уравновешивания на траектории длиной 500 пс проводили сбор данных с последующим усреднением данных на интервалах 500–1000 пс для каждой температуры.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
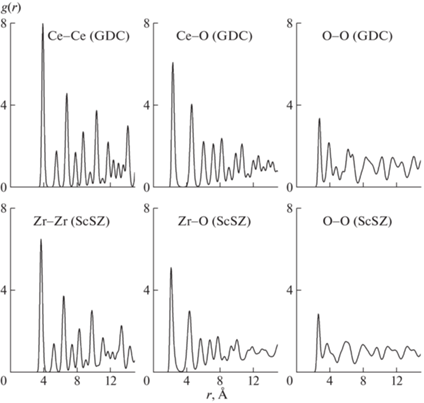
На рис. 2 и 3 представлены радиальные парные корреляционные функции (РПКФ), g(r), для ионов в соответствующих слоях гетерофазной системы при 1600 K.
Видно, что моделируемые фазы кристаллически упорядочены и сохраняют эту упорядоченность при повышении температуры. Рассчитанные РПКФ для фаз ScSZ и GDC в целом воспроизводят корреляционные функции, полученные ранее при моделировании двухслойной гетеросистемы ScSZ/GDC [38].
В фазе Pr2CuO4 наиболее “сглаженный” вид имеют РПКФ для ионов типа O2, что соответствует их относительно большей подвижности. При повышении температуры ход g(r) качественно не изменяется; наиболее заметный признак разупорядочения – “размытие” вторичных максимумов РПКФ Cu–O2 во второй координационной сфере.
Коэффициенты диффузии ионов кислорода (DO) определяли из временн${\text{ы}}'$х зависимостей среднеквадратичных смещений ионов при разных температурах. На рис. 4 показаны температурные зависимости рассчитанных коэффициентов кислорода DO в фазах ScSZ, GDC и Pr2CuO4. Видно, что ионы O1 имеют заметно меньшую подвижность по сравнению с O2 в слое купрата празеодима.
Рис. 4.
Температурные зависимости рассчитанных коэффициентов диффузии ионов кислорода в слоях GDC ($\square $, энергия активации диффузии Ea = 0.81 эВ) и ScSZ ($\bigcirc $, Ea = 0.62 эВ), ионов O2 ($\vartriangle $, в плоскости ab, Ea = 0.69 эВ) и О1 ($\triangledown $, в направлении с, Ea = 0.45 эВ) в слое Pr2CuO4.
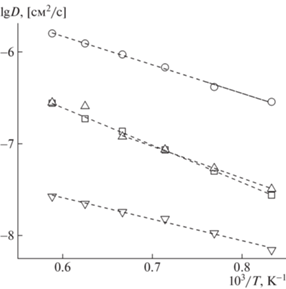
Найденные методом МД значения коэффициентов диффузии кислорода для фазы ScSZ при 1200–1300 K близки к оценкам, сделанным на основании экспериментальных данных по определению коэффициента диффузии как изотопным методом, так и из данных по электропроводности – DO ≈ 5 × 10–7 см2/с для образца ScSZ при 1300 K (экстраполированные значения) [43, 44]. МД-моделирование, осуществленное при температурах 1200–1700 K с несколько различающимися параметрами модельного потенциала [44], дает значение энергии активации для данного состава ScSZ примерно 0.67–0.7 эВ, что хорошо согласуется с полученными расчетами (0.62 эВ). Отметим, что согласно [40] результаты МД-расчетов весьма чувствительны к вариациям параметров потенциала. Аналогичная ситуация отмечается для GDC, где использованная в настоящей работе модель (как и ряд других, ранее применявшихся в МД-расчетах [39, 45]) занижает подвижность ионов кислорода примерно на порядок по сравнению с экспериментом.
Для фазы Pr2CuO4 МД-моделирование подтверждает низкую подвижность ионов O1 и анизотропию диффузии ионов O2, мигрирующих преимущественно перпендикулярно оси c кристалла. Температурная зависимость коэффициента диффузии ионов O2 качественно воспроизводит результаты, полученные при МД-моделировании купрата празеодима [41]. Наблюдаемый “подскок” ионной подвижности (сопровождаемый снижением энергии активации) примерно при 1600 K (при 1500 K по данным [41]) может быть связан с эффектом предплавления, отмеченным ранее и для других ионных проводников [46, 47]. Очень сильный разброс экспериментальных значений коэффициента диффузии кислорода в Pr2CuO4 затрудняет сравнение этих данных с результатами МД-расчетов. Использование метода радиоактивных меток дает значения (для керамики) DO = 3.8 × 10–10 см2/с при 1173 K с энергией активации ∼3 эВ в диапазоне 973–1173 K [23]. В то же время применение релаксационного метода приводит к значениям DO = 6.1 × 10–6 см2/с при 1173 K и энергии активации ∼0.13 эВ в диапазоне 873–1173 K [24]. В последнем случае правильнее говорить об определении коэффициента химической диффузии кислорода, а не коэффициента самодиффузии.
Для визуального наблюдения особенностей анионного переноса на межфазных границах были проанализированы траектории движения кислорода. Особый интерес представляла картина транспорта кислорода через границы ScSZ/GDC и GDC/Pr2CuO4 трехфазной гетерогенной системы. Поэтому на рис. 5 показаны типичные пути перемещения О2– в направлении оси z, т.е. перпендикулярно межфазным границам системы.
Рис. 5.
Траектории миграции анионов кислорода из слоя GDC в направлении слоя ScSZ (а) и слоя Pr2CuO4 (б) при 1700 K (малые темные сферы – анионы кислорода, большие светлые сферы – катионы, тип которых указан на сфере).

Как следует из анализа результатов, представленных на рис. 5, во всех слоях анионы перемещаются путем перескока из узла в соседний вакантный узел, т.е. наблюдается обычный вакансионный механизм. Большая часть таких “скачков” происходит быстро (за 1–4 пс), но при нарушениях решетки в приграничных областях возможны “блуждания” между узлами кристаллической решетки длительностью в десятки пикосекунд. При этом нет принципиальной разницы между переходами через границы обоих типов – в обоих случаях происходит перескок на расстояние ∼2.5–3 Å за несколько пикосекунд.
ЗАКЛЮЧЕНИЕ
Cложную гетероструктуру Zr0.8Sc0.2O1.9/ Ce0.9 Gd0.1O1.95/Pr2CuO4, связанную с реально исследуемым катодом ТОТЭ, удалось смоделировать в рамках подхода классической молекулярной динамики. Модельная система, состоящая из трех тонких пленок оксидов, сохраняет исходную кристаллическую структуру: слои Zr0.8Sc0.2O1.9 и Ce0.9Gd0.1O1.95 описываются в рамках флюоритовых кубических фаз, а купрат Pr2CuO4 имеет перовскитоподобную структуру T′-типа.
Рассчитанные коэффициенты диффузии согласуются в целом с экспериментальными данными для индивидуальных соединений и составляют, например, DO ≈ 5 × 10–7 см2/с для ScSZ при 1300 K. Для купрата Pr2CuO4 однозначно доказана анизотропия диффузии: коэффициенты диффузии кислорода в плоскости ab на порядок превышают соответствующие значения DO в направлении с.
Анализ траекторий перемещения анионов кислорода как в объеме, так и через границы GDC/ScSZ и GDC/Pr2CuO4 указывает на осуществление вакансионного механизма транспорта в исследуемой системе.
Работа выполнена при частичной финансовой поддержке Российского фонда фундаментальных исследований (проект № 17-03-00650).
Список литературы
O’Hayre R., Cha S.W., Collela W.G., Prinz F.B. Fuel cell fundamentals. 3d ed. New Jersey, USA: Wiley, 2016. 608 p.
Zheng Y., Wang J., Yu B. et al. // Chem. Soc. Rev. 2017. V. 46 P. 1427. https://doi.org/10.1039/C6CS00403B
Kendall K. Portable early market SOFCs // High-temperature Solid Oxide Fuel Cells for the 21st Century (Second Edition). Fundamentals, Design and Applications / Eds. Kendall K., Kendall M. Elsevier, Academic Press, 2016. P. 329.
Maric R., Mirshekari G. Solid Oxide Fuel Cells: From Fundamental Principles to Complete Systems (Electrochemical Energy Storage and Conversion). CRC Press, 2020. 256 p.
Zhang J., Lenser C., Menzler N.H., Guillon O. // Solid State Ionics. 2020. V. 344. P. 115138. https://doi.org/10.1016/j.ssi.2019.115138
Advances in medium and high temperature solid oxide fuel cell technology / Eds. Boaro M., Arico A.S. Springer, 2017. 342 p.
Intermediate temperature solid oxide fuel cells / Ed. Kaur G. Elsevier, 2019. 516 p.
Cai G., Gu Y., Ge L. et al. // Ceram. Int. 2017. V. 43. P. 8944. https://doi.org/10.1016/j.ceramint.2017.04.033
Zakaria Z., Kamarudin S.K. // Int. J. Energy Res. 2021. V. 45. P. 4871. https://doi.org/10.1002/er.6206
Cho G.Y., Lee Y.H., Hong S.W. et al. // Int. J. Hydrogen Energy. 2015. V. 40. P. 15704. https://doi.org/10.1016/j.ijhydene.2015.09.124
Hirano M., Oda T., Uai K. et al. // J. Am. Ceram. Soc. 2002. V. 85. P. 1336. https://doi.org/10.1111/j.1151-2916.2002.tb00275.x
Jacobson A.J. // Chem. Mater. 2010. V. 22. P. 660. https://doi.org/10.1021/cm902640j
Ding P., Li W., Zhao H. et al. // J. Phys. Mater. V. 2021. P. 4022002.
Niemczyk A., Świerczek K. // E3S Web of Conferences. 2019. V. 108. P. 01019.
Ahmad M.Z., Ahmad S.H., Chen R.S. et al. // Int. J. Hydrogen Energy. 2021. V. 47. P. 1103. https://doi.org/10.1016/j.ijhydene. 2021.10.094
Fabbri E., Pergolesi D., Traversa E. // Sci. Technol. Adv. Mater. 2010. V. 11. P. 054503. https://doi.org/10.1088/1468-6996/11/5/054503
Harrison C.M., Slater P.R., Steinberger-Wilckens R. // Solid State Ionics. 2020. V. 354. P. 115410. https://doi.org/10.1016/j.ssi.2020.115410
Tarancón A., Morata A., Dezanneau G. et al. // J. Power Sources. 2007. V. 174. P. 255. https://doi.org/10.1016/j.jpowsour.2007.08.077
Tarancón A., Burriel M., Santiso J. et al. // J. Mater. Chem. 2010. V. 20. P. 3799. https://doi.org/10.1039/B922430K
Baharuddin N.A., Muchtar A., Somalu M.R. // Int. J. Hydrogen Energy. 2017. V. 42. P. 9149. https://doi.org/10.1016/j.ijhydene.2016.04.097
Fu X., Liu M., Meng X. et al. // Ionics. 2020. V. 26. P. 7. https://doi.org/10.1007/s11581-019-03314-9
Shijie Z., Na L., Liping S. et al. // J. Alloys Compd. 2022. V. 895. P. 162548. https://doi.org/10.1016/j.jallcom.2021.162548
Kaluzhskikh M.S., Kazakov S.M., Mazo G.N. et al. // J. Solid State Chem. 2011. V. 184. P. 698. https://doi.org/10.1016/j.jssc.2011.01.035
Zheng K., Gorzkowska-Sobas A., Świerczek K. // Mat. Res. Bull. 2012. V. 47. P. 4089https://doi.org/10.1016/j.materresbull.2012.08.072
Sun C., Li Q., Sun L. et al. // Mater. Res. Bull. 2014. V. 53. P. 65. https://doi.org/10.1016/j.materresbull.2014.01.040
Lyskov N.V., Kaluzhskikh M.S., Leonova L.S. et al. // Int. J. Hydrogen Energy. 2012. V. 37. P. 18357. https://doi.org/10.1016/j.ijhydene.2012.09.099
Kolchina L.M., Lyskov N.V., Kuznetsov A.N. et al. // RSC Adv. 2016. V. 6. P. 101029. https://doi.org/10.1039/C6RA21970E
Lyskov N.V., Kolchina L.M., Galin M.Z. et al. // Solid State Ionics. 2018. V. 319. P. 156.https://doi.org/10.1016/j.ssi.2018.02.017
Kolchina L.M., Lyskov N.V., Petukhov D. et al. // J. Alloys Compd. 2014. V. 605. P. 89. https://doi.org/10.1016/j.jallcom.2014.03.179
Mukherjee K., Hayamizu Y., Kim C.S. et al. // ACS Appl. Mater. Interfaces. 2016. V. 8. P. 34295. https://doi.org/10.1021/ acsami. 6b08977
Zhao T., Sun L.-P., Li Q. et al. // J. Electrochem. Energy Conv. Storage, ASME. 2016. V. 13. P. 011006. https://doi.org/10.1115/1.4033526
Zhao S., Li N., Sun L. et al. // Int. J. Hydrogen Energy. 2021. V. 47. P. 6227. https://doi.org/10.1016/j.ijhydene.2021.11.250
Matsui T., Li S., Muroyama H. et al. // Solid State Ionics. 2017. V. 300. P. 135. https://doi.org/10.1016/j.ssi.2016.12.014
Somekawa T., Matsuzaki Y., Tachikawa Y. et al. // Solid State Ionics. 2015. V. 282. P. 1. https://doi.org/10.1016/j.ssi.2015.09.005
Wang F., Brito M.E., Yamaji K. et al. // Solid State Ionics. 2014. V. 262. P. 454. https://doi.org/10.1016/j.ssi.2014.04.002
Xu H., Cheng K., Chen M. et al. // J. Power Sources. 2019. V. 441. P. 227152. https://doi.org/10.1016/j.jpowsour.2019.227152
Kim C., Park H., Jang I. et al. // J. Power Sources. 2018. V. 378. P. 404. https://doi.org/10.1016/j.jpowsour.2017.12.065
Галин М.З., Иванов-Шиц А.К., Мазо Г.Н. // Кристаллография. 2018. Т. 63. № 1. С. 114. https://doi.org/10.7868/S0023476118010071
Иванов-Шиц А.К., Мазо Г.Н. // Кристаллография. 2018. Т. 63. С. 5.
Иванов-Шиц А.К., Готлиб И.Ю., Галин М.З. и др. // Кристаллография. 2019. Т. 64. С. 380. https://doi.org/10.1134/S0023476119030123
Мазо Г.Н., Мамаев Ю.А., Галин М.З. и др. // Неорган. материалы. 2011. Т. 47. С. 1337.
Smith W., Todorov I.T., Leslie M. // Z. Kristallogr. 2005. B. 220. S. 563. https://doi.org/10.1524/zkri.220.5.563.65076
Sakai T., Hyodo J., Ogushi M. et al. // Solid State Ionics. 2017. V. 301. P. 156. https://doi.org/10.1016/j.ssi.2017.02.002
Yu Z.Q., Devanathan R., Jiang W. et al. // Solid State Ionics. 2010. V. 181. P. 367. https://doi.org/10.1016/j.ssi.2010.01.024
Kumari N., Anjum U., Ali Haider M. et al. // MRS Adv. 2019. V. 4. P. 783. https://doi.org/10.1557/adv.2019.165
Ivanov-Schitz A.K., Mazo G.N., Povolotskaya E.S. et al. // Solid State Ionics. 2004. V.173. P.103. https://doi.org/10.1016/j.ssi.2004.07.059
Иванов-Шиц А.К., Мазо Г.Н., Поволоцкая Е.С. и др. // Кристаллография. 2005. Т. 50. С. 510.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография