Кристаллография, 2023, T. 68, № 1, стр. 11-17
Энергии растворения примесей и их кластеров в повеллите CaMoO4
В. Б. Дудникова 1, *, Н. Н. Еремин 1
1 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: VDudnikova@hotmail.com
Поступила в редакцию 16.09.2022
После доработки 27.09.2022
Принята к публикации 03.10.2022
- EDN: DNRRBM
- DOI: 10.31857/S002347612301006X
Аннотация
Методом межатомных потенциалов проведено моделирование примесных дефектов в повеллите CaMoO4. Рассчитаны энергии растворения одно-, двух- и трехвалентных примесей, представлен их сравнительный анализ и основные закономерности изменения. Определены позиции наиболее вероятной локализации дефектов. Для гетеровалентных примесей найден наиболее энергетически выгодный механизм компенсации их заряда как за счет собственных дефектов кристалла, так и по схеме сопряженного изоморфизма. Показано, что образование кластеров примеси с собственными дефектами кристалла и в большей степени образование кластеров примесей с разными зарядами позволяет существенно снизить их энергию растворения. Образование нейтральных кластеров одновалентных примесей с вакансиями кислорода не только увеличивает растворимость примесей, но и снижает вероятность образования центров окраски.
ВВЕДЕНИЕ
Молибдат кальция, CaMoO4 (повеллит), имеет структуру шеелита (тетрагональная сингония, пр. гр. I41/a). Атомы кальция окружены восемью атомами кислорода с двумя наборами межатомных расстояний (КЧ = 4 + 4). Атомы молибдена находятся в окружении атомов кислорода, объединенных в тетраэдры. Каждый катион кальция окружен четырьмя такими же катионами и восемью катионами молибдена (рис. 1).
Повеллит и твердые растворы на его основе представляют интерес как в фундаментальном, так и в технологическом отношении в связи с возможностью их использования в качестве люминофоров [1, 2], лазерных материалов [3, 4], криогенных детекторов [5, 6] и целого ряда других практических применений. Возможность образования твердых растворов повеллита с радиоактивными элементами играет важную роль при захоронении ядерных отходов [7, 8].
Легирование редкоземельными и переходными элементами позволяет придать матричным кристаллам люминесцентные, лазерные и другие весьма важные свойства. Гетеровалентные примесные дефекты могут также оказывать влияние на собственные дефекты кристалла и определяемые ими свойства. Как правило, уровень легирования невысок и экспериментальное исследование механизмов растворения затруднительно. В этом отношении весьма актуально использование атомистического моделирования. Оно позволяет провести сравнение растворимости разных элементов, установить наиболее вероятную их локализацию и компенсацию заряда и облегчает решение задачи получения кристаллов с заданными свойствами.
Моделирование примесных дефектов было проведено в изоструктурном молибдату кальция соединении PbWO4 в [9, 10]. Настоящая работа является продолжением начатого ранее исследования по моделированию собственных дефектов в CaMoO4 [11] и посвящена моделированию примесных дефектов в этих кристаллах.
МЕТОДИКА МОДЕЛИРОВАНИЯ
Моделирование проведено методом межатомных потенциалов с помощью программы GULP 4.0.1 (General Utility Lattice Program) [12], в основе которой лежит процедура минимизации энергии кристаллической структуры.
Атомистический подход основан на использовании эмпирически определенных межатомных потенциалов, описывающих взаимодействие между атомами или ионами в кристалле. Парный потенциал Uij взаимодействия ионов i и j с зарядами qi и qj является алгебраической суммой нескольких составляющих:
(1)
${{U}_{{ij}}}({{R}_{{ij}}}) = {{q}_{i}}{{q}_{j}}{{e}^{2}}{\text{/}}{{R}_{{ij}}} + {{A}_{{ij}}}\exp ( - {{R}_{{ij}}}{\text{/}}{{{{\rho }}}_{{ij}}}) - {{C}_{{ij}}}{\text{/}}R_{{ij}}^{6}.$Расчет энергии дефектов проводили по методу Мотта–Литтлтона [13], в основе которого лежит модель “вложенных сфер”. Центральная область в расчетах имела радиус 10 Å, следующая за ней сфера имела радиус 22 Å, что позволило обеспечить хорошую сходимость результатов.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Процесс растворения примесей может быть записан в виде квазихимических реакций обмена между основным компонентом и примесным компонентом в виде оксида. При гетеровалентном замещении кальция одновалентным ионом Ме+ образуется примесный дефект с избыточным отрицательным зарядом, который необходимо скомпенсировать. Возможны различные механизмы компенсации заряда такого дефекта. Избыточный отрицательный заряд, вносимый одновалентной примесью, может быть скомпенсирован за счет собственных дефектов повеллита (вакансий в позициях кислорода ${v}_{{\text{O}}}^{{ \bullet \bullet }}$ или интерстициальных внедрений кальция ${\text{Ca}}_{{\text{I}}}^{{ \bullet \bullet }}$) следующим образом:
(3)
$\frac{1}{2}{\text{M}}{{{\text{e}}}_{2}}{\text{O}} + {\text{Ca}}_{{{\text{Ca}}}}^{ \times } + \frac{1}{2}{\text{O}}_{{\text{O}}}^{ \times } \Leftrightarrow {\text{Me}}_{{{\text{Ca}}}}^{'} + \frac{1}{2}{v}_{{\text{O}}}^{{ \bullet \bullet }} + {\text{CaO,}}$(4)
$\frac{1}{2}{\text{M}}{{{\text{e}}}_{2}}{\text{O}} + {\text{Ca}}_{{{\text{Ca}}}}^{ \times } \Leftrightarrow {\text{Me}}_{{{\text{Ca}}}}^{'} + \frac{1}{2}{\text{Ca}}_{{\text{I}}}^{{ \bullet \bullet }} + \frac{1}{2}{\text{CaO}}{\text{.}}$Энергии растворения одновалентных примесей ЕS(Me+) для реакций (3), (4) могут быть оценены соответственно из следующих уравнений:
(5)
$\begin{gathered} {{Е}_{S}}({\text{M}}{{{\text{e}}}^{ + }}) = {{E}_{d}}({\text{Me}}_{{{\text{Ca}}}}^{'}) + \frac{1}{2}{{Е}_{d}}({v}_{{\text{O}}}^{{ \bullet \bullet }}) + \\ + \;{{E}_{L}}({\text{CaO}})--\frac{1}{2}{{E}_{L}}({\text{M}}{{{\text{e}}}_{{\text{2}}}}{\text{O}}), \\ \end{gathered} $(6)
$\begin{gathered} {{Е}_{S}}({\text{M}}{{{\text{e}}}^{ + }}) = {{E}_{d}}({\text{Me}}_{{{\text{Ca}}}}^{'}) + \frac{1}{2}{{Е}_{d}}({\text{Ca}}_{{\text{I}}}^{{ \bullet \bullet }}) + \\ + \;\frac{1}{2}{{E}_{L}}({\text{CaO}})--\frac{1}{2}{{E}_{L}}({\text{M}}{{{\text{e}}}_{{\text{2}}}}{\text{O}}), \\ \end{gathered} $Возможно также интерстициальное вхождение одновалентных ионов, вносящих избыточный положительный заряд, при компенсации заряда вакансией кальция ${v}_{{{\text{Ca}}}}^{{''}}$:
(7)
$\frac{1}{2}{\text{M}}{{{\text{e}}}_{2}}{\text{O}} + \frac{1}{2}{\text{Ca}}_{{{\text{Ca}}}}^{ \times } \Leftrightarrow {\text{Me}}_{{\text{I}}}^{ \bullet } + \frac{1}{2}{v}_{{{\text{Ca}}}}^{{''}} + \frac{1}{2}{\text{CaO}}{\text{.}}$(8)
$\begin{gathered} {{Е}_{S}}({\text{M}}{{{\text{e}}}^{ + }}) = {{E}_{d}}({\text{Me}}_{{\text{I}}}^{ \bullet }) + \frac{1}{2}{{Е}_{d}}({v}_{{{\text{Ca}}}}^{{''}}) + \\ + \;\frac{1}{2}{{E}_{L}}({\text{CaO}})--\frac{1}{2}{{E}_{L}}({\text{M}}{{{\text{e}}}_{{\text{2}}}}{\text{O}}). \\ \end{gathered} $(9)
${\text{M}}{{{\text{e}}}_{{\text{2}}}}{\text{O}} + {\text{Ca}}_{{{\text{Ca}}}}^{ \times } \Leftrightarrow {\text{Me}}_{{{\text{Ca}}}}^{'} + {\text{Me}}_{{\text{I}}}^{ \bullet } + {\text{CaO}},$(10)
$\begin{gathered} {{Е}_{S}}({\text{M}}{{{\text{e}}}^{ + }}) = {{E}_{d}}({\text{Me}}_{{{\text{Ca}}}}^{'}) + {{E}_{d}}({\text{Me}}_{{\text{I}}}^{ \bullet }) + \\ + \;{{E}_{L}}({\text{CaO}})--{{E}_{L}}({\text{M}}{{{\text{e}}}_{{\text{2}}}}{\text{O}}). \\ \end{gathered} $Для моделирования кристаллической структуры повеллита использовали структурные данные из [14] и параметры межатомных взаимодействий, определенные в [11]. Они представлены в табл. 1 вместе со значениями энергии собственных дефектов, необходимых для компенсации избыточных зарядов, вносимых примесью. Структурная энергия CaO получена при использовании параметров межатомного взаимодействия из табл. 1 и составляла EL(CaO) = –36.19 эВ.
Таблица 1.
Используемые в работе значения параметров межатомных потенциалов и зарядов атомов в кристалле повеллита, энергии собственных дефектов
| Взаимо-действие | Параметры потенциалов | Атом | Заряд, e | Дефект | Еd, эВ | ||
|---|---|---|---|---|---|---|---|
| A, эВ | ρ, Å | C, эВ Å6 | |||||
| Ca–OS | 2157.414944 | 0.311170 | 0.000000 | Ca | 2.000000 | ${v}_{{{\text{Ca}}}}^{{''}}$ | 23.96 |
| MoS–OS | 1073.797588 | 0.368729 | 0.000000 | MoC | 0.268423 | ${\text{Ca}}_{{\text{I}}}^{{ \bullet \bullet }}$ | –12.62 |
| OS–OS | 1868.561623 | 0.120368 | 10.909249 | MoS | 5.731577 | ||
| – | χ (эВ/Å–2) | OC | 0.306187 | ${v}_{{\text{O}}}^{{ \bullet \bullet }}$ | 22.15 | ||
| MoS–MoC | 74.480726 | OS | –2.306187 | ||||
| OS–OC | 13.804354 | ||||||
В табл. 2 приведены результаты расчета энергии примесных дефектов Ed и энергии растворения примесей ES при разных механизмах растворения и компенсации электронейтральности. Значения ES наиболее энергетически выгодных механизмов растворения выделены жирным шрифтом. Для примесей использовали параметры взаимодействия из [15]. Также приведены значения структурной энергии оксидов EL(MeiOy), полученные с использованием этих параметров. Значения ионных радиусов r приведены согласно [16].
Таблица 2.
Параметры потенциалов взаимодействия для примесных ионов, структурные энергии оксидов EL(MeiOy) и результаты расчета энергии примесных дефектов (Еd) и энергии растворения примесей (ЕS) в повеллите для изолированных дефектов
| Мe | r, Å | А, эВ | ρ, Å | qc, эВ | qs, эВ | χ, эВ/Å–2 | Ed, эВ | EL, эВ (MeiOy) | ES, эВ | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Одновалентные примеси | Уравнения | |||||||||||
| (5) | (6) | (8) | (10) | |||||||||
| Li | 0.92 | 426.480 | 0.3000 | 1 | 14.14 (–6.28) | –30.51 | 4.28 | 4.99 | 2.86 | 2.18 | ||
| Na | 1.18 | 1271.504 | 0.3000 | 1 | 14.85 (–2.54) | –26.29 | 2.88 | 3.59 | 4.49 | 2.41 | ||
| K | 1.51 | 3587.570 | 0.3000 | 1 | 16.42 (1.30) | –23.18 | 2.89 | 3.60 | 6.77 | 4.71 | ||
| Двухвалентные примеси | Уравнение (12) | |||||||||||
| Mg | 0.89 | 2457.243 | 0.2610 | 1.580 | 0.420 | 349.95 | –3.18 | –40.99 | 1.62 | |||
| Sr | 1.26 | 1956.702 | 0.3252 | 0.169 | 1.831 | 21.53 | 1.01 | –34.01 | –1.17 | |||
| Ba | 1.42 | 4818.416 | 0.3067 | 0.169 | 1.831 | 34.05 | 2.62 | –32.46 | –1.51 | |||
| Трехвалентные примеси | Уравнения | |||||||||||
| (14) | (16) | |||||||||||
| Компенсатор | ||||||||||||
| $\frac{1}{2}{v}_{{{\text{Ca}}}}^{{''}}$ | ${\text{Li}}_{{{\text{Ca}}}}^{'}$ | ${\text{Na}}_{{{\text{Ca}}}}^{'}$ | ${\text{K}}_{{{\text{Ca}}}}^{'}$ | |||||||||
| Al | 0.686 | 2409.505 | 0.2649 | 0.043 | 2.957 | 403.98 | –30.63 | –157.60 | 5.86 | 5.18 | 3.79 | 3.80 |
| Ga | 0.772 | 2339.776 | 0.2742 | 3.000 | –29.07 | –153.58 | 5.41 | 4.73 | 3.33 | 3.34 | ||
| Fe | 0.780 | 3219.335 | 0.2641 | 1.971 | 1.029 | 179.58 | –28.96 | –152.34 | 4.91 | 4.23 | 2.83 | 2.84 |
| Yb | 0.985 | 991.029 | 0.3515 | –0.278 | 3.278 | 308.91 | –22.89 | –137.43 | 3.52 | 2.84 | 1.44 | 1.45 |
| Y | 1.019 | 1519.279 | 0.3291 | 3.000 | –23.31 | –136.39 | 2.58 | 1.90 | 0.51 | 0.52 | ||
| Tb | 1.040 | 845.137 | 0.3750 | –0.972 | 3.972 | 299.98 | –20.64 | –130.82 | 2.46 | 1.78 | 0.39 | 0.40 |
| Gd | 1.053 | 866.339 | 0.3770 | –0.973 | 3.973 | 299.96 | –20.13 | –129.56 | 2.34 | 1.66 | 0.27 | 0.28 |
| Eu | 1.066 | 847.868 | 0.3791 | –0.991 | 3.991 | 304.92 | –19.99 | –129.28 | 2.34 | 1.66 | 0.26 | 0.27 |
| Nd | 1.109 | 13084.217 | 0.2550 | 1.678 | 1.322 | 302.35 | –23.76 | –133.02 | 0.451 | –0.23 | –1.63 | –1.62 |
| Pr | 1.126 | 13431.118 | 0.2557 | 1.678 | 1.322 | 302.36 | –23.47 | –132.33 | 0.390 | –0.29 | –1.69 | –1.68 |
| La | 1.160 | 5436.827 | 0.2939 | 5.149 | –2.149 | 173.90 | –21.06 | –128.15 | 0.717 | 0.04 | –1.36 | –1.35 |
При изоморфном замещении кальция одновалентными примесями и компенсации электронейтральности собственными дефектами кристалла более выгодна компенсация заряда вакансиями кислорода (3), (5) по сравнению с компенсацией интерстициальными ионами кальция (4), (6). Для крупного иона калия это наиболее выгодный механизм растворения. Однако для лития он требует значительных энергетических затрат.
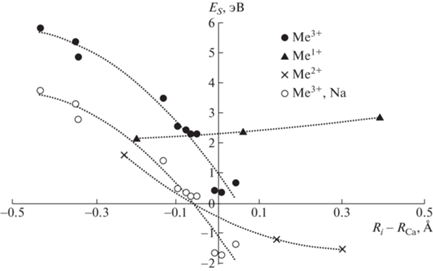
Для одновалентных примесей, как и для ионов кальция [11], наиболее энергетически выгодными являются интерстициальные позиции с координатами 0.5, 0.5, 0.375. Энергии интерстициальных одновалентных ионов в табл. 2 приведены в скобках. Для лития интерстициальное вхождение в кристалл при компенсации заряда вакансиями кальция (7), (8) выгоднее изоморфного замещения. Вместе с тем литий и натрий легче всего растворяются по механизму самокомпенсации заряда (9), (10). На рис. 2 показаны энергии растворения одновалентных примесей для наиболее энергетически выгодных механизмов их растворения.
Рис. 2.
Энергии растворения примесей в повеллите в виде изолированных дефектов. Для замещения Ca на щелочные металлы приведены энергии растворения с наиболее энергетически выгодным механизмом компенсации заряда.
Изовалентные замещения иона кальция двухвалентной примесью Me2+ можно записать в форме следующей квазихимической реакции:
(11)
${\text{Ca}}_{{{\text{Ca}}}}^{ \times } + {\text{MeO}} \Leftrightarrow {\text{Me}}_{{{\text{Ca}}}}^{ \times } + {\text{CaO}}{\text{.}}$(12)
${{Е}_{S}}({\text{M}}{{{\text{e}}}^{{2 + }}}) = {{Е}_{d}}({\text{Me}}_{{{\text{Ca}}}}^{ \times }) + {{E}_{L}}({\text{CaO}})--{{E}_{L}}({\text{MeO}}).$Наибольший практический интерес представляет растворимость трехвалентных, в частности, редкоземельных элементов. Для трехвалентных примесей компенсация избыточного положительного заряда может проходить за счет вакансий кальция:
(13)
$\frac{1}{2}{\text{M}}{{{\text{e}}}_{2}}{{{\text{O}}}_{3}} + \frac{3}{2}{\text{Ca}}_{{{\text{Ca}}}}^{ \times } \Leftrightarrow {\text{Me}}_{{{\text{Ca}}}}^{ \bullet } + \frac{1}{2}{v}_{{{\text{Ca}}}}^{{''}} + \frac{3}{2}{\text{CaO}}{\text{.}}$(14)
$\begin{gathered} {{Е}_{S}}({\text{M}}{{{\text{e}}}^{{3 + }}}) = {{E}_{d}}({\text{Me}}_{{{\text{Ca}}}}^{ \bullet }) + \frac{1}{2}{{Е}_{d}}({v}_{{{\text{Ca}}}}^{{''}}) + \\ + \;\frac{3}{2}{{E}_{L}}({\text{CaO}})--\frac{1}{2}{{E}_{L}}({\text{M}}{{{\text{e}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}). \\ \end{gathered} $Сравнение зависимостей энергий растворения одновалентных, двухвалентных и трехвалентных примесей от разницы ионных радиусов кальция и замещающих его примесных ионов (рис. 2) свидетельствует о том, что изовалентное замещение требует меньших энергетических затрат, чем гетеровалентное.
Компенсация заряда может происходить также при сопряженном изоморфизме трехвалентного и одновалентного ионов11 в позиции кальция:
(15)
$\begin{gathered} \frac{1}{2}{\text{M}}{{{\text{e}}}_{2}}{{{\text{O}}}_{3}} + \frac{1}{2}{{{\text{M}}}_{2}}{\text{O}} + {\text{2Ca}}_{{{\text{Ca}}}}^{ \times } \Leftrightarrow \\ \Leftrightarrow {\text{M}}_{{{\text{Ca}}}}^{'} + {\text{Me}}_{{{\text{Ca}}}}^{ \bullet } + 2{\text{CaO}}{\text{.}} \\ \end{gathered} $(16)
$\begin{gathered} {{Е}_{S}}({\text{M}}{{{\text{e}}}^{{3 + }}},{{{\text{M}}}^{ + }}) = {{E}_{d}}({\text{Me}}_{{{\text{Ca}}}}^{ \bullet }) + {{E}_{d}}({\text{M}}_{{{\text{Ca}}}}^{'}) + \\ + \;2{{E}_{L}}({\text{CaO}})--\frac{1}{2}{{E}_{L}}({\text{M}}{{{\text{e}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}})--\frac{1}{2}{{E}_{L}}({{{\text{M}}}_{{\text{2}}}}{\text{O}}). \\ \end{gathered} $В табл. 2 представлены значения энергии растворения трехвалентных примесей как по механизму компенсации заряда собственными дефектами, вакансиями кальция, так и по механизму сопряженного изоморфизма. Интерстициальное растворение для трехвалентных примесей маловероятно. Так, для алюминия и неодима энергии интерстициального растворения при компенсации избыточного заряда примеси вакансиями кальция составляют 11.15 и 16.15 эВ соответственно.
Из табл. 2 видно, что при сопряженном изоморфизме наиболее выгодными компенсаторами заряда являются ионы натрия. Ионы калия уступают им лишь незначительно. На рис. 2 представлены данные о солегировании трехвалентных примесей натрием. Видно, что сопряженный изоморфизм позволяет значительно увеличить растворимость трехвалентных примесей.
До сих пор речь шла о растворении примесей в виде изолированных, невзаимодействующих ионов. Однако известно, что заряженные примеси могут образовывать парные, тройные и более сложные кластеры как с собственными дефектами кристалла, так и с другими примесями. В результате взаимодействия трехвалентной примеси с вакансией кальция могут образовываться заряженные кластеры:
(17)
${\text{Me}}_{{{\text{Сa}}}}^{ \bullet } + {v}_{{{\text{Ca}}}}^{{''}} \Leftrightarrow ({\text{M}}{{{\text{e}}}_{{{\text{Ca}}}}}{{{v}}_{{{\text{Ca}}}}}){\kern 1pt} '{\kern 1pt} .$(18)
$\begin{gathered} {{Е}_{S}}({\text{M}}{{{\text{e}}}_{{{\text{Ca}}}}}{{{v}}_{{{\text{Ca}}}}}){\kern 1pt} ' = \frac{1}{2}[{{E}_{d}}({\text{M}}{{{\text{e}}}_{{{\text{Ca}}}}}{{{v}}_{{{\text{Ca}}}}}){\kern 1pt} {\text{'}} + {{E}_{d}}({\text{Me}}_{{{\text{Ca}}}}^{ \bullet }) + \\ + \;3{{E}_{L}}({\text{CaO}})--{{E}_{L}}({\text{M}}{{{\text{e}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}})]. \\ \end{gathered} $Таблица 3.
Результаты расчета энергии растворения трехвалентных примесей в виде кластеров
| Примесь | Примесно-вакансионные кластеры | Примесно-примесные кластеры |
||||||
|---|---|---|---|---|---|---|---|---|
| Заряженные (MeCa–${{{v}}_{{{\text{Ca}}}}}$)' |
(MeCa–${{{v}}_{{{\text{Ca}}}}}$–MeCa)× 1–2–3 |
(MeCa–${{{v}}_{{{\text{Ca}}}}}$–MeCa)× 1–2–4 |
(Me–Na)× | |||||
| Ed | ES Ур. (16) |
Ed | ES Ур. (18) |
Ed | ES Ур. (18) |
Ed | ES Ур. (20) |
|
| Al | –7.55 | 5.42 | –40.23 | 4.40 | –40.94 | 4.04 | –16.38 | 3.18 |
| Ga | –6.42 | 4.76 | –37.55 | 3.73 | –37.84 | 3.58 | –15.53 | 2.02 |
| Fe | –6.26 | 4.27 | –37.08 | 3.34 | –37.08 | 3.34 | –14.91 | 2.02 |
| Yb | –0.03 | 2.97 | –25.71 | 1.57 | –24.21 | 2.32 | –8.68 | 0.80 |
| Y | –0.33 | 2.09 | –26.54 | 0.64 | –25.04 | 1.39 | –9.07 | 0.11 |
| Tb | 2.22 | 1.92 | –21.30 | 0.48 | –20.12 | 1.06 | –6.36 | 0.18 |
| Gd | 2.74 | 1.80 | –17.39 | 1.80 | –18.8 | 1.10 | –5.94 | 0.39 |
| Eu | 2.87 | 1.79 | –19.78 | 0.46 | –18.53 | 1.10 | –5.71 | –0.31 |
| Nd | –0.66 | 0.02 | –24.38 | 0.04 | –25.97 | –0.76 | –9.40 | 2.12 |
| Pr | –0.38 | –0.04 | –23.82 | –0.03 | –25.42 | –0.83 | –9.12 | –2.19 |
| La | 1.93 | 0.23 | –19.12 | 0.23 | –20.88 | –0.66 | –6.84 | –2.00 |
Возможно также образование нейтральных кластеров, состоящих из димера примеси и вакансии кальция:
(19)
${\text{2Me}}_{{{\text{Сa}}}}^{ \bullet } + {v}_{{{\text{Ca}}}}^{{''}} \Leftrightarrow {{({\text{M}}{{{\text{e}}}_{{{\text{Ca}}}}}{{{v}}_{{{\text{Ca}}}}}{\text{M}}{{{\text{e}}}_{{{\text{Ca}}}}})}^{ \times }}.$(20)
$\begin{gathered} {{Е}_{S}}[\frac{1}{2}{{({\text{M}}{{{\text{e}}}_{{{\text{Ca}}}}}{{{v}}_{{{\text{Ca}}}}}{\text{M}}{{{\text{e}}}_{{{\text{Ca}}}}})}^{ \times }}] = \frac{1}{2}[{{E}_{d}}~{{\left( {{\text{M}}{{{\text{e}}}_{{{\text{Ca}}}}}{{{v}}_{{{\text{Ca}}}}}{\text{M}}{{{\text{e}}}_{{{\text{Ca}}}}}} \right)}^{ \times }} + \\ + \;3{{E}_{L}}({\text{CaO}})--{{E}_{L}}({\text{M}}{{{\text{e}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}})]. \\ \end{gathered} $Наряду с кластерами, образуемыми примесными ионами с собственными дефектами кристалла, возможно образование примесно-примесных кластеров, объединение трехвалентных примесей, вносящих избыточный положительный заряд с одновалентными примесями с избыточным отрицательным зарядом:
(21)
${\text{Me}}_{{{\text{Ca}}}}^{ \bullet }~ + {\text{\;M}}_{{{\text{Ca}}}}^{'} \Leftrightarrow {{({\text{M}}{{{\text{e}}}_{{{\text{Ca}}}}}{{{\text{M}}}_{{{\text{Ca}}}}})}^{ \times }}.$(22)
$\begin{gathered} {{Е}_{S}}{{({\text{M}}{{{\text{e}}}_{{{\text{Ca}}}}}{{{\text{M}}}_{{{\text{Ca}}}}})}^{ \times }}~ = {{E}_{d}}{{({\text{M}}{{{\text{e}}}_{{{\text{Ca}}}}}{{{\text{M}}}_{{{\text{Ca}}}}})}^{ \times }} + \\ + \;2{{E}_{L}}({\text{CaO}})--\frac{1}{2}{{E}_{L}}({\text{M}}{{{\text{e}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}})--\frac{1}{2}{{E}_{L}}({{{\text{M}}}_{{\text{2}}}}{\text{O}}). \\ \end{gathered} $Сравнение рис. 2 и 3 свидетельствует о том, что зависимости, характеризующие растворение в виде примесно-вакансионных кластеров (рис. 3), попадают в интервал значений, находящихся между зависимостью энергии растворения изолированных трехвалентных ионов и зависимостью, характеризующей сопряженный изоморфизм (рис. 2). А изоморфизм кластеров одновалентных и трехвалентных ионов является наиболее выгодным механизмом растворения трехвалентных примесей.
Образование кластеров одновалентных примесей с компенсирующими их заряд вакансиями кислорода также позволяет уменьшить энергию растворения примесей. В этом случае энергия растворения определяется следующим образом:
(23)
$\begin{gathered} {{Е}_{S}} = \frac{1}{2}[{{E}_{d}}~{{({\text{M}}{{{\text{e}}}_{{{\text{Ca}}}}}{{{v}}_{{\text{O}}}}{\text{M}}{{{\text{e}}}_{{{\text{Ca}}}}})}^{ \times }} + {{E}_{L}}({\text{CaO}}) - \\ --\;\frac{1}{2}{{E}_{L}}({\text{M}}{{{\text{e}}}_{{\text{2}}}}{\text{O}})]. \\ \end{gathered} $Возможны также образование кластеров между интерстициально и изоморфно входящими одновалентными примесями и растворение одновалентных примесей по механизму
(24)
${\text{M}}{{{\text{e}}}_{2}}{\text{O\;}} + {\text{Ca}}_{{{\text{Ca}}}}^{ \times } \Leftrightarrow {{({\text{M}}{{{\text{e}}}_{{\text{I}}}}{\text{M}}{{{\text{e}}}_{{{\text{Ca}}}}})}^{ \times }} + {\text{CaO}}.$(25)
${{Е}_{S}} = {{E}_{d}}{{({\text{M}}{{{\text{e}}}_{{\text{I}}}}{\text{M}}{{{\text{e}}}_{{{\text{Ca}}}}})}^{ \times }} + {{E}_{L}}({\text{CaO}})--{{E}_{L}}({\text{M}}{{{\text{e}}}_{{\text{2}}}}{\text{O}}),$ЗАКЛЮЧЕНИЕ
Сравнение разных механизмов растворения одновалентных примесей свидетельствует о том, что для калия наиболее энергетически выгодно замещение иона кальция при компенсации заряда вакансиями кислорода. Для ионов лития и натрия оптимальным способом растворения является сочетание изоморфного замещения кальция с интерстициальным вхождением в кристалл. Особенно большой энергетический выигрыш дает образование их кластеров. Образование нейтральных кластеров одновалентных примесей с вакансиями кислорода позволяет не только увеличить растворимость примесей, но и снижает вероятность образования центров окраски.
Для двухвалентных примесей достаточно энергетически выгодно изоморфное замещение кальция. Для трехвалентных примесей компенсация избыточного положительного заряда может проходить за счет вакансий кальция. В интерстициальные позиции двухвалентные и трехвалентные ионы не встраиваются.
Сравнение зависимостей энергий растворения одно-, двух- и трехвалентных примесей от разницы ионных радиусов кальция и замещающих его примесных ионов свидетельствует о том, что изовалентное замещение требует меньших энергетических затрат, чем гетеровалентное.
Компенсация заряда может происходить при сопряженном изоморфизме трехвалентного и одновалентного ионов в позиции кальция. При этом наиболее выгодными компенсаторами заряда являются ионы натрия. Ионы калия уступают им незначительно. Сопряженный изоморфизм позволяет значительно увеличить растворимость трехвалентных примесей.
Образование кластеров трехвалентных примесей с вакансиями кальция, компенсирующими их заряд, уменьшает энергию растворения примесей. Трехвалентные примеси в повеллите предпочитают образование незаряженных кластеров. А изоморфизм кластеров одновалентных и трехвалентных ионов является самым выгодным механизмом растворения трехвалентных примесей.
Список литературы
Hu Y., Zhuang W., Ye H. et al. // J. Alloys Compd. 2005. V. 390. P. 226.
Dixit P., Chauhan V., Kumar P., Pandey P.C. // J. Luminescence. 2020. V. 223. P. 117240.
Zhuang R.Z., Zhang L.Z., Lin Z.B., Wang G.F. // Mat. Res. Innovations 2008. V. 12. P. 62.
Шилова Г.В., Сироткин А.А., Зверев П.Г. // Квантовая электроника. 2019. Т. 49. С. 570.
Mikhailik V.B., Henry S., Kraus H., Solskii I. // Nucl. Instrum. Method Phys. Res. A. 2007. V. 583. P. 350.
Lee S.J., Choi J.H., Danevich F.A. et al. // Astropart. Phys. 2011. V. 34. P 732.
Bosbach D., Rabung T., Brandt F., Fanghanel T. // Radiochim. Acta. 2004. V. 92. P. 639.
Taurines T., Boizot B. // J. Am. Ceram. Soc. 2012. V. 95. P. 1105.
Lin Q., Feng X. // J. Phys.: Condens. Matter. 2003. V. 15. P. 1963.
Chen T., Liu T., Zhang Q. et al. // Nucl. Instrum. Method Phys. Res. A. 2007. V. 575. P. 390.
Дудникова В.Б., Антонов Д.И., Жариков Е.В., Еремин Н.Н. // ФТТ. 2022. Т. 64. С. 1452.
Gale J.D. // Z. Kristallographie. 2005. B. 220. S. 552.
Mott N.F., Littleton M.J. // Trans. Faraday Soc. 1938. V. 34. P. 485.
Александров В.Б., Горбатый Л.В., Илюхин В.В. // Кристаллография. 1968. Т. 13. С. 512.
Bush T.S., Gale J.D., Catlow C.R.A., Battle P.J. // Mater. Chem. 1994. V. 4. P. 831.
Shannon R.D. // Acta Cryst. A. 1976. V. 32. P. 751.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография




