Кристаллография, 2023, T. 68, № 1, стр. 160-165
Лабораторный конусно-лучевой рентгеновский микротомограф
Ю. С. Кривоносов 1, *, А. В. Бузмаков 1, М. Ю. Григорьев 1, А. А. Русаков 1, Ю. М. Дымшиц 1, В. Е. Асадчиков 1
1 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
* E-mail: Yuri.S.Krivonosov@yandex.ru
Поступила в редакцию 20.06.2022
После доработки 20.06.2022
Принята к публикации 22.06.2022
- EDN: DPCSPN
- DOI: 10.31857/S0023476123010149
Аннотация
Разработан опытный образец лабораторного конусно-лучевого рентгеновского микротомографа. Микротомограф собран на базе микрофокусного источника рентгеновского излучения, работающего в диапазоне ускоряющих напряжений 30–80 кВ. Проведена автоматизация работы микротомографа, создано программное обеспечение для реконструкции трехмерных изображений. Продемонстрированы результаты томографический исследований нескольких тестовых объектов с разрешением менее 10 мкм.
ВВЕДЕНИЕ
На современном этапе технологического развития рентгеновская микротомография является востребованным инструментом для широкого круга научных и прикладных исследований. Высокая проникающая способность излучения рентгеновского диапазона позволяет применять томографические методы для изучения материалов, сильно различающихся по коэффициенту поглощения, включая мягкие ткани и элементы скелета животных и человека [1, 2], изделия медицинских технологий [3], керамики [4], металлы [5], изделия микроэлектроники [6] и т.д. Отметим, что с точки зрения существующей классификации под термином рентгеновская микротомография обычно понимают томографические измерения с разрешением на уровне от 1 до 50 мкм на образцах размером от 1 до 100 мм. Наилучшее качество рентгеновских микротомографических измерений в настоящее время достигается на источниках синхротронного излучения. Благодаря высокой интенсивности и уникальным характеристикам пучка синхротронные источники позволяют реализовать как простейшие оптические схемы, так и использовать дополнительные оптические элементы, повышающие разрешение до субмикронного уровня. Кроме этого, именно на синхротронных источниках созданы наилучшие условия для фазоконтрастной рентгеновской микротомографии [7].
Наряду с использованием синхротронных источников важным направлением развития приборной базы для микротомографии в течение последних десятилетий стало создание лабораторных рентгеновских микротомографов, доступных для широкого круга пользователей. Использование микрофокусных источников рентгеновского излучения также делает возможным получать фазовый контраст наряду с абсорбционным, при этом по имеющимся данным оптическое разрешение лучших лабораторных микротомографов становится сопоставимо с микротомографией на синхротронных станциях [8], в том числе, за счет применения современных нанофокусных рентгеновских источников с фокусным пятном субмикронного размера [9, 10].
Задачей настоящей работы было создание опытного образца лабораторного рентгеновского микротомографа для проведения научных исследований. При разработке конструкции микротомографа была взята за основу конусно-лучевая схема томографии. В отличие от параллельной томографической схемы, в которой разрешение определяется размером пикселя системы регистрации [11], конусно-лучевая схема позволяет осуществлять съемку исследуемого объекта с необходимым проекционным увеличением, что, в свою очередь, повышает разрешение системы. Ограничение по разрешению в конусно-лучевой схеме определяется, в первую очередь, размером источника. В отличие от медицинской томографии, где объект исследования неподвижен в процессе эксперимента, в конструкции лабораторных томографов обычно используют схему получения теневых проекций, в которой источник и детектор статичны, а исследуемый образец вращается. Такая схема эксперимента дает возможность существенно снизить затраты на проектирование и комплектующие, уменьшить габариты томографа, а также обеспечить наилучшую механическую стабильность.
КОНСТРУКЦИЯ МИКРОТОМОГРАФА
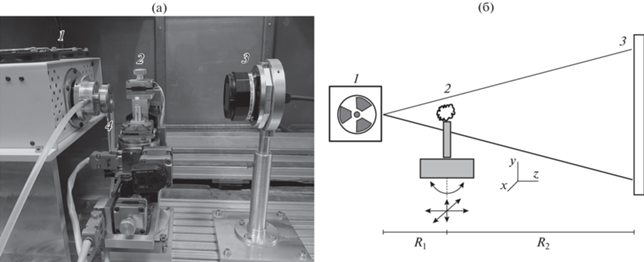
Фотография и принципиальная схема рентгенооптической части микротомографа представлены на рис. 1. Все элементы оптической системы смонтированы на поверхности лабораторного стола. Источник, образец и детектор располагаются на оптической скамье с возможностью продольного перемещения. Максимально возможное расстояние между анодом рентгеновской трубки и плоскостью детектора составляет 560 мм. Проекционное увеличение оптической системы определяется соотношением M = (R1 + R2)/R1, где R1 – расстояние между источником и образцом, R2 – расстояние между образцом и детектором (рис. 1б). Элементы рентгенооптической системы установки закрыты биологической защитой на основе свинца толщиной 3–4 мм. Такая защита эффективно экранирует рентгеновское излучение с энергией до 80 кэВ. Предусмотрен доступ к рентгенооптическим элементам микротомографа через две боковые дверцы для настройки эксперимента. Кроме этого, предусмотрено полное автоматическое откидывание колпака биологической защиты с помощью электрического линейного привода. Для прокладки управляющих коммуникаций в корпусе биологической защитой предусмотрены рентгенозащитные каналы.
Рис. 1.
Фотография (a) и принципиальная схема рентгенооптической части микротомографа (б): 1 – рентгеновский микрофокусный источник РАП-100; 2 – координатно-гониометрическая платформа для крепления исследуемого образца; 3 – рентгеновский детектор XIMEA; 4 – узел водяного охлаждения анодной пролетной трубы рентгеновской трубки с установленным фокусирующим магнитом.
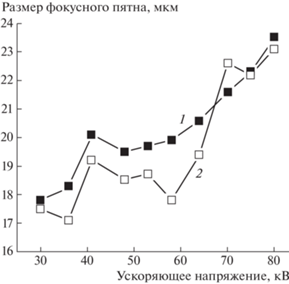
Источник рентгеновского излучения. Для генерации рентгеновского излучения выбран высоковольтный источник РАП-100 (производства ЗАО “ЭЛТЕХ-Мед”, г. Санкт-Петербург) с диапазоном ускоряющих напряжений 30–80 кВ. В источнике установлена микрофокусная рентгеновская трубка БС6 (производства АО “СВЕТЛАНА-РЕНТГЕН”, г. Санкт-Петербург) с анодом прострельного типа. Для получения необходимого спектра зондирующего излучения есть возможность применять данные трубки с анодами из таких материалов, как медь, молибден либо рений. Для стабилизации температуры анодного узла трубки в конструкции источника используется принудительное водяное охлаждение анодной пролетной трубы (4 на рис. 1а). Данная мера позволяет исключить возможные изменения линейных размеров пролетной трубы вследствие температурного расширения, а также повысить мощность на мишени анода. Максимальная мощность трубки в непрерывном режиме работы с системой водяного охлаждения составляет 8 Вт. Важным параметром, обеспечивающим разрешение в конусно-лучевой схеме, является размер фокусного пятна источника. По оценкам, представленным в работе [12], минимальный линейный размер a элементов, обнаруживаемых в структуре объекта, примерно равен половине размера s фокусного пятна источника (a ≥ s/2). Для трубок БС6, по данным завода-изготовителя, номинальный размер фокусного пятна составляет 100 мкм. При использовании дополнительной магнитной фокусировки размер фокусного пятна можно уменьшить до 20 мкм. В конструкции источника РАП-100 магнитная фокусировка реализована с помощью постоянного магнита (4 на рис. 1а). Настройка фокусного пятна трубки проводится посредством изменения положения постоянного магнита на оси пролетной трубы. Отметим, что эффективный размер фокусного пятна источника будет больше, чем размер пучка электронов на аноде трубки вследствие диффузного рассеяния электронов в материале мишени. Площадь возбуждения рентгеновского излучения также будет увеличиваться при увеличении ускоряющего напряжения трубки [13]. В настоящей работе для измерения эффективного размера фокусного пятна источника использовали методику косвенных измерений, известную в литературе, как “метод края”. Методика основана на определении величины геометрической нерезкости изображения на границе тестового объекта [14, 15]. Были проведены измерения размеров эффективного фокусного пятна источника во всем диапазоне ускоряющих напряжений. Результаты измерений представлены на рис. 2. Согласно полученной зависимости линейные размеры фокусного пятна постепенно увеличиваются с 17.5 до 23.5 мкм по мере роста ускоряющего напряжения.
Рис. 2.
Зависимость размеров эффективного фокусного пятна источника от ускоряющего напряжения: 1 – вертикальное направление; 2 – горизонтальное направление. Измерения проведены на трубке с медным анодом.
Характеристики детектора рентгеновского излучения. Для регистрации рентгеновского излучения в конструкции микротомографа использован детектор XIMEA MH110XC-KK-FA (https://www.ximea.com) с размером пикселя 9 мкм и полем зрения 36 × 24 мм2. Диапазон рабочих энергий детектора составляет 7–100 кэВ. В детекторе установлена 11 мегапиксельная CCD-матрица модели KAI011002 размером 4032 × × 2688 пикс2. Для охлаждения матрицы используется элемент Пельтье. Фронтальным чувствительным элементом детектора является сцинтиллятор GadOx:Eu толщиной 22 мкм и размером зерна 2.5 мкм, который преобразует рентгеновские кванты в видимый свет. Максимальная частота кадров детектора составляет 2.1 кадр/с. Подключение детектора к компьютеру осуществляется с помощью интерфейса IEEE1394A Firewire.
Узел крепления исследуемого образца. Для крепления образца разработана автоматизированная координатно-гониометрическая платформа (КГП) (2 на рис. 1). Исследуемый образец устанавливается на гониометрическое устройство КГП, которое обеспечивает вращение вокруг вертикальной оси в диапазоне 360°. Позиционирование гониометрического устройства в плоскости, перпендикулярной оптической оси пучка, осуществляется с помощью горизонтального и вертикального перемещений. В конструкции КГП установлены три шаговых двигателя, обеспечивающих дискретность вращения гониометра 0.01° и дискретность вертикального и горизонтального перемещений 0.0025 мм. Для совмещения исследуемого образца с осью вращения на верхней плоскости гониометрического устройства установлены два взаимно перпендикулярных линейных перемещателя.
Система автоматизации микротомографа. Для проведения экспериментов разработана полностью автоматизированная система управления микротомографом. С ее помощью возможно задавать параметры эксперимента, осуществлять сканирование исследуемого образца и мониторинг в процессе эксперимента, проводить сбор и хранение первичных томографических данных. Пользовательский интерфейс системы управления реализован в виде интернет-страницы, расположенной на основном томографическом сервере ФНИЦ “Кристаллография и фотоника” РАН. Подключение может осуществляться как из локальной сети, так и через сеть Интернет.
ОБРАБОТКА ТОМОГРАФИЧЕСКОГО ЭКСПЕРИМЕНТА
В процессе микротомографического эксперимента собираются три набора данных. Во-первых, регистрируются проекции “темнового тока” детектора IDARK – сигнал детектора в отсутствие рентгеновского излучения, обусловленный тепловой генерацией заряда в полупроводниковой матрице. Во-вторых, проводится измерение проекций зондирующего пучка IEMPTY в отсутствие образца, для чего образец выдвигается из поля зрения детектора. Далее проводится съемка теневых проекций исследуемого образца IDATA в диапазоне углов 0–360° с шагом 0.5°. Стандартный расчет нормированных проекций проводили согласно выражению
На следующем этапе предварительной обработки данных выполняли проверку и коррекцию инварианта Радона методом, описанным в [16]. Условие коррекции заключалось в том, что интегральная интенсивность нормированной и логарифмированной проекции должна сохраняться для всех угловых положений объекта (выполнение радоновского инварианта). Далее проводили поиск оси вращения объекта, а также проверку углового отклонения оси вращения от вертикали в плоскости, перпендикулярной оптической оси. Томографическую реконструкцию выполняли с помощью алгоритма FDK [17] с использованием программного пакета “ASTRA-TOOLBOX” [18].
ПРИМЕРЫ ТЕСТОВЫХ ЭКСПЕРИМЕНТОВ
С целью проверки работы созданного микротомографа провели измерения различных тестовых образцов. В первую очередь для оценки разрешения рентгенооптической системы микротомографа была исследована регулярная сетка из золота с размером стенок в плоскости объекта 6 мкм и периодом 12 мкм. На рис. 3а показано изображение сетки, полученное с помощью оптического микроскопа LOMO БИОЛАМ М-1. Проекция сетки, измеренная с помощью микротомографа, представлена на рис. 3б. На основе измеренной томографической проекции вычисляли размер перегородок сетки, для этого строили профиль их интенсивности, как показано на рис. 3в. За размер перегородки принимали значение ширины ее профиля на полувысоте, усредненное по нескольким измерениям. Размер перегородки золотой сетки, измеренный таким образом, составил 6.1 мкм. На основании проведенных измерений золотой сетки можно считать, что предельно возможное разрешение оптической системы созданного микротомографа находится на уровне 6 мкм.
Рис. 3.
Двумерная проекция золотой сетки с размером стенки 6 мкм и периодом 12 мкм: измерение с помощью оптического микроскопа (а); измерение на микротомографе (б) (материал анода Re, ускоряющее напряжение 35 кВ, проекционное увеличение M = 25.6); профиль интенсивности вдоль линии 1 (в).

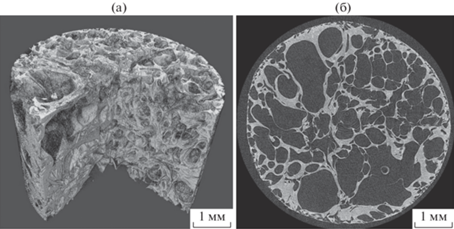
Была сделана томография трехмерного матрикса из биодеградируемого полимера. Данные матриксы относятся к классу перспективных материалов для решения задач регенеративной медицины. Они находят широкое применение при восстановлении целостности и функций тканей и органов с использованием биоискусственных тканеинженерных конструкций. Образец был изготовлен методом сверхкритической флюидной пластификации D,L-полилактида марки Purasorb PDL-05 и его последующего вспенивания в цилиндрических пресс-формах [19]. Особенностью данного образца является наличие развитой пористой структуры с размерами пор и перегородок в широком диапазоне длин от единиц микрон до миллиметров. Результаты томографии полимера PDL-05 представлены на рис. 4. Была сделана оценка толщин тонких перегородок полимерного матрикса. Для этого, так же как описано выше, по томографическому изображению строили профиль перегородки и измеряли его ширину на полувысоте. Измеренные таким образом толщины нескольких наиболее тонких перегородок оказались в диапазоне 8–11 мкм.
Рис. 4.
Трехмерное томографическое изображение с вырезанным сегментом (а) и аксиальное томографическое сечение (б) образца пористого полилактидного матрикса PDL-05 (материал анода Re, ускоряющее напряжение 35 кВ, проекционное увеличение M = 4.0).
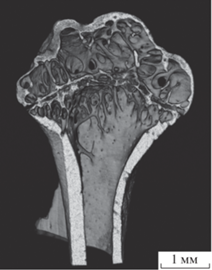
В качестве биологического образца с большим коэффициентом поглощения была выбрана плечевая кость монгольской песчанки. Данный образец является перспективным объектом для изучения влияния космической невесомости на элементы скелета амниот [20]. Трехмерное томографическое изображение плечевой кости представлено на рис. 5. Следует отметить, что использование полихроматического тормозного спектра рентгеновского излучения и сильное поглощение костной ткани приводят к “ужесточению пучка” по мере прохождения через образец и появлению “эффекта чаши” на восстановленных томографических изображениях. Для компенсации “эффекта чаши” в оптическую схему дополнительно устанавливали Al-фильтр толщиной 140 мкм между источником и образцом, а также выполняли процедуру автоматической коррекции синограмм по алгоритму, описанному в [21].
ЗАКЛЮЧЕНИЕ
Описаны первые экспериментальные результаты, полученные на опытном образце лабораторного рентгеновского микротомографа, созданного в ФНИЦ “Кристаллография и фотоника” РАН. Микротомограф работает в конусно-лучевой томографической схеме, диапазон ускоряющих напряжений микрофокусного источника рентгеновского излучения составляет 30–80 кВ. Проведен полный цикл томографического эксперимента, включая получение первичных томографических данных, математическое восстановление трехмерного изображения объекта и визуализация полученных результатов. На ряде тестовых объектов продемонстрировано оптическое разрешение микротомографа менее 10 мкм.
Авторы выражают благодарность В.К. Попову, С.В. Савельеву, В.И. Гулимовой за образцы, предоставленные для измерений, Е.Н. Потрахову – за консультации при выполнении работы.
Работа выполнена при поддержке Министерства науки и высшего образования Российской Федерации в рамках выполнения работ по Государственному заданию ФНИЦ “Кристаллография и фотоника” РАН (по работам “проведение микротомографических исследований”) и по Соглашению № 075-15-2021-136 от 12.10.2021 г. (по работам “конструирование микротомографа с микрофокусным источником”).
Список литературы
Williams J.A., Windmill J.F., Tanner K.E. et al. // Bone Reports. 2020. V. 12. P. 100233. https://doi.org/10.1016/j.bonr.2019.100233
Bikis C., Thalmann P., Degrugillier L. et al. // J. Neurosci. Methods. 2018. V. 294. P. 59. https://doi.org/10.1016/j.jneumeth.2017.11.005
Cresswell-Boyes A.J., Barber A.H., Mills D. et al. // J. Microsc. 2018. V. 272. № 3. P. 207. https://doi.org/10.1111/jmi.12725
Machado A.S., Oliveira D.F., Gama Filho H.S. et al. // X-Ray Spectrom. 2017. V. 46. № 5. P. 427. https://doi.org/10.1002/xrs.2786
Lame O., Bellet D., Michiel M.D. et al. // Nucl. Instrum. Methods. B. 2003. V. 200. P. 287. https://doi.org/10.1016/s0168-583x(02)01690-7
Carlton H.D., Elmer J.W., Li Y. et al. // JoVE (Journal of Visualized Experiments). 2016. V. 110. https://doi.org/10.3791/53683
Wilde F., Ogurreck M., Greving I. et al. // Am. Inst. Phys. Conference Proc. 2016. V. 1741. № 1. P. 030035. https://doi.org/10.1063/1.4952858
Migga A., Schulz G., Rodgers G. et al. // J. Med. Imaging. 2022. V. 9. № 3. P. 031507. https://doi.org/10.1117/1.JMI.9.3.031507
Sasov A., Pauwels B., Bruyndonckx P. // Developments in X-Ray Tomography VII. – SPIE. 2010. V. 7804. P. 225. https://doi.org/10.1117/12.860340
Nachtrab F., Hofmann T., Speier C. et al. // J. Instrum. 2015. V. 10. № 11. P. C11009. https://doi.org/10.1088/1748-0221/10/11/C11009
Бузмаков А.В., Асадчиков В.Е., Золотов Д.А. и др. // Кристаллография. 2018. Т. 63. № 6. С. 1007. https://doi.org/10.1134/S0023476118060073
Мазуров А.И., Потрахов Н.Н. // Известия вузов России. Радиоэлектроника. 2019. Т. 22. № 3. С. 53. https://doi.org/10.32603/1993-8985-2019-22-3-x-x
Гоулдстейн Дж., Яковиц Х., Ньюбэри Д. и др. Практическая растровая электронная микроскопия / под ред. Дж. Гоулдстейна, Х. Яковица. М.: Мир, 1978. 656 с.
ГОСТ 22091.9-86, Приборы рентгеновские. Методы измерения размеров эффективного фокусного пятна X-ray devices. The methods of measuring effective focus spot size. 1986
European Standard EN 12543-5:1999 “Non-destructive testing Characteristics of focal spots in industrial X-ray systems for use in non-destructive testing – Measurement of the effective focal spot size of mini and micro focus X-ray tubes”. 1999
Бузмаков А.В., Асадчиков В.Е., Золотов Д.А. и др. // Известия РАН. Серия Физическая. 2019. Т. 83. № 2. С. 194. https://doi.org/10.1134/S0367676519020066
Feldkamp L.A., Davis L.C., Kress J.W. // J. Opt. Soc. Am. 1984. V. 1. P. 612. https://doi.org/10.1364/JOSAA.1.000612
Van Aarle W., Palenstijn W.J., Cant J. et al. // Opt. Express. 2016. V. 24. № 22. P. 25129. https://doi.org/10.1364/OE.24.025129
Bogorodskii S.E., Vasilets V.N., Krotova L.I. et al. // Inorg. Mater.: Appl. Res. 2013. V. 4. № 5. P. 448. https://doi.org/10.1134/S2075113313050043
Krivonosov Y.S., Gulimova V.I., Buzmakov A.V. et al. // Frontiers Physiol. 2021. V. 12. P. 2161. https://doi.org/10.3389/fphys.2021.752893
Ingacheva A.S., Chukalina M.V. // Math. Problems Eng. 2019. V. 2019. P. 1. https://doi.org/10.1155/2019/1405365
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография