Кристаллография, 2023, T. 68, № 2, стр. 189-195
“IN-LINE”-метод фазоконтрастной рентгеновской микротомографии с использованием широкофокусного лабораторного источника
Ю. С. Кривоносов 1, *, А. В. Бузмаков 1, В. Е. Асадчиков 1, А. А. Федорова 2
1 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
2 Московский педагогический государственный университет
Москва, Россия
* E-mail: Yuri.S.Krivonosov@yandex.ru
Поступила в редакцию 07.11.2022
После доработки 15.12.2022
Принята к публикации 16.12.2022
- EDN: BQGLEO
- DOI: 10.31857/S0023476123020108
Аннотация
Описана экспериментальная реализация “in-line”-метода рентгеновского фазового контраста с использованием стандартной широкофокусной рентгеновской трубки в качестве полихроматического источника. С помощью предложенной схемы эксперимента проведены in vitro томографические измерения образца эпифиза головного мозга человека, по результатам которых визуализировано морфологическое строение мягких тканей органа. Экспериментально продемонстрировано преимущество фазоконтрастной томографии в сравнении с традиционной абсорбционной для задач изучения структурных особенностей мягких тканей. Схема “in-line” фазового контраста, реализованная на лабораторной установке, позволяет проводить томографические исследования образцов с линейными размерами несколько миллиметров и разрешением ∼20 мкм.
ВВЕДЕНИЕ
В настоящее время методы рентгеновского фазового контраста активно используют для изучения различных слабо поглощающих материалов в жестком рентгеновском диапазоне [1, 2]. Судя по многочисленным публикациям, рентгеновскую фазоконтрастную томографию наиболее часто применяют для исследования мягких тканей биологических объектов [3–5], поскольку чувствительность традиционной абсорбционной радиографии здесь оказывается недостаточной по причине малых изменений коэффициента поглощения внутри объекта [6].
В настоящей работе использован метод рентгеновского фазового контраста, который в научной литературе обычно называется “in-line”-голография, “in-line phase contrast” или “propagation based phase contrast” [7]. В работах середины 90-х годов впервые было продемонстрировано использование этого метода как на монохроматических синхротронных источниках (СИ) [8, 9], так и на полихроматическом лабораторном источнике с использованием микрофокусной рентгеновской трубки [10]. В “in-line”-методе фазового контраста на исследуемый объект падает когерентное или частично когерентное излучение, и на некотором расстоянии за объектом, в области дифракции Френеля, возникает интерференционная картина, обусловленная взаимодействием опорных лучей и лучей, отклоненных при прохождении через объект. На рентгеновской проекции, а также на восстановленном томографическом изображении объекта «in-line» фазовый контраст визуально проявляется в подчеркивании границ темными и светлыми контурами. С точки зрения проведения эксперимента “in-line” схема рентгеновского фазового контраста проста в реализации, она не требует использования сложных и дорогостоящие оптических элементов. В основном “in-line”-метод реализован на СИ, где пучок практически параллельный и имеет высокую степень пространственной когерентности. Несмотря на то что на СИ уже создано множество экспериментальных станций для фазоконтрастной томографии и именно на СИ можно получить наилучшее на сегодня разрешение, регулярно встречаются научные публикации, в которых описаны рентгеновские фазоконтрастные эксперименты с использованием лабораторных источников [11–13]. В настоящей работе показаны реализация “in-line”-метода рентгеновского фазового контраста с использованием стандартной широкофокусной рентгеновской трубки в качестве полихроматического источника и его применение для микротомографии эпифиза головного мозга человека.
Взаимодействие рентгеновского излучения с веществом традиционно описывают с помощью
комплексного показателя преломления $n(x,y,z) = 1 - {{\delta }}(x,y,z) + i{{\beta }}(x,y,z)$, где декремент преломления ${{\delta }}(x,y,z)$ будет определять сдвиг фазы волны, а коэффициент ${{\beta }}(x,y,z)$ соотносится с линейным коэффициентом поглощения материала образца на выбранной длине
волны λ следующим образом  . Сдвиг фазы волны определяется соотношением
. Сдвиг фазы волны определяется соотношением
В традиционной радиографии контраст изображения основан на поглощении рентгеновского излучения объектом, а изменение фазы волны никак не учитывается. Однако в “жесткой” области рентгеновского диапазона, когда энергия фотонов E > 10 кэВ, сдвиг фазы может играть более важную роль при формировании изображения, поскольку декремент преломления δ на 2–3 порядка превышает β, причем соотношение δ/β обычно больше для легких элементов. Таким образом, изменение фазы волны может дать существенно больший вклад в контраст изображения, чем только поглощение в традиционной радиографии. Также вдали от краев поглощения с ростом энергии увеличивается соотношение δ/β, поскольку δ изменяется обратно пропорционально квадрату энергии, в то время как β уменьшается пропорционально четвертой степени энергии излучения [14].
В случае сферической волны, распространяющейся от монохроматического точечного источника, выражение для расчета интенсивности в плоскости детектора, учитывающее как эффект поглощения, так и изменения фазы волны, может быть записано, как показано в [15]:
где I0 – интенсивность зондирующего пучка, измеренная в плоскости детектора в отсутствие образца, m – проекционное увеличение, R2 – расстояние между образцом и детектором. Анализ выражения (2) показывает, что возможность наблюдения фазового контраста зависит от расстояния R2. Во-первых, фазовый член в выражении (2) растет пропорционально расстоянию образец–детектор, во-вторых, в случае контактной съемки, когда R2 = 0, контраст изображения объекта будет обусловлен исключительно поглощением. Также степень выраженности эффекта фазового контраста будет зависеть от величины флуктуаций набега фазы в плоскости объекта.МЕТОДИКА ЭКСПЕРИМЕНТА
Принципиальная схема рентгеновского фазоконтрастного эксперимента в “in-line”-геометрии представлена на рис. 1. Данная экспериментальная схема была протестирована ранее в режиме получения отдельных фазоконтрастных изображений тестовых объектов, результаты описаны в [16]. В качестве источника излучения использована стандартная рентгеновская трубка с молибденовым анодом и электрической мощностью 3 кВт. Размер фокусного пятна на аноде рентгеновской трубки составил 12 × 0.4 мм2. Для формирования конического зондирующего пучка после рентгеновской трубки установлена щелевая апертура с двумя щелями, расположенными взаимно перпендикулярно друг другу. Размеры щелей составляли 130 мкм как в горизонтальном, так и вертикальном направлениях. Исследуемый образец устанавливали на гониометрической платформе. Расстояние от источника до образца составляло R1 = 1350 мм, расстояние между образцом и детектором в режиме фазового контраста составляло R2 = 250 мм. Излучение регистрировали детектором XIMEA xiRAY11 с размером пикселя 9 мкм. Все измерения проведены в полихроматическом спектре рентгеновской трубки без дополнительной фильтрации. Изображение зондирующего пучка в плоскости исследуемого образца представлено на рис. 2а. В предложенной геометрии эксперимента рабочая область зондирующего пучка составила 17.0 мм по горизонтали и 6.7 мм по вертикали.
Рис. 1.
Схема эксперимента: 1 – широкофокусная рентгеновская трубка, 2 – щелевая апертура, 3 – исследуемый образец, установленный на гониометрическом устройстве, 4 – CCD-детектор. R0 = 90, R1 = 1350, R2 = 250 мм.
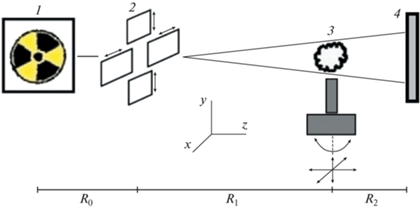
Рис. 2.
Изображение зондирующего пучка в плоскости образца (а), проекция квадратной сетки (Au) с толщиной нити 20 мкм (б). R1 = 1350, R2 = 250 мм.

Для проверки возможности получения фазового контраста в предложенной экспериментальной схеме были измерены рентгеновские проекции тестового объекта, в качестве которого использовали полиэтиленовую трубку с внешним диаметром 2.4 мм и внутренним диаметром 1.7 мм. Фазоконтрастные нормированные проекции полиэтиленовой трубки, измеренные в вертикальном и горизонтальном положениях, представлены на рис. 3а, 3б. Нормировку проекций проводили на первичный пучок, измеренный в отсутствие образца. Профили интенсивности вдоль пунктирных линий (рис. 3в, 3г) демонстрируют скачки интенсивности на границах полиэтилен–воздух. Данный эффект визуально выражается в подчеркивании границ объекта и может быть описан изменением лапласиана набега фазы ${{\nabla }^{2}}{{\varphi }}(x,y)$ в выражении (2) на границах объекта.
Рис. 3.
Фазоконтрастные нормированные проекции полиэтиленовой трубки в вертикальном (а) и горизонтальном (б) положениях и соответствующие профили интенсивности (в, г), построенные вдоль пунктирных линий. R1 = 1350, R2 = 250 мм.

Чтобы оценить разрешение предложенной оптической схемы с учетом выбранных параметров эксперимента, были проведены оценочные расчеты, описанные ниже. Подробный анализ оптимизации параметров эксперимента в конусно-лучевой геометрии можно найти в [17]. Здесь ограничимся лишь самыми общими рассуждениями и оценками разрешения. Будем считать геометрию эксперимента конусно-лучевой, несмотря на то, что соотношение R2/R1 ≪ 1 и размер источника – f = 130 мкм – сравнительно большой. Одним из важных параметров конусно-лучевой схемы (рис. 4) является проекционное увеличение объекта m = = (R1+R2)/R1, благодаря которому размер вокселя в томографическом изображении становится равным ${v}ox$ = p/m, где p – размер пикселя детектора. Таким образом, для случая идеального точечного источника в конусно-лучевой геометрии можно было бы добиться необходимого оптического разрешения, меняя проекционное увеличение. Однако по причине конечных размеров источника возникает размытие объекта в плоскости детектора, которое пропорционально проекционному увеличению, и его величина может быть оценена как U = f(m – 1). Для практических применений можно считать, что достоверная регистрация характерного элемента a возможна, когда размер его изображения в плоскости регистрации не меньше, чем величина геометрической нерезкости U, т.е. m a ≥ f(m – 1). Тогда, понимая под разрешением минимально детектируемый системой размер a, запишем выражение для разрешения, которое может обеспечить источник, в зависимости от проекционного увеличения:
Кривая 1 на рис. 4б – расчет разрешения по выражению (3), выполненный для источника рентгеновского излучения, использованного в настоящей работе (f = 130 мкм). Данная зависимость показывает, как будет меняться разрешение конусно-лучевой схемы в случае протяженного источника и идеального детектора, обладающего любым сколь угодно малым разрешением. Вторым фактором, влияющим на оптическое разрешение, является система регистрации. Будем считать, что разрешение, которое способен обеспечить детектор, зависит от проекционного увеличения следующим образом: где k – количество пикселей, которое должен перекрыть на проекции характерный элемент объекта, необходимое для его достоверного распознавания. В расчетах, выполненных в данной работе, использовали k = 3. Будем считать, что элементы объекта размером менее чем 3 пикселя на изображении либо распознать невозможно для случая их близкого расположения друг к другу, либо они распознаются с существенным искажением своих линейных размеров. Кривая 2 на рис. 4б, рассчитанная по выражению (4), показывает, как меняется разрешение конусно-лучевой схемы для детектора, использованного в настоящей работе (p = 9 мкм), и идеального точечного источника. В данных рассуждениях не учитывали влияние соотношения сигнал–шум, а также собственную геометрическую нерезкость детектора.Рис. 4.
Схема конусно-лучевой геометрии (а) и результаты расчета ее разрешения (б); 1 – расчет для источника с f = 130 мкм и идеального детектора, обладающего любым сколь угодно малым разрешением; 2 – расчет для детектора с размером пикселя p = 9 мкм и идеального точечного источника.

Будем считать, что оптимальное проекционное увеличение и соответствующее ему разрешение оптической системы находятся в области пересечения кривых 1 и 2 на рис. 4б. Также из анализа рис. 4б следует, что в области контактной съемки при m ≈ 1 разрешение зависит от системы регистрации, а с ростом проекционного увеличения определяется размером источника. Для оптической системы, предложенной в настоящей работе, оптимальным является проекционное увеличение на уровне m ≈ 1.2 с возможностью получить пространственное разрешение ~22 мкм. Для экспериментальной проверки разрешения была измерена проекция тестовой регулярной золотой сетки с толщиной нити 20 мкм (рис. 2б).
ОБРАЗЕЦ ДЛЯ ИССЛЕДОВАНИЙ И ПАРАМЕТРЫ ЭКСПЕРИМЕНТА
Объектом исследования в настоящей работе стал эпифиз головного мозга человека. Эпифиз – это эндокринная железа, которая располагается в центральной области мозга, его основная функция – выработка гормона мелатонина [18]. Ожидается, что исследование эпифизов методом фазоконтрастной микротомографии даст возможность визуализировать их морфологическую структуру на уровне сосудов, пинеалоцитов, нейронов, клеток глии и позволит изучить их морфологическое строение для проведения дальнейших исследований возрастных и половых изменений, а также индивидуальных цитоархитектонических различий. Интерпретация результатов исследования эпифиза поможет в построении подходов, связанных с изучением нарушения регуляции циркадных ритмов у лиц, страдающих нейродегенеративными заболеваниями, в частности болезнью Альцгеймера [19].
В процессе подготовки к эксперименту образец эпифиза был предварительно обезвожен в спиртах восходящей концентрации и залит в парафин. Сделаны две томографии образца, а именно, в фазоконтрастном (R2 = 250 мм) и в абсорбционном (R2 = 15 мм) режимах. Установлены следующие параметры томографического эксперимента: ускоряющее напряжение 47 кВ, ток 45 мА, проекционное увеличение m = 1.19 (для измерений в режиме фазового контраста), количество измеренных проекций 1000, угловой шаг 0.2°, общее время проведения эксперимента 6.5 ч. Реконструкцию томографических данных проводили алгебраическим методом для параллельной геометрии, поскольку величина вертикального смещения в плоскости изображения для элементов образца, лежащих в одном томографическом слое, обусловленная конической геометрией пучка и линейными размерами исследуемого образца, не превышала разрешения оптической системы. Также при обработке томографических данных не использовали какие-либо методы предварительного восстановления набега фазы, поэтому название “фазоконтрастная томография” употреблять здесь не совсем корректно в строгом понимании данного термина. Отметим, что в сложившейся практике для восстановления набега фазы исследователи часто используют алгоритм, предложенный в [20]. Однако в настоящей работе прежде всего ставили задачу добиться наиболее четкой визуализации внутренней структуры образца эпифиза, по этой причине восстановление набега фазы не проводили.
РЕЗУЛЬТАТЫ ИЗМЕРЕНИЙ
На рис. 5а, 5в представлены продольные сечения исследуемого образца, сделанные по восстановленным томографическим изображениям для измерений в фазоконтрастном и абсорбционном режимах. С целью продемонстрировать эффект фазового контраста были построены профили восстановленных значений на границе воздушных пор, оставшихся в парафине. Профиль восстановленной интенсивности вдоль линии 1 (рис. 5б) имеет характерный для фазового контраста скачок на границе, где лапласиан сдвига фазы ${{\nabla }^{2}}{{\varphi }}(x,y)$ выражении (2) меняется быстро. Данный эффект визуально выражается в подчеркивании границы воздух–парафин темными и светлыми контурами. В случае томографического изображения, измеренного в режиме абсорбционно контраста, визуально не наблюдается подчеркивания границы воздух–парафин, и профиль интенсивности на рис рис. 5г, построенный вдоль линии 2, имеет характерную ступенчатую форму. Можно констатировать, что на абсорбционном томографическом изображении (рис. 5в) наблюдаются лишь слабо заметные контуры образца эпифиза на фоне парафина. Напротив, на фазоконтрастном изображении (рис. 5а) отчетливо проявляется морфологическая структура мягких тканей эпифиза, в частности видны кровеносные сосуды. Многочисленные кальцификаты, обнаруженные в эпифизе, хорошо просматриваются как на абсорбционном, так и на фазоконтрастном томографических сечениях.
ОБСУЖДЕНИЕ
В работе показана возможность применения “in-line”-метода рентгеновского фазового контраста на лабораторном источнике со стандартной широкофокусной трубкой. Эффект фазового контраста продемонстрирован как на измеренных проекциях тестового объекта (полиэтиленовая трубка), так и в полученном томографическом изображении образца эпифиза головного мозга человека. На примере образца эпифиза продемонстрировано закономерное преимущество фазоконтрастной томографии в сравнении с абсорбционной для задач изучения морфологического строения мягких тканей. Основными ограничениями предложенной схемы эксперимента являются недостаточная суммарная интенсивность излучения в плоскости образца ∼3 × × 106 имп./с, а также сравнительно низкое оптическое разрешение ∼20 мкм. Отметим, что интенсивность, которую обеспечивает стандартная рентгеновская трубка, не позволяет в предложенной геометрии эксперимента существенно уменьшать формирующее отверстие щелевого коллиматора, что в свою очередь позволило бы усилить эффект фазового контраста за счет увеличения пространственной когерентности и возможности увеличить расстояние образец–детектор R2, также это позволило бы повысить разрешение оптической системы. Один из способов увеличения интенсивности зондирующего пучка в подобной схеме эксперимента состоит в использовании более мощных рентгеновских источников с вращающимся анодом, а также дополнительных коллимирующих многослойных зеркал, которые, в том числе, будут выполнять роль монохроматора, как это было показано в [11]. Разрешение на уровне 20 мкм позволило визуализировать кровеносные сосуды, расположенные в мягких тканях эпифиза, а также многочисленные кальцификаты. При этом для более детального изучения эпифиза разрешение требуется увеличить. Например, для визуализации пинеалоцитов – основных клеток эпифиза, вырабатывающих гормон мелатонин, а также для изучения строения кальцификатов необходимо проводить томографические измерения с разрешением 1–3 мкм, как это было показано в [21].
В завершении обсуждения имеет смысл отметить, что, по мнению авторов, наиболее впечатляющих результатов в применении “in-line” фазоконтрастной рентгеновской микротомографии в лабораторных условиях на сегодня удается получить с использованием современных нанофокусных рентгеновских источников. Так, в [22] показаны результаты измерений тестовых биологических объектов, выполненные на лабораторных томографах с разрешением ~1 мкм и качеством томографических изображений, сопоставимых с тем, что получают на лучших станциях СИ.
Авторы выражают благодарность С.В. Савельеву и О.А. Юнеман за образцы, предоставленные для измерений.
Работа выполнена при поддержке Министерства науки и высшего образования РФ в рамках выполнения работ по Государственному заданию ФНИЦ “Кристаллография и фотоника” РАН (в части “обработки и анализа томографических данных”) и по гранту № 075-15-2021-1362 (в части “получения микротомографических изображений”).
Список литературы
Legland D., Alvarado C., Badel E. et al. // Appl. Sci. 2022. V. 12. № 7. P. 3454. https://doi.org/10.3390/app12073454
Zhang X., Wei L., Yao L. et al. // Exp. Therm. Fluid Sci. 2022. P. 110771. https://doi.org/10.1016/j.expthermflusci.2022.110771
Massimi L., Bukreeva I., Santamaria G. et al. // NeuroImage. 2019. V. 184. P. 490. https://doi.org/10.1016/j.neuroimage.2018.09.044
Massimi L., Suaris T., Hagen C. K. et al. // Sci. Rep. 2021. V. 11. № 1. P. 1. https://doi.org/10.1038/s41598-021-83330-w
Barbone G.E., Bravin A., Mittone A. et al. // Radiology. 2021. V. 298 (1). P. 135. https://doi.org/10.1148/radiol.2020201622
Лидер В.В., Ковальчук М.В. // Кристаллография. 2003. Т. 58. № 6. С. 764. https://doi.org/10.7868/S0023476113050068
Mayo S., Endrizzi M. Handbook of Advanced Non-Destructive Evaluation / Eds. Ida AG. N., Meyendorf N. Switzerland: Springer Nature, 2018. P. 1. https://doi.org/10.1007/978-3-319-30050-4_54-1
Snigirev A., Snigireva I., Kohn V. et al. // Rev. Sci. Instrum. 1995. V. 66. P. 5486. https://doi.org/10.1063/1.1146073
Cloetens P., Barrett R., Baruchel J. et al. // J. Phys. D: Appl. Phys. 1996. V. 29. № 1. P. 133. https://doi.org/10.1088/0022-3727/29/1/023
Wilkins S.W., Gureyev T.E., Gao D. et al. // Nature. 1996. V. 384. P. 335. https://doi.org/10.1038/384335a0
Brombal L., Kallon G., Jiang J. et al. // Phys. Rev. Appl. 2019. V. 11. № 3. P. 034004. https://doi.org/10.1103/PhysRevApplied.11.034004
Massimi L., Suaris T., Hagen C. K. et al. // IEEE Trans. Med. Imaging. 2021. V. 41. № 5. P. 1188. https://doi.org/10.1109/TMI.2021.3137964
Shaker K., Häggmark I., Reichmann J. et al. // Commun. Phys. 2021. V. 4 № 1. P. 1. https://doi.org/10.1038/s42005-021-00760-8
Zhou S.A., Brahme A. // Phys. Med. 2008. V. 24. № 3. P. 129. https://doi.org/10.1016/j.ejmp.2008.05.006
Peterzol A., Olivo A., Rigon L. et al. // Med. Phys. 2005.V. 32. № 12. P. 3617. https://doi.org/10.1118/1.2126207
Krivonosov Yu.S., Asadchikov V.E., Buzmakov A.V. // Crystallography Reports. 2020. V. 65. № 4. P. 503. https://doi.org/10.1134/S1063774520040136
Nesterets Y.I., Gureyev T.E., Dimmock M.R. // J. Phys. D: Appl. Phys. 2018. V. 51. № 11. P. 115402. https://doi.org/10.1088/1361-6463/aaacee
López-Muñoz F., Boya J., Marín F. et al. // J. Pineal Res. 1996. V. 20. № 3. P. 115. https://doi.org/10.1111/j.1600-079x.1996.tb00247.x
Kunz D., Schmitz S., Mahlberg R. et al. // Neuropsychopharmacology. 1999. V. 21. № 6. P. 765. https://doi.org/10.1016/S0893-133X(99)00069-X
Paganin D., Mayo S.C., Gureyev T.E. et al. // J. Microsc. 2002. V. 206. № 1. P. 33. https://doi.org/10.1046/j.1365-2818.2002.01010.x
Bukreeva I., Junemann O., Cedola A. et al. // J. Struct. Biol. 2020. V. 212. № 3. P. 107659. https://doi.org/10.1016/j.jsb.2020.107659
Migga A., Schulz G., Rodgers G. et al. // J. Med. Imaging. 2022. V. 9. № 3. P. 031507. https://doi.org/10.1117/1.JMI.9.3.031507
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография



