Кристаллография, 2023, T. 68, № 2, стр. 228-233
Локальное атомное окружение ионов Zn2+ в водном растворе ZnCl2 низкой концентрации: исследования методом спектроскопии XANES
В. Ю. Лысенко 1, М. А. Кременная 1, Г. Э. Яловега 1, *
1 Южный федеральный университет
Ростов-на-Дону, Россия
* E-mail: yalovega@sfedu.ru
Поступила в редакцию 20.12.2022
После доработки 20.12.2022
Принята к публикации 27.12.2022
- EDN: BQHCUB
- DOI: 10.31857/S002347612302011X
Аннотация
На основе литературных данных проанализировано разнообразное локальное окружение ионов цинка в растворе ZnCl2, зависящее от симметрии, типа лигандов, а также от концентрации раствора. Проведен теоретический анализ экспериментальных спектров XANES для K-края поглощения цинка в водном растворе ZnCl2 критически малой концентрации (10–3 М). Показано, что доминирующими в этом растворе являются комплексы Zn(H2O)$_{6}^{{2 + }}$ с ионами Zn2+, находящимися в октаэдрическом окружении молекулами воды.
ВВЕДЕНИЕ
Практически все биохимические процессы протекают в растворах, в которых атомная и электронная структуры растворяемого вещества могут быть модифицированы растворителем. Исследование локального окружения переходных металлов в растворе – актуальная и достаточно сложная задача вследствие возможности их комплексообразования с молекулами растворителя, влияющего на реакционную способность. Например, цинк может быть полезным микроэлементом или токсикантом почти для всех существующих живых форм в зависимости от концентрации раствора и координации ионов цинка [1]. Высокая растворимость хлорида цинка в водном растворе определяет его роль в живой природе, так как от этого зависит его биоаккумуляция в организмах и растениях [2]. Кроме того, интерес к растворам ZnCl2 обусловлен их использованием в качестве активирующего агента при адсорбции ионов различных металлов из сточных вод [3, 4] и катализе [5].
Локальную структуру иона Zn2+ в водных растворах ZnCl2 изучали в разное время экспериментально и теоретически, в том числе в зависимости от концентрации раствора. В основном эти исследования проводили для больших концентраций хлорида цинка в водном растворе – от 1 до 30 М. Малые концентрации, менее 1 M, практически не исследовали. Однако именно они наиболее значимы при исследовании биологических процессов. Растворы концентрацией от 5 до 27.5 М исследовали методом рентгеновской дифракции. В таких высококонцентрированных растворах цинк тетраэдрически координирован тремя хлоридными лигандами и одной молекулой воды [6]. Результаты спектроскопии комбинационного рассеяния света не дали однозначного ответа на вопрос о локальном окружении ионов цинка в водном растворе ZnCl$_{4}^{{2 - }}$. Обсуждалась вероятность существования как тетраэдрически координированного хлором цинка, так и октаэдрически координированных комплексов ZnCl4(Н2О)$_{2}^{{2 - }}$. Более поздние исследования подтвердили тетраэдрическую координацию Zn2+ в растворах большой концентрации [7]. Так как точную информацию о локальной структуре металлического центра в растворах часто трудно определить экспериментально, был проведен ряд исследований раствора ZnCl2 методами многомасштабного моделирования. Структура и энергия образования хлоридов цинка (ZnCln$^{{2--n}}$, n = 0–4) в водном растворе была изучена аb initio квантово-механическими методами. Было предсказано существование комплексов Zn(H2O)$_{6}^{{2 + }}$, ZnCl2(H2O)2, ZnCl3(H2O)– и ZnCl$_{4}^{{2 - }}$ в растворе [8]. Природа делокализации электронов при переходе от лигандов к металлам в первой координационной сфере высокоспиновых комплексов [Fe(H2O)6]2+/3+ и 2[Zn(H2O)6]2+ была изучена на основе теории функционала электронной плотности [9].
Хорошо известно, что одним из методов определения локальной атомной структуры исследуемого элемента является рентгеновская спектроскопия поглощения (XAS – X-Ray Absorption Spectroscopy) с использованием синхротронного излучения. Спектроскопия XAS хорошо адаптирована к исследованию таких сложных объектов, как металлсодержащие координационные комплексы, например металлопротеины, и может выступать в качестве метода, повышающего точность определения структуры металлических центров по сравнению с традиционными методами [10]. Прежде всего это селективный метод, который позволяет определить локальное окружение конкретного элемента, что важно при изучении конденсированных сред со сложным химическим составом. Разновидностью спектроскопии XAS является рентгеновская спектроскопия поглощения в околопороговой области (X-Ray Absorption Near Edge Structure – XANES), которая в отличие от протяженной тонкой структуры рентгеновского спектра поглощения (Extended X-Ray Absorption Fine Structure – EXAFS) позволяет определять локальную симметрию окружения поглощающего атома (валентные углы химической связи). Кроме того, спектроскопия XANES информативна при низкой концентрации исследуемого элемента в различных агрегатных состояниях – аморфном, кристаллическом, растворе, смеси различных фаз [11]. Она применима ко всем металлам в различных оксидных состояниях, в том числе к спектроскопически “бесшумным элементам”, таким как цинк. Эти возможности особенно важны при исследованиях элементов, для которых другие методы менее доступны [12, 13]. Теоретическое моделирование спектров XANES позволяет преодолеть одно из его основных ограничений – усреднение экспериментального спектра при различных видах окружения исследуемого элемента. В [14] было продемонстрировано преимущество такого подхода при определении лигандного окружения в комплексах [CoII(H2O)6]2+ и [CoII(H2O)5Cl]+ в растворе соляной кислоты.
Аквакомплексы, подобные исследуемым, ранее изучали методом EXAFS-спектроскопии [15–17] при концентрациях от 30 до 0.1 М. В настоящей работе локальная атомная структура ионов цинка Zn2+ в водном растворе ZnCl2 сверхнизкой концентрации (10–3 М) определена на основе теоретического анализа околопороговой области экспериментального спектра XANES, полученного в [18].
МЕТОДЫ
Измерения анализируемых спектров проводили в Курчатовском центре синхротронного излучения на линии поворотного магнита LANGMUIR во флуоресцентном режиме в условиях полного внешнего отражения. Раствор соли заливали в ленгмюровскую ванну, XANES-спектры записывали вблизи критического угла полного внешнего отражения при θ ≥ θc в течение 24 ч.
Теоретический анализ спектров рентгеновского поглощения для K-краев цинка проводили методом конечных разностей с использованием полного потенциала с помощью программы FDMNES версии 2022 г. [19]. Размер кластеров, включаемых в расчет, подбирали таким образом, чтобы в него входили все атомы исследуемой модели (∼4 Å). Для полученных спектров проводили процедуру лоренцевской свертки для учета эффектов уширения. Структурные параметры используемых в расчете моделей были взяты из литературных источников.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Одним из факторов, осложняющих процедуру определения параметров водных комплексов, является то, что их структура находится в динамике и может иметь несколько различных конфигураций. Хлорид цинка в водном растворе может образовывать комплексы разных видов, некоторые из них имеют более одной конформации. Экспериментальные данные указывают на существование ZnCl+, ZnCl2, ZnCl3– и ZnCl$_{4}^{{2 - }}$ с разным количеством связанных молекул воды в различном геометрическом окружении [20]. Расчеты аb initio показали возможность образования линейных ZnCl2(H2O)4, тетраэдрических ZnCl2(H2O)2, плоских ZnCl3–, тетраэдрических ZnCl$_{4}^{{2 - }}$ и октаэдрических ZnCl4(H2O)$_{2}^{{2 - }}$ комплексов [8]. Кроме того, локальное окружение ионов Zn2+ зависит от концентрации растворенного вещества. Например, с помощью метода молекулярной динамики было показано, что образование комплексов, содержащих более одного иона цинка, маловероятно при малых концентрациях (менее 4 М). В работе исследовали комплексообразование ионов Zn2+ в водном растворе ZnCl2 очень малой концентрации (10–3 М). Следовательно, наиболее вероятным кажется образование одиночных комплексов, а не больших кластеров с несколькими ионами цинка, что согласуется с данными [21]. Анализ литературных данных показал идентичность спектров XANES раствора ZnCl2 концентрацией 0.15 и 1 M и спектра раствора концентрацией 10–3 М – совпадают форма и энергетические положения пиков (рис. 1). Различия состоят в интенсивности основного пика А – с увеличением концентрации он уменьшается. Из всех приведенных спектров Zn2+ следует, что он имеет октаэдрическую координацию, спектр раствора концентрацией 10–3 М практически полностью совпадает со спектром из [22] (рис. 1, кривая 1). Сопоставление экспериментальных спектров хлорида цинка и нитрата цинка при одинаковых концентрациях показало их практически полную идентичность (рис. 1, кривая 2). Таким образом, основываясь на анализе только экспериментальных спектров XANES, сложно сделать вывод о лигандном окружении ионов цинка в водном растворе.
Анализ литературных данных показывает, что основные различия в локальном окружении октаэдрически координированных комплексов Zn2+ в водных растворах ZnCl2 состоят в типе лигандов и длине химической связи между цинком и его ближайшим окружением.
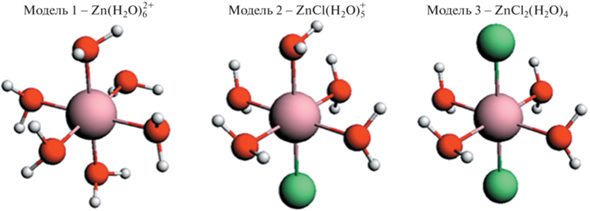
В [25] отмечено, что при низких концентрациях хлорида цинка в водном растворе наиболее вероятными являются комплексы Zn(H2O)$_{6}^{{2 + }}$, ZnCl(H2O)$_{5}^{ + }$ и ZnCl2(H2O)$_{4}^{0}$. После проведенных расчетов методом молекулярной динамики была показана доминирующая роль комплексов Zn(H2O)$_{6}^{{2 + }}$ и ZnCl(H2O)$_{5}^{ + }$. Если образование комплексов Zn(H2O)$_{6}^{{2 + }}$ подтверждено практически всеми исследованиями, то возможность образования ZnCl(H2O)$_{5}^{ + }$ дискутируется. Тем не менее вероятность образования комплексов ZnCl(H2O)$_{5}^{ + }$ была определена методом молекулярной динамики [8] и подтверждена для некоторых концентраций рентгеновской дифракцией [26]. Основываясь на результатах экспериментальных и теоретических исследований, проведенных различными авторами, были построены структурные модели возможных комплексов цинка в водном растворе (рис. 2). Были рассмотрены три возможные модели лигандного окружения Zn2+ в геометрии октаэдра. В первой модели Zn(H2O)6 (модель 1) Zn2+ окружен шестью молекулами воды, во второй модели ZnCl(H2O)5 (модель 2) окружение Zn2+ – искаженный октаэдр с пятью молекулами воды и одним атомом хлора, в третьей модели ZnCl2(H2O)$_{4}^{0}$ (модель 3) ион цинка имеет два лиганда хлора и четыре молекулы воды.
Межатомные расстояния Zn–O и Zn–Cl в первой координационной сфере окружения иона цинка также варьируются в зависимости от метода определения. В табл. 1 приведены данные о длинах связи Zn–O и Zn–Cl для различных моделей и литературные источники, на основе которых они были построены.
Таблица 1.
Длина химической связи в структурных моделях комплексов Zn2+ в водном растворе ZnCl2 из различных литературных источников
| Комплекс | Модель | Связь | Длина связи (теория), Å |
Длина связи (эксперимент), Å |
Литература |
|---|---|---|---|---|---|
| Zn(H2O)$_{6}^{{2 + }}$ | 1.1 | Zn–O | 2.05 | [27] | |
| 1.2 | Zn–O | 2.08 | [28] | ||
| 1.3 | Zn–O | 2.14 | [8] | ||
| ZnCl(H2O)$_{5}^{ + }$ | 2.1 | Zn–O | 2.16, 2.19, 2.20, 2.21 | [8] | |
| Zn–Cl | 2.27 | ||||
| 2.2 | Zn–O | 2.10 | [14] | ||
| Zn–Cl | 2.46 | ||||
| 2.3 | Zn–O | 2.07 | [29] | ||
| Zn–Cl | 2.24 | ||||
| 2.4 | Zn–O | 2.03 | [25] | ||
| Zn–Cl | 2.29 | ||||
| 2.5 | Zn–O | 2.04 | [30] | ||
| Zn–Cl | 2.33 | ||||
| ZnCl2(H2O)4 | 3.1 | Zn–O | 2.09 | [31] | |
| Zn–Cl | 2.28 | ||||
| 3.2 | Zn–O | 2.22 | [8] | ||
| Zn–Cl | 2.35 |
Для структурных моделей (рис. 2) с различными расстояниями Zn–O и Zn–Cl были рассчитаны теоретические спектры XANES за K-краем поглощения цинка. Общие тенденции изменения теоретических спектров представлены на рис. 3. Характерной особенностью спектров всех моделей является недооценка интенсивности особенности В по сравнению с экспериментальным спектром. Такое поведение характерно для теоретических расчетов, проводимых с помощью программного комплекса FDMNES, и наблюдалось при расчетах K-краев поглощения кобальта в комплексах [CoII(H2O)6]2+ и [CoII(H2O)5Cl]+ с идентичным окружением хлорида кобальта [14]. Выраженность особенности B в теоретических спектрах XANES зависит от степени искажения октаэдра при увеличении аксиальных межатомных расстояний Zn–О или Zn–Cl (не приведен здесь). Теоретические спектры XANES для моделей 2 и 3 различаются формой несущественно. Основные различия в спектрах всех моделей выражаются в изменении энергетических расстояний между пиками А и В, обусловленном изменением межатомных расстояний Zn–O и Zn–Cl. Согласно этим данным с экспериментальным спектром хорошо согласуются спектры модели 1.1, расстояния в которой определены методом XAS. Отличие спектров модели 1 от спектров моделей 2 и 3 состоит в возникновении особенности A', характерной для искаженного октаэдра и обусловленной энергетическим переходом электрона 1s → 3d, запрещенным дипольным переходом в центросимметричной системе. Предкраевая особенность A' отсутствует в спектрах модели 1 и экспериментальном спектре, что говорит в пользу доминирования комплексов Zn(H2O)$_{6}^{{2 + }}$ в водном растворе ZnCl2 концентрацией 10–3 моль/л.
Рис. 3.
Сравнение с экспериментальным спектром раствора ZnCl2 концентрации 10–3 М [18] теоретических спектров для различных моделей окружения ионов Zn2+, представленных в табл. 1: a – молекулами воды с различными межатомными расстояниями Zn–O (1.1–2.05, 1.3–2.14 Å), б – молекулами воды и ионами хлора с различными расстояниями Zn–O и Zn–Cl (2.1–2.16, 2.19, 2.20, 2.21, 2.27 Å, 2.5–2.04, 2.33 Å, 3.1–2.09, 2.28 Å, 3.2–2.22, 2.35 Å).

ВЫВОДЫ
По данным спектроскопии рентгеновского поглощения XANES водного раствора ZnCl2 концентрацией 10–3 М, полученного в ленгмюровской ванне, исследовано локальное атомное окружение ионов Zn2+. На основе литературных данных проанализировано разнообразное локальное окружение ионов цинка в растворе ZnCl2, зависящее от симметрии, типа лигандов, а также от концентрации раствора. При малых концентрациях (менее 1 М) наиболее вероятными являются одиночные водные октаэдрические комплексы Zn(H2O)$_{6}^{{2 + }}$, ZnCl(H2O)$_{5}^{ + }$ и ZnCl2(H2O)$_{4}^{0}$. Теоретическое моделирование спектров XANES показало, что доминирующими комплексами в водном растворе критически малой концентрации (∼10–3 М) являются комплексы Zn(H2O)$_{6}^{{2 + }}$. Ионы цинка в растворе октаэдрически координированы молекулами воды.
Работа выполнена при поддержке Совета по грантам Президента Российской Федерации (грант для государственной поддержки молодых российских ученых № МК-2767.2021.1.2).
Список литературы
Sandstead H.H. // Handbook on the Toxicology of Metals, 4th ed., Elsevier, 2014. P. 1369.
Pipan-Tkalec Z., Drobne D., Jemec A. et al. // Toxicology. 2010. V. 269. P. 198. https://doi.org/10.1016/j.tox.2009.08.004
Kula I., Uğurlu M., Karaoğlu H. et al. // Bioresour. Technol. 2008. V. 99. P. 492. https://doi.org/10.1016/j.biortech.2007.01.015
Yusuff A.S., Lala M.A., Thompson-Yusuff K.A. et al. // S. Afr. J. Chem. Eng. 2022. V. 42. P. 138. https://doi.org/10.1016/j.sajce.2022.08.002
Wen D., Fang Z., He H. et al. // Int. J. Chem. React. Eng. 2018. V. 16. P. 20170256. https://doi.org/10.1515/ijcre-2017-0256
Kruh R.F., Standleyc L. // Inorg. Chem. 1962. V. 1. P. 941.
Eastela J., Giaquintap V., March N.H. et al. // Chem. Phys. 1983. V. 76. P. 125.
Parchment O.G., Vincent M.A., Hillier I.H. // J. Phys. Chem. 1996. V. 100. P. 9689.
Pokhrel N., Lamichhane H.P. // J. Sci. Technol. 2018. V. 22. P. 148. https://doi.org/10.3126/jist.v22i2.19607
Yalovega G.E., Kremennaya M.A. // Crystallography Reports. 2020. V. 65. P. 813. https://doi.org/10.1134/S1063774520060395
Фетисов Г.В. Синхротронное излучение. Методы исследования структуры веществ. М.: Физматлит, 2007. 672 с.
Aziz E.F., Ottosson N., Bonhommeau S. et al. // Phys. Rev. Lett. 2009. V. 102. P. 68103. https://doi.org/10.1103/PhysRevLett.102.06810313
Shi W., Punta M., Bohon J. et al. // Genome Res. 2011. V. 21. P. 898. https://doi.org/10.1101/gr.115097.110
Uchikoshi M., Shinoda K. // Struct. Chem. 2019. V. 30. P. 945. https://doi.org/10.1007/s11224-018-1245-7
D’Angelo P., Zitolo A., Ceccacci F. et al. // J. Chem. Phys. 2011. V. 135. P. 15450. https://doi.org/10.1063/1.3653939
D'Angelo P., Barone V., Chillemi G. et al. // J. Am. Chem. Soc. 2002. V. 124. P. 1958. https://doi.org/10.1021/ja015685x
Dreier P., Rabe P. // J. Phys. Colloq. 1986. V. 47. P. C8-809. https://doi.org/10.1051/jphyscol:19868155
Новикова Н.Н., Якунин С.Н., Ковальчук М.В. и др. // Кристаллография. 2019. Т. 64. № 6. С. 931.
Joly Y. // Phys. Rev. B. 2001. V. 63. P. 125120.
Silber H.B., Simon D., Gaizer F. // Inorg. Chem. 1984. V. 23. P. 2844.
Brugger J.L., Liu W., Etschmann B. et al. // Chem. Geol. 2016. V. 447. P. 219.
Alloteau F., Valbi V., Majérus O. et al. // Glass Atmospheric Alteration: Cultural Heritage, Industrial and Nuclear Glasses. Hermann, 2019. P. 192.
Nelson J. // J. Synchrotron Radiat. 2021. V. 28. P. 1119. https://doi.org/10.1107/S1600577521004033
Walker A., Vratsanos M., Kozawa S. et al. // Soft Matter. 2019. V. 15. P. 7596.
Harris D.J., Brodholt J.P., Harding J.H. et al. // Mol. Phys. 2001. V. 99. P. 825. https://doi.org/10.1080/00268970010015588
Paschina G., Piccaluga G., Pinna G. et al. // J. Chem. Phys. 1983. V. 78. P. 5745.
Takahashi M., Tanida H., Kawauchi S. et al. // J. Synchrotron Radiat. 1999. V. 6. P. 278.
Magini M., Licheri G., Paschina G. et al. // X-ray Diffraction of Ions in Aqueous Solution: Hydration and Complex Formation. CRC Press: Boca Raton, FL. 1988. P. 284.
Paschina G., Piccaluga G., Pinna G. et al. // J. Chem. Phys. 1983. V. 78. P. 5745.
Liu W., Borg S.J., Testemale D. et al. // Geochim. Cosmochim. Acta. 2011. V. 75. P. 1227. https://doi.org/10.1016/j.gca.2010.12.002
Powelld H., Gullidgep M.N., Neilsong W. et al. // Molec. Phys. 1990. V. 71. P. 1107.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография