Кристаллография, 2023, T. 68, № 2, стр. 234-245
Комплексы этилендиаминтетрауксусной кислоты с аминами: молекулярные структуры этилендиаминтетраацетата бис(моноэтаноламиния) и этилендиаминтетраацетата бис[три(гидроксиметил)метанаминия] тригидрата
В. В. Семенов 1, *, Н. В. Золотарева 1, О. В. Новикова 1, Б. И. Петров 1, Н. М. Лазарев 1, Г. К. Фукин 1, А. В. Черкасов 1, Е. Н. Разов 2
1 Институт металлоорганической химии им. Г.А. Разуваева РАН
Нижний Новгород, Россия
2 Нижегородский государственный университет им. Н.И. Лобачевского
Нижний Новгород, Россия
* E-mail: vvsemenov@iomc.ras.ru
Поступила в редакцию 03.06.2022
После доработки 05.09.2022
Принята к публикации 05.09.2022
- EDN: BSGBEV
- DOI: 10.31857/S0023476123020145
Аннотация
Четырехосновная этилендиаминтетрауксусная кислота H4L присоединяет две молекулы одноосновного амина, давая соответствующие соли: этилендиаминтетраацетаты бис(моноэтаноламиния) H2L2– ⋅ 2+H3NCH2CH2ОН, три(гидроксиметил)метанаминия H2L2– ⋅ 2+H3NС(CH2ОН)3 ⋅ 3H2О, диэтиламиния H2L2– ⋅ 2+H2N(C2H5)2 ⋅ H2О, трет-бутиламиния H2L2– ⋅ 2+H3NС(CH3)3 ⋅ 5H2О, триэтаноламиния H2L2– ⋅ 2+HN(CH2CH2ОH)3. Двухосновные гексаметилен-1,6-диамин, триэтилендиамин и тетраметилэтилендиамин образуют аддукты 1 : 1: H2L2– ⋅ +NH3(CH2)6NH$_{3}^{ + }$, H2L2– ⋅ +NH3CH2CH2(OCH2CH2)2NH$_{3}^{ + }$, H2L2– ⋅ +HN(CH2CH2)3NH+ ⋅ H2О и H2L2– ⋅ +H(CH3)2NCH2CH2N(CH3)2H+. Представлены молекулярные структуры этилендиаминтетраацетата бис(моноэтаноламиния) и этилендиаминтетраацетата бис[три(гидроксиметил)метанаминия] тригидрата.
ВВЕДЕНИЕ
Аминиевые соли протонных кислот используются в качестве фармацевтических и агрохимических [1] препаратов, ионных жидкостей [2, 3], в процессах очистки нефти [4]. Наибольшее количество практических приложений [5] нашли аминоспирты: моно-, ди- и триэтаноламины. Моноэтаноламин связывает кислотные примеси в нефти [4] и предотвращает процессы коррозии стали при транспортировке, используется для выделения углекислого газа [6] из отходящих топливных газов. Триэтаноламин образует целый класс координационных соединений – атранов с транс-аннулярной связью между атомом азота и гетероэлемента [1, 7], многие из которых [1, 8, 9] обладают высокой биологической активностью.
Компоненты фармацевтических препаратов должны обладать высокой степенью чистоты. В связи с этим разработка методов их очистки представляется весьма актуальной задачей. В настоящем сообщении представлены методы синтеза девяти аминиевых солей этилендиаминтетрауксусной кислоты, предложены способы их очистки перекристаллизацией из органических растворителей. Синтезированные и очищенные соединения охарактеризованы методами ИК-, ЯМР-, масс-спектроскопии, элементного, рентгенофазового (РФА), термогравиметрического анализов (ТГА), оптической и сканирующей электронной микроскопией (СЭМ), для двух кристаллов выполнен рентгеноструктурный анализ (РСА).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Методы анализа
ИК- и ЯМР-спектроскопия. ИК-спектры соединений в виде суспензии в вазелиновом (область 1400–400 см–1) и фторированном (4000–1400 см–1) маслах между пластинами KBr регистрировали на ИК-фурье-спектрометре ФСМ 1201 (Россия), спектры ЯМР 1Н и 13С – на ЯМР-спектрометре AvanceNEO 300 (BrukerAvanceIII 400) (ФРГ) в D2O.
Элементный анализ. Элементный анализ выполнен на автоматическом элементном анализаторе VarioELcube (Elementar Analysen SystemeGmbH) (ФРГ) в конфигурации CHNS, газ-носитель – гелий марки 6.0.
Микроскопия. Оптическая микроскопия выполнена на микроскопе Микромед 3 производства “Нингбо Шепт Хенг Оптикс энд Электроникс Ко., ЛТД” с цифровой камерой ToupCam14MP (КНР); электронная микроскопия – на сканирующем электронном микроскопе Tescan VEGA II (Чешская Республика). Микрорельеф исследовали при увеличениях от ×500 до ×50 000. Съемку проводили при ускоряющем напряжении 20 кВ и рабочем расстоянии 2–8 мм, использовали детекторы вторичных электронов (SE) и обратно рассеянных электронов (BSE).
Рентгенофазовый анализ. Рентгенографические исследования выполнены на рентгеновском дифрактометре Shimadzu XRD-7000 (Япония).
Масс-спектроскопия. Масс-спектры измерены на хромато-масс-спектрометре PolarisQ с хроматографом TraceGCUltra (США).
Термический анализ. Термогравиметрический анализ выполнен на приборе синхронного термического анализа TGA/DSC 3+ METTLERTOLEDO (Швейцария), скорость нагрева составляла 5°С/мин, скорость подачи аргона – 20 мл/мин. Измерения проводили в температурном интервале от +25 до +500°С.
Рентгеноструктурный анализ бесцветных прозрачных монокристаллических образцов I (0.30 × × 0.12 × 0.12 мм) и II (0.52 × 0.14 × 0.09 мм) выполнен на дифрактометре Bruker D8 Quest (ФРГ) (МоKα-излучение, ω-сканирование, λ = 0.71073 Å, T = 100.0(2) K). Измерение и интегрирование экспериментальных наборов интенсивностей, учет поглощения и уточнение структур проведены с использованием программных пакетов APEX3 [10], SADABS [11] и SHELX [12].
Соединение I (C10H14N2O8, 2C2H8NO) кристаллизуется в пр. гр. P2/c (a = 11.0592(5), b = 5.1727(3), с = 17.0128(8) Å, β = 100.072(2)°, V = = 958.23(8) Å3, Z = 2, dрасч = 1.436 г/см3, μ = = 0.122 мм‒1). Измерено 12 277 отражений (θ = 27.89°), 2287 независимых отражений (Rint = 0.0671) были использованы для решения структуры и последующего уточнения 188 параметров полноматричным МНК по $F_{{hkl}}^{2}$ в анизотропном приближении для неводородных атомов. Водородные атомы были найдены из разностного синтеза Фурье электронной плотности и уточнены изотропно. После финального уточнения wR2 = 0.0935 и S(F 2) = 1.030 для всех отражений (R1 = 0.0371 для всех 1849 отражений, удовлетворяющих условию F 2 > 2σ(F 2)). Остаточные максимум и минимум электронной плотности составили 0.35/–0.22 э/Å3.
Соединение II (C10H14N2O8, 2C4H12NO3, 3H2O) кристаллизуется в пр. гр. P21/c (a = 10.2658(5), b = 21.9583(12), с = 11.7248(6) Å, β = 91.272(2)°, V = 2642.3(2) Å3, Z = 4, dрасч = 1.480 г/см3, μ = = 0.131 мм–1). Измерено 33 069 отражений (θ = 27.88°), 6296 независимых отражений (Rint = 0.1011) были использованы для решения структуры и последующего уточнения 527 параметров полноматричным МНК по $F_{{hkl}}^{2}$ в анизотропном приближении для неводородных атомов. Водородные атомы были найдены из разностного синтеза Фурье электронной плотности и уточнены изотропно. После финального уточнения wR2 = 0.0962 и S(F 2) = 1.052 для всех отражений (R1 = 0.0464 для всех 4572 отражений, удовлетворяющих условию F 2 > 2σ(F 2)). Остаточные максимум и минимум электронной плотности составили 0.33/–0.30 э/Å3.
Структуры I и II депонированы в Кембриджский банк структурных данных под номерами CCDC 2144221 (I), 2172960 (II) и доступны по адресу ccdc.cam.ac.uk/structures.
Синтез
Реактивы. Этилендиаминтетрауксусную кислоту получали обработкой динатриевой соли (трилона-Б) серной кислотой, промывали дистиллированной водой, сушили на воздухе и затем в сушильном шкафу при 110°С. В работе использовали моноэтаноламин (2-аминоэтанол) квалификации “ч” производства ООО “СинтезОКА”, г. Дзержинск, ТУ 2423-002-78722668-2010; триэтаноламин квалификации «ч» производства ООО “Синтез ОКА”, г. Дзержинск, ТУ 2423-005-78722668-2010, АО “ЭКОС-1”; трет-бутиламин ТУ 6-09-06-490-75 и гексаметилен-1,6-диамин, “ч”, ТУ 6-09-36-73, Ереванский завод химреактивов; 2,2'(этилендиокси)бис(этиламин) Fluka; тетраметилэтилендиамин и 1,4-диазабицикло [2, 2, 2 ]октан, Sigma-Aldrich Chemie GmbH.
Этилендиаминтетраацетат бис(моноэтаноламиния) (I). К суспензии 2.0 г (6.89 × 10–3 моль) ЭДТА в 50 мл метанола прибавляли по каплям при перемешивании раствор 0.84 г (1.38 × 10–2 моль) моноэтаноламина в 10 мл метанола. В течение 1 ч суспензия ЭДТА растворилась, после чего началось накопление нового осадка. Через 12 ч смесь фильтровали, осадок сушили на воздухе. Получили 1.60 г белого порошка, из которого кристаллизацией из горячего метанола выделили 1.40 г (3.38 × × 10–3 моль, 49%) этилендиаминтетраацетата бис(моноэтаноламиния) H2L2– ⋅ 2+NH3CH2CH2ОН. Найдено: C 40.17, H 7.46, N 13.39 мас. %.
C14H30N4O10. Вычислено: C 40.56, H 7.30, N 13.52 мас. %. ИК-спектр: 3238, 3110, 3005, 2770, 2636, 2529, 2487, 2380, 2106, 1621, 1629, 1578, 1513, 1456, 1402, 1376, 1358, 1328, 1304, 1271, 1227, 1197, 1140, 1066, 1012, 973, 914, 851, 807, 678, 628, 592, 565, 494 см–1.
Этилендиаминтетраацетат бис[три(гидроксиметил)метанаминия] тригидрат H2L2– ⋅ 2+H3NС (CH2ОН)3 ⋅ ⋅ 3H2О (II). К суспензии 2.00 г (6.89 × 10–3 моль) ЭДТА в 20 мл Н2О прибавляли по каплям при перемешивании раствор 1.67 г (1.38 × × 10–2 моль) три(гидроксиметил)метанамина в 10 мл Н2О. Через 5 мин суспензия ЭДТА растворилась. Прозрачный раствор оставляли в открытом широком бюксе. Через 5 сут его объем уменьшился в 4 раза, вязкость увеличилась. Раствор смешивали с 15 мл диоксана. Через 24 ч выпавший осадок фильтровали, промывали ацетоном, растворители удаляли в вакууме. Получили 3.07 г (5.21 × 10–3 моль, 75%) этилендиаминтетраацетата бис(тригидроксиметил)-метанаминия тригидрата H2L2– ⋅ 2+H3NС(CH2ОН)3 ⋅ ⋅ 3H2О в виде белого мягкого порошка. Найдено: С 36.56, H 8.25, N 9.41 мас. %.
C18H44N4O17. Вычислено: С 36.73, H 7.54, N 9.52 мас. %. ИК-спектр: 3390, 3273, 3220, 1706, 1638, 1611, 1534, 1459, 1393, 1346, 1322, 1200, 1075, 1057, 956, 917, 860, 810, 720, 702, 631 см–1. ЯМР 1Н (D2O): 3.54 c. (4H, –CH2N), 3.60 c. (12H, CH2OH), 3.78 c. (8H, CH2C(O)O–); 13C: 51.51 c. (2C, CH2N), 57.91 c. (4C, CH2–C(O)), 59.47 c. (6C, CH2–OH), 61.56 (2C, –C(CH2–)), 170.78 (4C, –C(O)O). Кристаллы для РСА получали из пересыщенного раствора в этиловом спирте.
Этилендиаминтетраацетат бис(диэтиламиния) гидрат H2L2– ⋅ 2+H2N(C2H5)2 ⋅ H2О (III) получили из ЭДТА и диэтиламина, перекристаллизовали из смеси метанол–ацетон. Найдено: С 47.68, H 8.73, N 12.24 мас. %.
C18H40N4O9. Вычислено: С 47.36, H 8.83, N 12.27 мас. %. ИК-спектр: 3464, 3437, 3381, 3020, 2853, 2824, 2776, 2743, 2514, 2493 2469, 2412, 2371, 2308, 2183, 1930, 1712, 1632, 1456, 1396, 1361, 1227, 1212, 1194, 1090, 1066, 1051, 970, 956, 920, 848, 807, 681, 625, 568, 491, 452 см–1. ЯМР 1Н (D2O, δ, м.д.): 1.13 т. (J = 7.3 Гц, 12 Н, СН3), 2.93 кв. (J = 7.2 Гц, 8Н, –CH2–NH2+), 3.54 с. (4Н, CH2–N), 3.76 с. (8Н, СН2С(О)). ЯМР 13С (D2O, δ, м.д.): 10.47 (4С, CH3), 42.13 (4C, +NCH2CH3), 51.45 c. (2С, CH2N), 57.96 c. (4C, CH2C(O)), 170.33 c. (4С, C(O)O). Масс-спектр, м/э: 58, 74 (100%), 81, 99, 121, 143, 149, 170, 178, 185, 187, 217, 255, 285, 313, 353, 368, 395, 423.
Этилендиаминтетраацетат бис(трет-бутиламиния) пентагидрат H2L2– ⋅ 2+H3NС(CH3)3 ⋅ 5H2О (IV) получили из ЭДТА и трет-бутиламина, перекристаллизовали из раствора в метаноле. Найдено: С 40.90, H 8.92, N 10.23 мас. %.
C18H48N4O13. Вычислено: С 40.90, H 9.15, N 10.60 мас. %. ИК-спектр: 3562, 3437 пл, 3306, 3050, 2734, 2636, 2555, 2171, 2028, 1691, 1623, 1560, 1349, 1289, 1230, 1212, 1191, 1087, 950, 905, 854, 804, 711, 681, 631, 604, 544, 497, 482 см–1.
Этилендиаминтетраацетат бис(триэтаноламиния) H2L2– ⋅ 2+HN(CH2CH2ОH)3 (V) получили из ЭДТА и триэтаноламина, перекристаллизовали из раствора в метаноле. Найдено: С 45.06, H 8.10, N 9.53 мас. %.
C22H46N4O14. Вычислено: С 44.74, H 7.85, N 9.49 мас. %. ИК-спектр: 3416, 3127, 3104, 3008, 2776, 2675, 1662, 1635, 1459, 1396, 1379, 1352, 1319, 1298, 1215, 1194, 1099, 1063, 1033, 1009, 956, 914, 854, 810, 675, 631, 568, 521, 482 см–1. ЯМР 1Н (D2O, δ, м. д.): 3.35–3.39 м. (12Н, –СН2–), 3.55 с. (4Н, –СН2–, ЭДТА), 3.78 с. (8Н, СН2–С(О), ЭДТА), 3.83–3.86 м. (12Н, СН2–О, ТЭА). ЯМР 13С (D2O, δ, м. д.): 51.66 (6С, –СН2–, ТЭА), 55.09 (6С, СН2СН2ОН), 55.35 (2С, CH2N+), 57.91 (6С, CH2OH), 170.50 (4С, СОО–). Соединение растворяется в этиленхлоргидрине, плохо растворяется в метаноле, диоксане, диметоксиэтане, умеренно растворяется в этиловом спирте, ацетонитриле и диметилсульфоксиде. По данным РСА кристаллы, выделенные из этиленхлоргидрина, представляли собой хлорид триэтаноламиния Cl–+HN(CH2CH2ОH)3.
Этилендиаминтетраацетат гексаметилен-1,6-диаминия H2L2– ⋅ +NH3(CH2)6NH$_{3}^{ + }$ (VI) получили из ЭДТА и гексаметилен-1,6-диамина, перекристаллизовали из раствора в метаноле. Найдено: С 47.55, H 8.18, N 13.81 мас. %.
C16H32N4O8. Вычислено: С 47.03, H 7.90, N 13.72 мас. %. ИК-спектр: 3446, 3351, 3053, 2657, 2564, 2180, 1638, 1575, 1519, 1462, 1393, 1316, 1250, 1131, 1104, 1072, 1030, 1000, 961, 914, 899, 836, 798, 723, 625, 547, 524, 473 см–1.
Этилендиаминтетраацетат 2,2'-(этилендиокси)ди(этиламиния) H2L2– ⋅ +NH3CH2CH2OCH2CH2 OCH2CH2NH$_{3}^{ + }$ (VII) получили из ЭДТА и 2,2'-(этилендиокси)ди(этиламина), перекристаллизовали из раствора в метаноле– диметилсульфоксиде. Найдено: С 42.93, H 7.89, N 12.81 мас. %.
C16H32N4O10 Вычислено: С 43.62, H 7.33, N 12.72 мас. %. ИК-спектр: 3390, 3273, 3062, 2725, 2636, 2561, 2150, 1632, 1566, 1539, 1459, 1402, 1376, 1328, 1253, 1119, 1063, 1003, 991, 926, 905, 720, 628, 565, 535 см–1.
Этилендиаминтетраацетат триэтилендиаминия гидрат H2L2– ⋅ +HN(CH2CH2)3NH+ ⋅ H2О (VIII) получили из ЭДТА и ДАБКО, перекристаллизовали из смеси растворителей метанол–толуол. Найдено: С 45.47, H 7.18, N 12.92 мас. %.
C16H30N4O9. Вычислено: С 45.49, H 7.16, N 13.26 мас. %. ИК-спектр: 3408, 3235, 3038, 2996, 2317, 1629, 1399, 1346, 1295, 1227, 1200, 1090, 1063, 976, 950, 911, 857, 798, 693, 634, 565, 497 см–1.
Этилендиаминтетраацетат тетраметилэтилендиаминия H2L2– ⋅ +H(CH3)2NCH2CH2N(CH3)2H+ (IX) получили из ЭДТА и тетраметилэтилендиамина, перекристаллизовали из смеси растворителей метанол–ацетон. Найдено: С 46.51, H 7.56, N 13.18 мас. %.
C16H32N4O8. Вычислено: С 47.05, H 7.90, N 13.72 мас. %. ИК-спектр: 3402, 3098, 3020, 2669, 2374, 1909, 1715, 1623, 1495, 1459, 1495, 1388, 1376, 1352, 1310, 1206, 1134, 1093, 985, 908, 875, 848, 810, 735, 693, 631, 589, 521, 491, 458 см-1. ЯМР 1Н (D2O, δ, м.д.): 2.84 c. (12Н, CH3), 3.51 c. (4Н, –CH2–, ТМЕДА), 3.52 с. (4Н, –CH2–, ТМЕДА), 3.77 с. (8Н, СН2С(О)О). ЯМР 13С (D2O, δ, м.д.): 43.30 с. (4С, СН3), 50.93 с. (2С, CH2–NH+(CH3)2), 51.71 c. (2С, CH2N+), 58.26 c. (4С, CH2–C(O)), 170.75 c. (4С, C(O)O).
Соединение растворяется в этиленхлоргидрине, не растворяется в этилацетате, плохо растворяется в диоксане, ацетонитриле, н-бутиловом спирте. Крупные кристаллы получали добавлением диоксана к раствору в этиленхлоргидрине. По данным РСА они представляли собой гидрохлорид тетраметилэтилендиаминия Cl– ⋅ +H(CH3)2NCH2CH2N(CH3)2.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В [13] были представлены результаты исследования синтеза и свойств аминиевых производных нитрилотриуксусной кислоты N(CH2COOH)3 (НТА, комплексон-1). В настоящем сообщении показаны методы получения и условия перекристаллизации соединений аминов с этилендиаминтетрауксусной кислотой H4L (ЭДТА, комплексон-2).
В синтезах использованы следующие амины:
| Моноэтаноламин | H2NCH2CH2OH | МЭА |
| Три(гидроксиметил)метанамин | H2NС(CH2ОН)3 | ТГМА |
| Диэтиламин | HN(C2H5)2 | ДЭА |
| Трет-бутиламин | H2NС(CH3)3 | ТБА |
| Триэтаноламин | N(CH2CH2ОH)3 | ТЭА |
| Гексаметилен-1,6-диамин | H2N(CH2)6NH2 | ГМДА |
| 2,2'-(этилендиокси)ди(этиламин) | NH2CH2CH2OCH2 CH2OCH2CH2NH2 | ЭОДА |
| Триэтилендиамин (диазабицикло-2,2,2-октан) | N(CH2CH2)3N | ДАБКО |
| Тетраметилэтилендиамин | (CH3)2NCH2CH2N (CH3)2 | ТМЕДА |
ЭДТА представляет собой четырехосновную кислоту [14] с постепенно убывающей кислотностью: ${\text{р}}K_{{\text{а}}}^{1}$ = 2.00, ${\text{р}}K_{{\text{а}}}^{2}$ = 2.68, ${\text{р}}K_{{\text{а}}}^{3}$ = 6.11, ${\text{р}}K_{{\text{а}}}^{4}$ = = 10.17. Сильной кислотой ее можно считать только относительно диссоциации по первым двум стадиям. Две свободные кислотные группировки в ее бетаиновой структуре позволяют надеяться на максимальное присоединение только двух молекул амина. В связи с этим реакции проводили в молярном соотношении ЭДТА : амин = 1 : 2.
ЭДТА плохо растворяется в воде и в органических растворителях. Добавление амина к водной суспензии вызывает быстрое растворение из-за образования аминиевой соли. Удаление воды приводит к образованию твердой фазы, состоящей из кристаллов целевого соединения, внедренных в смолообразную смесь олигомеров. Отделить аминиевую соль от смолы чаще всего бывает затруднительно. Синтезы в среде метилового спирта привели к образованию кристаллических осадков только в случае МЭА, ДЭА и ТЭА, в то время как с ТГМА, ТБА, ЭОДА, ДАБКО и ТМЕДА получались растворимые соединения. После удаления метанола и нагревания остатка в вакууме целевые соединения выкристаллизовывались из пересыщенных растворов в МеОН, этилцеллозольве, МеОН–толуоле или МеОН–ацетоне. Выходы чистых образцов варьировали от 25 до 95%. Таким образом были получены девять соединений, формулы, названия и выходы которых представлены в табл. 1. Попытки перекристаллизации соединений IV и VIII из этиленхлоргидрина ClCH2CH2OH неожиданно привели по данным РСА к образованию соответствующих гидрохлоридов Cl–+HN(CH2CH2ОH)3 и Cl–+H(CH3)2NCH2 CH2N(CH3)2. Соединения охарактеризованы методами ИК-, ЯМР-спектроскопии, масс-спектрометрии, РФА, а производные МЭА и ТГМА – рентгеноструктурного анализа.
Таблица 1.
Формулы, названия и выходы полученных соединений
| Соеди-нение | Формула | Название | Выход, % |
|---|---|---|---|
| I | H2L2– ⋅ 2+H3NCH2CH2ОН | Этилендиаминтетраацетат бис(моноэтаноламиния) | 49 |
| II | H2L2– ⋅ 2+H3NС(CH2ОН)3 ⋅ 3H2О | Этилендиаминтетраацетат бис[три(гидроксиметил)метанаминия] тригидрат | 75 |
| III | H2L2– ⋅ 2+H2N(C2H5)2 ⋅ H2О | Этилендиаминтетраацетат бис(диэтиламиния) гидрат | 40 |
| IV | H2L2– ⋅ 2+H3NС(CH3)3 ⋅ 5H2О | Этилендиаминтетраацетат бис(трет-бутиламиния) пентагидрат | 53 |
| V | H2L2– ⋅ 2+HN(CH2CH2ОH)3 | Этилендиаминтетраацетат бис(триэтаноламиния) | 95 |
| VI | H2L2– ⋅ +H3N (CH2)6NH$_{3}^{ + }$ | Этилендиаминтетраацетат гексаметилен-1,6-диаминия | 37 |
| VII | H2L2– ⋅ +H3NCH2CH2(OCH2CH2)2NH$_{3}^{ + }$ | Этилендиаминтетраацетат 2,2'-(этилендиокси)ди(этиламиния) | 25 |
| VIII | H2L2– ⋅ +HN(CH2CH2)3NH+ ⋅ H2О | Этилендиаминтетраацетат триэтилендиаминия гидрат | 35 |
| IX | H2L2– ⋅ +H(CH3)2NCH2CH2N(CH3)2H+ | Этилендиаминтетраацетат тетраметилэтилендиаминия | 76 |
Трансформация ИК-спектра при образовании соли наилучшим образом демонстрируется на примере трет-бутиламина. На рис. 1 представлены ИК-спектры ЭДТА, ТБА и соединения IV.
Для ЭДТА в области поглощения карбоксильных групп поликристаллического образца [14] существует только одна интенсивная полоса при 1697 см–1, свидетельствующая о равноценности всех карбоксильных групп. Известно [15], что кислоты в твердом состоянии не обнаруживают полос поглощения ни свободной, ни связанной группы ОН. Этим объясняется отсутствие ожидаемого интенсивного поглощения в области 3500 см–1. Трет-бутиламин показывает две полосы валентных колебаний связи N–H средней интенсивности при 3348, 3279 см–1 первичного амина и плечо при 3184 см–1, обусловленное [16] обертоном полосы деформационного колебания N–H. Деформационные N–H-колебания проявляются в области 1599 см–1. К валентным колебаним C–N можно отнести полосы поглощения при 1242, 1218 и 1033 см–1. Широкая интенсивная полоса при 845 см–1 обусловлена веерными колебаниями N–H первичного амина. Присоединение амина к кислоте вызывает очень сильные изменения ИК-спектра. В широкой области от 3550 до 2300 см–1 появляются интенсивные перекрывающиеся полосы поглощения валентных колебаний N–H положительно заряженной группы NH$_{3}^{ + }$ и валентных колебаний Н–О молекул кристаллогидратной воды. Интенсивная уширенная полоса с центром при 1623 см–1 обусловлена колебаниями карбоксилат-аниона –СОО– и деформационными колебаниями группы NH$_{3}^{ + }$. Полоса веерных колебаний первичной аминной группы при 845 см–1 ожидаемо никак не проявляется.
Присоединение других аминов к ЭДТА вызывает в целом аналогичные изменения ИК-спектров. В производных третичных аминов ТЭА, ДАБКО и ТМЕДА связь N–H появляется только после их присоединения к ЭДТА. В ИК-спектре этих аминиевых солей полоса поглощения деформационных колебаний связи N–H во фрагменте H–N+C3 (1662, 1629, 1623 см–1 соответственно) является самой интенсивной, несмотря на меньшее число таких связей по сравнению с производными первичных и вторичных аминов. Только в ИК-спектре соединения IX с высокочастотной стороны от полосы при 1623 см–1 появляется отчетливо выраженная полоса поглощения средней интенсивности при 1715 см–1, которая отражает возможность образования наряду с карбоксилат-анионом –СОО– также свободной группы –СООН.
Из девяти полученных соединений кристаллы только двух (I, II) оказались пригодными для проведения рентгеноструктурного эксперимента. На рис. 2 представлены фотографии и СЭМ-изображения соединения II. Кристаллы представляют собой прямоугольные параллепипеды различной величины. Среди множества мелких встречаются (рис. 2в) достаточно крупные экземпляры длиной до 0.4 мм. Для приблизительно такой же формы и качества кристаллов соединения III (рис. 3) РСА не удалось выполнить из-за малого числа зарегистрированных отражений.
Рис. 2.
Микрофотографии (а, б) и СЭМ-изображения (в, г) кристаллов этилендиаминтетраацетата бис[три(гидроксиметил)метанаминия] тригидрата H2L2– ⋅ 2+H3NС(CH2ОН)3 ⋅ 3H2О (II): а – сухие, б – в капле этилового спирта, увеличение ×200.

Рис. 3.
Микрофотография (а, б) и СЭМ-изображение (в) этилендиаминтетраацетата бис(диэтиламиния) гидрата H2L2– ⋅ 2+H2N(C2H5)2 ⋅ H2О (III): а – увеличение ×40, б – ×200.

Соединение IV (рис. 4) кристаллизуется из метанола в форме длинных палочек, отдельных или выходящих из одного центра.
Рис. 4.
Микрофотографии кристаллов этилендиаминтетраацетата бис(трет-бутиламиния)пентагидрата H2L2– ⋅ ⋅ 2+H3NС(CH3)3 ⋅ 5H2О (IV), а – увеличение ×40, б – ×100.

Производное триэтаноламина V из этилового спирта образует тонкие пластинки (рис. 5а), из ДМСО – нитевидные кристаллы и волокна (рис. 5б). В хлорсодержащем растворителе (этиленхлоргидрине) имеет место превращение в гидрохлорид триэтаноламиния – кристаллы пирамидальной формы (рис. 5в).
Рис. 5.
Микрофотографии кристаллов этилендиаминтетраацетата бис(триэтаноламиния) H2L2– ⋅ 2+HN(CH2CH2ОH)3 (V) (а, б) и гидрохлорида триэтаноламиния Cl–+HN(CH2CH2ОH)3 (в), а – в этиловом спирте, ×40; б – в ДМСО, ×20; в – в этиленхлоргидрине, ×20.

Выполнен РСА этилендиаминтетраацетата бис(моноэтаноламиния) H2L2– ⋅ 2+NH3CH2CH2ОН (I) и этилендиаминтетраацетата бис[три(гидроксиметил)метанаминия] тригидрата H2L2– ⋅ 2+H3 NС(CH2ОН)3 ⋅ 3H2О (II). Подходящие для проведения РСА бесцветные прозрачные монокристаллические образцы I и II были получены из пересыщенных растворов метилового и этилового спиртов соответственно. Молекулярные структуры I и II показаны на рис. 6 и 7, а основные длины связей и углы приведены в табл. 2.
Рис. 6.
Молекулярная структура H2L2– ⋅ 2+NH3CH2CH2ОН (I). Тепловые эллипсоиды построены с 50%-ной вероятностью. Атомы водорода CH2-групп не приведены. Атомы с индексом A построены с помощью оператора симметрии 1 – x, y, 1.5 – z.
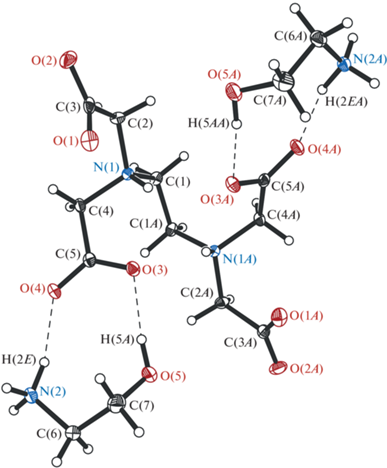
Рис. 7.
Молекулярная структура этилендиаминтетраацетата бис[три(гидроксиметил)метанаминия] тригидрата H2L2– ⋅ 2+H3NС(CH2ОН)3 ⋅ 3H2О (II). Тепловые эллипсоиды построены с 50%-ной вероятностью. Молекулы воды и атомы водорода CH2-групп не приведены.
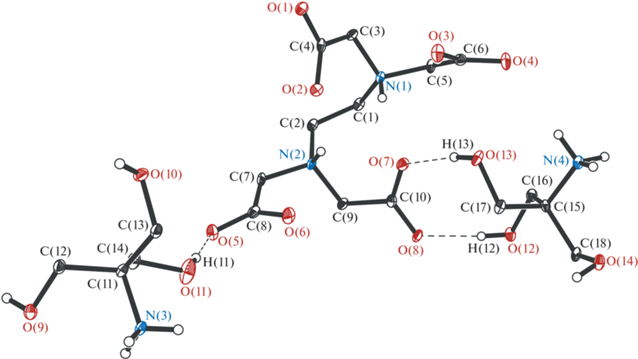
Таблица 2.
Избранные длины связей и углы в соединениях I и II
| I | II | ||
|---|---|---|---|
| Длины связей, Å | |||
| N(1)–C(1) | 1.506(2) | N(1)–C(1) | 1.503(2) |
| N(1)–C(2) | 1.500(2) | N(1)–C(3) | 1.506(2) |
| N(1)–C(4) | 1.501(2) | N(1)–C(5) | 1.506(2) |
| C(1)–C(1A) | 1.509(2) | N(2)–C(2) | 1.506(2) |
| C(3)–O(1) | 1.248(2) | N(2)–C(7) | 1.499(2) |
| C(3)–O(2) | 1.251(2) | N(2)–C(9) | 1.500(2) |
| C(5)–O(3) | 1.265(2) | C(1)–C(2) | 1.511(2) |
| C(5)–O(4) | 1.241(2) | C(4)–O(1) | 1.260(2) |
| C(6)–N(2) | 1.492(2) | C(4)–O(2) | 1.252(2) |
| C(7)–O(5) | 1.416(2) | C(6)–O(3) | 1.237(2) |
| C(6)–O(4) | 1.271(2) | ||
| C(8)–O(5) | 1.266(2) | ||
| C(8)–O(6) | 1.243(2) | ||
| C(10)–O(7) | 1.256(2) | ||
| C(10)–O(8) | 1.254(2) | ||
| N(3)–C(11) | 1.500(2) | ||
| N(4)–C(15) | 1.506(2) | ||
| Углы, град | |||
| C(2)–N(1)–C(4) | 113.2(2) | C(1)–N(1)–C(3) | 114.1(2) |
| C(2)–N(1)–C(1) | 108.5(2) | C(1)–N(1)–C(5) | 111.2(2) |
| C(4)–N(1)–C(1) | 111.3(2) | C(3)–N(1)–C(5) | 113.2(2) |
| O(1)–C(3)–O(2) | 127.5(2) | C(2)–N(2)–C(7) | 108.9(2) |
| O(4)–C(5)–O(3) | 127.2(2) | C(2)–N(2)–C(9) | 114.2(2) |
| C(7)–N(2)–C(9) | 111.4(2) | ||
| O(1)–C(4)–O(2) | 125.7(2) | ||
| O(3)–C(6)–O(4) | 126.2(2) | ||
| O(5)–C(8)–O(6) | 127.3(2) | ||
| O(7)–C(10)–O(8) | 126.6(2) | ||
Согласно данным РСА соединение I кристаллизуется в моноклинной пр. гр. P2/c. В независимой части элементарной ячейки располагается дианион ЭДТА, лежащий в частном положении на оси второго порядка, а также катион моноэтаноламиния в общем положении. Длины связей N–C в дианионе лежат в узком интервале значений 1.500(2)–1.506(2) Å, расстояние N–H равно 0.91(2) Å, а сумма углов C–N–C вокруг атома N(1) равна 333.0(2)°. Конформацию молекулы ЭДТА относительно связи C(1)–C(1A) можно описать как син-клинальную, двугранный угол N(1)C(1)C(1A)N(1A) равен 72.8(2) °. Несмотря на то что в целом распределение длин связей C–O в ацетатных группах (1.241(2)–1.265(2) Å) свидетельствует о делокализации электронной плотности по –COO-фрагменту, интересно отметить их некоторую неэквивалентность. Так, в одной из ацетатных групп длины связей C–O практически равны между собой (C(3)–O(1) 1.248(2), C(3)–O(2) 1.251(2) Å), в другой одна из связей заметно длиннее, чем вторая (C(5)–O(3) 1.265(2), C(5)–O(4) 1.241(2) Å).
Длины связей O–C и O–H в катионе моноэтаноламиния в I составляют 1.416(2) и 0.90(2) Å соответственно. Расстояние N–C равно 1.492(2) Å, а длины связей N–H лежат в интервале значений 0.91(2)–0.94(2) Å.
Соединение II кристаллизуется в моноклинной пр. гр. P21/c. В независимой части элементарной ячейки располагаются в общем положении дианион ЭДТА, два катиона три(гидроксил)метанаминия и три молекулы воды. Распределение длин связей N–C (1.499(2)–1.506(2) Å) и N–H (0.90(2), 0.92(2) Å) в дианионе II полностью воспроизводит аналогичные характеристики в I. Суммы углов C–N–C равны 338.5(2)° и 334.5(2)°. Конформация ЭДТА в II скошена чуть меньше по сравнению с I, двугранный угол N(1)C(1)C(2) N(2) равен 65.5(2)°. При этом, как и в I, ацетатные группы в II неэквивалентны: в двух из них длины связей C–O близки между собой и лежат в узком интервале значений 1.252(2)–1.260(2) Å, в то время как в двух других одна из связей заметно длиннее, чем вторая (C(6)–O(4) 1.271(2), C(6)–O(3) 1.237(2), C(8)–O(5) 1.266(2), C(8)–O(6) 1.243(2) Å).
Расстояния O–C и O–H в катионах три(гидроксил)метанаминия в II лежат в интервалах значений 1.418(2)–1.424(2) и 0.82(2)–0.88(3) Å соответственно. Длины связей N–C равны 1.500(2) и 1.506(2) Å, а длины связей N–H лежат в широком интервале значений 0.91(2)–0.98(2) Å.
Анализ кристаллической структуры I показывает, что в кристаллической упаковке реализуются многочисленные внутри- и межмолекулярные O⋅⋅⋅H (1.82–2.66 Å) взаимодействия. Так, каждая из ацетатных групп –C(5)O(3)O(4) связана с катионом моноэтаноламиния посредством двух водородных O⋅⋅⋅H-связей (OH⋅⋅⋅O 1.82(2), NH⋅⋅⋅O 1.88(2) Å). В то же время каждый из катионов связан еще с двумя ацетатными группами –C(3)O(1)O(2) двух различных соседних молекул также за счет O⋅⋅⋅H-взаимодействий (2.04(2), 2.08(2), 2.44(2) Å). Наконец, между соседними молекулами моноэтаноламиния наблюдаются слабые короткие O⋅⋅⋅H (2.52(2) Å) и H⋅⋅⋅H (2.42(4) Å) контакты.
Аналогично I реализация O‧‧‧H-взаимодействий в кристаллической упаковке II является мотивообразующим фактором формирования кристаллической структуры. Так, одна из ацетатных групп дианиона в II связана с катионом три(гидроксил)метанаминия посредством двух OH‧‧‧O-взаимодействий (1.81(2), 1.85(2) Å). Значительный вклад в реализацию межмолекулярных взаимодействий в структуре II вносят молекулы воды (OH‧‧‧O 1.80–2.65 Å).
Также интересно отметить более короткие внутримолекулярные контакты в молекуле ЭДТА в II (1.97(2)–2.41(2) Å) по сравнению с I (2.15(2)–2.59(2) Å).
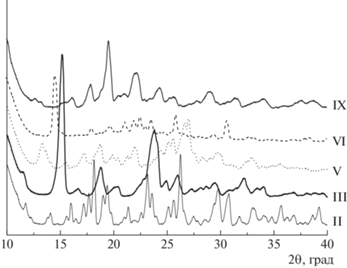
На рис. 8 показаны дифрактограммы аминиевых солей II, III, V, VI, IX. Отсутствие какого-либо подобия свидетельствует о том, что каждое соединение кристаллизуется в своей кристаллографической форме. Высокое качество кристаллов соединения II находит свое отражение во внешнем виде рентгенограммы. Рефлексы хорошо разрешены и выражены в виде острых пиков. Дифрактограммы III, V, VI, IX имеют более размытый вид.
Соединения II–VI, IX исследованы методом термического анализа (рис. 9). Следовало предположить, что при нагревании аминиевые соли будут диссоциировать с разрывом наиболее слабой координационной связи на амин и кислоту аналогично тому, как это происходит, например, с хлористым аммонием.
ЭДТА представляет собой малолетучее соединение, в то время как все использованные амины легко подвергаются перегонке (возгонке) при атмосферном или пониженном давлении. На кривых ТГА можно было ожидать наличия ступеней, соответствующих потерям масс аминов. Вклад массы амина в общую молекулярную массу соединения составляет, %: II – 41, III – 32, IV – 28, V – 51, VI – 38, IX – 28. Кроме того, соединения II и IV содержат в своем составе три и пять молекул воды, что составляет соответственно 9 и 17%. Анализ кривых потери массы не вполне соответствует ожидаемым закономерностям. Это может быть следствием наличия в кристаллах сильных координационных и водородных связей. В [17] показано, что энергия водородной связи в кристалле соли амина может достигать 20.5 ккал/моль. Две отчетливо выраженных стадии потери массы наблюдаются для соединений III и VI. Для соединения III вторая стадия вполне соответствует удалению молекулы летучего диэтиламина. Однако для соединения VI она составляет 28% вместо ожидаемых 38%. В целом соединения II, V, VI с наименее летучими аминами (ТГМА, ТЭА, ГМДА) обладают большей термической устойчивостью по сравнению с соединениями III, IV, IX (ДЭА, ТБА, ТМЕДА). Производное ТГМА начинает быстро разлагаться только при 140°С, а ТЭА – при 160°С. Нагревание до 500°С вызывает глубоко протекающую деструкцию аминиевых солей. Потери массы достигают 80–98%.
В табл. 3 представлены молекулярные массы основных осколочных ионов, появляющихся в масс-спектрах ЭДТА и ее аминиевых солей в результате бомбардировки пучком электронов с энергией 70 эВ. Приведенные данные подтверждают химическое родство исследованных соединений с ЭДТА. Однако пиков молекулярных ионов не было обнаружено ни в одном случае. Молекулярные массы, соответствующие массам аминов, присутствуют в производных ДЭА (III, М + 1 = 74, 100%), ТЭА (V, М = 149, 48%) и ЭОДА (VII, М + 1 = 149, 54%).
Таблица 3.
Молекулярные массы (м/э) основных осколочных ионов в масс-спектрах ЭДТА и ее аминиевых производных
| ЭДТА | 56 | 81 | 95 | 99 | 121 | 127 | 135 | 143 | 147 | 161 | 178 | 185 | 199 | 255 | 285 | 313 | 353 | 367 | 395 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| II | 81 | 97 | 121 | 135 | 147 | 185 | 255 | 285 | 313 | 353 | 368 | 395 | ||||||||
| III | 58 | 74 | 81 | 99 | 121 | 135 | 143 | 178 | 185 | 255 | 285 | 313 | 353 | 368 | 395 | |||||
| IV | 58 | 81 | 95 | 121 | 127 | 135 | 143 | 161 | 185 | 255 | 285 | 313 | 353 | 368 | ||||||
| V | 56 | 81 | 95 | 100 | 143 | 149 | 177 | 185 | 199 | 255 | 313 | 353 | 368 | 395 | ||||||
| VI | 56 | 81 | 97 | 99 | 121 | 127 | 135 | 143 | 149 | 161 | 185 | 200 | 255 | 285 | 313 | 353 | 368 | 395 | ||
| VII | 56 | 81 | 97 | 121 | 135 | 149 | 161 | 177 | 185 | 199 | 255 | 285 | 313 | 353 | 368 | 395 | ||||
| IX | 58 | 81 | 95 | 121 | 135 | 147 | 185 | 199 | 255 | 285 | 313 | 367 | 395 |
Таким образом, труднорастворимая в воде и практически нерастворимая в метаноле этилендиаминтетрауксусная кислота при взаимодействии с аминами образует хорошо (в воде) или ограниченно (в метаноле) растворимые аминиевые соли. Четырехосновная кислота H4L присоединяет две молекулы монофункциональных аминов, давая производные H2L2– ⋅ 2+H3NCH2CH2ОН, H2L2– ⋅ 2+H3NС(CH2ОН)3 ⋅ 3H2О, H2L2– ⋅ 2+H2N(C2H5)2 ⋅ ⋅ H2О, H2L2– ⋅ 2+H3NС(CH3)3 ⋅ 5H2О, H2L2– ⋅ ⋅ 2+HN(CH2CH2ОH)3. Дифункциональные амины образуют аддукты 1 : 1: H2L2– ⋅ +H3N (CH2)6NH$_{3}^{ + }$, H2L2– ⋅ +H3NCH2CH2(OCH2CH2)2NH$_{3}^{ + }$, H2L2– ⋅ ⋅ +HN(CH2CH2)3NH+ ⋅ H2О, H2L2– ⋅ +H(CH3)2 NCH2CH2N(CH3)2H+. Очистка соединений производилась перекристаллизацией из пересыщенных растворов в МеОН, этилцеллозольве, МеОН–толуоле, МеОН–ацетоне. В хлорсодержащем растворителе – этиленхлоргидрине – установлено образование гидрохлоридов триэтаноламиния Cl–+HN(CH2CH2ОH)3 и тетраметилэтилендиаминия Cl–+H(CH3)2NCH2CH2N(CH3)2.
Исследования выполнены в рамках госзадания (Тема № 45.4 “Химия функциональных материалов”, № 0094-2016-0012) с использованием оборудования ЦКП “Аналитический центр ИМХ РАН” в Институте металлоорганической химии им. Г.А. Разуваева РАН при поддержке гранта “Обеспечение развития материально-технической инфраструктуры центров коллективного пользования научным оборудованием” (Уникальный идентификатор RF–2296.61321X0017, Соглашение № 075-15-2021-670). Монокристальные рентгеноструктурные исследования соединений проведены в рамках госзадания (Тема № 44.2, № АААА-А16-116122110053-1). При выполнении работы использовались приборы Центра коллективного пользования ННГУ Научно-образовательного центра “Физика твердотельных наноструктур”. Исследования методом сканирующей электронной микроскопии выполнены по теме № 0035-2019-0026, № госрегистрации 01201458049.
Список литературы
Кондратенко Ю.А., Кочина Т.А. // Журн. общей химии. 2021. Т. 91. С. 1807.
Кондратенко Ю.А., Кочина Т.А., Фундаменский В.С. // Физика и химия стекла. 2016. Т. 42. С. 807. https://doi.org/10.1134/S1087659616060092
Кондратенко Ю.А., Няникова Г.Г., Молчанова К.В., Кочина Т.А. // Физика и химия стекла. 2017. Т. 43. С. 496. https://doi.org/10.1134/S108765961705008X
Фахриев А.М., Фахриев Р.А., Белкина М.М. // Патент РФ № 2099631. 1995. БИ. 1997. № 35. С. 534.
Биргеле И.С., Кемме А.А., Купче Э.Л. и др. Кремнийорганические производные аминоспиртов / Под ред. Лукевица Э.Я. Рига: Зинатне, 1987. 230 с.
Баженов С.Д., Новицкий Э.Г., Василевский В.П. и др. // Журн. прикл. химии. 2019. Т. 92. С. 957. https://doi.org/10.1134/S0044461819080024
Puri J.K., Singh R., Chahal V.K. // Chem. Soc. Rev. 2011. V. 40. P. 1791. https://doi.org/10.1039/b925899j
Воронков М.Г., Албанов А.И., Аксаментова Т.Н. и др. // Журн. общей химии. 2009. Т. 79. С. 1817. https://doi.org/10.1134/S1070363209110097
Мирскова А.Н., Адамович С.Н., Мирсков Р.Г., Воронков М.Г. // Изв. РАН. Сер. хим. 2014. № 9. С. 1869. https://doi.org/10.1007/s11172-014-0679-3
Bruker (2018). APEX3. Bruker AXS Inc., Madison, Wisconsin, USA.
Krause L., Herbst-Irmer R., Sheldrick G.M., Stalke D. // J. Appl. Cryst. 2015. V. 48. P. 3. https://doi.org/10.1107/S1600576714022985
Sheldrick G.M. // Acta Cryst. A. 2015. V. 71. P. 3. https://doi.org/10.1107/S2053273314026370
Румянцев Р.В., Золотарева Н.В., Новикова О.В. и др. // Кристаллография. 2021. Т. 66. С. 448. https://doi.org/10.31857/S002347612103022X
Дятлова Н.М., Темкина В.Я., Попов К.И. Комплексоны и комплексонаты металлов. М.: Химия, 1988. 544 с.
Беллами Л. Инфракрасные спектры сложных молекул. М.: Изд-во иностр. лит., 1963. 590 с.
Сильверстейн Р., Басслер Г., Моррил Т. Спектрометрическая идентификация органических соединений. М.: Мир, 1977. 590 с.
Семенов В.В., Золотарева Н.В., Новикова О.В. и др. // Изв. РАН. Сер. хим. 2022. № 5. С. 980.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография