Лесоведение, 2022, № 3, стр. 270-284
Микробиологическая индикация почв лесных посадок в Ширинской степи
И. Д. Гродницкая a, *, В. А. Сенашова a, Г. И. Антонов a, Э. О. Пашкеева a
a Институт леса им. В.Н. Сукачева СО РАН
660036 Красноярск, Академгородок, д. 50/28, Россия
* E-mail: igrod@ksc.krasn.ru
Поступила в редакцию 15.11.2021
После доработки 15.12.2021
Принята к публикации 02.02.2022
- EDN: UEWYBT
- DOI: 10.31857/S002411482203007X
Аннотация
Для борьбы с деградацией земель и опустыниванием на эрозионно-опасных землях степных экосистем создаются устойчивые долголетние защитные лесные насаждения, выполняющие водоохранную и почвозащитную функции. В Ширинской сухой озерно-котловинной степи (Р. Хакасия) в прибрежной зоне оз. Шира сотрудниками ИЛ СО РАН созданы искусственные посадки лесных (сосны обыкновенной (Pinus sylvestris L.), лиственницы сибирской (Larix sibirica L.), вяза приземистого (Ulmus humilis L.)) и географических культур (сосны сибирской (P. sibirica Du Tour), сосны обыкновенной). Вследствие пожара в 2015 г. были повреждены прибрежные 40-летние лесные культуры, выгорел приземный почвенный слой. Агротехнические приемы при посадке географических культур (2017 г.) и пожар в лесных культурах повлияли на состояние почвенных микробиомов в них. Цель исследований – с помощью микробиологических индикаторов дать оценку скорости восстановления биологических свойств почвы в посадках лесных насаждений после антропогенных нарушений (пожара и агротехнических воздействий) в прибрежной сухостепной зоне оз. Шира. Объектами исследований были участки “Гари и Пожарища” и “Географические культуры”. С помощью микробных индикаторов установлено, что почвенные микробиомы участков “Гари и Пожарища” восстанавливаются с разной интенсивностью. На пожарищах восстановление идет значительно быстрее, чем в гарях, о чем свидетельствуют высокие значения ОЧМ, МБ, ФА и Кг, которые приближаются к контрольным. Удельное микробное дыхание (qCO2) находится в пределах природной вариабельности. В почве гарей отмечено увеличение доли гидролитиков, активно участвующих в разложении полусгоревших растительных остатков. В географических культурах под саженцами сосны обыкновенной идет процесс формирования специфических ризосферных микробиомов, обусловленный влиянием корневых выделений климатипов. Значения ОЧМ, ЭТГМ, МБ, ФА, qCO2 меняются то в большую, то в меньшую сторону, состояние микробных сообществ не достигает своей эко-физиологической нормы.
Степные территории юга Красноярского края, республик Хакасии и Тывы в той или иной степени подвержены деградации земель и опустыниванию. Важнейшей задачей в степных экосистемах является создание устойчивых долголетних защитных лесных насаждений, выполняющих водоохранную, почвозащитную, санитарно-гигиеническую и эстетическую функции, поддерживающие агроэкологические свойства почв на оптимальном уровне (Кулик, 2007; Шарагин, 2011). Разные виды древесных растений могут оказывать специфическое воздействие на почвообразовательные процессы и свойства почв, формирование в них соответствующих микробиоценозов, тем самым способствуя продуктивности таких почв (Лобанов, 2007). Особое внимание уделяется исследованиям ризосферных микробных комплексов древесных пород, играющих важную роль не только в процессах роста и развития растения, но и в поддержании почвенного гомеостаза, реализации почвой своих экологических функций (Bulgarelli et al., 2013; Schlaeppi, Bulgarelli, 2015).
Раннюю диагностику биологического потенциала почв и устойчивости лесных насаждений можно оценить по структуре, динамике и функциональной активности микробных комплексов, тесно связанных с агрохимическими показателями почв (Сорокин и др., 2017). Исследования почвенных микробиоценозов неустойчивых аридных (степных) экосистем являются актуальными, поскольку с помощью микробиологических индикаторов можно оценить состояние почвенного плодородия и развитие искусственных фитоценозов, а также скорость их восстановления после антропогенных воздействий с получением количественных характеристик. Как биоиндикатор, микробное сообщество является самым чутким показателем почвенно-химических условий, способным дать интегральную оценку состояния почвенного покрова и экосистемы в целом (Звягинцев, 1987; Ананьева, 2003; Сорокин, 2009).
В Ширинской сухой озерно-котловинной степи (Республика Хакасия) в прибрежной зоне оз. Шира на эрозионно-опасных землях в 1975–1978 гг. сотрудниками ИЛ СО РАН были созданы искусственные посадки лесных культур для борьбы с деградацией земель и опустыниванием (Сорокин, Молоков, 1985). В 2017 г. в степном массиве были высажены географические культуры (климатипы) Pinus sp. разных видов. Все посадки были проведены на одном типе почв, которые идентифицируются как агроземы аккумулятивно-карбонатные темные легко- и среднесуглинистые (Классификация …, 2004; Сорокин и др., 2017). На протяжении многих лет на базе Ширинского опытно-экспериментального пункта ФИЦ КНЦ СО РАН осуществляются комплексные исследования, изучаются выживаемость, устойчивость интродуцированных древесных пород, а также проводится оценка лесорастительных свойств почв и трансформации их плодородия под воздействием насаждений (Сорокин и др., 2017; Сенашова и др., 2020; Гродницкая и др., 2021). Пожар, прошедший в 2015 г. в Ширинском районе, повредил прибрежные посадки лесных культур, достигшие к этому времени 40-летнего возраста, повлиял на состояние почвенной биоты в них. Возникла необходимость оценить состояние микробных сообществ в недавно поврежденных почвах, степень их деградации и способности к продукционным процессам.
Ежегодный мониторинг состояния микробных сообществ на антропогенно нарушенных участках почвы в сухой Ширинской степи (агротехнические воздействия, пожар) позволяет с помощью микробных индикаторов оценивать и прогнозировать лесорастительный (биологический) потенциал почв под посадками лесных культур с получением количественных характеристик.
Целью исследований являлось с помощью микробиологических индикаторов дать оценку скорости восстановления и формирования биологических свойств почвы в посадках лесных насаждений после антропогенных нарушений (пожара и агротехнических воздействий) в прибрежной сухостепной зоне оз. Шира (Ширинская степь).
ОБЪЕКТЫ И МЕТОДИКА
Объекты исследований. Объектами исследований являлись почвенные микробиомы, ассоциированные с искусственными насаждениями: 1) взрослыми древостоями лесных культур (посадки 1975–1978 гг.), состоящих из лиственницы сибирской, вяза приземистого, сосны обыкновенной и 2) саженцами географических культур различных популяций (климатипы) (посадки 2017 г.) Pinus sibirica (далее сосна кедровая, К) и Pinus sylvestris (далее сосна обыкновенная, С).
Посадку чистых культур хвойных (лиственницы сибирской и сосны обыкновенной) осуществляли на подготовленной почве под меч Колесова, размещение шахматно-групповое. На ромбовидные площадки с длиной диагоналей 4 × 6 м высаживали 50 саженцев. При высадке саженцев вяза (Ulmus humilis) использовали механизированную посадку (ширина междурядий 1.5 м, шаг посадки – 1 м (Сорокин, Молоков, 1985; Сорокин, Сорокина, 2009). В 2015 г. в пос. Шира был сильный пожар и все приозерные посадки лесных культур были в разной степени повреждены. Пробные площади выбрали по степени повреждения насаждений огнем (“Гари и Пожарища”), согласно терминологии Н.П. Курбатского (1972) – гари (полностью сгоревшие, Г) и пожарища (поврежденные огнем, но продолжающие вегетировать, П). С учетом вышеприведенных особенностей исследуемых участков использовали следующую аббревиатуру (коды участков): ГЛР – гарь лиственница ризосфера, ГЛМ – гарь лиственница междурядье; ГСР – гарь сосна ризосфера, КГС – контроль гарь сосна), ПЛМ – пожарище лиственница междурядье, ПЛР – пожарище лиственница ризосфера, ПВМ – пожарище вяз междурядье, ПВР – пожарище вяз ризосфера, КЛВ – контроль для лиственницы и вязов. Поскольку пожар повредил все лесные культуры, в качестве относительного контроля для участков лиственницы и вязов (КЛВ) были взяты образцы почвы целины (старая залежь), граничащей с этими посадками (верхняя часть макросклона), для участков сосны (КГС) – из целины, прилегающей к посадкам сосны, менее всего затронутой пожаром (нижняя часть макросклона). Образцы почвы для микробиологических и биохимических анализов отбирали из зоны ризосферы и между рядами посадок (междурядье) с глубины 5–10 см с 2018 по 2020 гг. в начале, середине и конце вегетационного периода.
В мае 2017 г. на территории ОЭП “Ширинский” ФИЦ КНЦ СО РАН в рамках многолетнего эксперимента сотрудниками ИЛ СО РАН был распахан участок степи и заложена опытная плантация (участок “Вузовский”) с географическими культурами Pinus sp. В подготовленную почву под меч Колесова высаживали географические культуры 5- и 3-летних саженцев двух видов сосен (P. sibirica Du Tour, К и P. sylvestris Ledeb, С) различного происхождения (климатипы): КМ – P. sibirica “Монгольский”, КБ – P. sibirica “Байкальский”; СУ – P. sylvestris “Усть-кут”, СБ – P. sylvestris “Богучаны”, СП – P. sylvestris “Пудож”. Шаг посадки – 1 м, расстояние между рядами – 3 м. Плантация климатипов заложена рядовым способом на склоне западной экспозиции, на бывшей пашне. Микрорельеф выражен слабо, чередуются блюдцеобразные микрозападины и потяжины. При этом саженцы климатипов СУ, КМ, КБ, СБ высажены в блюдцеобразной западине у подножия склона, а саженцы климатипа СП – на верхней части склона. Контрольный участок (К), невозделанный участок степи, граничивший с посадками географических культур, заложен на выположенной верхней части склона западной экспозиции. Образцы почвы для микробиологических и биохимических (энзиматических) анализов отбирали в начале, середине и в конце вегетационного периода из зоны ризосферы саженцев (5–10 см) с 2017 по 2020 гг.
Почвы под всеми искусственными посадками и на контрольных участках являются генетически однородными – это агроземы аккумулятивно-карбонатные, темные маломощные легкосуглинистые на лессовидном карбонатном суглинке (Классификация почв …, 2004).
Методы исследований. В образцах почвы всех исследуемых участков стандартными методами определяли влажность (ГОСТ 28268-89) и рН (портативным потенциометром Аквилон–410) почвы. Для оценки и прогнозирования скорости восстановления почвенного плодородия после антропогенных воздействий (пожар, агротехническая обработка) на участках “Гари и Пожарища” и “Географические культуры” в течение нескольких лет проводили ежегодный мониторинг состояния микробных сообществ в лесных насаждениях с помощью следующих микробных индикаторов: общей численности микроорганизмов (ОЧМ), микробной биомассы (МБ), базального (БД) и удельного дыхания микроорганизмов (qCO2), а также ферментативной активности (ФА). Помимо этого, на участках с географическими культурами в ризосфере саженцев сосны кедровой и сосны обыкновенной регистрировали этапы формирования специфических микробных сообществ, характерных для конкретных видов и климатипов растений.
Классическими микробиологическими методами определяли общую численность (ОЧМ) культивируемых микроорганизмов и эколого-трофических групп (ЭТГМ), согласно Практикуму …, 2005. Посев почвенной суспензии (0.05 мл) производили на следующий день после отбора образцов из разведений 1 : 103 на поверхность питательных сред в чашках Петри в трехкратной повторности. Засеянные чашки Петри инкубировали при температуре 27–28°С. Подсчет численности колоний бактерий проводили на 3–5 сут, а грибов – на 5–7-е сут. Число колониеобразующих единиц (КОЕ) высчитывали по формуле:
M = a × 10n/V,
где M – количество клеток в 1 мл;
a – среднее число колоний, выросшее при высеве из данного разведения;
10n – коэффициент разведения;
V – объем суспензии (мл), взятый для посева (Практикум …, 2005).
Данные количественного учета пересчитывали на 1 г сухой почвы. Таксономическую принадлежность (до рода) бактерий и грибов проводили по культуральным и морфологическим характеристикам (Методы …, 1991; Watanabe, 2002) с помощью микроскопа МИКМЕД-2 (ОАО Ломо).
Дыхательную (респирометрическую) активность микроорганизмов определяли методом субстрат-индуцированного дыхания (СИД) с использованием газового хроматографа Agilent 6890 N (США). По количеству выделяемого почвенными микроорганизмами СО2 определяли микробную биомассу, МБ (Смик) (Anderson, Domsch, 1978; Методы …, 1991; Sparling et al., 1995), базальное дыхание (БД) и микробный метаболический коэффициент (qCO2) (Anderson, Domsch, 1978; Anderson, Domsch, 1990; Ананьева, 2003).
Ферментативную активность почвы определяли методами А.Ш. Галстяна и Т.А. Щербаковой (Хазиев, 2005). Колориметрическими методами с использованием фотоэлектроколориметра КФК-3 определяли активность ферментов: инвертазы (И), уреазы (У), фосфатазы (Ф) с предварительным компостированием в течение 24 ч, активность пероксидазы (ПО) и полифенолоксидазы (ПФО) – с предварительным компостированием в течение 30 мин в термостате при температуре 30–38°С. Активность инвертазы выражали в мг глюкозы/г почвы, уреазы – в мг N-NH4/г почвы, фосфатазы – в мг P2O5/г почвы, пероксидазы и полифенолоксидазы – в мг бензохинона/г почвы. По соотношению активности полифенолоксидазы и пероксидазы (ПФО/ПО) высчитывался коэффициент гумификации (Кг), позволяющий судить об интенсивности процесса минерализации гумуса (Хазиев, 2005).
Статистическая обработка результатов проведена с помощью пакета программ Exel-2003, Exel-2013. Для выявления зависимостей между микробиологической и ферментативной активностью исследуемых участков (гари, пожарища, географические культуры), рН, и влажностью почвы были проведены дисперсионный и корреляционный анализы; коэффициенты корреляции (r) были значимы при р < 0.05 (р < 0.01).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Участки “Гари и Пожарища”. В 2015 г. все посадки 40–42-летних лесных культур были охвачены пожаром. На момент пожара средняя высота деревьев лиственницы и сосны составляла 7–12 м, вяза – 4 м (Сорокин и др., 2017; Коновалова и др., 2020).
Анализ почвы под нарушенными пожарами посадками лесных насаждений в течение нескольких лет исследований (2018–2020 гг.) показал, что на эколого-физическое состояние почвенных микробиомов оказывали влияние влажность и рН почвы. С 2018 г. по 2020 г. значения рН в среднем увеличились в щелочную сторону на 0.89 единиц (табл. 1), а влажность почвы понизилась в 1.2 и 1.3 раза по сравнению с 2018 г., что повлияло на численность микроорганизмов. Так, в 2019 г. отмечено снижение обшей численности микроорганизмов (ОЧМ) в среднем на 18% по сравнению с 2018 г. и на 13% – с 2020 г. (рис. 1 ). На исследуемых участках (опытных и контрольных) преимущественно доминировали актиномицеты (р. Streptomyces), типичные представители степных ландшафтов, доля которых от общего количества бактерий в 2018 г. достигала 52.10% (ПЛР), в 2020 – 73.58% (ГСР), содоминантами выступали неспоровые бактерии – до 40.5–46.9% (ГЛР). Споровые бактерии р. Bacillus также регулярно обнаруживались в почвенных образцах, их доля в разные годы составляла от 11.7 до 37.2% общей численности. Самой малочисленной группой были микроскопические грибы, среди которых наиболее часто встречались зигомицетовые (Zygomycota MOREAU) из рода Mortierella Coem, предпочитающие некислые почвы и являющиеся классическими сапротрофами, активно участвующими в разложении органических веществ. Их доля в некоторых случаях достигала 80% от суммарной численности выявленных грибов. Также встречались грибы родов Penicillium Link, Mucor Fresen, Cladosporium Link, Acremonium Link., Trichoderma Pers. На протяжении исследований в почве под посадками доминировали представители олиготрофно-копиотрофного комплекса. Однако в 2020 г. на участках с погибшей лиственницей (ГЛР, ГЛМ) отмечали увеличение содержания гидролитиков до 37% по сравнению с 2018 г. за счет увеличения численности споровых бактерий (табл. 2). По-видимому, со временем разложение грубых растительных остатков (корневая система, в частности), оставшихся после пожара, становится доступным для освоения большему разнообразию микробных групп.
Таблица 1.
Средние значения влажности (W) и рН почвенных образцов на участках “гари Пожарища” и “Географические культуры”
| Код образца | Годы исследований | |||||||
|---|---|---|---|---|---|---|---|---|
| 2017 | 2018 | 2019 | 2020 | |||||
| W, % | рН | W, % | рН | W, % | рН | W, % | рН | |
| Участок “Гари и Пожарища”* | ||||||||
| ПЛМ | – | – | 21 | 6.94 | 17.7 | 8.12 | 12 | 8.0 |
| ПЛР | – | – | 20.4 | 7.02 | 19.9 | 7.84 | 12 | 7.93 |
| ГЛМ | – | – | 22.1 | 7.17 | 20.1 | 7.94 | 14 | 8.35 |
| ГЛР | – | – | 20.3 | 7.08 | 19.6 | 7.4 | 18 | 7.25 |
| ПВМ | – | – | 19.7 | 6.97 | 21 | 8.39 | 19 | 8.63 |
| ПВР | – | – | 20.8 | 7.0 | 21 | 8.29 | 18 | 8.57 |
| КЛВ | – | – | 18.8 | 7.03 | 16.7 | 7.63 | 14.3 | 7.22 |
| ГСР | – | – | 12.7 | 7.1 | 8.7 | 7.5 | 10.7 | 7.92 |
| КГС | – | – | 13.6 | 7.13 | 10 | 7.5 | 9.5 | 7.59 |
| Участок “Географические культуры”** | ||||||||
| К | 10.2 | 7.06 | 12 | 7.01 | 12.3 | 8.42 | 6.9 | 8.38 |
| КМ | 15.7 | 6.98 | 15.8 | 7.04 | 14.2 | 8.3 | 12 | 7.97 |
| КБ | 16.7 | 6.75 | 20 | 7.03 | 14.6 | 7.97 | 12 | 7.96 |
| СУ | 13.9 | 6.85 | 16.5 | 7.21 | 16.3 | 8.52 | 12.6 | 8.08 |
| СБ | 23.5 | 6.84 | 21.9 | 7.11 | 17.4 | 8.56 | 12.7 | 8.19 |
| СП | 17.3 | 6.87 | 15.9 | 6.99 | 16.7 | 8.19 | 12.8 | 8.73 |
Примечание. Прочерк (–) – измерения не выполнялись; * ПЛМ – пожарище лиственница междурядье, ПЛР – пожарище лиственница ризосфера, ГЛМ – гарь лиственница междурядье, ГЛР – гарь лиственница ризосфера, ПВМ – пожарище вяз междурядье, ПВР – пожарище вяз ризосфера, КЛВ – контроль для лиственницы и вязов, ГСР – гарь сосна ризосфера, КГС – контроль гарь сосна; ** К – контроль (нераспаханный участок, прилегающий к посадкам); КМ – сосна кедровая “Монголия”; КБ – сосна кедровая “Байкал”; СУ – сосна обыкновенная “Усть-Кут”; СБ – сосна обыкновенная “Богучаны”; СП – сосна обыкновенная “Пудож”.
Рис. 1.
Динамика общей численности микроорганизмов (ОЧМ) на участках “Гари и Пожарища” за вегетационные периоды 2018–2020 гг. (усредненные данные).
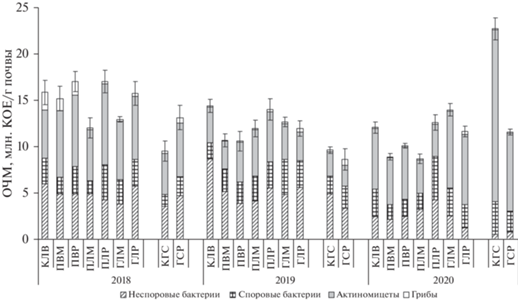
Таблица 2.
Соотношение эколого-трофических групп микроорганизмов (ЭТГМ) на участках “Гари и Пожарища”, %
| ЭТГМ, % | КЛВ | ПВМ | ПВР | ПЛМ | ПЛР | ГЛМ | ГЛР | КГС | ГСР | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2018 | 2020 | 2018 | 2020 | 2018 | 2020 | 2018 | 2020 | 2018 | 2020 | 2018 | 2020 | 2018 | 2020 | 2018 | 2020 | 2018 | 2020 | |
| Гидролитики | 18.55 | 11.53 | 20.74 | 15.84 | 13.63 | 16.98 | 17.73 | 18.53 | 24.02 | 18.62 | 17.36 | 54.91 | 19.37 | 20.29 | 13.36 | 21.54 | 16.83 | 21.35 |
| Олиготрофы | 59.89 | 53.98 | 54.73 | 62.25 | 64.56 | 60.71 | 60.45 | 53.21 | 54.9 | 50.05 | 57.98 | 32.77 | 60.9 | 58.96 | 58.49 | 50.98 | 61.58 | 59.46 |
| Копиотрофы | 21.56 | 34.49 | 24.53 | 21.91 | 21.81 | 22.31 | 21.82 | 28.26 | 21.08 | 31.33 | 24.65 | 12.32 | 19.73 | 20.76 | 28.15 | 27.48 | 21.59 | 19.19 |
Примечание. ПЛМ – пожарище лиственница междурядье, ПЛР – пожарище лиственница ризосфера, ГЛМ – гарь лиственница междурядье, ГЛР – гарь лиственница ризосфера, ПВМ – пожарище вяз междурядье, ПВР – пожарище вяз ризосфера, КЛВ – контроль для лиственницы и вязов, ГСР – гарь сосна ризосфера, КГС – контроль гарь сосна
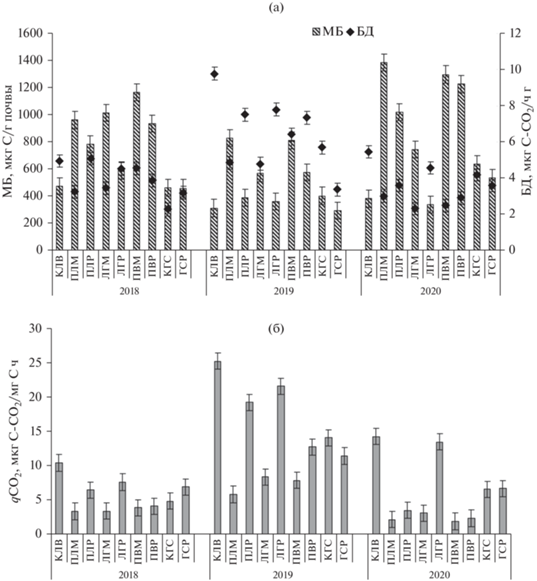
Содержание микробной биомассы (МБ) менялось в зависимости от породы древостоя по годам и месяцам вегетации (май–сентябрь). В течение наблюдений максимальные значения МБ отмечены в пожарищах лиственницы (ПЛМ – 1385 и ПЛР – 1018 мкг С/г почвы) и вязов (ПВМ – 1298 и ПВР – 1226 мкг С / г почвы) (рис. 2 а). Удельное микробное дыхание микроорганизмов в 2018 и 2020 гг. находилось в пределах эколого-физиологической нормы (qCO2 – 5.6–6.0 мкг С-СО2/мг С/ч), в то время как в 2019 г при более низких значениях МБ наблюдали повышенное базальное и удельное дыхание (qCO2 – 14.7 мкг С-СО2/мг С/ч) (рис. 2 б), что свидетельствовало о стрессе микробиоценозов, вызванном снижением влажности. Высокие коэффициенты корреляции в 2018 г между влажностью и МБ (r = 0.70), в 2019 г. – между влажностью и МБ, и БД (r = 0.50 и 0.50) подтверждают наше предположение.
Рис. 2.
(а) – Содержание микробной биомассы (МБ) и интенсивность базального дыхания (БД) микроорганизмов, (б) – значения микробного метаболического коэффициента (qCO2) на участках “Гари и Пожарища” за вегетационные периоды 2018–2020 гг. (усредненные данные).
Согласно ряду данных, исследования даже 3–4 ферментов (оксидоредуктаз и гидролаз) достаточно, чтобы дать адекватную биохимическую характеристику почвенному покрову (Казеев и др., 2003, 2004).
Активность гидролитических ферментов под разными культурами варьировала в течение года и сезона. На гарях под сосной (в наиболее сильно горевших участках) в 2019 г. отмечены самые низкие показатели активности инвертазы (29.2 мг/г) и фосфатазы (0.26 мг/г), а активность урезы наоборот была высокой (до 1.87 мг/г.) (табл. 3). Такая ситуация свидетельствует о том, что активность углеродного и фосфорного метаболизма почвы участка ГСР замедлена при оптимизации напряженности азотного обмена. Ранее, при исследовании южно-таежных сосняков Средней Сибири, А.В. Богородская (2006) отмечала положительное действие низкоинтенсивных пожаров на биогенность почвы, которая выражалась в небольшом повышении активности гидролитических ферментов. К 2020 г. в среднем активность уреазы снизилась в 1.4 раза, а инвертазы и фосфатазы увеличилась в 1.2 и 2 раза соответственно по сравнению с 2019 г. Максимальную активность фосфатазы (1.13–1.34 мг/г) регистрировали в междурядьях пожарищ лиственницы и вяза (ПЛМ и ПВМ). Высокие коэффициенты корреляции отмечены: в 2019 г. – между гидролитическими ферментами и влажностью1 (от r1 = –0.50 (У) до r1 = 0.79 (Ф) и r1 = 0.88 (И)) и рН2 (r2 = 0.46 (Ф) и r2 = 0.60 (И)); в 2020 г. – между влажностью и Ф (r1 = 0.70), и И (r1 = 0.60).
Таблица 3.
Ферментативная активность участков “Гари и Пожарища” за период 2019–2020 гг. (усредненные данные), n = 3
| Код образца | Уреаза (У), мг N-NH4/г почвы | Фосфатаза (Ф), мг P2O5/г почвы | Инвертаза (И), мг глюкозы/г почвы | Полифенол-оксидаза (ПФО) | Пероксидаза (ПО) | Коэффициент гумификации, Кг |
|---|---|---|---|---|---|---|
| мг 1.4 – бензохинона/г почвы | ||||||
| 2019 г. | ||||||
| КЛВ | 2.01 ± 0.002 | 0.39 ± 0.02 | 61.24 ± 22.00 | 0.75 ± 0.02 | 0.80 ± 0.07 | 0.93 |
| КГС | 2.45 ± 0.40 | 0.22 ± 0.02 | 38.38 ± 4.95 | 0.47 ± 0.07 | 1.19 ± 0.42 | 0.43 |
| ГСР | 1.87 ± 0.14 | 0.26 ± 0.03 | 29.18 ± 12.69 | 0,54 ± 0.07 | 1.21 ± 0.04 | 0.44 |
| ЛГМ | 1.45 ± 0.53 | 0.49 ± 0.01 | 51.61 ± 9.44 | 1.16 ± 0.15 | 1.15 ± 0.18 | 1.01 |
| ЛГР | 1.81 ± 0.03 | 0.74 ± 0.16 | 60.27 ± 13.86 | 0.82 ± 0.11 | 1.03 ± 0.11 | 0.82 |
| ПЛМ | 1.59 ± 0.20 | 0.76 ± 0.21 | 66.29 ± 8.56 | 1.09 ± 0.11 | 0.86 ± 0.04 | 1.27 |
| ПЛР | 1.17 ± 0.04 | 0.63 ± 0.18 | 66.27 ± 2.24 | 1.23 ± 0.06 | 0.90 ± 0.04 | 1.36 |
| ПВМ | 1.79 ± 0.52 | 0.67 ± 0.02 | 68.81 ± 9.17 | 0.99 ± 0.13 | 0.79 ± 0.08 | 1.25 |
| ПВР | 2.11 ± 0.48 | 0.51 ± 0.01 | 60.56 ± 8.10 | 0.97 ± 0.13 | 0.77 ± 0.01 | 1.25 |
| 2020 г. | ||||||
| КЛВ | 1.54 ± 0.46 | 1.10 ± 0.75 | 79.91 ± 3.34 | 1.16 ± 0.44 | 0.90 ± 0.17 | 1.24 |
| КГС | 1.85 ± 1.01 | 0.59 ± 0.40 | 55.24 ± 11.91 | 0.82 ± 0.27 | 1.23 ± 0.39 | 0.82 |
| ГСР | 1.51 ± 0.51 | 0.87 ± 0.64 | 40.75 ± 24.25 | 0.95 ± 0.34 | 1.12 ± 0.14 | 0.90 |
| ЛГМ | 0.74 ± 0.17 | 1.29 ± 0.78 | 50.14 ± 7.98 | 1.58 ± 0.27 | 1.29 ± 0.03 | 1.23 |
| ЛГР | 1.35 ± 0.42 | 1.06 ± 0.48 | 64.49 ± 9.63 | 1.22 ± 0.50 | 1.16 ± 0.01 | 1.05 |
| ПЛМ | 1.26 ± 0.13 | 1.19 ± 0.63 | 69.66 ± 5.19 | 1.43 ± 0.22 | 1.07 ± 0.17 | 1.33 |
| ПЛР | 0.99 ± 0.14 | 0.83 ± 0.38 | 65.83 ± 2.68 | 1.56 ± 0.27 | 1.25 ± 0.31 | 1.27 |
| ПВМ | 1.20 ± 0.07 | 1.34 ± 0.69 | 79.54 ± 1.56 | 1.39 ± 0.27 | 1.07 ± 0.20 | 1.31 |
| ПВР | 1.38 ± 0.24 | 1.13 ± 0.62 | 73.54 ± 21.08 | 1.37 ± 0.26 | 1.05 ± 0.26 | 1.33 |
Примечание. КЛВ – Контроль для лиственницы и вяза, КГС – сосна гарь контроль; ГСР – сосна гарь ризосфера; ЛГМ – лиственница гарь междурядье; ЛГР – лиственница гарь ризосфера; ПЛМ – пожарище лиственница междурядье; ПЛР – пожарище лиственница ризосфера; ПВМ – пожарище вяз междурядье; ПВР – пожарище вяз ризосфера.
Окислительно-восстановительный потенциал почвы участков гари и пожарищ диагностировали по активности оксидоредуктаз – полифенолоксидазе и пероксидазе. Полифенолпероксидазам отводится важная роль в формировании гумусовых веществ, устойчивых к разложению, участвующих в превращениях соединений ароматического ряда. Они катализируют окисление моно-, ди-, трифенолов до хинонов в присутствии кислорода либо перекиси водорода (Хазиев, 2005; Якушев и др., 2014). В наших исследованиях максимум активности полифенолоксидазы и пероксидазы приходится в основном на гари (ЛГМ и ЛГР) и пожарища лиственницы (ПЛМ и ПЛР) – до 1.56–1.58 мг/г (табл. 3). Не менее важным показателем, указывающим на характер протекающих в почве процессов (минерализация гумуса или его новообразование), является коэффициент гумификации (Кг). И если в гарях сосны (ГСР) данный коэффициент в течение года остается достаточно низким, то в пожарищах лиственницы (ПЛМ и ПЛР) и вяза (ПВР и ПВР) он намного превышал 1 (табл. 3), что свидетельствует об удовлетворительных условиях для процессов гумусонакопления и гумусообразования (Казеев, 2004; Якушев и др., 2014).
Участки “Географические культуры”
Создание плантации географических культур в условиях Ширинской степи вызвано необходимостью испытания климатических экотипов (популяций), отобранных после многолетних исследований в географических культурах в Богучанском и Ермаковском лесничествах Красноярского края (Кузьмина, Кузьмин, 2017). Испытание перспективных климатипов по комплексу лесохозяйственных показателей в новых лесорастительных условиях региона является одним из требований сортоиспытания. Результаты испытания в условиях Ширинской степи позволят получить полезную информацию по адаптации климатипов Pinus sp., вопросам перемещения семян и посадочного материала, а также для объективной оценки сортов-популяций, корректировки лесосеменного районирования сосны обыкновенной и сосны кедровой в Сибири.
Известно, что растения в процессе развития (филлосфера и ризоплана) выделяют в окружающую среду продукты вторичного метаболизма, многие из которых обладают фитонцидными свойствами. При этом наблюдается видоспецифичность этих выделений, что приводит к формированию микробного сообщества, характерного для конкретного вида растения при равных других гидротермических факторах (Рощина, 2012). Особый интерес вызывало формирование специфических микробных сообществ под разными видами и климатическими экотипами Pinus sp. с первого года после высадки саженцев.
Исследования 2017–2020 гг. показали, что под посадками географических культур проявились первые признаки изменения нативного почвенного микробиоценоза. Несмотря на то, что все климатипы формируют схожие по таксономическому составу микробные сообщества, отмечены тенденции их изменения в сторону формирования специфических для видов хвойных микробиомов, обусловленных особенностями качественного состава экзометаболитов корневой системы.
Кроме того, за период наблюдений (2017–2020 гг.) значения рН в среднем существенно увеличились в щелочную сторону на 1.33 единицы, а влажность почвы понизилась в 1.2 и 1.6 раза по сравнению с 2018 г. (табл. 1), что повлияло на численность микроорганизмов (рис. 4 ). Под климатипами сосны кедровой за весь период исследований отмечена более низкая общая численность микроорганизмов (ОЧМ), чем в контроле и под климатипами сосны обыкновенной. По-видимому, корневые выделения сосны кедровой формируют более специфические микробоценозы, чем сосны обыкновенной. В среднем ОЧМ в 2020 г. превышала таковую в 2017 в 1.4, в 2019 – в 1.5 раза, и была ниже, чем в 2018 г. в 1.4 раза. В 2020 г. значительно увеличилось число споровых бактерий (актиномицетов в том числе) и снизилось количество грибов и неспоровых форм (рис. 3).
Рис. 3.
Динамика общей численности микроорганизмов (ОЧМ) на участках “Географические культуры” (усредненные значения) за вегетационные периоды 2017–2020 гг.
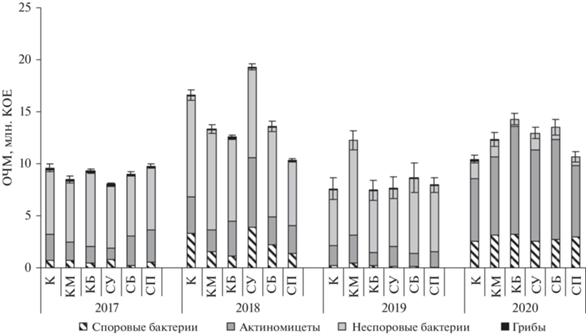
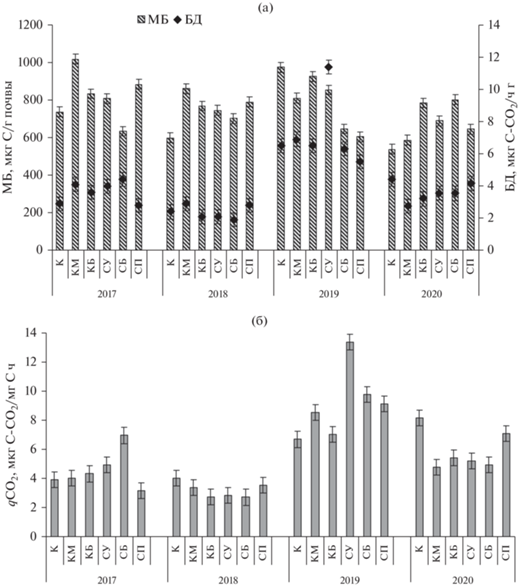
Рис. 4.
(а) – Содержание микробной биомассы (МБ) и интенсивность базального дыхания (БД) микроорганизмов, (б) – значения микробного метаболического коэффициента (qCO2) на участках “Географические культуры” за период 2017–2020 гг. (усредненные данные).
В ризосферной почве климатипов в течение 4‑х лет выявляли типичных и специфичных представителей микробного сообщества для сосны кедровой и сосны обыкновенной, оказывающих влияние на рост саженцев. В основном это неспоровые (рр. Pseudomonas Migula, Xanthomonas Dowson) и споровые бактерии (рр. Actinobacteria Goodfellow, Streptomyces Waksman and Henrici и Bacillus Coch.). Грибы были самой малочисленной группой, преимущественно микромицеты, дрожжевые формы находили только в варианте СБ. Среди микромицетов доминировали представители родов Mortierella (до 60% от всех выделенных грибов) и Penicillium. Также выделяли грибы родов Mucor, Cladosporium, Trichoderma и Fusarium Link.
За период исследований в почве под саженцами отмечены изменения в соотношении эколого-трофических групп микроорганизмов (табл. 4). Под саженцами климатипов преобладали олиготрофные группы микроорганизмов, их доля колебалась в пределах 50.6–68.3%, содоминантами выступали копиотрофы. В почве климатипов кедра сибирского (КБ и КМ) доля гидролитиков несколько выше, чем в остальных вариантах (табл. 4). В целом же, согласно усредненным данным за 2017–2020 гг., во всех вариантах наблюдалась тенденция к уменьшению доли гидролитиков (в 1.3 раза) и увеличению доли копиотрофов. Подобные изменения мы связываем с тем, что растительные остатки, попавшие в почву при вспашке участка и являвшиеся дополнительным субстратом для гидролитиков, деструктурировались, а корневая система укоренившихся саженцев стала выделять экзометаболиты в ризосферную зону, что обусловило рост численности копиотрофной группы микроорганизмов. Олиготрофная составляющая микробного комплекса в ряде вариантов либо оставалась на прежнем уровне (СБ, КБ), либо имела тенденцию к снижению численности, однако данное явление было отмечено и в контроле, что, возможно, обусловлено погодными условиями.
Таблица 4.
Соотношение эколого-трофических групп микроорганизмов (ЭТГМ) за 2017–2020 гг. в ризосфере климатипов Pinus sp.
| ЭТГМ, % | К | СУ | СБ | СП | КМ | КБ | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2017 | 2020 | 2017 | 2020 | 2017 | 2020 | 2017 | 2020 | 2017 | 2020 | 2017 | 2020 | |
| Гидролитики | 11.37 | 9.55 | 14.75 | 10.91 | 15.32 | 7.97 | 16.69 | 14.10 | 17.85 | 14.07 | 16.59 | 16.00 |
| Копиотрофы | 25.26 | 32.71 | 16.93 | 24.37 | 20.02 | 26.24 | 27.81 | 35.32 | 19.98 | 26.51 | 22.98 | 22.28 |
| Олиготрофы | 63.37 | 57.74 | 68.32 | 64.72 | 64.67 | 65.79 | 55.49 | 50.58 | 62.17 | 59.41 | 60.43 | 61.71 |
Динамика микробной биомассы (МБ) в первый вегетационный период во всех вариантах опыта и в контроле развивалась однотипно. На второй, третий и четвертый годы посадки под саженцами заметно проявлялось влияние корневых выделений на содержание МБ. В период 2018–2019 гг. корневые выделения сосны кедровой и сосны обыкновенной формируют большие, по сравнению с контролем, значения МБ, причем под сосной кедровой значения МБ выше (в среднем в 1.3 раза), чем под сосной обыкновенной. В 2020 г. общее содержание МБ под климатипами снизилась в 1.2 раза по сравнению с 2017 и 2019 гг., предполагаем, что это связано с формированием специфических для видов Pinus sp. ризосферных сообществ. Наибольшие значения МБ отмечены под климатипами КБ и СБ – 785 и 803 мкг С/г почвы соответственно (рис. 4а). Интенсивность микробного дыхания (БД и qCO2) снизилась, приблизившись к эко-физиологической норме. На содержание МБ, БД и qCO2 оказывали влияние влажность, температура и рН почвы. Так, в 2019 г. при пониженной влажности почвы (табл. 1) наблюдали повышенное базальное и удельное дыхание (в среднем qCO2 – 9.1 мкг С-СО2/мг С/ч) (рис. 4б).
Отмечены высокие коэффициенты корреляции между влажностью и МБ (r = 0.64), и qCO2 (r = –0.74), а также между рН и БД (r = 0.82), и qCO2 (r = 0.74).
Активность гидролитических ферментов на всех участках была низкой по сравнению с контролем (пашней) на всем протяжении исследования (2017–2020 гг.). Активность инвертазы (фермента, ответственного за гидролиз сахаров) под всеми климатипами повышалась с 2017 по 2020 гг. с 34 до 65.5 мг/г, однако не превышала таковую на контроле (пашня), где она составляла в среднем 45 мг/г почвы (табл. 5). Возможно, это связано с тем, что в процессе зарастания пашни увеличиваются запасы корней в верхнем слое почвы, и это в целом влияет на напряженность биологических процессов, а также положительным образом сказывается на общей биохимической обстановке пахотного слоя. Наибольшая средняя активность уреазы в основном была зарегистрирована под климатипами кедров байкальского и монгольского (КБ и КМ) – до 1.5 мг/г, а активность инвертазы под климатипом СП до 42.3 мг/г. Наиболее высокая активность фосфатазы была отмечена под КБ – до 1 мг/г почвы (табл. 5). В течение 2017–2018 г. активность гидролаз под саженцами зависела больше от влажности, чем от рН. Отмечены высокие коэффициенты корреляции в 2017 г. между ферментами, влажностью1 (r1 = 0.81 (У), r1 = 0.63 (Ф), r1 = –0.82 (И)) и рН2 (r2 = –0.75 (У) и r2 = 0.69 (И)); в 2018 г. между влажностью1 и У (r1 = 0.65), Ф (r1 = 0.71), И (r1 = –0.70). С рН коррелировала только фосфатаза (r2 = 0.50). В 2019 г. и 2020 г. наибольшее значение на активность гидролитических ферментов оказывали рН2 и t3 почвы: (r2 = 0.89 (У), r2 = –0.66 (Ф), r2 = 0.56 (И)); (r3 = = 0.61 (У), r3 = –0.67 (Ф), r3 = 0.80 (И)).
Таблица 5.
Ферментативная активность и коэффициенты гумификации участка “Географические культуры” за период 2017–2020 гг. (усредненные данные), n = 3
| Код образца | Уреаза (У), мг N-NH4/г почвы | Фосфатаза (Ф), мг P2O5/г почвы | Инвертаза (И), мг глюкозы/г почвы | Полифенолоксидаза (ПФО) | Пероксидаза (ПО) |
Коэффициент гумификации (Кг) |
|---|---|---|---|---|---|---|
| мг 1.4 – бензохинона/г почвы | ||||||
| 2017 г. | ||||||
| К | 0.95 ± 0.02 | 0.52 ± 0.12 | 34.11 ± 3.22 | 0.69 ± 0.03 | 0.56 ± 0.08 | 1.25 |
| КМ | 1.77 ± 0.12 | 0.71 ± 0.08 | 26.80 ± 3.07 | 0.68 ± 0.05 | 0.64 ± 0.04 | 1.06 |
| КБ | 1.86 ± 0.26 | 0.65 ± 0.08 | 27.03 ± 2.04 | 0.69 ± 0.08 | 0.62 ± 0.04 | 1.14 |
| СУ | 1.58 ± 0.12 | 0.64 ± 0.03 | 24.70 ± 0.04 | 0.77 ± 0.05 | 0.59 ± 0.09 | 1.36 |
| СБ | 1.89 ± 0.18 | 0.74 ± 0.10 | 26.89 ± 2.34 | 0.63 ± 0.09 | 0.56 ± 0.08 | 1.13 |
| СП | 1.66 ± 0.02 | 0.52 ± 0.05 | 27.94 ± 1.68 | 0.63 ± 0.03 | 0.64 ± 0.01 | 0.99 |
| 2018 г. | ||||||
| К | 0.90 ± 0.02 | 0.59 ± 0.08 | 37.84 ± 2.44 | 0.49 ± 0.16 | 0.40 ± 0.08 | 1.23 |
| КМ | 1.63 ± 0.25 | 0.73 ± 0.13 | 30.36 ± 2.39 | 0.58 ± 0.19 | 0.48 ± 0.14 | 1.10 |
| КБ | 1.76 ± 0.16 | 0.66 ± 0.12 | 30.82 ± 1.85 | 0.51 ± 0.28 | 0.42 ± 0.11 | 1.15 |
| СУ | 1.65 ± 0.15 | 0.68 ± 0.07 | 30.50 ± 2.46 | 0.47 ± 0.21 | 0.44 ± 0.09 | 1.23 |
| СБ | 1.49 ± 0.15 | 0.77 ± 0.11 | 30.89 ± 2.04 | 0.62 ± 0.17 | 0.52 ± 0.12 | 1.14 |
| СП | 1.52 ± 0.01 | 0.61 ± 0.10 | 32.11 ± 0.85 | 0.63 ± 0.21 | 0.48 ± 0.12 | 1.11 |
| 2019 г. | ||||||
| К | 1.61 ± 0.22 | 0.43 ± 0.17 | 63.15 ± 4.49 | 0.48 ± 0.05 | 0.42 ± 0.01 | 1.22 |
| КМ | 1.38 ± 0.46 | 0.65 ± 0.25 | 44.65 ± 9.85 | 0.56 ± 0.08 | 0.43 ± 0.12 | 1.15 |
| КБ | 1.44 ± 0.37 | 0.54 ± 0.24 | 47.51 ± 5.19 | 0.55 ± 0.02 | 0.35 ± 0.07 | 1.26 |
| СУ | 1.10 ± 0.27 | 0.55 ± 0.07 | 35.96 ± 11.17 | 0.55 ± 0.05 | 0.47 ± 0.02 | 1.22 |
| СБ | 1.57 ± 0.49 | 0.29 ± 0.07 | 35.33 ± 13.32 | 0.56 ± 0.07 | 0.40 ± 0.08 | 1.21 |
| СП | 1.53 ± 0.51 | 0.51 ± 0.07 | 52.29 ± 1.09 | 0.49 ± 0.11 | 0.40 ± 0.04 | 1.15 |
| 2020 г. | ||||||
| К | 2.03 ± 0.32 | 0.91 ± 0.14 | 65.49 ± 3.41 | 0.50 ± 0.05 | 0.50 ± 0.10 | 0.99 |
| КМ | 1.52 ± 0.30 | 1.55 ± 0.32 | 44.31 ± 4.75 | 0.71 ± 0.08 | 0.47 ± 0.05 | 1.49 |
| КБ | 1.24 ± 0.08 | 2.21 ± 0.71 | 55.24 ± 1.27 | 0.56 ± 0.02 | 0.50 ± 0.06 | 1.13 |
| СУ | 0.87 ± 0.02 | 1.27 ± 0.32 | 43.77 ± 9.49 | 0.55 ± 0.03 | 0.49 ± 0.05 | 1.13 |
| СБ | 1.24 ± 0.08 | 1.01 ± 0.39 | 48.55 ± 13.27 | 0.64 ± 0.02 | 0.50 ± 0.07 | 1.28 |
| СП | 2.83 ± 0.39 | 1.05 ± 0.23 | 56.80 ± 2.81 | 0.63 ± 0.09 | 0.53 ± 0.06 | 1.18 |
Активность оксидоредуктаз была существенно выше, чем гидролаз. Наибольшие значения ПФО проявляла под климатипом СУ – до 0.77 мг/г почвы, в то время как пероксидаза под КМ и СП увеличилась до 0.63 мг/г почвы. С самым высоким коэффициентом гумификации (Кг) оказалась почва под климатипом кедра байкальского (1.25) и кедра монгольского (до 1.5), причем коэффициенты гумификации растут с 2017 по 2020 год под всеми климатипами, за исключением СУ, в то время как на контроле он снизился с 1.25 до 0.99.
Следует отметить, что Кг везде в основном оставался больше единицы, что говорит об удовлетворительных условиях минерализации органического вещества черноземов. Причем в начале исследований (2017 г.) данный коэффициент имел тренд к увеличению в конце вегетационного периода, в процессе зарастания пашни мы видим обратное явление: в сентябре 2018–2019 гг. данный коэффициент снижается до 0.85–1.0. А.В. Якушев (2014) отмечал, что при потеплении климата изменение запасов почвенного гумуса зависит от температурной чувствительности полифенолоксидаз, что подтверждают высокие коэффициенты корреляции между температурой почвы и ПО (r3 = 0.53), ПФО (r3 = –0.52) и Кг (r3 = –0.45) в 2020 г. Они играют важную роль в разложении лигнина, минерализации и образовании гумуса. За период исследований наблюдается “выравнивание” коэффициента гумификации по сравнению с контролем и его небольшое повышение (табл. 5).
Отмечено, что по имеющимся шкалам энзимологической активности (Гапонюк, Малахов С.В, 1985; Звягинцев, 1987) активность гидролитических ферментов считается низкой, в то время как активность пероксидазы и полифенолоксидазы на протяжении 3-х лет исследований остается высокой. Cusack с соавторами (Cusack et al., 2010) отмечали, что при потеплении климата наблюдается снижение активности гидролаз, а активность оксидоредуктаз не изменяется. Также активность всех ферментов снижается в конце вегетационного периода (сентябрь), но остается высокой в мае-июне на всем протяжении исследования. Wallenstein и Weintraub (2008) доказали, что активность ферментов возрастает с повышением температуры (до некоторого оптимума) и из-за потепления климата, по крайней мере, теоретически, должна увеличиваться скорость ферментативных реакций. С другой стороны, микробы могут снизить синтез фермента и его секрецию в ответ на потепление (Allison, 2005; Wallenstein et al., 2012; Henry, 2013).
ЗАКЛЮЧЕНИЕ
На участках “Гари и Пожарища” численность основных групп почвенных микробных сообществ (ОЧМ), содержание микробной биомассы (МБ) и интенсивность дыхания микроорганизмов (БД) изменялись в большей степени в зависимости от влажности почвы, в меньшей – от температуры и рН. На восстановившихся пожарищах отмечены бóльшие значения общей микробной численности (ОМЧ) и биомассы (МБ). На пожарищах вяза и лиственницы наибольшие значения ОЧМ зарегистрированы в ризосфере, а МБ – между рядами посадок. В целом за 3 года исследований изменилось соотношение ЭТГМ в сторону увеличения гидролитико-копиотрофных групп и уменьшение олиготрофов, о чем свидетельствует снижение их численности в 2.2 и увеличение гидролитиков в 1.2 раза. Ферментативная активность почвы в гарях и пожарищах увеличивается в течение периода вегетации, что может отражать как сезонные климатические изменения, так и повышение интенсивности почвенных биологических процессов, связанных с восстановлением лесорастительной способности горевшей почвы. На пожарищах вязов (в ризосфере и междурядьях) состояние почвенных микробиомов близко таковым контрольным участкам, что отражает большинство микробиологических индикаторов. В гарях лиственницы, и особенно сосны, почвенные микробные сообщества еще не достигли своей эко-физиологической нормы.
На участках “Географические культуры” под саженцами Pinus sp. формируются специфические ризосферные микробные сообщества, обусловленные влиянием не только абиотических факторов, но и корневых выделений, о чем свидетельствуют значения общей микробной численности и перегруппировка эколого-трофической структуры микробных сообществ, микробная биомасса и энзиматическая активность под климатипами. После четырех лет вегетации отмечены достоверные различия значений общей численности микроорганизмов ризосферной зоны среди климатипов сосны кедровой и сосны обыкновенной (СП), что говорит о способности корневых выделений растений одного вида, но различного географического происхождения формировать специфические микробоценозы. В ризосферной почве климатипов выявили бактерий, оказывающих влияние на рост саженцев. В основном это неспоровые (рр. Pseudomonas, Xanthomonas) и споровые бактерии (рр. Actinobacteria и Bacillus). Самой малочисленной группой были грибы, преимущественно микромицеты, среди которых доминировали представители рода Mortierella Coem (до 60% от всех выявленных грибов). Отмечено снижение микромицетов из р. Penicillium (на 10–15%). На участках с географическими культурами идет процесс формирования микробных сообществ под саженцами Pinus sp., который далек от завершения, об этом свидетельствуют все микробные индикаторы.
Адекватными универсальными микробиологическими индикаторами для диагностики и мониторинга состояния почвы сухой озерно-котловинной Ширинской степи в исследуемых фитоценозах являлись: соотношение эколого-трофических групп микроорганизмов (ЭТГМ), содержание микробной биомассы (МБ), коэффициент удельного микробного дыхания (qCO2). Специфическими индикаторами являлись: для участков “Гари и Пожарища” – увеличение доли популяций споровых бактерий из родов Bacillus и Streptomyces, грибов р. Trichoderma; для участков “Географические культуры” – увеличение доли популяции ризосферных грибов из родов Mortierella и Mucor и снижение доли грибов из рода Penicillium.
Список литературы
Ананьева Н.Д. Микробиологические аспекты самоочищения и устойчивости почв. М.: Наука, 2003. 222 с.
Богородская А.В. Влияние пожаров на микробные комплексы почв сосновых лесов Средней Сибири: автореф. дис. … канд. биол. наук (спец. 03.00.16; 03.00.07). Красноярск. 2006. 21 с.
Гапонюк Э.И., Малахов С.В. Комплексная система показателей экологического мониторинга почв // Миграция загрязняющих веществ в почвах и сопредельных средах. Труды 4-го Всесоюз. совещ. Л.: Гидрометеоиздат, 1985. С. 3–10.
ГОСТ 28268-89 Почвы. Методы определения влажности, максимальной гигроскопической влажности и влажности устойчивого завядания растений.
Гродницкая И.Д., Сенашова В.А., Пашкеева О.Э., Антонов Г.И. Микробиологическая индикация почв зоны сухой степи в искусственных фитоценозах после пожара и агротехнических воздействий (Р. Хакасия) // Электронное издание. Материалы IX Всероссийской научной конференции с международным участием “Лесные почвы и изменение климата”. М.: ЦЭПЛ РАН, 2021. С. 52–56. https://forestsoil.ru/wp-content/ uploads/2021/09/SBORNIK_LESNYE_POCHVY_I_ IZMENENIE_KLIMATA_2021.pdf
Звягинцев Д.Г. Почва и микроорганизмы. М.: Из-во МГУ, 1987. 256 с.
Звягинцев Д.Г. Биологическая активность почв и шкалы для оценки некоторых ее показателей // Почвоведение. 1978. № 6. С. 48–54.
Казеев К.Ш., Колесников С.И., Вальков В.Ф. Биологическая диагностика и индикация почв: методология и методы исследований. Ростов-на-Дону: Изд-во Рост. ун-та, 2003. 204 с.
Казеев К.Ш., Колесников С.И., Вальков В.Ф. Биология почв Юга России. Ростов-на-Дону: Изд-во ЦВВР, 2004. 350 с.
Коновалова А.Е., Коновалова М.Е., Пименов А.В. Особенности роста по диаметру красно- и желтопыльниковой форм сосны обыкновенной // Сибирский лесной журн. 2020. № 3. С. 63–72.
Кузьмина Н.А., Кузьмин С.Р. Анализ динамики роста климатипов сосны обыкновенной в географических культурах в Средней Сибири // Сибирский лесной журн. 2017. № 2. С. 31–39.
Кулик К.Н Опустынивание земель и защитное лесоразведение в Российской Федерации // Опустынивание земель и борьба с ним. Абакан. 2007. С. 25–29.
Курбатский Н.П. Терминология лесной пирологии // Вопросы лесной пирологии. Красноярск: ИЛиД СО АН СССР. 1972. С. 171–231.
Лобанов А.М. Роль защитных лесных насаждений Ширинской степи в предотвращении опустынивания // Опустынивание земель и борьба с ним. Абакан. 2007. С. 87–94.
Методы почвенной микробиологии и биохимии / Под ред. Д.Г. Звягинцева. М.: Изд-во Моск. университета, 1991. 303 с.
Мишустин Е.Н. Микробные ассоциации почвенных типов. В кн.: Проблемы и методы биологической диагностики и индикации почв. М.: Наука, 1976. С.19–42.
Практикум по микробиологии / Под ред. А.И. Нетрусова. М.: Академия, 2005. 603 с.
Рощина В.В., Рощина В.Д. Выделительная функция высших растений. LAP Lambert Academic Publishing, 2012. 476 с.
Сенашова В.А., Гродницкая И.Д., Пашкеева О.Э., Антонов Г.И. Формирование почвенных микробных сообществ под географическими культурами Pinus sp. в аридных условиях // Экосистемы Центральной Азии: исследование, сохранение, рациональное использование: материалы XV Убсунурского Международного симпозиума. Кызыл (5-8 июля 2020 г.) / Под ред. Ч.Н. Самбыла. Красноярск: Изд-во “Офсет”, 2020. С. 161–165. ISBN 978-5-6044448-0-1
Сорокин Н.Д., Молоков В.А. Повышение приживаемости культур лиственницы в степных районах Хакасии // Лес. хоз-во. 1985. № 5. С. 55–57.
Сорокин Н.Д., Сорокина О.А. Опыт повышения жизнеспособности лиственницы (Larix sibirica) в условиях сухостепных почв Ширинского заповедника (Хакасия) // Самарская Лука: проблемы региональной и глобальной экологии. 2009. Т. 18. № 2. С. 64–69.
Сорокин Н.Д., Сенашова В.А., Сорокина О.А. Биогенность почв как показатель устойчивости искусственных лесных насаждений в сухостепных условиях Хакасии // Известия РАН. Серия биологическая. 2017. № 3. С. 329–336. https://doi.org/10.7868/S0002332917030092
Хазиев Ф.Х. Методы почвенной энзимологии. М.: Наука, 2005. 252 с.
Шарагин А.М. Влияние лесных пожаров на экологическую ситуацию // Успехи современного естествознания. 2011. № 7. С. 236.
Шишов Л.Л., Тонконогов В.Д., Лебедева И.И., Герасимова М.И. Классификация и диагностика почв России. Смоленск: Ойкумена, 2004. 342 с.
Якушев А.В., Кузнецова И.Н., Благодатская Е.В., Благодатский С.А. Зависимость активности полифенолпероксидаз и полифенолоксидаз в современных и погребенных почвах от температуры // Почвоведение. 2014. № 5. С. 590–596. https://doi.org/10.7868/S0032180X14050268
Allison S.D. Cheaters, diffusion and nutrients constrain decomposition by microbial enzymes in spatially structured environments // Ecology Letters. 2005. V. 8. № 6. P. 626–635.
Anderson J.P.E., Domsch K.H. A physiological method for the quantitative measurement of microbial biomass in soils // Soil Biology and Biochemistry. 1978. V. 10. № 3. P. 314–322.
Anderson T.H., Domsch K.H. Application of eco-physiological quotients (qCO2 and qD) on microbial biomass from soils of different cropping histories // Soil Biology and Biochemistry. 1990. V. 22. P. 251–255.
Bulgarelli D., Schlaeppi K., Spaepen S., Ver Loren van Themaat E., Schulze-Lefert P. Structure and function of bacterial microbiota of plants // Annual Review of Plant Biology. 2013. V. 64. P. 807–838. https://doi.org/10.1146/annurev-arplant-050312-120106
Cusack D.F., Torn M.S., McDowell W.H., Silver W.L. The response of heterotrophic activity and carbon cycling to nitrogen additions and warming in two tropical soils // Global Change Biology. 2010. V. 16. № 9. P. 2555–2572.
Henry H.A.L. Soil extracellular enzyme dynamics in a changing climate // Soil Biology and Biochemistry. 2013. № 47. P. 53–59.
Sparling G.T. The substrate-induced respiration method // Methods in applied soil microbiology and biochemistry. Acad. Press, London.1995. P. 397–404.
Schlaeppi K., Bulgarelli D. The plant microbiome at work // Mol. Plant-Microbe Interact. 2015. V. 28. № 3. P. 212–217. https://doi.org/10.1094/MPMI-10-14-0334-FI
Wallenstein M.D., Haddix M.L., Lee D.D., Conant R.T., Paul E.A. A litter-slurry technique elucidates the key role of enzyme production and microbial dynamics in temperature sensitivity of organic matter decomposition // Soil Biology and Biochemistry. 2012. № 47. P. 18–26.
Wallenstein M.D., Weintraub M.N. Emerging tools for measuring and modeling the in situ activity of soil extracellular enzymes // Soil Biology and Biochemistry. 2008. V. 40. № 9. P. 2098–2106.
Watanabe T. Pictorial atlas of soil and seed fungi: morphologies of cultured fungi and key to species. 2nd ed. Boca Raton: CRC Press, Inc., 2002. 506 p.
Дополнительные материалы отсутствуют.


