Лесоведение, 2023, № 1, стр. 35-43
Взаимосвязи фенольных соединений, танинов, лигнина, азота и углерода в растениях ельников кустарничково-зеленомошных на Кольском полуострове
Н. А. Артемкина *
Институт проблем промышленной экологии Севера КНЦ РАН
184200 Мурманская обл, Апатиты, мкр-н Академгородок, д. 14а, Россия
* E-mail: n.artemkina@ksc.ru
Поступила в редакцию 15.11.2021
После доработки 17.01.2022
Принята к публикации 06.04.2022
- EDN: NGJMDA
- DOI: 10.31857/S0024114823010047
Аннотация
Анализировали стареющие (опадающие) органы (листья/хвоя) следующих растений: ель сибирская (Picea abies ssp. obovata (Ledeb.) Domin), береза пушистая (Betula pubescens Ehrh), брусника обыкновенная (Vaccinium vitis-idaea L.), водяника гермафродитная (Empetrum hermaphroditum Hager.), черника обыкновенная (Vaccinium myrtillus L.), плевроциум Шребера (Pleurozium schreberi (Brid.) Mitt.), политрихум (Polytrichum spp.), дерен шведский (Chamaepericlymenum suecicum (L.) Aschers. & Graebn. (Cornus suecica L.)), овсик извилистый (Deschampsia flexuosa (L.) Trin.). Установили значительное варьирование химического состава (содержание лигнина, фенольных соединений, танинов, азота и углерода, а также стехиометрические отношения “С/N”, “лигнин/N”, “лигнин/целлюлоза”) среди растений северотаежных лесов на межвидовом уровне. Поступление вторичных метаболитов с опадом зависит от видового состава растительных сообществ и вклада различных видов растений в состав растительного покрова. На внутривидовом уровне (для ели сибирской, произрастающей в различных положениях ландшафта ельников кустарничково-зеленомошных (автоморфный, транзитный и аккумулятивный ландшафты)) определили повышение содержания растворимых танинов (p < 0.05) в хвое ели в автоморфной позиции ландшафта. Изучены некоторые взаимосвязи между вторичными метаболитами, азотом и углеродом в составе стареющих фотосинтезирующих органах доминирующих различных видов растений в северотаежных ельниках кустарничково-зеленомошных.
Вторичные метаболиты, в том числе фенольные соединения вносят значительный вклад во взаимодействие растений с окружающей средой (Cheynier et al., 2013). Ранее мы установили, что микромозаика растительности в лесных биогеоценозах определяет пространственную гетерогенность состава верхних органогенных горизонтов почв, формирующихся из опада доминирующих растений разного качества. Поступления элементов питания (С, N) и вторичных метаболитов (фенольных соединений, танинов и лигнина) с опадом зависит от видового состава растительных сообществ и вклада различных видов растений в состав растительного покрова (Артемкина и др., 2018а, 2018б; Шевченко и др., 2019; He et al., 2019; Rosenfield et al., 2020).
Известно, что скорость разложения опада определяется, в том числе стехиометрическими отношениями “С/N”, “лигнин/N”, “лигнин/целлюлоза” (Berg, 2014).
Показатель “С/N” повсеместно используется в экспериментах по разложению опада растений, передает взаимосвязь между азотом и углеродом, т.е. питательным статусом опада растений. Отношение “С/N” в опаде растений – хороший предсказатель скорости разложения этого опада. Чем ýже отношение “С/N”, тем быстрее разлагается опад. При низких соотношениях C : N (например, при высоких концентрациях N) микроорганизмы высвобождают N непосредственно из опада. При более высоких начальных соотношениях C : N чистая иммобилизация обычно происходит, когда микроорганизмы получают доступ к N, находящемуся в подстилке, и преобразуют его в микробную биомассу или экзоферменты (Parton et al., 2007). На начальных стадиях трансформации опада высокое содержание азота способствует разложению, тогда как на следующей стадии, стадии лигнина, оказывает обратное воздействие, так как происходит угнетение грибов белой гнили (Berg, 2000).
Показатель “лигнин/N” может выступать как индикатор динамики азота в процессах трансформации и формирования органического вещества почвы (Osono, Takeda, 2004). Установлена значимая отрицательная корреляционная связь (r = –0.66, P < 0.001) между начальным соотношением “лигнин/N” в опаде растений, произрастающих в Европе, и скоростью разложения этого опада (Fortunel et al., 2009).
Показатель отношения “лигнин/целлюлоза” в значительной степени определяет в дальнейшем скорость разложения опада в первой фазе его трансформации (Berg, 2014). В долгосрочной перспективе концентрация целлюлозы уменьшается, тогда как концентрация лигнина увеличивается, и существует уровень, при котором относительные количества остаются постоянными.
Было определено, что разложение всех органов (листья, стебли, корни, репродуктивные части) последовательно изменялось связанными со структурой растений показателями (лигнин, C и влажность) (Aerts et al., 2012). Другие исследования показывают, что идентичность опада (полное множество черт, включенных в каждую разновидность растений) – лучший предсказатель, чем простой стехиометрический показатель межвидового изменения в скорости разложения опада (Cornwell и др., 2008). Ранее нами были представлены только результаты отдельно по фенольным соединениям, отдельно по С и N (горизонтальное, внутрибиогеоценотическое (между отдельными элементарными биогеоареалами) и межбиогеоценотическое варьирование). В этой работе показаны взаимодействия вторичных метаболитов с С и N.
Наша работа направлена на изучение взаимосвязей между вторичными метаболитами (фенольные соединения, включая лигнин, танины), азотом и углеродом в составе стареющих фотосинтезирующих органах доминирующих различных видов растений в северотаежных ельниках кустарничково-зеленомошных.
ОБЪЕКТЫ И МЕТОДИКА
Объекты исследования ельников кустарничково-зеленомошных расположены в центральной части Кольского полуострова (67°29′ с.ш., 34°32′ в.д.) в водосборном бассейне озера Умбозеро (Манаков, Никонов, 1981). В древесном ярусе преобладает ель сибирская, возраст которой варьирует от 30 до 200 лет и более. В напочвенном покрове встречаются: водяника гермафродитная, плевроциум Шребера, политрихум обыкновенный (Polytrichum commune Hedw.), брусника обыкновенная, черника обыкновенная, дерен шведский, овсик извилистый. Пробные площади размером 50 × 50 м заложены в 5-кратной повторности в ельниках кустарничково – зеленомошных. На каждой пробной площади отобраны для анализа образцы стареющих фотосинтезирующих органов растений (хвоя ели, листья кустарничков, зеленые мхи).
В лаборатории образцы высушивали, затем каждый из них измельчали и просеивали через сито с ячеей 1 мм. Содержание азота определяли по Кьельдалю, углерода – по Тюрину. Количественное определение растворимых конденсированных танинов в образцах проводили фотоколориметрическим методом (555 нм) после взаимодействия с раствором н-бутанол: HCl (95 : 5 v/v) (Ossipova et al., 2001). Концентрации фенольных соединений определяли фотоколориметрическим методом (730 нм) с реактивом Фолина – Чокальтеу (Kanerva et al., 2008). Расчет количества фенольных соединений и танинов проводили по калибровочным графикам, построенным по таниновой кислоте и конденсированным танинам листьев березы Черепанова (Betula pubescens ssp. Czerepanovii) соответственно. Содержание лигнина определяли с помощью обработки пробы 72%-ной серной кислотой после предварительного кипячения в растворе ЦТАБ (10 г цетилтриметиламмония бромида в 1 л 0.5-молярного раствора H2SO4) (Rowland, Roberts, 1994).
Статистическая обработка результатов проводилась с помощью пакета программ Excel 7.0.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Были определены концентрации вторичных метаболитов, в том числе лигнина, азота и углерода в доминирующих видах растений ельника кустарничково-зеленомошного. Анализировали стареющие (опадающие) органы (листья/хвоя) следующих растений: ели сибирской, березы пушистой, брусники обыкновенной, водяники гермафродитной, черники обыкновенной, плевроциума Шребера, политрихума, дерена шведского, овсика извилистого (табл. 1).
Таблица 1.
Химический состав растений ельника кустарничково-зеленомошного
| Виды растений | C, % | N, % | С/N | Лигнин/N | Лигнин/целлюлоза |
|---|---|---|---|---|---|
| Ель сибирская | 52.4 ± 1.3 | 0.83 ± 0.07 | 64 ± 5 | 18.0 ± 1.2 | 0.92 ± 0.05 |
| Плевроциум Шребера | 45.6 ± 1.8 | 0.70 ± 0.07 | 67 ± 6 | 33.3 ± 2.6 | 0.68 ± 0.05 |
| Политрихум | 44.8 ± 2.0 | 0.62 ± 0.05 | 80 ± 5 | 49.0 ± 7.2 | 0.71 ± 0.03 |
| Водяника гермафродитная | 55.9 ± 1.5 | 0.65 ± 0.03 | 87 ± 6 | 43.8 ± 4.6 | 2.49 ± 0.12 |
| Брусника обыкновенная | 50.1 ± 1.0 | 0.94 ± 0.14 | 49 ± 9 | 15.5 ± 2.4 | 0.67 ± 0.08 |
| Черника обыкновенная | 49.6 ± 0.7 | 1.40 ± 0.18 | 35 ± 4 | 8.8 ± 0.3 | 0.80 ± 0.02 |
| Береза пушистая | 47.3 ± 1.5 | 1.64 ± 0.04 | 29 ± 1 | 8.6 ± 0.2 | 1.31 ± 0.10 |
| Дерен шведский | 41.2 ± 0.9 | 1.14 ± 0.03 | 36 ± 1 | 2.0 ± 0.2 | 0.19 ± 0.02 |
| Овсик извилистый | 45.0 ± 1.6 | 0.95 ± 0.03 | 47 ± 3 | 3.4 ± 0.2 | 0.12 ± 0.00 |
Содержание углерода существенно изменялось между исследованными видами растений с максимальными значениями для водяники гермафродитной (55.9%) и минимальными для дерена шведского (41.2%). Концентрации азота были наибольшими в березе пушистой (1.64%) и чернике обыкновенной (1.40%), немного меньше азота накапливалось в дерене шведском (1.14%). Минимальное содержание азота было установлено в политрихуме (0.62%) и водянике гермафродитной (0.65%).
Значение показателя “С/N” существенно варьирует в зависимости от вида растений, и его можно представить в порядке уменьшения: водяника гермафродитная (87), политрихум (80), плевроциум Шребера (67), ель сибирская (64), брусника обыкновенная (49), овсик извилистый (47), дерен шведский (36), черника обыкновенная (35), береза пушистая (29). Причем изменения показателя “С/N” объясняются как трансформациями азота, так и углерода в различных видах растений.
По уровню значения показателя “лигнин/N” опад можно расположить в следующий ряд: политрихум (49.0) > листья водяники гермафродитной (43.8) > плевроциум Шребера (33.3) > хвоя ели сибирской (18.0) > листья брусники обыкновенной (15.5) > листья черники обыкновенной (8.8) > листья березы пушистой (8.6) > овсик извилистый (3.4) > дерен шведский (2.0). Таким образом, по рассматриваемому параметру наиболее устойчивыми к разложению являются мхи политрихума, наименее – дерен шведский.
Отношение “лигнин/целлюлоза” (в значительной степени определяет в дальнейшем скорость разложения опада в первой фазе его трансформации) уменьшается в порядке: водяника гермафродитная (2.49) > ель сибирская (0.83) > > черника обыкновенная (0.80) > политрихум обыкновенный (0.71) > плевроциум Шребера (0.68) > брусника обыкновенная (0.67) > дерен шведский (0.19) > овсик извилистый (0.12).
Самые большие отношения C/N и лигнин/N были определены для водяники гермафродитной (85.8 и 43.8 соответственно), политрихума (72.5 и 49.0) и плевроциума Шребера (64.8 и 33.3). Кроме того, для листьев водяники гермафродитной найден самый широкий показатель “лигнин/целлюлоза” (2.49). Именно этим трем видам опада свойственна низкая скорость разложения, и, следовательно, замедленный круговорот питательных веществ.
Мы установили, что различные виды растений могут быть сгруппированы согласно своему химическому составу (рис. 1). Два компонента, N и лигнин, как уже было сказано выше, играют определяющую роль в процессах трансформации опада и в первую очередь влияют на скорость его разложения (Berg, 2000; Лебедев, Шестибратов, 2021). Ранее были выявлены особенности влияния эндогенного и минерального азота как на минерализацию, так и на гумификацию лесного опада (Ларионова и др., 2017). Анализируя полученные данные, мы нашли, что различные виды растений фактически сформировали отличные гомогенные группы, которые не накладывались друг на друга (рис. 1). Исключение составляют: водяника гермафродитная и политрихум, химический состав которых близок по этим параметрам. Для сравнения: стареющие органы водяники гермафродитной и политрихума характеризуются наличием одновременно низких концентраций N и высоких лигнина, тогда как опад черники обыкновенной и березы пушистой отличается высоким содержанием N и средними концентрациями лигнина. Для многолетней хвои ели сибирской были определены более высокие концентрации лигнина, чем для брусники обыкновенной, и далее – для овсика извилистого и дерена шведского при среднем содержании N.
Рис. 1.
Концентрации лигнина, азота (N) и углерода (С) в различных видах растений ельника кустарничково-зеленомошного.
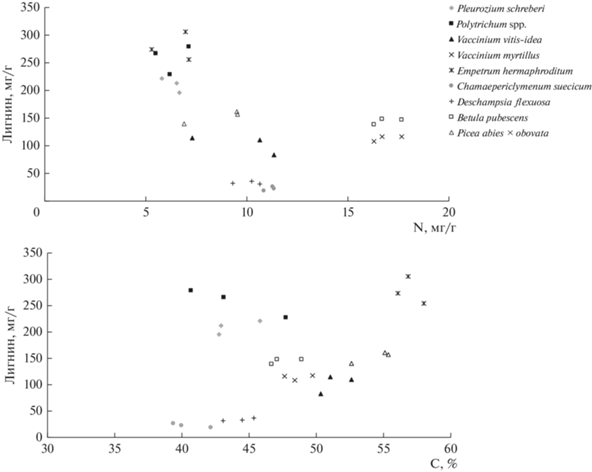
Рассмотрев взаимосвязь лигнина и углерода, мы также нашли различные гомогенные группы растений. Группа из политрихума обыкновенного и плевроциума Шребера показывает высокое содержание лигнина и среднее углерода. Черника обыкновенная, брусника обыкновенная, береза пушистая и ель сибирская формируют группу с высоким содержанием С и средним лигнина. Овсик извилистый и дерен шведский образуют группу с низким содержанием лигнина при средних концентрациях С. Отдельную позицию занимает водяника гермафродитная, у которой высокое содержание и лигнина, и углерода.
Фенольные соединения обладают высокой аллелопатической активностью и подавляют всхожесть семян (Лебедев, Лебедев, 2015; Колмогорова, Уфимцев, 2018). Содержание лигнина, фенольных соединений и танинов соответствует данным, представленным ранее для растений бореальных лесов Швеции (Wardle et al., 2003). По показателям фенольных соединений и азота (рис. 2) практически большинство видов проявляют индивидуальный характер, за исключением брусники обыкновенной и дерена шведского (высокое содержание фенольных соединений и среднее N), а также политрихума обыкновенного и плевроциума Шребера (низкое содержание азота и фенольных соединений). Для черники обыкновенной свойственны высокие концентрации и фенолов, и азота. Для ели сибирской – средние концентрации N при среднем содержании фенолов. Береза пушистая выявляется в области значительного содержания N при среднем фенолов. Овсик извилистый показывает низкое содержание фенолов и среднее азота, а водяника гермафродитная – низкое содержание азота и фенольных соединений.
Рис. 2.
Концентрации фенольных соединений, азота (N) и углерода (С) в различных видах растений ельника кустарничково-зеленомошного.
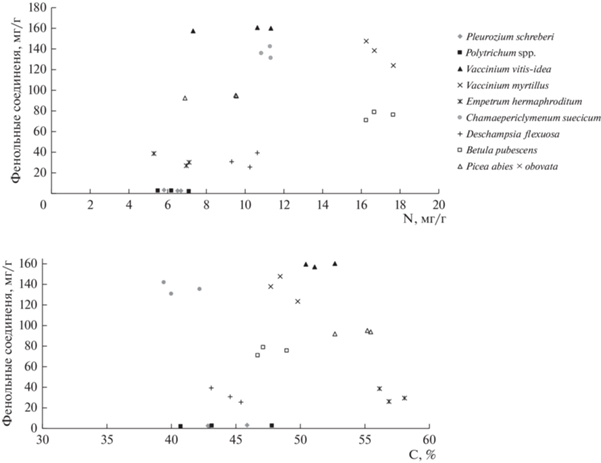
Такое же разнообразие химического состава свойственно растениям при сопоставлении концентраций углерода и фенольных соединений. Овсик извилистый показывает низкое содержание углерода при низком содержании фенольных соединений, еще ниже этот показатель установлен для политрихума обыкновенного и плевроциума Шребера. Опад ели сибирской обнаруживает высокое содержание углерода при среднем фенольных соединений. Береза пушистая проявляется на диаграмме в области средних концентраций углерода и фенольных соединений. Высокое содержание фенольных соединений типично для брусники обыкновенной (высокие концентрации С), черники обыкновенной (средние концентрации С) и дерена шведского (низкие концентрации С). Водяника гермафродитная при низких концентрациях фенольных соединений показывает максимальные среди рассматриваемых растений концентрации углерода.
Проанализировав взаимосвязь танинов и азота (рис. 3), мы нашли четыре основных кластера. Брусника обыкновенная представляет высокие концентрации танинов при средних значениях азота. Опаду березы пушистой и черники обыкновенной присуще высокое содержание азота при среднем танинов. Водяника гермафродитная проявляется в области низкого содержания и танинов, и азота. Средние значения концентраций азота и танинов характерны для опада ели сибирской. Минимальные концентрации танинов свойственны овсику извилистому и дерену шведскому при средних значениях азота.
Рис. 3.
Концентрации танинов, азота (N) и углерода (С) в различных видах растений ельника кустарничково-зеленомошного.
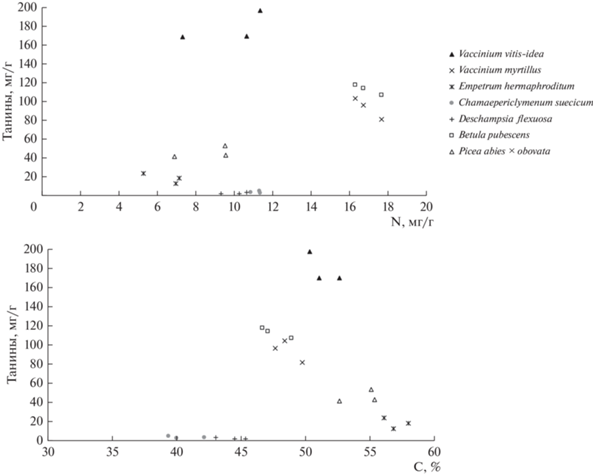
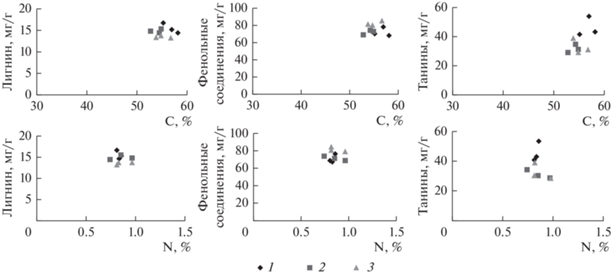
Рис. 4.
Концентрации лигнина, фенольных соединений, танинов, азота (N) и углерода (С) в опаде ели сибирской в различных положениях ландшафта. 1 – автоморфный ландшафт; 2 – транзитный ландшафт; 3 – аккумулятивный ландшафт.
Четыре группы растений мы определили при анализе взаимодействия танинов и углерода. Максимальные концентрации танинов при средних значениях углерода типичны для брусники обыкновенной. Береза пушистая и черника обыкновенная представлены в области средних значений содержания танинов и углерода. Ель сибирская и черника обыкновенная проявляются в области максимальных значений углерода и малых концентраций танинов. Овсик извилистый и дерен шведский показывают минимальные концентрации и углерода, и танинов.
Ель сибирская произрастает в различных положениях ландшафта ельников кустарничково-зеленомошных (автоморфный ландшафт, транзитный ландшафт, аккумулятивный ландшафт). Проанализировав взаимосвязи лигнина, фенольных соединений, танинов, азота и углерода, мы нашли только повышение содержания танинов (p < 0.05) в хвое ели в автоморфной позиции ландшафта. Автоморфная позиция ландшафта находится на вершине склона. Одним из основных факторов влияния на повышение содержания танинов в данном случае может быть световой режим (Kivimäenpää et al., 2014). По другим характеристикам достоверных различий не установлено.
ЗАКЛЮЧЕНИЕ
Таким образом, мы определили значительное варьирование химического состава растений (лигнин, фенольные соединения, танины, азот и углерод) северотаежных лесов на межвидовом уровне. Поступление вторичных метаболитов с опадом определяется видовым составом растительных сообществ и вкладом различных видов растений в состав растительного покрова (Артемкина и др., 2018а). На внутривидовом уровне (для ели сибирской) определили только повышение содержания танинов (p < 0.05) в хвое ели в автоморфной позиции ландшафта.
Полученные данные послужат возможной основой для более полного понимания того, как будут влиять различные растения на химические свойства опада и почвы в арктических лесных экосистемах, а следовательно, на особенности их функционирования. На основе корреляционных связей между качеством опада и скоростью разложения химический состав опада (содержание фенольных соединений, в том числе танинов, лигнина) может быть использован как предсказатель для определения темпов потери массы среди растений и также может послужить ключевыми переменными в биогеохимических моделях, описывающих процессы в экосистемах, в частности, процесс разложения опада растений, процесс трансформации углерода.
Список литературы
Артемкина Н.А., Орлова М.А., Лукина Н.В. Микромозаика растительности и вариабельность химического состава L-горизонтов подстилки северотаежных ельников кустарничково-зеленомошных // Лесоведение. 2018а. № 2. С. 97–106. https://doi.org/10.7868/S002411481802002X
Артемкина Н.А., Лукина Н.В., Орлова М.А. Пространственное варьирование содержания вторичных метаболитов, углерода и азота в подстилках северотаежных ельников // Лесоведение. 2018б. № 1. С. 37–47. https://doi.org/10.7868/S0024114818010035
Колмогорова Е.Ю., Уфимцев В.И. Некоторые особенности химического состава опада сосны обыкновенной, произрастающей в условиях породного отвала // Успехи современного естествознания. 2018. № 11-2. С. 267–272.
Ларионова А.А., Квиткина А.К., Быховец С.С., Лопес де Гереню В.О., Колягин Ю.Г., Каганов В.В. Влияние азота на минерализацию и гумификацию лесных опадов в модельном эксперименте // Лесоведение. 2017. № 2. С. 128–139.
Лебедев В.Г., Шестибратов К.А. Генная инженерия биосинтеза лигнина в деревьях: компромисс между свойствами древесины и жизнеспособностью растений // Физиология растений. 2021. Т. 68. № 4. С. 339–355.
Лебедев В.М., Лебедев Е.В. Вопросы аллелопатии в лесных фитоценозах – состояние и перспективы // Агрохимия. 2015. № 4. С. 85–91.
Манаков К.Н., Никонов В.В. Биологический круговорот минеральных элементов и почвообразование в ельниках Крайнего Севера. Л.: Наука, 1981. 196 с.
Шевченко Н.Е., Кузнецова А.И., Тебенькова Д.Н., Смирнов В.Э., Гераськина А.П., Горнов А.В., Грабенко Е.А., Тихонова Е.В., Лукина Н.В. Сукцессионная динамика растительности и запасы почвенного углерода в хвойно-широколиственных лесах Северо-Западного Кавказa // Лесоведение. 2019. № 3. С. 163–176. https://doi.org/10.1134/S0024114819030082
Aerts R., van Bodegom P.M., Cornelissen J.H.C. Litter stoichiometric traits of plant species of high-latitude ecosystems show high responsiveness to global change without causing strong variation in litter decomposition // New Phytologist. 2012. V. 196. P. 181–188. https://doi.org/10.1111/j.1469-8137.2012.04256.x
Berg B. Foliar Litter Decomposition: A Conceptual Model with Focus on Pine (Pinus) Litter – A Genus with Global Distribution // ISRN Forestry. 2014. V. 2014. P. 1–22. https://doi.org/10.1155/2014/838169
Berg B. Litter decomposition and organic matter turnover in northern forest soils // Forest Ecology and Management. 2000. V. 133. P. 13–22.
Cheynier V., Comte G., Davies K.M., Lattanzio V., Martens S. Plant phenolics: Recent advances on their biosynthesis, genetics, and ecophysiology // Plant Physiology and Biochemistry. 2013. V. 72. P. 1–20.
Cornwell W.K., Cornelissen J.H.C., Amatangelo K., Dorrepaal E., Eviner V.T., Godoy O., Hobbie S.E., Hoorens B., Kurokawa H., Perez–Harguindeguy N. et al. 2008. Plant species traits are the predominant control on litter decomposition rates within biomes worldwide // Ecology Letters. 2008. V. 11. № 10. P. 1065–1071.
Fortunel C., Garnier E., Joffre R., Kazakou E., Quested H., Grigulis K., Lavorel S., Ansquer P., Castro H., Cruz P., Doleżal J., Eriksson O., Freitas H., Golodets C., Jouany C., Kigel J., Kleyer M., Lehsten V., Lepš J., Meier T., Pakeman R., Papadimitriou M., Papanastasis V. P., Quetier F., Robson M., Sternberg M., Theau J.-P., Thebault A., Zarovali M. Leaf traits capture the effects of land use changes and climate on litter decomposability of grasslands across Europe // Ecology. 2009. V. 90. № 3. P. 598–611.
He M., Zhao R., Tian Q., Huang L., Wang X., Liu F. Predominant effects of litter chemistry on lignin degradation in the early stage of leaf litter decomposition // Plant and Soil. 2019. V. 442. P. 453–469. https://doi.org/10.1007/s11104-019-04207-6
Kanerva S., Kitunen V., Loponen J., Smolander A. Phenolic compounds and terpenes in soil organic horizon layers under silver birch, Norway spruce and Scots pine // Biology and Fertility of Soils. 2008. V. 44. P. 547–556.
Kivimäenpää M., Riikonen J., Sutinen S., Holopainen T. Cell structural changes in the mesophyll of Norway spruce needles by elevated ozone and elevated temperature in open-field exposure during cold acclimation // Tree Physiology. 2014. V. 34. № 4. P. 389–403.
Osono T., Takeda H. Accumulation and release of nitrogen and phosphorus in relation to lignin decomposition in leaf litter of 14 tree species // Ecological Research. 2004. V. 19. № 6. P. 593–602.
Ossipova S., Ossipov V., Haukioja E., Loponen J., Pihlaja K. Proanthocyanidins of mountain birch leaves: quantification and properties // Phytochemical Analysis. 2001. V. 12. № 2. P. 128–133.
Parton W., Silver W.L., Burke I.C., Grassens L., Harmon M.E., Currie W.S., King J.Y., Adair E.C., Brandt L.A., Hart S.C., et al. Global-scale similarities in nitrogen release patterns during long-term decomposition // Science. 2007. V. 315. P. 361–364. https://www.jstor.org/stable/20035252
Rosenfield M.V., Keller J.K., Clausen C., Cyphers K., Funk J.L. Leaf traits can be used to predict rates of litter decomposition // Oikos. 2020. V. 129. P. 1589–1596. https://doi.org/10.1111/oik.06470
Rowland A.P., Roberts J.D. Lignin and cellulose fractionation in decomposition studies using acid-detergent fibre methods // Communications in Soil Science and Plant Analysis. 1994. V. 25. № 3–4. P. 269–277.
Wardle D.A., Nilsson M.-C., Zackrisson O., Gallet C. Determinants of litter mixing effects in a Swedish boreal forest // Soil Biology and Biochemistry. 2003. V. 35. P. 827–835.
Дополнительные материалы отсутствуют.


