Мембраны и мембранные технологии, 2022, T. 12, № 1, стр. 69-78
Исследование процесса получения диэтиламина из его соли методом биполярного электродиализа
Т. В. Карпенко a, *, Н. В. Ковалев a, Н. В. Шельдешов a, В. И. Заболоцкий a
a Кубанский государственный университет
350040 Краснодар, ул. Ставропольская, 149, Россия
* E-mail: tany1328@mail.ru
Поступила в редакцию 30.09.2021
После доработки 06.10.2021
Принята к публикации 08.10.2021
- EDN: DMKJVL
- DOI: 10.1134/S2218117222010047
Аннотация
Исследовано влияние концентраций растворов, расположенных по обе стороны от биполярной мембраны аМБ-2м в процессе получения диэтиламина и серной кислоты из сульфата диэтиламмония, на частотный спектр электрохимического импеданса биполярной мембраны аМБ-2м и на вольт-амперную характеристику мембраны Ralex AMH. Концентрации растворов практически не влияют на импеданс мембраны аМБ-2м и заметно влияют на вольт-амперную характеристику мембраны Ralex AMH. Определены технико-экономические характеристики электромембранного процесса получения диэтиламина и серной кислоты из сульфата диэтиламмония. Использование модифицированной биполярной мембраны аМБ-2м в сочетании с анионообменной гетерогенной мембраной Ralex AMH в электродиализном аппарате позволяет получать растворы диэтиламина с концентрацией около 0.5 моль-экв/л и серной кислоты с концентрацией около 0.9 моль-экв/л из 0.5 моль-экв/л сульфата диэтиламмония.
ВВЕДЕНИЕ
Необходимость получения аминов из их хлоридных солей для возврата в технологический цикл возникает при получении из хлоридов калия, аммония и натрия, калиевых и аммонийных солей фосфорной кислоты в качестве удобрений, гидрокарбоната натрия и карбонатных солей калия [1–3] . На стадии регенерации аминов при подщелачивании их солей используется гидроксид кальция, при этом в качестве побочного продукта образуется хлорид кальция. Регенерация аминов может проводиться и электрохимическим методом в электролизере с катионообменной мембраной. В этом случае образующиеся на катоде ионы гидроксила реагируют с протонированной формой амина, в результате чего образуется амин [1]. В этом методе дополнительные химические реагенты кроме хлорида щелочного металла не используются, а побочными продуктами являются газообразные водород и хлор, образующиеся на электродах.
С появлением биполярных ионообменных мембран [2–5], в которых диссоциация молекул воды в отличие от электрохимических систем не сопровождается выделением газообразных продуктов, появилась возможность проводить регенерацию неорганических и органических кислот, щелочей [6–10] и аминов. Круг задач, которые позволило решить применение электродиализа с биполярными мембранам для регенерации аминов из их солей существенно расширился. Было исследовано получение в электродиализных аппаратах с биполярным и мембранами пиридина и триэтаноламина [11], этилендиамина [12], этиленовых аминов [13]. Был разработан процесс улавливания из воздуха диметилизопропиламина, который используется для отверждения эпоксидных смол, и возврата его в технологический процесс [9, с. 28]. В [14] был предложен процесс выделения этаноламина из его соли, получаемой с помощью генномодифицированных организмов в ферментативном процессе. В [15] и [16] исследовались процессы выделения диоксида углерода и диоксида серы из топливных газов сорбцией их растворами этаноламина и пиперазина с последующей их регенерацией в электродиализном аппарате с биполярными мембранами и повторным использованием. В таких аппаратах на одну пару электродов приходится на порядки больше элементарных ячеек, чем при использовании электролизеров, вследствие чего расход дорогостоящих анодных материалов резко снижается.
Несмотря на обилие работ по получению кислот и щелочей с помощью электродиализа с биполярными мембранами, публикаций, посвященных получению аминов из их солей, немного, и в них не исследовано влияние прилегающих к биполярной и анионообменной мембранам растворов на их электрохимические характеристики.
Целью данной работы является исследование основных электрохимических характеристик биполярной мембраны, модифицированной фосфорнокислотным катионитом, и анионообменной мембраны, в зависимости от состава прилегающих к ним растворов при получении диэтиламина из его соли, а также основные характеристики процесса получения диэтиламина из сульфата диэтиламмония с помощью лабораторного электродиализатора с биполярными мембранами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исследуемой биполярной мембраны использовалась биполярная мембрана аМБ-2м, модифицированная фосфорнокислотным катионитом, полученная ранее авторами [17]. Биполярную мембрану получали методом горячего прессования катионообменной гетерогенной мембраны Ralex CMH и анионообменной гетерогенной мембраны Ralex AMH с предварительным нанесением на поверхность катионообменной мембраны фосфорнокислотного катализатора. Фосфорнокислотные группы, находясь в биполярной области мембраны [18], ускоряют реакцию диссоциации молекул воды и снижают напряжение на биполярной мембране.
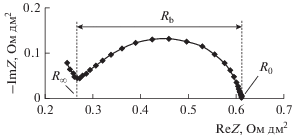
Электрохимические характеристики биполярной мембраны аMБ-2м были исследованы методом импедансной спектроскопии в четырехэлектродной электрохимической ячейке (рис. 1) по методике, описанной в [17, 19]. В качестве вспомогательных ионообменных мембран при измерении частотных спектров электрохимического импеданса использовались гетерогенные катионообменные мембраны Ralex CMH и анионообменные мембраны Ralex AMH. Измерения проводили в системе “раствор серной кислоты|раствор диэтиламина и сульфата диэтиламмония” в двух режимах: с различным соотношением концентраций диэтиламина (DEA) и сульфата диэтиламмония (DEAH2SO4) при постоянной концентрации серной кислоты и при различных концентрациях серной кислоты при постоянных концентрациях диэтиламина и сульфата диэтиламмония.
Рис. 1.
Схема электрохимической ячейки для измерения частотных спектров электрохимического импеданса биполярной мембраны. К – катионообменная мембрана Ralex CMH; А – анионообменная мембрана Ralex AMH; КА – исследуемая биполярная мембрана аМБ-2м; 1 и 4 – электроды, поляризующие исследуемую биполярную мембрану по постоянному и переменному току; 2 и 3 – потенциальные электроды для измерения разности потенциалов на мембране по переменному току.

Для определения значения предельного электродиффузионного тока анионообменной мембраны Ralex AMH при разных концентрациях диэтиламина и сульфата диэтиламмония были измерены динамические вольт-амперные характеристики мембраны. Исследование проводили в том же лабораторном электродиализаторе, в котором исследовался процесс получения диэтиламина (рис. 3).
Рис. 3.
Схема мембранного пакета электродиализного аппарата, предназначенного для получения диэтиламина и серной кислоты из раствора сульфата диэтиламмония. Сплошными стрелками показаны потоки ионов, переносимых через мембраны при пропускании через аппарат электрического тока. Пунктирными линиями показаны нежелательные процессы в мембранном пакете электродиализного аппарата.
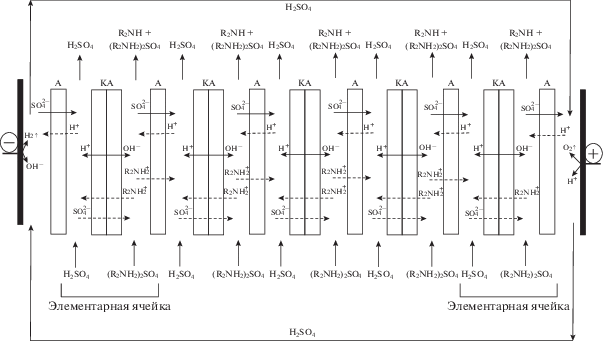
Мембранный пакет электродиализного аппарата содержал пять двухкамерных элементарных ячеек. Каждая элементарная ячейка электродиализатора включала в себя основно-солевую и кислотную камеры, образованные последовательно расположенными анионообменными мембранами Ralex AMH и биполярными мембранами аМБ-2м. Выбор такой конфигурации объясняется малой степенью диссоциации органических оснований, что приводит при использовании трехкамерной элементарной ячейки к малой электропроводности раствора в основной камере и большим энергозатратам процесса [7]. Совместное присутствие хорошо диссоциирующей соли амина и получаемого амина при использовании двухкамерной ячейки повышает электропроводность и снижает напряжение на аппарате, что позволяет снизить энергозатраты процесса [8].
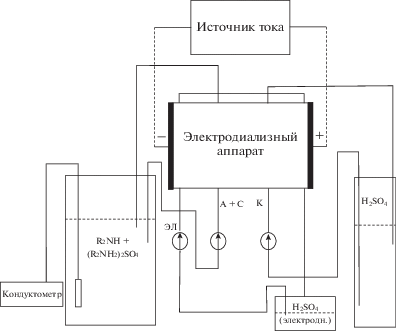
Рабочая площадь каждой мембраны и электрода равнялась 9 см2, расстояние между мембранами задавалось толщиной рамок и сетчатыми прокладками и составляло 1.2 мм. Гидравлическая схема (рис. 4) включала перистальтические насосы LOIP LS-301, обеспечивавшие независимую циркуляцию растворов через камеры электродиализатора с заданными скоростями. Линейная скорость циркуляции растворов через каждую камеру составляла 2.5 см/с.
Рис. 4.
Гидравлическая схема электродиализной установки, предназначенной для получения амина и серной кислоты из соли амина. ЭЛ – цикл раствора электродных камер, А + С – цикл основно-солевого раствора, К – цикл раствора кислоты.
При измерении динамических вольт-амперных характеристик и исследовании процесса получения диэтиламина в каждом гидравлическом цикле использовался стеклянный градуированный цилиндр для измерения объема раствора, циркулирующего через каждую камеру (объемы растворов в каждой камере и трубках, подводящих к электрохимической ячейке и отводящих растворы из нее, также учитывались).
При измерении динамических вольт-амперных характеристик для измерения разности потенциалов на анионообменной мембране Ralex AMH дополнительно по обе стороны от исследуемой мембраны на одинаковом расстоянии от ее поверхности располагали капилляры, соединенные через буферную емкость со стандартными хлорид-серебряными электродами. Измерения проводились в гальванодинамическом режиме в диапазоне плотностей токов от 0 до 3.3 А/дм2 при скорости сканирования 3.3 × 10–4 А/с и температуре 25 ± 2°С.
Электродиализный процесс получения диэтиламина и серной кислоты из сульфата диэтиламмония проводился в гальваностатическом режиме при плотностях тока равных 2, 2.5 и 3 А/дм2. Начальная концентрация сульфата диэтиламмония в солевом растворе была равна 0.5 моль-экв/л, концентрация серной кислоты – 0.1 моль-экв/л. Температура растворов соли с амином и кислоты в начале эксперимента равнялась 25°С, к концу эксперимента температура повышалась до 29–30°С.
Через определенные промежутки времени в течение всего эксперимента из емкостей с основно-солевым и кислотным растворами отбирались пробы для последующего анализа. Концентрации диэтиламина и сульфата диэтиламмония в основно-солевом растворе определяли по его удельной электропроводности и рН при температуре 25°С. Предварительно готовили серию калибровочных растворов с различным соотношением концентраций диэтиламина и сульфата диэтиламмония в растворах при их суммарной концентрации 0.5 моль-экв/л, измеряли электропроводность и рН этих растворов при температуре 25°С, строили калибровочные зависимости (рис. 5 и 6) и находили аппроксимирующие уравнения в виде полиномов.
Рис. 5.
Калибровочная зависимость концентрации сульфата диэтиламмония в присутствии диэтиламина при их суммарной концентрации 0.5 моль-экв/л от удельной электропроводности раствора, циркулирующего в основно-солевой камере электродиализатора.

Рис. 6.
Калибровочная зависимость логарифма отношения концентраций диэтиламина и сульфата диэтиламмония при их суммарной концентрации 0.5 моль-экв/л от рН раствора, циркулирующего в основно-солевой камере электродиализатора.
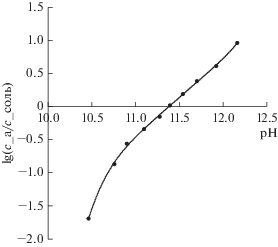
Вначале рассчитывали концентрацию сульфата диэтиламмония в основно-солевом растворе по его удельной электропроводности (рис. 5), а затем рассчитывали отношение концентраций диэтиламина и сульфата диэтиламмония по рН раствора (рис. 6) и далее – концентрацию диэтиламина.
Концентрации серной кислоты и сульфата диэтиламмония в пробах растворов, циркулирующих через кислотные камеры, определяли титрованием с помощью автоматического титратора Titroline 6000 по методике, описанной в [20].
По полученным зависимостям от времени количеств серной кислоты и диэтиламина в растворах, циркулирующих через камеры лабораторного электродиализатора, рассчитывали его основные технико-экономические характеристики в процессе получения диэтиламина и серной кислоты из сульфата диэтиламмония.
Интегральные выходы по току серной кислоты и диэтиламина η в электродиализном аппарате рассчитывались по формуле (1):
где I – ток, подаваемый на аппарат, А; Nяч – число элементарных ячеек в мембранном пакете электродиализного аппарата; n – количество полученной кислоты или амина, моль-экв; τ – время, прошедшее с начала эксперимента, с; F – постоянная Фарадея, 96 485 A c/моль.Интегральные удельные энергозатраты, необходимые для получения кислоты и амина, E рассчитывались по формуле (2):
(2)
$E = \frac{{\left( {{{U}_{{{\text{ЭДС - 1}}}}} - {{U}_{{{\text{эл}}{\text{.кам}}}}}} \right)F}}{{3600 \times {{{10}}^{3}}M\eta }},$Интегральные удельные производительности аппарата по серной кислоте и диэтиламину P рассчитывались по формуле (3):
где S – активная площадь каждой мембраны, м2.РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Из анализа полученных частотных спектров импеданса видно, что форма спектров биполярной мембраны аМБ-2м при всех плотностях тока в исследованном диапазоне частот примерно одинакова, а сопротивление биполярной области мембраны аМБ-2м с ростом приложенной плотности постоянного тока проходит через слабо выраженный максимум при плотности тока 0.009 А/дм2 и далее уменьшается с увеличением плотности тока (рис. 7).
Рис. 7.
Частотные спектры электрохимического импеданса биполярной мембраны аМБ-2м при плотностях тока 0–2.6 А/дм2 в системе “диэтиламин, сульфат диэтиламмония–серная кислота”.
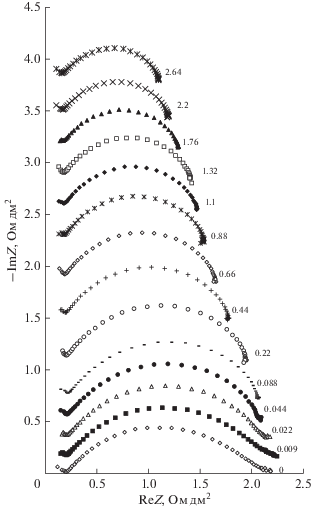
Увеличение сопротивления биполярной области при малых (0–0.009 А/дм2) токах связано с уменьшением концентрации подвижных ионов и увеличением толщины пространственного заряда на межфазной границе катионит|анионит [8, 21]. При плотности тока выше, чем 0–0.009 А/дм2, сопротивление уменьшается из-за повышения концентрации ионов H+ и OH– в области пространственного заряда и миграцией их из биполярной области мембраны в прилегающие к ней растворы кислоты и смеси диэтиламина и сульфата диэтиламмония.
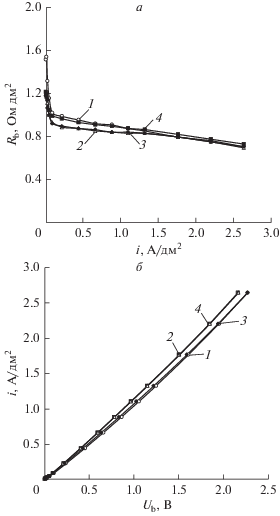
Для оценки области концентраций серной кислоты и диэтиламина и диапазона плотностей тока, в которых можно использовать биполярную мембрану аМБ-2м в процессах получения серной кислоты и диэтиламина из сульфата диэтиламмония, были рассчитаны зависимости сопротивления биполярной области мембраны от плотности тока и парциальные по перенапряжению вольт-амперные характеристики биполярной области от концентраций растворов, прилегающих к мембране. Концентрация серной кислоты, а также соотношение концентраций амина и его соли, практически не влияют на электрохимические характеристики биполярной мембраны аМБ-2м (рис. 8, 9), что позволяет сделать вывод о том, что ее можно использовать во всем диапазоне исследуемых концентраций раствора серной кислоты и раствора смеси диэтиламина с сульфатом диэтиламмония. Малая величина плотности тока, при котором наблюдается максимум на зависимости сопротивления биполярной области от плотности тока, свидетельствует о достаточно высокой селективности биполярной мембраны аМБ-2м в растворах, в которых она находится в процессе получения диэтиламина из сульфата диэтиламмония.
Рис. 8.
Зависимость сопротивления биполярной области мембраны от плотности тока (а) и парциальные по перенапряжению вольтамперные характеристики биполярной области (б) при разных концентрациях серной кислоты в системе “серная кислота | 0.25 моль-экв/л диэтиламин, 0.25 моль-экв/л сульфат диэтиламмония”, моль-экв/л: 1 – 0.25, 2 – 0.5, 3 – 0.75, 4 – 1.

Рис. 9.
Зависимость сопротивления биполярной области мембраны от плотности тока (а) и парциальные по перенапряжению вольт-амперные характеристики биполярной области (б) при разных соотношениях концентраций диэтиламина и его соли в системе “0.5 моль-экв/л H2SO4–диэтиламин, сульфат диэтиламмония”. 1 – 0.5 моль-экв/л DEAH2SO4, 2 – 0.375 моль-экв/л DEAH2SO4 и 0.125 моль-экв/л DEA, 3 – 0.25 моль-экв/л DEAH2SO4 и 0.25 моль-экв/л DEA, 4 – 0.125 моль-экв/л DEAH2SO4 и 0.375 моль-экв/л DEA.
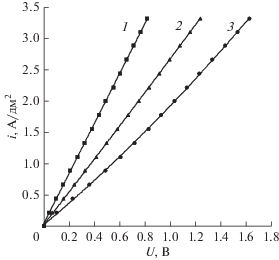
Анализ вольт-амперных характеристик анионообменной мембраны Ralex AMH показывает, что в области исследованных плотностей тока электродиффузионные предельные токи на мембране отсутствуют (рис. 10). Это означает, что на анионообменной мембране не должны развиваться дополнительные процессы, характерные для токов, превышающих предельный электродиффузионный ток, некоторые из которых приводят к ухудшению электрохимических характеристик мембраны [22]. Увеличение концентрации сульфата диэтиламмония снижает перенапряжение на мембране. Это объясняется тем, что при увеличении концентрации соли увеличивается необменная сорбция сульфата диэтиламмония мембраной, что ведет к уменьшению сопротивления мембраны.
Рис. 10.
Вольтамперные характеристики анионообменной мембраны Ralex AMH при разных соотношениях концентраций диэтиламина и его соли в системе “0.5 моль-экв/л H2SO4–диэтиламин, сульфат диэтиламмония”. 1 – 0.5 моль-экв/л DEAH2SO4, 2 – 0.25 моль-экв/л DEAH2SO4 и 0.25 моль-экв/л DEA, 3 – 0.025 моль-экв/л DEAH2SO4 и 0.475 моль-экв/л DEA.
Под действием электрического тока в элементарной ячейке электродиализного аппарата (рис. 3) протекают процессы, приводящие к образованию диэтиламина и серной кислоты. Вследствие переноса через анионообменный слой биполярной мембраны в основно-солевую камеру иона гидроксила, возникающего в результате диссоциации молекул воды в биполярной области, образуется молекула диэтиламина (уравнение (4)):
(4)
${{\left( {{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}}} \right)}_{{\text{2}}}}{\text{NH}}_{2}^{ + } + {\text{O}}{{{\text{H}}}^{ - }} \to {{\left( {{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{5}}} \right)}_{2}}{\text{NH}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}}$Через анионообменную мембрану в кислотную камеру переносится сульфат-анион, который совместно с поступающим из катионообменного слоя биполярной мембраны катионом водорода образует серную кислоту (уравнение (5)):
(5)
$2{{{\text{H}}}^{ + }} + {\text{SO}}_{4}^{{2 - }} \to {{{\text{H}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{4}}.$Сравнение зависимостей концентраций растворов от времени работы электродиализного аппарата в процессе получения диэтиламина и серной кислоты из сульфата диэтиламмония показывает, что концентрации диэтиламина (рис. 11a) и серной кислоты (рис. 12) со временем растет, а концентрация сульфата диэтиламмония уменьшается в основно-солевой камере (рис. 11a). Завершение процесса электродиализной конверсии сульфата диэтиламмония в диэтиламин подтверждается зависимостью удельной электропроводности в основно-солевой камере от времени работы электродиализного аппарата (рис. 11б). Удельная электропроводность снижается при всех плотностях тока до значения, близкого к удельной электропроводности раствора чистого амина.
Рис. 11.
Зависимость концентраций диэтиламина (1, 2, 3) и сульфата диэтиламмония (1', 2 ', 3 ') (а) и зависимость удельной электропроводности (б) в растворе, циркулирующем через основно-солевые камеры электродиализатора c биполярными мембранами аМБ-2м от времени его работы при разных плотностях тока: 1, 1' – 2 А/дм2, 2, 2' – 2.5 А/дм2, 3, 3' – 3 А/дм2. Сплошными линиями показаны аппроксимирующие кривые.

Рис. 12.
Зависимость концентраций серной кислоты (1, 2, 3) и сульфата диэтиламмония (1', 2 ', 3 ') в растворе, циркулирующем через кислотные камеры электродиализатора c биполярными мембранами аМБ-2м от времени его работы при разных плотностях тока: 1, 1' – 2 А/дм2, 2, 2 ' – 2.5 А/дм2, 3, 3 ' – 3 А/дм2. Сплошными линиями показаны аппроксимирующие кривые.

При увеличении плотности тока на электродиализном аппарате процесс получения диэтиламина и серной кислоты из сульфата диэтиламмония происходит интенсивнее, что подтверждается увеличением наклона зависимости концентраций соли, амина, кислоты и электропроводности основно-солевого раствора от времени работы электродиализного аппарата (рис. 11, 12).
Загрязнение получаемого раствора серной кислоты катионами диэтиламмония растет с увеличением концентрации получаемой серной кислоты (рис. 12), при этом содержание катионов диэтиламмония не превышает 5%. Присутствие солевых ионов в кислотной камере вызвано диффузией амина через анионообменный слой биполярной мембраны, а также диффузией амина и соли амина через анионообменную мембрану в раствор серной кислоты.
Интегральные выходы по току серной кислоты и диэтиламина уменьшаются с ростом их концентрации, а также с уменьшением плотности тока (рис. 13, 14). В случае серной кислоты снижение связано в большей степени с миграцией иона водорода через анионообменную мембрану и в меньшей степени с миграцией сульфат-аниона через биполярную мембрану. Снижение выхода по току диэтиламина связано не только с его переносом в камеру с кислотой, но и с его протонированием ионами водорода, мигрирующими через анионообменную мембрану из кислотной в основно-солевую камеру.
Рис. 13.
Зависимость интегральных выходов по току серной кислоты от концентрации при разных плотностях тока: 1 – 3 А/дм2, 2 – 2.5 А/дм2, 3 – 2 А/дм2. Сплошными линиями показаны аппроксимирующие кривые.

Рис. 14.
Зависимость интегральных выходов по току диэтиламина от концентрации при разных плотностях тока: 1 – 3 А/дм2, 2 – 2.5 А/дм2, 3 – 2 А/дм2. Сплошными линиями показаны аппроксимирующие кривые.

Интегральные удельные энергозатраты (табл. 1) возрастают с увеличением концентраций получаемых диэтиламина и кислоты. Это увеличение не связано со снижением концентрации соли диэтиламина, являющейся сильным электролитом, и с увеличением концентрации слабо диссоциирующего диэтиламина в основно-солевой камере, которое должно приводить к увеличению напряжения на ней, так как напряжение на электродиализном аппарате незначительно снижается в течение всего процесса. Это снижение вызвано более быстрым снижением напряжения на кислотной камере при увеличении в ней концентрации серной кислоты, чем увеличением напряжения на основно-солевой камере. Еще одной причиной возрастания удельных энергозатрат является уменьшение выхода по току амина и кислоты (формула (2)) с возрастанием их концентраций в растворах. Снижение выхода по току (формула (3)) с увеличением концентраций амина и кислоты в растворах вызывает уменьшение интегральной удельной производительности по серной кислоте и диэтиламину (табл. 1).
Таблица 1.
Интегральные удельные энергозатраты и интегральные удельные производительности электродиализатора по серной кислоте и диэтиламину от концентраций получаемых веществ и плотности тока
| c, моль-экв/л | E, кВт ч/кг | P, кг/(ч м2) | |||||
|---|---|---|---|---|---|---|---|
| 2 А/дм2 | 2.5 А/дм2 | 3 А/дм2 | 2 А/дм2 | 2.5 А/дм2 | 3 А/дм2 | ||
| H2SO4 | 0.20 | 16.3 | 12.8 | 13.4 | 0.28 | 0.46 | 0.58 |
| 0.60 | 17.5 | 14.1 | 15.7 | 0.23 | 0.37 | 0.47 | |
| 1.00 | 21.8 | 18.9 | 20.6 | 0.18 | 0.28 | 0.27 | |
| ДЭА | 0.15 | 19.2 | 16.8 | 15.4 | 0.23 | 0.33 | 0.49 |
| 0.30 | 20.5 | 17.4 | 17.0 | 0.19 | 0.3 | 0.43 | |
| 0.45 | 29.3 | 19.4 | 20.1 | 0.14 | 0.27 | 0.37 | |
Ранее исследуемая биполярная мембрана аМБ-2м изучалась в процессах получения серной [17] и азотной [23] кислот из сульфата натрия и нитрата натрия соответственно. Было показано, что модифицированная биполярная мембрана аМБ-2м имеет близкие к лучшей по перенапряжению промышленной биполярной мембране МБ-3 вольт-амперные характеристики. При этом мембрана аМБ-2м имеет явные преимущества перед мембраной МБ-3 в процессе получения кислоты и щелочи. Использование биполярной мембраны аМБ-2м в электродиализном аппарате позволяет получать кислоты и гидроксид натрия с более высокими концентрациями, выходами по току и удельной производительностью, чем в случае использования промышленных мембран MB-3. Это связано с тем, что исследуемая биполярная мембрана аМБ-2м имеет более низкие в сравнении с промышленными российскими гетерогенными биполярными мембранами MB-3 эффективные числа переноса коионов соли и более высокие числа переноса ионов водорода и гидроксила.
Таким образом, характеристики процесса получения диэтиламина из сульфата диэтиламмония при использовании биполярной мембраны аМБ-2м в электродиализном аппарате должны превосходить характеристики процесса при использовании промышленных мембран MB-3.
ЗАКЛЮЧЕНИЕ
Исследовано влияние концентраций растворов, расположенных по обе стороны от биполярной мембраны аМБ-2м в процессе получения диэтиламина и серной кислоты из сульфата диэтиламмония, на электрохимические характеристики биполярной мембраны аМБ-2м. Концентрации серной кислоты и соотношение концентраций диэтиламина и сульфата диэтиламмония слабо влияют на сопротивление и перенапряжение на биполярной области мембраны аМБ-2м. Отношение концентраций амина и его соли при их суммарной концентрации 0.5 моль-экв/л влияет на вольт-амперную характеристику мембраны Ralex AMH. С увеличением концентрации амина в растворе напряжение на мембране возрастает из-за снижения концентрации сорбированных ионов в фазе мембраны и увеличения ее сопротивления.
Определены технико-экономические характеристики электромембранного процесса получения диэтиламина и серной кислоты из сульфата диэтиламмония. Использование модифицированной биполярной мембраны аМБ-2м в сочетании с анионообменной гетерогенной мембраной Ralex AMH в электродиализном аппарате позволяет получать растворы диэтиламина с концентрацией около 0.5 моль-экв/л и серной кислоты с концентрацией около 0.9 моль-экв/л из 0.5 моль-экв/л сульфата диэтиламмония.
Список литературы
Мазунин С.А., Чечулин В.Л. // Журн. прикл. химии. 2010. V. 87. P. 170.
Гринь Г.И., Панасенко В.В., Бондаренко Л.Н., Федорченко Т.В., Синческул А.Л., Дейнека Д.Н., Адаменко С.Ю. // Труды БГТУ. 2016. № 3. С. 115–121.
Бобокулов А.Н., Эркаев А.У., Тоиров З.К. // Universum: химия и биология : электрон. научн. журн. 2017. № 10 (40). URL: https://7universum.com/ru/nature/archive/item/5168 (дата обращения: 04.08.2021).
Львов А.В., Фиошин М.Я., Соловьев Г.С., Крашенинников С.А., Греф Т.С., Беглова А.В., Шиллер Д., Ильин Б.А., Антипов В.Н., Боввен В.С., Юрков Л.И., Родионов А.И., Преснов А.Е., Барыбин В.Н., Реморов Б.С., Осетров Н.Ф., Касаткина И.И. А.с. СССР № 1 047 835. // Бюл. изобр. 1983. № 38.
Frilette V.J. // J. Phys. Chem. 1956. V. 60. P. 435.
Nagasubramanian P.K., Chlanda F.P., Liu K.J. // J. Membr. Sci. 1977. V. 2. P. 109.
Гребень В.П., Пивоваров Н.Я., Коварский Н.Я. Нефедова Г.З. // Журн. физ. химии. 1978. Т. 52. С. 2641.
Simons R. // J. Membr. Sci. 1993. V. 78. P. 13.
Kemperman A.J.B. Ed. Handbook on Bipolar Membrane Technology. Twente University Press, Enschede. 2000.
Пурселли Ж. // Электрохимия. 2002. Т. 38. С. 1026.
Шельдешов Н.В., Заболоцкий В.И. Биполярные ионообменные мембраны. Получение. Свойства. Применение. В кн: Мембраны и мембранные технологии (ред. Ярославцев А.Б.). M.: Научный Мир, 2013. С. 70.
Strathmann H., Grabowski A., Eigenberger G. // Ind. Eng. Chem. Res. 2013. V. 52(31). P. 10364.
Y. Tanaka. Ion Exchange Membranes. Fundamentals and Applications, 2nd Edition. Elsevier Science. 2015. 522 p.
Брикенштейн М.А., Крыщенко К.И., Царев В.Н., Ефимов О.Н. // Хим. пром-сть. 1975. № 3. С. 178.
Chang Y. // J. Appl. Electrochem. 1979. V. 9. P. 731.
Гребень В.П., Пивоваров Н.Я., Четверикова А.Т., Родзик И.Г. // Журн. прикл. химии. 1993. Т. 66. С. 574.
De Groot M.T., de Rooij R.M., Bos A.A.C.M., Bargeman G. // J. Membr. Sci. 2011. V. 378. P. 415.
Xu T., Huang C. // AIChE J. 2008. V. 54. P. 3147.
Jiang Ch., Li Sh., Zhang D., Yang Zh., Yu D., Chen X., Wang Y., Xu T. // Chem. Eng. J. 2019. V. 360. P. 654.
Ковалев Н.В., Карпенко Т.В., Шельдешов Н.В., Заболоцкий В.И. // Мембраны и мембранные технологии. 2021. Т. 11. С. 263.
Шельдешов Н.В., Заболоцкий В.И., Письменская Н.Д., Гнусин Н.П. // Электрохимия. 1986. Т. 22. С. 791.
Шельдешов Н.В., Заболоцкий В.И., Беспалов А.В., Ковалев Н.В., Алпатова Н.В., Акимова А.В., Мочалова Т.В., Ковалева В.И., Боярищева А.Ю. // Мембраны и мембранные технологии. 2017. Т. 7. С. 187.
Шельдешов Н.В., Заболоцкий В.И., Карпенко Т.В., Ковалев Н.В. // Мембраны и мембранные технологии. 2020. Т. 10. № 3. С. 198.
Умнов В.В., Шельдешов Н.В., Заболоцкий В.И. // Электрохимия. 1999. Т. 35. С. 411.
Заболоцкий В.И., Никоненко В.В. Перенос ионов в мембранах. М.: Наука, 1996. 392 с.
Sheldeshov N.V., Zabolotsky V.I., Kovalev N.V., Karpenko T.V. // Sep. Purif. Technol. 2020. V. 241. 116 648
Дополнительные материалы отсутствуют.
Инструменты
Мембраны и мембранные технологии