Мембраны и мембранные технологии, 2022, T. 12, № 5, стр. 351-364
Теоретическое и экспериментальное исследование нейтрализационного диализа эквимолярной смеси фенилаланина и минеральной соли при ее различной концентрации
М. В. Порожный a, *, А. Э. Козмай a, А. А. Мареев a, В. В. Гиль a
a ФГБОУ ВО Кубанский государственный университет
350040 Краснодар, Россия
* E-mail: porozhnyj@mail.ru
Поступила в редакцию 10.05.2022
После доработки 04.06.2022
Принята к публикации 09.06.2022
- EDN: QQYLHJ
- DOI: 10.31857/S221811722205008X
Аннотация
Предложена нестационарная математическая модель процесса разделения раствора аминокислоты (фенилаланина) и минеральной соли (NaCl) методом нейтрализационного диализа (НД), осуществляемого в циркуляционном гидродинамическом режиме. Модель учитывает характеристики мембран (толщину, обменную емкость и электропроводность) и раствора (концентрацию и природу компонентов), а также скорость потока раствора в камерах диализатора. В отличие от известных моделей новая модель учитывает перенос катионов и анионов фенилаланина через мембраны и диффузионные слои системы НД. Кроме того, модель учитывает способность аминокислоты вступать в реакции протонирования/депротонирования. Сопоставление результатов моделирования с экспериментальными данными позволяет сделать вывод, что модель адекватно описывает НД растворов смеси фенилаланина и NaCl. Показано, что для заданной пары мембран (катионообменной мембраны CSE и анионообменной мембраны ASE, Astom, Япония) и исследованных концентраций, рН смешанного раствора остается сравнительно низким в течение всего процесса, а скорость снижения электропроводности оказывается меньше по сравнению с индивидуальным раствором NaCl. На основе анализа экспериментальных данных и результатов моделирования проведена оценка потерь фенилаланина в процессе НД.
1. ВВЕДЕНИЕ
Важным условием устойчивого развития мирового сообщества является применение возобновляемых источников сырья и энергии. К наиболее перспективным путям обеспечения этого условия относятся разработка технологий ферментативной переработки и извлечения ценных компонентов из биомассы [1], а также из сточных вод и отходов пищевых, фармацевтических и химических производств [2]. Наиболее дорогостоящими из выделяемых веществ являются пептиды и аминокислоты, обладающие антираковой, антидиабетной, иммуномодулирующей активностью [3], традиционно получаемые путем ферментативного гидролиза белков. Такие вещества являются амфолитами, химическое строение и электрический заряд которых зависят от pH среды вследствие их способности участвовать в реакциях протонирования-депротонирования. Очистка этих веществ от минеральных примесей, их концентрирование, а также селективное разделение близких по характеристикам амфолитов на практике представляют собой достаточно сложную задачу.
Особенно привлекательным для деминерализации, концентрирования, фракционирования амфолитов [4] является применение ионообменных мембран (ИОМ) в составе электродиализных [5–8], диализных [9], электрофоретических модулей [10] или гибридных биомембранных реакторов [11], а также комбинированных установок с ультрафильтрационными и ионообменными мембранами (электроультрафильтрация) [12, 13], т. к. позволяет использовать для разделения не только различие в подвижности частиц, но и в знаке и величине их электрического заряда.
Диализ является одним из наиболее простых в техническом исполнении мембранных методов разделения. Ключевым моментом разделения и очистки амфолитов при их диализной переработке является необходимость контроля рН этих растворов, что невозможно без добавления соответствующих реагентов. Чтобы обеспечить минимальные потери амфолита в процессе его очистки от минеральных примесей, в межмембранном пространстве камеры обессоливания необходимо поддерживать значения pH, при которых весь амфолит находится в молекулярной или цвиттер-ионной форме.
Современные фундаментальные исследования в области очистки и разделения амфолит-содержащих растворов методами диализа в основном направлены на изучение механизмов переноса амфолитов и сильных электролитов через ионообменные мембраны и примембранные слои раствора. Из достаточно ограниченного числа работ, посвященных этой теме, следует, что отличия в массообменных характеристиках мембранных модулей в случае сильных электролитов и амфолитов, в основном, связывают со способностью амфолитов к образованию крупных заряженных ассоциатов [14], а также с химическими взаимодействиями их различных форм с H+ (OH–) ионами, например, введенными в раствор путем добавления химических реагентов [15]. Если такие взаимодействия имеют место, возникает эффект облегчённой диффузии [16–19]. Этот эффект заключается, например, в приобретении цвиттер-ионом аминокислоты заряда, противоположного заряду фиксированных групп мембраны, что позволяет аминокислоте легко проходить через мембрану в качестве противоиона.
Возможность управления значением рН раствора в камере обессоливания диализатора без внесения реагентов достигается путем применения нейтрализационного диализа (НД) – комбинации двух процессов доннановского обменного диализа, когда ионы Н+ и ОН– проникают через катионообменную мембрану (КОМ) и анионообменную мембрану (АОМ), соответственно, обмениваясь с ионами электролита, в камеру обессоливания, где происходит их рекомбинация с образованием молекул воды.
Величину потоков ионов при НД можно контролировать путем варьирования как свойств мембран (толщина, значение обменной емкости, степень сшивки матрицы, природа функциональных групп), так и параметров процесса (концентрации растворов кислоты, щелочи, соли в кислотной, щелочной камерах и камере обессоливания, соответственно; скорости прокачки растворов в соответствующих камерах) [20–23]. Поступление ионов H+ и OH– в камеру обессоливания может обеспечить изменение заряда амфолита в межмембранном пространстве без добавления буферных растворов. Этот аспект особенно важен для фармакологических, биохимических приложений и пищевой промышленности, где внесение дополнительных реагентов резко ухудшает качество получаемых продуктов. В отличие от электродиализа, где изменение рН раствора возможно путем задания соответствующего токового режима при плотностях тока выше предельного (когда на межфазной границе мембрана/раствор происходит генерация ионов H+ и OH–), НД позволяет осуществлять процесс деминерализации амфолит-содержащих растворов с возможностью контролируемого изменения рН в камере обессоливания в более “мягких” условиях без приложения электрического поля. Из-за отсутствия внешнего электрического поля в процессе НД отсутствуют индуцированные протеканием электрического тока сопряженные эффекты концентрационной поляризации (например, генерация Н+ и ОН– ионов, электроконвекция), что облегчает экспериментальное и теоретическое изучение процессов переноса. Однако, заранее предсказать эффект от изменения того или иного параметра весьма сложно, если нет адекватной математической модели, с помощью которой можно было бы оценивать соответствующие эффекты. Проблема управления рН обессоливаемого амфолит-содержащего раствора в процессе НД возникает из-за большого количества параметров, влияющих на рН.
В области моделирования переноса ионов в похожих процессах, таких как диализ, электродиализ и обратный электродиализ, существуют как одномерные нестационарные (аналитические и численные) [24, 25], так и численные двумерные стационарные модели [26, 27]. Однако, особенностью этих моделей является описание переноса только через одну мембрану, что не позволяет перенести результаты этих исследований на систему НД.
Поведение мембранных систем в растворах амфолитов не удаётся описать с использованием модельных представлений, развитых применительно к сильным электролитам (NaCl) [28]. Во многом это связано с математическими трудностями, которые вызваны необходимостью учитывать транспорт большого количества взаимодействующих между собой частиц, а также сопряжение потоков этих частиц в мембране, на границе мембрана/раствор и в прилегающих к мембране диффузионных слоях.
Попытка смоделировать процесс деминерализации амфолит-содержащего раствора (смесь фенилаланина и хлорида натрия) в процессе НД предпринята в работе [29]. В модели предполагается, что частицы амфолита не переносятся через мембраны (коэффициенты диффузии частиц амфолита как минимум на порядок ниже коэффициентов диффузии ионов сильного электролита в мембранах), но могут вступать в реакции протонирования-депротонирования с ионами H+ и OH–, поступающими в камеру обессоливания через КОМ и АОМ, соответственно. Было показано, что участие фенилаланина в реакциях протонирования-депротонирования придавало буферное свойство смешанному раствору хлорида натрия и аминокислоты. Это позволило избежать колебаний pH раствора в камере обессоливания, а также колебаний потоков ионов соли через мембраны. Однако, данная модель не позволяет оценить потери амфолита в процессе обессоливания амфолит-содержащего раствора, а также описать механизмы транспорта частиц амфолита через мембраны в процессе НД.
В данной работе проведено экспериментальное и теоретическое исследование процесса НД смеси фенилаланина и минеральной соли в циркуляционном режиме. В отличие от известных моделей [29–31], новая модель учитывает изменения концентрации ионов минеральной соли (NaCl) и частиц фенилаланина (в форме катиона, аниона и цвиттер-иона) в камере обессоливания и перенос заряженных форм фенилаланина через мембраны и диффузионные слои. Также учтена способность аминокислоты в камере обессоливания системы НД изменять свой электрический заряд за счет реакций протонирования/депротонирования. Разработанная нестационарная модель учитывает основные практически важные характеристики мембран (толщина, обменная емкость и электропроводность) и растворов (концентрации, коэффициенты диффузии компонентов и константы равновесия реакций протолиза), а также скорость течения растворов в камерах диализатора.
2. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
2.1. Исследуемые мембраны
Исследованы новые коммерческие мембраны производства ASTOM (Япония): сильнокислотная мембрана CSE и сильноосновная мембрана ASE, структурные характеристики которых не раскрываются производителем. Основные свойства исследуемых мембран, полученные в рамках данной работы, представлены в табл. 1.
Таблица 1.
Основные свойства исследуемых мембран
| Свойства мембран | ASE | CSE |
|---|---|---|
| Обменная емкость, ммоль см–3 | 1.99 | 1.85 |
| Влагосодержание, % | 24.4 | 42.0 |
| Плотность, г см–3 | 1.03 | 1.17 |
| Электрическая проводимость (в 0.1 М NaCl), мСм см–1 | 3.77 | 7.37 |
| Электрическая проводимость (в 0.1 М Phe), мСм см–1 | 2.32 (pH 13.1) | 5.67 (pH 0.5) |
| Электрическая проводимость (в 0.1 М NaOH), мСм см–1 | 6.76 | – |
| Электрическая проводимость (в 0.1 М HCl), мСм см–1 | – | 71.12 |
| Толщина в набухшем состоянии, мкм | 150 | 139 |
2.2. Характеризация мембран
Электрическая проводимость. Значения электрической проводимости мембран были получены разностным методом [32] посредством определения сопротивления мембран с использованием лабораторной ячейки-пинцета и измерителя иммитанса MT4080A (MOTECH) при частоте переменного тока 1 кГц.
Влагосодержание. Перед определением влагосодержания образцы уравновешивали с деионизованной водой. Затем образец извлекали и удаляли избытки влаги с поверхности мембраны фильтровальной бумагой. Для измерения массы набухшего образца, mн, и массы сухого образца, mс, использовался анализатор влагосодержания MB25 (Ohaus). Доведение образца до сухого состояния осуществлялось при температуре 100°С для катионообменной мембраны и 80°С для анионообменной мембраны до тех пор, когда масса исследуемого образца переставала меняться. Влагосодержание мембраны, W (%), рассчитывалось следующим образом:
Плотность. Плотность ионообменных мембран определяли методом гидростатического взвешивания. Образец набухшей мембраны помещали на чашку весов, погруженную в воду. После измерения массы мембраны в воде, mw, образец извлекали, с поверхности удаляли избыток влаги фильтровальной бумагой и определяли массу набухшего образца в воздушной среде, mн. Значение истинной плотности мембраны в набухшем состоянии, ρмб, находили по формуле:
(2)
${{\rho }_{{{\text{мб}}}}} = \frac{{{{m}_{{\text{н}}}}}}{{{{m}_{{\text{н}}}} - {{m}_{w}}}} \times 0.998.$Обменная емкость. Для определения обменной емкости катионообменной мембраны образец известной массы, приведенный в H+ форму, выдерживали в 100 мл 0.1 н раствора гидроксида натрия в течение 1 ч. После чего от раствора над мембраной отбирали 25 мл, добавляли несколько капель смешанного индикатора и титровали 0.1 н раствором соляной кислоты до перехода окраски от синей к зеленой. Обменную емкость мембраны, Q, в ммоль г–1 определяли, используя следующую формулу:
где V – точный объем израсходованного на титрование раствора соляной кислоты 0.1 н.Для определения обменной емкости анионообменной мембраны образец известной массы, приведенный в Cl– форму, выдерживали в 1 н растворе нитрата калия объемом 250 мл в течение 12 ч в колбе с плотно притертой крышкой. После чего количество замещенных ионов хлора определяли титрованием по методу Мора с использованием 0.01 н раствора AgNO3 до появления бурого оттенка.
2.3. Процесс нейтрализационного диализа
Нейтрализационный диализ проводили в трехкамерной диализной ячейке, состоящей из кислотной и щелочной камер, а также камеры обессоливания, разделенных катионообменной мембраной (КОМ) и анионообменной мембраной (АОМ) (рис. 1). Площадь активной поверхности мембран составляла 7.29 см2 (2.7 см × 2.7 см), межмембранное расстояние и толщина каждой камеры составляли 0.6 см. Все камеры ячейки имеют специальные устройства ввода и вывода раствора, что обеспечивает ламинарный поток в каждой из них. Это позволяет прогнозировать толщину диффузионного слоя с обеих сторон исследуемых мембран, используя конвективно-диффузионную модель [33]. С использованием перистальтических насосов растворы прокачивались через камеры ячейки, линейная скорость протока растворов в каждой камере составляла 1.5 см с–1. Через кислотную и щелочную камеры циркулировали 2 л 0.1 н раствора HCl и 2 л 0.1 н раствора NaOH, соответственно. Через камеру обессоливания прокачивали 0.5 л исследуемого раствора NaCl различной концентрации (0.005, 0.02, 0.05 М) или смешанного раствора NaCl и Phe (фенилаланина), содержащего растворенные компоненты в эквимолярном соотношении (0.005 М NaCl + 0.005 М Phe, 0.02 М NaCl + 0.02 М Phe, 0.05 М NaCl + 0.05 М Phe). Исходное значение pH смешанного раствора NaCl + Phe находилось в диапазоне значений 5.2–5.4, что близко к значению изоэлектрической точки Phe (pI = 5.76). Такие условия (согласно оценкам по уравнениям (13)–15) в разделе Математическая модель) обеспечивают мольную долю цвиттер-ионной формы Phe в смешанном растворе в диапазоне от 99.89 до 99.92%. Для оценки потери Phe в процессе НД его концентрация в обессоливаемом растворе определялась спектрофотометрическим методом на Cпектрофотометре УФ-1800 (ТМ ЭКОВЬЮ, Shanghai Mapada Instruments Co., Ltd.) при длине волны 259 нм.
Рис. 1.
Схема экспериментальной установки: трехкамерная диализная ячейка (1), состоящая из камеры обессоливания, кислотной и щелочной камер; емкости с кислотой (2), щелочью (3), обессоливаемым раствором (4); кондуктометрический датчик (5); pH-электрод (6); кондуктометр (7) и pH-метр (8), подключенные к ПК.

В процессе нейтрализационного диализа осуществлялся контроль pH и электропроводности обессоливаемого раствора посредством pH-метра Эксперт-001 и кондуктометра Эксперт-002 (ООО “Эконикс-Эксперт”, Россия). Эксперименты проводились при температуре 25.0 ± 0.5°С.
3. ТЕОРИЯ
3.1. Математическая модель
Исследуемая система состоит из трех камер: кислотной (A), щелочной (B) и камеры обессоливания (D), разделенных между собой катионообменной и анионообменной мембранами (рис. 2). Каждый из трактов, образованных соответствующими камерами вместе с элементами гидравлической системы (трубки, промежуточные емкости), имеет объемы VA, VB и VD для кислотной, щелочной камер и камеры обессоливания, соответственно. Растворы кислоты (HCl), щелочи (NaOH) и соли (NaCl) или смешанный раствор (NaCl + Phe) циркулируют через камеры A, B и D, соответственно, и через промежуточные емкости. Предполагается, что толщины диффузионных пограничных слоев (ДПС), прилегающих к поверхностям мембран, равны между собой. Это предположение обусловлено одинаковыми во всех камерах гидродинамическими условиями. Предполагается, что концентрации всех ионов практически не изменяются вдоль камеры обессоливания, что обусловлено малой длиной камер в ячейке диализатора, высокой скоростью протока раствора и малым временем прохождения раствора через камеру (около 2 с). Таким образом, концентрации ионов в любой момент времени одинаковы как в объеме камеры, так и в соответствующей промежуточной емкости.
Рис. 2.
Схема моделируемой системы. ДПС1 и ДПС2 – диффузионные пограничные слои, прилегающие к КОМ со стороны камер А и D, соответственно; ДПС3 и ДПС4 – диффузионные пограничные слои, прилегающие к АОМ со стороны камер D и B, соответственно; индексы 1, 2, 3 и 4 обозначают границы КОМ и АОМ с соответствующими камерами.

Были рассмотрены два случая НД. В первом случае проводилось обессоливание индивидуального раствора NaCl, при котором постановка задачи имеет такой же вид, как и в статье [22], за исключением учета в данной работе ДПС около КОМ и АОМ со стороны кислотной и щелочной камер, соответственно. Во втором случае обессоливался смешанный раствор NaCl + Phe. В отличие от упрощения, использованного в работе [29], концентрация фенилаланина в тракте обессоливания меняется в ходе процесса НД, т.е. учитывается транспорт заряженных форм фенилаланина через мембраны и прилегающие диффузионные слои. На границах раздела мембрана/раствор предполагается локальное термодинамическое равновесие между обмениваемыми ионами. В камерах системы и в мембранах предполагается локальное равновесие реакций протолиза аминокислоты и воды.
Электродиффузионный перенос ионов в мембранах и ДПС описывается следующими уравнениями:
– уравнение Нернста–Планка
(4)
${{J}_{j}} = - {{D}_{j}}\left( {\frac{{\partial {{C}_{j}}}}{{\partial x}} + {{z}_{j}}{{C}_{j}}\frac{F}{{RT}}\frac{{\partial \varphi }}{{\partial x}}} \right),$– условие электронейтральности
– условие протекания тока (нулевого тока в случае НД)
– уравнение материального баланса
Здесь ${{C}_{j}},$ ${{J}_{j}},$ ${{z}_{j}},$ ${{D}_{j}}$ – концентрация, плотность потока, заряд, коэффициент диффузии иона j, соответственно; $X$ – обменная емкость мембраны, ω – коэффициент, который принимает значения –1, +1 и 0 для АОМ, КОМ и раствора, соответственно; t – время; x – координата вдоль транспортной оси перпендикулярно поверхности мембраны; R, T и F – газовая постоянная, температура и постоянная Фарадея, соответственно. В камере D j = H+, OH–, Na+, Cl–, Phe+, Phe–, Phe±; в камере A и КОМ j = H+, Na+, Phe+; в камере B и АОМ j = OH–, Cl–, Phe–.Здесь и далее по тексту цвиттер-ион (${}^{ + }{\text{N}}{{{\text{H}}}_{3}} - {\text{CH}}\left( {{\text{C}}{{{\text{H}}}_{{\text{2}}}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{5}}}}} \right) - {\text{CO}}{{{\text{O}}}^{ - }}$), катион(+NH3–${\text{CH}}\left( {{\text{C}}{{{\text{H}}}_{{\text{2}}}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{5}}}}} \right) - {\text{COOH}}$) и анион (NH2–${\text{CH}}\left( {{\text{C}}{{{\text{H}}}_{{\text{2}}}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{5}}}}} \right) - {\text{CO}}{{{\text{O}}}^{ - }}$) фенилаланина обозначены как Phe±, Phe+ и Phe− соответственно.
Равновесие между ионами H+, OH– и молекулами воды в растворе описывается уравнением:
(8)
${{K}_{w}} = {{С}_{{\text{H}}}}{{C}_{{{\text{OH}}}}} = {{10}^{{ - 14}}}\,\,{\text{мол}}{{{\text{ь}}}^{2}} \cdot {{{\text{л}}}^{{ - 2}}}.$Фенилаланин (2-амино-3-фенилпропановая кислота) вступает в реакцию протолиза:
(9)
${\text{Ph}}{{{\text{e}}}^{ + }} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \leftrightarrow {\text{Ph}}{{{\text{e}}}^{ \pm }} + {{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}^{ + }},$(10)
${\text{Ph}}{{{\text{e}}}^{ \pm }} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \leftrightarrow {\text{Ph}}{{{\text{e}}}^{ - }} + {{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}^{ + }}.$Константы химического равновесия реакций (9), ${{K}_{1}},$ и (10), ${{K}_{2}},$ при 25°C равны
(11)
${{K}_{1}} = \frac{{\left[ {{\text{Ph}}{{{\text{e}}}^{{{ \pm }}}}} \right]\left[ {{{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}^{{\text{ + }}}}} \right]}}{{\left[ {{\text{Ph}}{{{\text{e}}}^{{\text{ + }}}}} \right]}} = 6.31 \times {{10}^{{ - 3}}}\,\,{\text{моль}} \cdot {{{\text{л}}}^{{ - 1}}}$(12)
${{K}_{2}} = \frac{{\left[ {{\text{Ph}}{{{\text{e}}}^{ - }}} \right]\left[ {{{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}^{{\text{ + }}}}} \right]}}{{\left[ {{\text{Ph}}{{{\text{e}}}^{{{ \pm }}}}} \right]}} = 4.90 \times {{10}^{{ - 10}}}\,\,{\text{моль}} \cdot {{{\text{л}}}^{{ - 1}}},$Локальное изменение концентраций частиц фенилаланина Phe±, Phe+ и Phe− рассчитывается по уравнениям (11) и (12) следующим образом
(13)
${{C}_{{{\text{Ph}}{{{\text{e}}}^{{\text{ + }}}}}}} = \frac{{{{C}_{{{\text{Ph}}{{{\text{e}}}^{{{\text{tot}}}}}}}}}}{{\frac{{{{K}_{1}}{{K}_{2}}}}{{C_{{\text{H}}}^{2}}} + \frac{{{{K}_{1}}}}{{{{C}_{{\text{H}}}}}} + 1}},$(14)
${{C}_{{{\text{Ph}}{{{\text{e}}}^{ - }}}}} = \frac{{{{K}_{1}}{{K}_{2}}{{C}_{{{\text{Ph}}{{{\text{e}}}^{{\text{ + }}}}}}}}}{{C_{{\text{H}}}^{2}}},$(15)
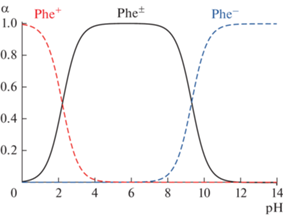
${{C}_{{{\text{Ph}}{{{\text{e}}}^{{{ \pm }}}}}}} = \frac{{{{K}_{1}}{{C}_{{{\text{Ph}}{{{\text{e}}}^{{\text{ + }}}}}}}}}{{{{C}_{{\text{H}}}}}},$Таким образом, в зависимости от рН раствора в камерах системы НД фенилаланин изменяет свою форму за счет реакций протолиза (рис. 3), влияя на ионный обмен в КОМ и АОМ.
Рис. 3.
Мольные доли частиц фенилаланина в водных растворах как функции pH, рассчитанные по уравнениям (13)–(15).
Стоит отметить, что потоки коионов через мембраны предполагаются равными нулю.
Изменение концентрации иона j в камере A, $C_{j}^{A},$ связано с потоками H+$\left( {J_{{\text{H}}}^{{(1)}}} \right),$ Na+$\left( {J_{{{\text{Na}}}}^{{(1)}}} \right)$ и Phe+$\left( {J_{{{\text{Ph}}{{{\text{e}}}^{{\text{ + }}}}}}^{{(1)}}} \right)$ через левую границу КОМ (индекс 1, рис. 2) уравнениями
(16)
$ - \frac{S}{{{{V}^{A}}}}J_{{\text{H}}}^{{(1)}} = \frac{{\partial C_{{\text{H}}}^{A}}}{{\partial t}},$(17)
$ - \frac{S}{{{{V}^{A}}}}J_{{{\text{Na}}}}^{{(1)}} = \frac{{\partial C_{{{\text{Na}}}}^{A}}}{{\partial t}},$(18)
$ - \frac{S}{{{{V}^{A}}}}J_{{{\text{Ph}}{{{\text{e}}}^{{\text{ + }}}}}}^{{(1)}} = \frac{{\partial C_{{{\text{Ph}}{{{\text{e}}}^{{\text{ + }}}}}}^{A}}}{{\partial t}},$Изменение концентрации иона j в камере B, $C_{j}^{B},$ связано с потоками OH–$\left( {J_{{{\text{OН}}}}^{{(4)}}} \right),$ Cl–$\left( {J_{{{\text{Cl}}}}^{{(4)}}} \right)$ и Phe–$\left( {J_{{{\text{Ph}}{{{\text{e}}}^{ - }}}}^{{(1)}}} \right)$ через правую границу АОМ (индекс 4, рис. 2) уравнениями:
(19)
$\frac{S}{{{{V}^{B}}}}J_{{{\text{OH}}}}^{{(4)}} = \frac{{\partial C_{{{\text{OH}}}}^{B}}}{{\partial t}},$(20)
$\frac{S}{{{{V}^{B}}}}J_{{{\text{Cl}}}}^{{(4)}} = \frac{{\partial C_{{{\text{Cl}}}}^{B}}}{{\partial t}},$(21)
$\frac{S}{{{{V}^{B}}}}J_{{{\text{Ph}}{{{\text{e}}}^{ - }}}}^{{(4)}} = \frac{{\partial C_{{{\text{Ph}}{{{\text{e}}}^{ - }}}}^{B}}}{{\partial t}}.$Изменение концентрации иона j в камере D, $C_{j}^{D},$ связано с потоками через правую границу КОМ (индекс 2) и левую границу АОМ (индекс 3) (рис. 2):
(22)
$\frac{{\partial C_{{{\text{Cl}}}}^{D}}}{{\partial t}} = - \frac{S}{{{{V}^{D}}}}J_{{{\text{Cl}}}}^{{(3)}},$(23)
$\begin{gathered} \frac{{\partial C_{{\text{H}}}^{D}}}{{\partial t}} = \frac{S}{{{{V}^{D}}}}J_{{\text{H}}}^{{(2)}} + {{k}_{1}}{{C}_{{{\text{Ph}}{{{\text{e}}}^{{\text{ + }}}}}}} - {{k}_{{ - 1}}}{{C}_{{{\text{Ph}}{{{\text{e}}}^{{{ \pm }}}}}}}{{C}_{{\text{H}}}} + {{k}_{2}}{{C}_{{{\text{Ph}}{{{\text{e}}}^{{{ \pm }}}}}}} - \\ - \,\,{{k}_{{ - 2}}}{{C}_{{{\text{Ph}}{{{\text{e}}}^{ - }}}}}{{C}_{{\text{H}}}} + {{k}_{d}}{{C}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}} - {{k}_{r}}{{C}_{{\text{H}}}}{{C}_{{{\text{OH}}}}}, \\ \end{gathered} $(24)
$\frac{{\partial C_{{{\text{OH}}}}^{D}}}{{\partial t}} = - \frac{S}{{{{V}^{D}}}}J_{{{\text{OH}}}}^{{(3)}} + {{k}_{d}}{{C}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}} - {{k}_{r}}{{C}_{{\text{H}}}}{{C}_{{{\text{OH}}}}},$(25)
$\frac{{\partial C_{{{\text{Ph}}{{{\text{e}}}^{{\text{ + }}}}}}^{D}}}{{\partial t}} = \frac{S}{{{{V}^{D}}}}J_{{{\text{Ph}}{{{\text{e}}}^{{\text{ + }}}}}}^{{(2)}} - {{k}_{1}}{{C}_{{{\text{Ph}}{{{\text{e}}}^{{\text{ + }}}}}}} + {{k}_{{ - 1}}}{{C}_{{{\text{Ph}}{{{\text{e}}}^{{{ \pm }}}}}}}{{C}_{{\text{H}}}},$(26)
$\frac{{\partial C_{{{\text{Ph}}{{{\text{e}}}^{ - }}}}^{D}}}{{\partial t}} = \frac{S}{{{{V}^{D}}}}J_{{{\text{Ph}}{{{\text{e}}}^{ - }}}}^{{(3)}} + {{k}_{2}}{{C}_{{{\text{Ph}}{{{\text{e}}}^{{{ \pm }}}}}}} - {{k}_{{ - 2}}}{{C}_{{{\text{Ph}}{{{\text{e}}}^{ - }}}}}{{C}_{{\text{H}}}},$Отметим, что поток считается положительным, если его направление соответствует положительному направлению оси х.
Решение системы уравнений (13)–(15) и (23)–(26) позволяет найти изменение концентраций ионов в камере обессоливания.
Концентрация ионов Na+ в камере D рассчитывается в соответствии с условием электронейтральности (5):
(27)
$C_{{{\text{Na}}}}^{D} = C_{{{\text{Cl}}}}^{D} + C_{{{\text{OH}}}}^{D} - C_{{\text{H}}}^{D} + {{C}_{{{\text{Ph}}{{{\text{e}}}^{ - }}}}} - {{C}_{{{\text{Ph}}{{{\text{e}}}^{{\text{ + }}}}}}}.$На границах мембрана/раствор предполагается ионообменное равновесие и выполнение условия непрерывности потока.
Локальное равновесие на границах мембрана/раствор описывается уравнениями
(28)
$K_{{{\text{H,Na}}}}^{c} = {{C_{{\text{H}}}^{c}{{C}_{{{\text{Na}}}}}} \mathord{\left/ {\vphantom {{C_{{\text{H}}}^{c}{{C}_{{{\text{Na}}}}}} {\left( {C_{{{\text{Na}}}}^{c}{{C}_{{\text{H}}}}} \right)}}} \right. \kern-0em} {\left( {C_{{{\text{Na}}}}^{c}{{C}_{{\text{H}}}}} \right)}},$(29)
$K_{{{\text{H,Ph}}{{{\text{e}}}^{{\text{ + }}}}}}^{c} = {{C_{{\text{H}}}^{c}{{C}_{{{\text{Ph}}{{{\text{e}}}^{{\text{ + }}}}}}}} \mathord{\left/ {\vphantom {{C_{{\text{H}}}^{c}{{C}_{{{\text{Ph}}{{{\text{e}}}^{{\text{ + }}}}}}}} {\left( {C_{{{\text{Ph}}{{{\text{e}}}^{{\text{ + }}}}}}^{c}{{C}_{{\text{H}}}}} \right)}}} \right. \kern-0em} {\left( {C_{{{\text{Ph}}{{{\text{e}}}^{{\text{ + }}}}}}^{c}{{C}_{{\text{H}}}}} \right)}},$(30)
$K_{{{\text{OH,Cl}}}}^{a} = {{C_{{{\text{OH}}}}^{a}{{C}_{{{\text{Cl}}}}}} \mathord{\left/ {\vphantom {{C_{{{\text{OH}}}}^{a}{{C}_{{{\text{Cl}}}}}} {\left( {C_{{{\text{Cl}}}}^{a}{{C}_{{{\text{OH}}}}}} \right)}}} \right. \kern-0em} {\left( {C_{{{\text{Cl}}}}^{a}{{C}_{{{\text{OH}}}}}} \right)}},$(31)
$K_{{{\text{OH}},{\text{Ph}}{{{\text{e}}}^{ - }}}}^{a} = {{C_{{{\text{OH}}}}^{a}{{C}_{{{\text{Ph}}{{{\text{e}}}^{ - }}}}}} \mathord{\left/ {\vphantom {{C_{{{\text{OH}}}}^{a}{{C}_{{{\text{Ph}}{{{\text{e}}}^{ - }}}}}} {\left( {C_{{{\text{Ph}}{{{\text{e}}}^{ - }}}}^{a}{{C}_{{{\text{OH}}}}}} \right)}}} \right. \kern-0em} {\left( {C_{{{\text{Ph}}{{{\text{e}}}^{ - }}}}^{a}{{C}_{{{\text{OH}}}}}} \right)}},$Условие непрерывности потока на границах КОМ/раствор имеет вид
(32)
${{\left( {{{J}_{j}}} \right)}_{{x = \delta }}} = {{\left( {J_{j}^{c}} \right)}_{{x = \delta }}},\,\,\,\,{{\left( {{{J}_{j}}} \right)}_{{x = {{d}^{c}} + \delta }}} = {{\left( {J_{j}^{c}} \right)}_{{x = {{d}^{c}} + \delta }}}.$На границах ДПС/объем раствора (камеры) задается условие непрерывности концентрации:
(33)
${{\left( {{{C}_{j}}} \right)}_{{x = 0}}} = C_{j}^{{\text{A}}},\,\,\,\,{{\left( {{{C}_{j}}} \right)}_{{x = {{d}^{c}} + 2\delta }}} = C_{j}^{{\text{D}}},$Аналогичные граничные условия заданы со стороны АОМ.
Дифференциальное уравнение для электрического потенциала может быть выведено из уравнений (4)–(6). В случае КОМ оно записывается как
(34)
$\begin{gathered} \frac{{\partial {{\varphi }^{c}}}}{{\partial x}} = - \frac{{RT}}{F} \times \\ \times \,\,\frac{{\left( {D_{{\text{H}}}^{c} - D_{{{\text{Ph}}{{{\text{e}}}^{{\text{ + }}}}}}^{c}} \right)\frac{{\partial C_{{\text{H}}}^{c}}}{{\partial x}} + \left( {D_{{{\text{Na}}}}^{c} - D_{{{\text{Ph}}{{{\text{e}}}^{{\text{ + }}}}}}^{c}} \right)\frac{{\partial C_{{{\text{Na}}}}^{c}}}{{\partial x}}}}{{\left( {D_{{\text{H}}}^{c} - D_{{{\text{Ph}}{{{\text{e}}}^{{\text{ + }}}}}}^{c}} \right)C_{{\text{H}}}^{c} + \left( {D_{{{\text{Na}}}}^{c} - D_{{{\text{Ph}}{{{\text{e}}}^{{\text{ + }}}}}}^{c}} \right)C_{{{\text{Na}}}}^{c} + D_{{{\text{Ph}}{{{\text{e}}}^{{\text{ + }}}}}}^{c}{{X}^{c}}}}. \\ \end{gathered} $В случае АОМ
(35)
$\begin{gathered} \frac{{\partial {{\varphi }^{a}}}}{{\partial x}} = \frac{{RT}}{F} \times \\ \times \,\,\frac{{\left( {D_{{{\text{OH}}}}^{a} - D_{{{\text{Ph}}{{{\text{e}}}^{ - }}}}^{a}} \right)\frac{{\partial C_{{{\text{OH}}}}^{a}}}{{\partial x}} + \left( {D_{{{\text{Cl}}}}^{a} - D_{{{\text{Ph}}{{{\text{e}}}^{ - }}}}^{a}} \right)\frac{{\partial C_{{{\text{Cl}}}}^{a}}}{{\partial x}}}}{{\left( {D_{{{\text{OH}}}}^{a} - D_{{{\text{Ph}}{{{\text{e}}}^{ - }}}}^{a}} \right)C_{{{\text{OH}}}}^{a} + \left( {D_{{{\text{Cl}}}}^{a} - D_{{{\text{Ph}}{{{\text{e}}}^{ - }}}}^{a}} \right)C_{{{\text{Cl}}}}^{a} + D_{{{\text{Ph}}{{{\text{e}}}^{ - }}}}^{a}{{X}^{a}}}}. \\ \end{gathered} $Таким же образом можно вывести дифференциальные уравнения для потенциала в ДПС1 (рис. 2):
(36)
$\frac{{\partial {{\varphi }^{{{\text{ДПС1}}}}}}}{{\partial x}} = \frac{{RT}}{F}\frac{{\left[ {{{D}_{{{\text{Cl}}}}} - {{D}_{{\text{H}}}} + \frac{{{{K}_{w}}}}{{C_{{\text{H}}}^{2}}}\left( {{{D}_{{{\text{Cl}}}}} - {{D}_{{{\text{OH}}}}}} \right)} \right]\frac{{\partial {{C}_{{\text{H}}}}}}{{\partial x}} + \left( {{{D}_{{{\text{Cl}}}}} - {{D}_{{{\text{Na}}}}}} \right)\frac{{\partial {{C}_{{{\text{Na}}}}}}}{{\partial x}} + \left( {{{D}_{{{\text{Cl}}}}} - {{D}_{{{\text{Ph}}{{{\text{e}}}^{{\text{ + }}}}}}}} \right)\frac{{\partial {{C}_{{{\text{Ph}}{{{\text{e}}}^{{\text{ + }}}}}}}}}{{\partial x}}}}{{\left( {{{D}_{{\text{H}}}} + {{D}_{{{\text{Cl}}}}}} \right){{C}_{{\text{H}}}} + \left( {{{D}_{{{\text{Na}}}}} + {{D}_{{{\text{Cl}}}}}} \right){{C}_{{{\text{Na}}}}} + \left( {{{D}_{{{\text{Ph}}{{{\text{e}}}^{{\text{ + }}}}}}} + {{D}_{{{\text{Cl}}}}}} \right){{C}_{{{\text{Ph}}{{{\text{e}}}^{{\text{ + }}}}}}} + \frac{{{{K}_{w}}}}{{{{C}_{{\text{H}}}}}}\left( {{{D}_{{{\text{OH}}}}} - {{D}_{{{\text{Cl}}}}}} \right)}}$(37)
$\frac{{\partial {{\varphi }^{{{\text{ДПС4}}}}}}}{{\partial x}} = \frac{{RT}}{F}\frac{{\left[ {{{D}_{{{\text{OH}}}}} - {{D}_{{{\text{Na}}}}} + \frac{{{{K}_{w}}}}{{C_{{{\text{OH}}}}^{2}}}\left( {{{D}_{{\text{H}}}} - {{D}_{{{\text{Na}}}}}} \right)} \right]\frac{{\partial {{C}_{{{\text{OH}}}}}}}{{\partial x}} + \left( {{{D}_{{{\text{Cl}}}}} - {{D}_{{{\text{Na}}}}}} \right)\frac{{\partial {{C}_{{{\text{Cl}}}}}}}{{\partial x}} + \left( {{{D}_{{{\text{Ph}}{{{\text{e}}}^{ - }}}}} - {{D}_{{{\text{Na}}}}}} \right)\frac{{\partial {{C}_{{{\text{Ph}}{{{\text{e}}}^{ - }}}}}}}{{\partial x}}}}{{\left( {{{D}_{{{\text{OH}}}}} + {{D}_{{{\text{Na}}}}}} \right){{C}_{{{\text{OH}}}}} + \left( {{{D}_{{{\text{Cl}}}}} + {{D}_{{{\text{Na}}}}}} \right){{C}_{{{\text{Cl}}}}} + \left( {{{D}_{{{\text{Ph}}{{{\text{e}}}^{ - }}}}} + {{D}_{{{\text{Na}}}}}} \right){{C}_{{{\text{Ph}}{{{\text{e}}}^{ - }}}}} + \frac{{{{K}_{w}}}}{{{{C}_{{{\text{OH}}}}}}}\left( {{{D}_{{\text{H}}}} - {{D}_{{{\text{Na}}}}}} \right)}}.$Дифференциальное уравнение для электрического потенциала в ДПС2 имеет вид:
(38)
$\frac{{\partial {{\varphi }^{{{\text{ДПС2}}}}}}}{{\partial x}} = \frac{{RT}}{F}\frac{{\left[ {{{D}_{{{\text{Cl}}}}} - {{D}_{{\text{H}}}} - \frac{{{{\alpha }_{1}}}}{{{{C}_{{\text{H}}}}}} - \frac{{2{{C}_{{{\text{Ph}}{{{\text{e}}}^{{\text{ + }}}}}}}{{\beta }_{1}}}}{{{{C}_{{\text{H}}}}}}} \right]\frac{{\partial {{C}_{{\text{H}}}}}}{{\partial x}} + \left[ {{{D}_{{{\text{Cl}}}}} - {{D}_{{{\text{Ph}}{{{\text{e}}}^{{\text{ + }}}}}}} + {{\beta }_{1}}} \right]\frac{{\partial {{C}_{{{\text{Ph}}{{{\text{e}}}^{{\text{ + }}}}}}}}}{{\partial x}} + \left( {{{D}_{{{\text{Cl}}}}} - {{D}_{{{\text{Na}}}}}} \right)\frac{{\partial {{C}_{{{\text{Na}}}}}}}{{\partial x}}}}{{\left( {{{D}_{{\text{H}}}} + {{D}_{{{\text{Cl}}}}}} \right){{C}_{{\text{H}}}} + \left[ {{{D}_{{{\text{Cl}}}}} + {{D}_{{{\text{Ph}}{{{\text{e}}}^{{\text{ + }}}}}}} + {{\beta }_{1}}} \right]{{C}_{{{\text{Ph}}{{{\text{e}}}^{{\text{ + }}}}}}} + \left( {{{D}_{{{\text{Na}}}}} + {{D}_{{{\text{Cl}}}}}} \right){{C}_{{{\text{Na}}}}} + {{\alpha }_{1}}}},$Аналогичное уравнение выводится для электрического потенциала в ДПС3:
(39)
$\frac{{\partial {{\varphi }^{{{\text{ДПС3}}}}}}}{{\partial x}} = \frac{{RT}}{F}\frac{{\left[ {{{D}_{{{\text{OH}}}}} - {{D}_{{{\text{Na}}}}} + \frac{{{{\alpha }_{2}}}}{{{{C}_{{{\text{OH}}}}}}} - \frac{{2{{C}_{{{\text{Ph}}{{{\text{e}}}^{ - }}}}}{{\beta }_{2}}}}{{{{C}_{{{\text{OH}}}}}}}} \right]\frac{{\partial {{C}_{{{\text{OH}}}}}}}{{\partial x}} + \left[ {{{D}_{{{\text{Ph}}{{{\text{e}}}^{ - }}}}} - {{D}_{{{\text{Na}}}}} + {{\beta }_{2}}} \right]\frac{{\partial {{C}_{{{\text{Ph}}{{{\text{e}}}^{ - }}}}}}}{{\partial x}} + \left( {{{D}_{{{\text{Cl}}}}} - {{D}_{{{\text{Na}}}}}} \right)\frac{{\partial {{C}_{{{\text{Cl}}}}}}}{{\partial x}}}}{{\left( {{{D}_{{{\text{Na}}}}} + {{D}_{{{\text{OH}}}}}} \right){{C}_{{{\text{OH}}}}} + \left[ {{{D}_{{{\text{Na}}}}} + {{D}_{{{\text{Ph}}{{{\text{e}}}^{ - }}}}} - {{\beta }_{2}}} \right]{{C}_{{{\text{Ph}}{{{\text{e}}}^{ - }}}}} + \left( {{{D}_{{{\text{Na}}}}} + {{D}_{{{\text{Cl}}}}}} \right){{C}_{{{\text{Cl}}}}} + {{\alpha }_{2}}}},$Далее уравнения (34)–(39) подставляются в уравнения Нернста–Планка (4), записанные для КОМ, АОМ и ДПС, и решаются численно с учетом уравнения (7) и граничных условий (32) и (33).
В начале процесса НД (при t = 0) предполагается равномерное распределение концентраций в диффузионных слоях, равных начальным концентрациям питающих растворов.
3.2. Параметры модели
Входные параметры модели условно можно разделить на три группы: термодинамические, кинетические и характеризующие природу ионообменного материала. Также имеется несколько входных параметров, характеризующих раствор и систему НД: концентрации электролитов, рН и толщины ДПС.
Термодинамические параметры включают константы ионообменного равновесия между мембранами и внешними растворами, константы химического равновесия реакций протонирования-депротонирования фенилаланина.
Кинетические параметры включают коэффициенты диффузии ионов и частиц фенилаланина в мембранах.
Параметр, характеризующий природу материала мембран –обменная емкость.
Выходными параметрами модели являются концентрации всех переносимых в процессе НД ионов и частиц Phe± в камерах системы.
Входные параметры исследуемой системы были получены из независимых экспериментов или взяты из литературы. Значения подгоночных параметров – коэффициентов диффузии ионов в мембранах – были оценены из данных по электропроводности мембран в соответствующих растворах, далее их значения варьировались в пределах 10% для выполнения условия наилучшего соответствия расчетных и экспериментальных кинетических зависимостей рН и электропроводности обессоливаемого раствора. Параметры модели, используемые при расчетах, представлены в табл. 2.
Поставленная задача решена численно методом конечных разностей Эйлера с использованием программного пакета Matlab.
4. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Экспериментальные и рассчитанные по предложенной модели кинетические зависимости электропроводности и pH обессоливаемого раствора в процессе НД индивидуального (NaCl) и смешанного (NaCl + Phe) растворов представлены на рис. 4.
Рис. 4.
Экспериментальные (точки) и рассчитанные по модели (линии) кинетические зависимости рН (а, в, д) и электропроводности (б, г, е) индивидуального и смешанного растворов в камере обессоливания НД. Концентрации и обозначения кривых указаны на графиках.

В случае самой высокой концентрации индивидуального раствора NaCl (0.05 М) на начальном этапе процесса НД наблюдается резкое снижение значений pH и небольшой прирост в электропроводности (рис. 4а, 4б). Это связано с тем, что поток ионов H+ через исследуемую КОМ из кислотной камеры в камеру обессоливания превышает соответствующий поток ионов OH– через исследуемую АОМ в условиях проведенного эксперимента. Это различие потоков описано в работах [22, 38] для аналогичной системы НД с мембранами CMX, AMX (Astom, Япония). При достаточно высокой концентрации обессоливаемого раствора лимитирующей стадией процесса переноса становится перенос через КОМ и АОМ (внутридиффузионная кинетика), а не диффузионные слои, прилегающие к ним со стороны камеры обессоливания. Коэффициент взаимодиффузии ионов Na+ и H+ в КОМ превышает соответствующее значение для пары Cl– и OH– в АОМ [38], что выражается в больших значения потоков первых по сравнению со вторыми через соответствующие мембраны и находит подтверждение в значениях электропроводности КОМ и АОМ в растворе HCl и растворе NaOH, соответственно, а также в растворе NaCl (табл. 1). Прирост в электропроводности обессоливаемого раствора на начальном этапе связан с тем, что на смену ионам Na+ в камеру обессоливания приходят ионы H+, обладающие большей подвижностью, в то время как снижение концентрации ионов Cl– незначительно.
Таблица 2.
Параметры модели, используемые при расчетах
| Параметр | Значение | Описание |
|---|---|---|
| ${{d}^{c}}$ и ${{d}^{a}}$ | 140 мкм и 150 мкм | Толщина КОМ и АОМ, соответственно |
| ${{\delta }^{{{\text{ДПС}}i}}}$ | 180 мкм | Толщина ДПСi, где $i = 1,2,3,4$ |
| ${{С}_{{{\text{NaCl}}}}}$ | 0.005, 0.02 и 0.05 моль л–1 | Начальная молярная концентрация соли в камере обессоливания D |
| ${{С}_{{{\text{HCl}}}}}$ | 0.1 моль л–1 | Начальная молярная концентрация кислоты в кислотной камере A |
| ${{С}_{{{\text{NaOH}}}}}$ | 0.1 моль л–1 | Начальная молярная концентрация щелочи в щелочной камере B |
| $С_{{{\text{Ph}}{{{\text{e}}}^{{{\text{tot}}}}}}}^{D}$ | 0.005, 0.02 и 0.05 моль л–1 | Начальная молярная концентрация фенилаланина в камере обессоливания D |
| ${{X}^{c}}$ и ${{X}^{a}}$ | 1.85 и 1.99 моль л–1 | Обменная емкость КОМ и АОМ, соответственно (в набухшем состоянии) |
| ${{D}_{{{\text{Na}}}}}$ | 1.34 × 10–5 см2 с–1 | Коэффициент диффузии Na+ в растворе [36] |
| ${{D}_{{{\text{Cl}}}}}$ | 2.03 × 10–5 см2 с–1 | Коэффициент диффузии Cl– в растворе [36] |
| DH | 9.31 × 10–5 см2 с–1 | Коэффициент диффузии H+ в растворе [36] |
| ${{D}_{{{\text{OH}}}}}$ | 5.26 × 10–5 см2 с–1 | Коэффициент диффузии OH– в растворе [36] |
| ${{D}_{{{\text{Ph}}{{{\text{e}}}^{ + }}}}}$ | 4.0 × 10–6 см2 с–1 | Коэффициент диффузии Phe+ в растворе [37] |
| ${{D}_{{{\text{Ph}}{{{\text{e}}}^{ - }}}}}$ | 6.0 × 10–6 см2 с–1 | Коэффициент диффузии Phe– в растворе [37] |
| $D_{{{\text{Na}}}}^{c}$ | 3.6 × 10–7 см2 с–1 | Коэффициент диффузии Na+ в КОМ |
| $D_{{\text{H}}}^{c}$ | 1.0 × 10–5 см2 с–1 | Коэффициент диффузии H+ в КОМ |
| $D_{{{\text{Ph}}{{{\text{e}}}^{{\text{ + }}}}}}^{c}$ | 3.5 × 10–8 см2 с–1 | Коэффициент диффузии Phe+ в КОМ |
| $D_{{{\text{Cl}}}}^{a}$ | 5.4 × 10–7 см2 с–1 | Коэффициент диффузии Cl– в АОМ |
| $D_{{{\text{OH}}}}^{a}$ | 9.6 × 10–7 см2 с–1 | Коэффициент диффузии OH– в АОМ |
| $D_{{{\text{Ph}}{{{\text{e}}}^{ - }}}}^{a}$ | 3.5 × 10–8 см2 с–1 | Коэффициент диффузии Phe– в АОМ |
| ${{K}_{w}}$ | 10–14 моль2 л–2 | Константа равновесия между ионами H+, OH– и молекулами воды в растворе |
| ${{K}_{1}}$ | 6.31 × 10–3 моль л–1 | Константа химического равновесия реакции (9) [34] |
| ${{K}_{2}}$ | 4.90 × 10–10 моль л–1 | Константа химического равновесия реакции (10) [34] |
| $K_{{{\text{H,Na}}}}^{c}$ | 1 | Константа ионообменного равновесия между ионами H+ и Na+ в КОМ |
| $K_{{{\text{H,Ph}}{{{\text{e}}}^{ + }}}}^{c}$ | 1 | Константа ионообменного равновесия между ионами H+ и Phe+ в КОМ |
| $K_{{{\text{OH,Cl}}}}^{a}$ | 1 | Константа ионообменного равновесия между ионами OH– и Cl– в АОМ |
| $K_{{{\text{OH,Ph}}{{{\text{e}}}^{ - }}}}^{a}$ | 1 | Константа ионообменного равновесия между ионами OH– и Phe– в АОМ |
| T | 293 К | Абсолютная температура |
| R | 8.314 Дж (моль К)–1 | Универсальная газовая постоянная |
| F | 96485 Кл моль–1 | Постоянная Фарадея |
По мере снижения концентрации обессоливаемого раствора роль диффузионных слоев (в которых коэффициент взаимодиффузии для пары Cl–/OH– выше, чем для пары Na+/H+) в управлении кинетикой процесса переноса растет и становится сопоставимой с ролью мембран. Таким образом, процесс приходит в стационарное состояние, сопровождаясь линейным снижением электропроводности и практически постоянным значением pH, которое обусловлено равенством потоков H+ и OH– в камеру обессоливания из кислотной и щелочной камер, соответственно.
В случае НД раствора NaCl с наименьшей из исследованных концентраций (0.005 М) наблюдается другая тенденция (рис. 4д, 4е). При такой низкой концентрации обессоливаемого раствора процессом управляет внешнедиффузионная кинетика, так как лимитирующей стадией является перенос в диффузионных слоях. Как было указано выше, коэффициент взаимодиффузии в них для пары Cl–/OH– больше, чем для пары Na+/H+, поэтому начальная стадия процесса сопровождается резким ростом pH. В процессе НД по мере увеличения концентрации OH– ионов в обессоливаемом растворе, их поток из щелочной камеры через АОМ уменьшается вследствие снижения градиента концентрации. В результате поток H+ ионов из кислотной камеры становится сопоставимым с соответствующим потоком OH– из щелочной камеры. pH обессоливаемого раствора достигает своего максимального значения, после этого наблюдается медленное снижение pH, обусловленное незначительным превышением потоком ионов H+ потока ионов OH–. В течение всего эксперимента наблюдается монотонное снижение электропроводности.
При НД индивидуального раствора NaCl промежуточной концентрации (0.02 М) наблюдается комбинация описанных выше эффектов (рис. 4в, 4г). При этом внутридиффузионная кинетика, управляющая процессом на начальном этапе, сменяется внешнедиффузионной по мере обессоливания раствора [20, 22]. Снижение pH в начале процесса НД связано с более высокой скоростью обмена катионов через КОМ, чем анионов через АОМ. По мере снижения концентрации обессоливаемого раствора диффузионные слои начинают вносить более весомый вклад в управление кинетикой процесса, что сопровождается ростом значения pH. Когда концентрация раствора достигает критически низкого значения (около 700 мин), перенос в диффузионных слоях становится лимитирующей стадией процесса, как следствие наблюдается резкий скачок pH. Электропроводность обессоливаемого раствора линейно снижается, около 700 мин наблюдается изменение линейной зависимости, что соответствует времени резкого скачка значения pH и переходу на внешнедиффузионную кинетику.
В случае смешанного раствора NaCl + Phe, как видно из рис. 4 (а, в, д), в ходе процесса НД pH смещается в кислотную область для всех исследованных концентраций. Сравнительно низкие значения рН можно объяснить следующим образом. Из-за относительно высокой подвижности ионы H+ определяют более быстрый обмен с ионами Na+ через КОМ (по сравнению с обменом OH–/Cl– через АОМ) и, попадая в камеру обессоливания, вступают в реакцию протонирования фенилаланина. В результате образуются новые носители положительного заряда и растет градиент концентрации Phe+ между камерой обессоливания и кислотной камерой. Это стимулирует рост скорости обмена через КОМ и поступление большего количества H+ в камеру обессоливания, поддерживая избыток этих ионов по сравнению с концентрацией ионов OH–. Однако, на определенном этапе процесса избыток ионов H+ к камере обессоливания снижает градиент концентрации этих ионов между камерами А и D, что приводит к уменьшению скорости обмена через КОМ и уравниванию потоков через КОМ и АОМ. При этом рН обессоливаемого раствора практически не изменяется во времени.
Как видно из рис. 4, модель хорошо описывает ход кинетических зависимостей рН, однако при концентрации смешанного раствора 0.005 М, когда процессом управляет перенос ионов через диффузионные слои около мембран со стороны камеры обессоливания, наблюдается небольшое расхождение между экспериментальной и теоретической зависимостями. По-видимому, это расхождение вызвано тем фактом, что в экспериментальной ячейке толщины диффузионных слоев около КОМ и АОМ могут немного отличаться из-за небольшого искривления мембран, вызванного, в частности, разницей в степени набухания мембран. Различие в толщине диффузионных слоев порядка нескольких десятков микрометров может заметно повлиять на ход кинетической зависимости рН в масштабах больших времен (24 ч). В модели предполагается равенство толщин ДПС.
Стоит отметить, что в случае НД смешанного раствора изменения pH обессоливаемого раствора менее выражены по сравнению с индивидуальным раствором NaCl. Так, при концентрации NaCl + Phe 0.02 M не наблюдается резкого изменения pH (рис. 4в). Такое поведение обусловлено буферной емкостью фенилаланина, обеспечиваемой реакциями протонирования-депротонирования [29].
Как видно из рис. 4 (б, г, е), скорость уменьшения электропроводности раствора в камере обессоливания в случае смеси NaCl + Phe ниже по сравнению со случаем индивидуального раствора NaCl, что объясняется конкурентным переносом заряженных форм фенилаланина, ионов соли и ионов H+ и OH–. Характеризуясь сравнительно низкими коэффициентами диффузии, ионы Phe+ и Phe– снижают диффузионный потенциал в соответствующих слоях системы (уравнения (34)–(39)), приводя к уменьшению скорости обмена и, соответственно, скорости обессоливания. Отметим, что при концентрации 0.05 M кинетическая зависимость электропроводности смешанного раствора лежит ниже соответствующей зависимости для индивидуального раствора (рис. 4б). Для случая 0.05 M NaCl механизм роста электропроводности раствора в камере обессоливания описан выше. Более низкие значения электропроводности смешанного раствора, по-видимому, обусловлены появлением ионов Phe+ и Phe– в результате реакций протонирования/депротонирования Phe±, в которых частично расходуются ионы H+ и OH–. При этом ионы Phe+ и Phe– обладают гораздо меньшей подвижностью по сравнению с ионами H+ и OH–.
Минимальные потери фенилаланина по окончании процесса НД (24 ч) наблюдались для случая 0.05 М смешанного раствора и составили 5.9%, в то время как расчеты с использованием предложенной модели оценивают потери в 2.6%. Разницу экспериментальных и теоретических значений можно объяснить отсутствием учета в модели переноса цвиттер-ионной формы фенилаланина через мембраны, внутреннее значение рН в которых отличается на 1–2 единицы от внешнего раствора [39], что приводит к изменению формы фенилаланина и реализации механизма облегченной диффузии [18].
Следует отметить, что относительно низкое значение рН в камере обессоливания определяет более высокую концентрацию ионов Phe+ по сравнению с Phe– (рис. 3), на основе чего можно заключить, что потери фенилаланина в основном обусловлены переносом его катионов через КОМ.
ЗАКЛЮЧЕНИЕ
Предложена одномерная нестационарная математическая модель процесса разделения раствора аминокислоты и сильного бинарного электролита методом нейтрализационного диализа. В модели учитываются важные для практики характеристики мембран (толщина, обменная емкость и электропроводность), концентрации растворов и способность аминокислоты (фенилаланина) вступать в реакции протонирования/депротонирования, изменяя электрический заряд в зависимости от рН среды. Новым в модели является учет переноса через мембраны фенилаланина в форме катионов (через КОМ) и анионов (через АОМ), что позволяет оценить потери фенилаланина в процессе НД.
Адекватность модели была подтверждена путем сравнения результатов моделирования кинетических зависимостей pH и электропроводности обессоливаемого раствора с экспериментальными данными, полученными с использованием лабораторной трехкамерной диализной ячейки, камеры которой разделены новыми ионообменными мембранами: сильноосновной ASE и сильнокислотной CSE (Astom, Япония).
Анализ теоретических и экспериментальных зависимостей рН и электропроводности индивидуального (NaCl) и смешанного эквимолярного (NaCl + Phe) растворов различной концентрации позволил заключить, что кинетика переноса ионов в системе НД в присутствии фенилаланина значительно отличается от кинетики переноса ионов в случае индивидуального раствора сильного электролита. Так, при определенной концентрации обессоливаемого раствора смена кинетики переноса от внутридиффузионной (доминирует перенос через мембраны) к внешнедиффузионной (доминирует перенос через диффузионные пограничные слои со стороны камеры обессоливания) не сопровождается характерным резким изменением рН, имеющим место в случае индивидуального раствора.
При НД смешанного раствора рН в камере обессоливания смещается в кислотную область в начале процесса. Анализ результатов моделирования показывает, что такое снижение обусловлено более высокой скоростью обмена через КОМ по сравнению с АОМ в исследуемой системе. Последующее уравнивание потоков через мембраны в ходе процесса НД выражается в практически постоянном во времени значении pH обессоливаемого раствора.
Показано, что скорость обессоливания смешанного раствора ниже по сравнению с индивидуальным раствором. Такое поведение объясняется сравнительно низкими коэффициентами диффузии ионов Phe+ и Phe–, которые вступают в конкурентный перенос с ионами минеральной соли, H+ и OH– ионами.
Проведены оценки потерь фенилаланина в ходе процесса НД. Следует отметить, что теоретически найденные значения оказываются ниже экспериментальных. Дальнейшее развитие модели, в частности учет переноса цвиттер-ионной формы фенилаланина, позволит более точно прогнозировать потери аминокислоты в ходе процесса НД и найти оптимальные условия процесса, позволяющие минимизировать эти потери.
Список литературы
Logan B.E., Rabaey K. // Science. 2012. V. 337. № 6095. P. 686–690.
Abels C., Carstensen F., Wessling M. // J. Membr. Sci. 2013. V. 444. P. 285–317.
Teng Y., Scott E.L., Witte-van Dijk S.C.M., Sanders J.P.M. // New Biotechnology. 2016. V. 33. № 1. P. 171–178.
Kotsanopoulos K.V., Arvanitoyannis I.S. // Crit. Rev. Food Sci. Nutr. 2015. V. 55. № 9. P. 1147–1175.
Martí-Calatayud M.C., Buzzi D.C., García-Gabaldón M., Bernardes A.M., Tenório J.A.S., Pérez-Herranz V. // J. Membr. Sci. 2014. V. 466. P. 45–57.
Parés Viader R., Jensen P.E., Ottosen L.M., Ahrenfeldt J., Hauggaard-Nielsen H. // Electrochim. Acta. 2015. V. 181. P. 100–108.
Ran J., Wu L., He Y., Yang Z., Wang Y., Jiang C., Ge L., Bakangura E., Xu T. // J. Membr. Sci. 2017. V. 522. P. 267–291.
Bazhenov S., Rieder A., Schallert B., Vasilevsky V., Unterberger S., Grushevenko E., Volkov V., Volkov A. // Int. J. Greenh. Gas Control. 2015. V. 42. P. 593–601.
Sato K. // J. Membr. Sci. 2008. V. 309. P. 175–181.
Galier S., Roux-de Balmann H. // Sep. Purif. Technol. 2011. P. 77. P. 237–244.
Luo H., Cheng X., Liu G., Zhou Y., Lu Y., Zhang R., Li X., Teng W. // J. Membr. Sci. 2017. V. 523. P. 122–128.
Husson E., Araya-Farias M., Desjardins Y., Bazinet L. // Innov. Food Sci. Emerg. Technol. 2013. V. 17. P. 153–62.
Holder A., Merath C., Kulozik U., Hinrichs J. // Int. Dairy J. 2015. V. 46. P. 31–38.
Mulder M. Basic principles of membrane technology. Dordrecht: Kluwer Academic, 1991.
Rautenbach R., Albrecht R. Membrane processes. Chichester: John Wiley & Sons, 1989.
Igawa M., Fukushi Y., Hayashita T., Hoffmann M.R. // Ind. Eng. Chem. Res. 1990. V. 29. № 5. P. 857–861.
Shaposhnik V.A., Eliseeva T.V. // J. Membr. Sci. 1999. V. 161. № 1–2. P. 223–228.
Metayer M., Legras M., Grigorchouk O., Nikonenko V., Langevin D., Labbe M., Lebrun L., Shaposhnik V. // Desalination. 2002. V. 147. № 1–3. P. 375–380.
Igawa M., Suzuki H. // J. Ion Exch. 2003. V. 14. P. S253–S256.
Denisov G.A., Tishchenko G., Bleha M., Shataeva L. // J. Membr. Sci. 1995. V. 98. P. 13–25.
Chérif M., Mkacher I., Dammak L., Ben Salah A., Walha K., Nikonenko V., Korchane S., Grande D. // Desalin. Water Treat. 2016. V. 57. № 31. P. 14403–14413.
Kozmai A., Chérif M., Dammak L., Bdiri M., Larchet C., Nikonenko V. // J. Membr. Sci. 2017. V. 540. P. 60–70.
Сауд А.М., Васильева В.И., Голева Е.А., Акберова Э.М., Козлов А.Т. // Сорбционные и хроматографические процессы. 2020. Т. 20. № 6. С. 749–759.
Ring S., Hasson D., Shemer H., Semiat R. // J. Membr. Sci. 2015. V. 476. P. 348–355.
Szczepański P., Szczepańska G. // J. Membr. Sci. 2017. V. 525. P. 277–289.
Varcoe J.R., Atanassov P., Dekel D.R., Herring A.M., Hickner M.A., Kohl P.A., Kucernak A.R., Mustain W.E., Nijmeijer K., Scott K., Xu T., Zhuang L. // Energy Environ. Sci. 2014. V. 7. P. 3135–3191.
Brauns E. // Desalin. Water Treat. 2013. V. 51. P. 6429–6443.
Zerdoumi R., Oulmi K., Benslimane S. // Desalination. 2014. V. 340. P. 42–48.
Kozmai A., Goleva E., Vasil’eva V., Nikonenko V., Pismenskaya N. // Membranes. 2019. V. 9. Art. № 171.
Tsukahara S., Nanzai B., Igawa M. // J. Membr. Sci. 2013. V. 448. P. 300–307.
Sato K., Yonemoto T., Tadaki T. // J. Chem. Eng. Jpn. 1993. V. 26. № 1. P. 68–74.
Карпенко Л.В., Демина О.А., Дворкина Г.А., Паршиков С.Б., Ларше К., Оклер Б., Березина Н.П. // Электрохимия. 2001. Т. 37. № 3. С. 328–335. [Karpenko L.V., Demina O.A., Dvorkina G.A., Parshikov S.B., Larchet C., Auclair B., Berezina N.P. // Russ. J. Electrochem. 2001. V. 37. № 3. P. 287–293.]
Newman J., Thomas-Alyea K.E. Electrochemical Systems. NJ: John Wiley & Sons, Inc., 2004. 672 p.
Lide D.R. Handbook of Chemistry and Physics. Boca Raton, FL: CRC Press, 2005.
Helfferich F.G. Ion Exchange. N.Y.: McGraw-Hill, 1962. 624 p.
Robinson R.A., Stokes R.H. Electrolyte solutions. 2nd Revised ed. N.Y.: Dover Publications Inc., 2003. 588 p.
Ma Y., Zhu C., Ma P., Yu K.T. // J. Chem. Eng. Data. 2005. V. 50. P. 1192–1196.
Chérif M., Mkacher I., Dammak L., Ben Salah A., Walha K., Grande D., Nikonenko V. // Desalination. 2015. V. 361. P. 13–24.
Franck-Lacaze L., Sistat Ph., Huguet P. // J. Membr. Sci. 2009. V. 326. № 2. P. 650–658.
Дополнительные материалы отсутствуют.
Инструменты
Мембраны и мембранные технологии


