Мембраны и мембранные технологии, 2023, T. 13, № 1, стр. 3-14
Электрохимические свойства и специфическая селективность гетерогенных ионообменных мембран в борат-нитратных растворах электролитов
В. И. Заболоцкий a, *, Н. А. Романюк a, **, С. А. Лоза a
a Кубанский государственный университет
Краснодар, Россия
* E-mail: vizab@chem.kubsu.ru
** E-mail: romanyuknazar@mail.ru
Поступила в редакцию 16.08.2022
После доработки 02.09.2022
Принята к публикации 07.10.2022
- EDN: HJHAPQ
- DOI: 10.31857/S221811722301008X
Аннотация
Методом вращающегося мембранного диска (ВМД) исследованы электрохимические характеристики гетерогенных катионо- и анионообменных мембран Ralex и механизм переноса ионов соли, борной кислоты и ее анионов через мембраны при различных значениях рН. Показано, что борная кислота переносится в основном через анионообменную мембрану. При значении рН 9.5 лимитирующей стадией переноса анионов через анионообменную мембрану является реакция образования аниона тетрагидроксибората ${\text{B(OH)}}_{{\text{4}}}^{ - }{\text{.}}$ Исследование процесса электродиализного разделения раствора нитрата натрия и борной кислоты показали, что метод электродиализа позволяет эффективно разделять компоненты смеси, при этом значение коэффициента специфической селективности составляет ${{P}_{{{{\text{B}} \mathord{\left/ {\vphantom {{\text{B}} {{\text{NaN}}{{{\text{O}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{NaN}}{{{\text{O}}}_{{\text{3}}}}}}}}}$ = (0.02–0.06), в зависимости от напряжения на электродиализаторе.
ВВЕДЕНИЕ
Борная кислота получила широкое применение в промышленности при изготовлении стекла, керамики, огнестойких материалов [1, 2], медицине и ветеринарии [3–6], в качестве добавки в свинцово-кислотные аккумуляторы [7, 8], в альтернативной энергетике [9]. Наиболее важным ее применением является использование в качестве поглотителя нейтронов на АЭС в цикле борного регулирования избыточной реактивности ядерных реакторов [10–12].
После использования в технологических процессах борная кислота загрязняется неорганическими веществами и для повторного использования необходима ее очистка от минеральных веществ и концентрирование. Отдельной и самостоятельной задачей является переработка дезактивированных кубовых остатков, содержащих борную кислоту [13]. Существуют различные способы переработки борсодержащих растворов: ионообменная технология [14–17], многократная перекристаллизация [18, 19], высаливание [20], ультрафильтрация и обратный осмос [12, 21, 22]. Существующая на Кольской АЭС реагентная технология регенерации борной кислоты [23] включает в себя осаждение боратов и сульфата кальция с последующей обработкой раствора азотной кислотой. На финальной стадии регенерации образуется раствор, содержащий нитрат натрия и борную кислоту. Необходимость захоронения и складирования дезактивированных кубовых остатков, приводит к увеличению площадей занимаемых под полигоны отходов [13]. Комплексная переработка кубовых остатков с повторным возвратом в технологический процесс азотной и борной кислот является актуальной задачей.
В диссоциированном состоянии основной формой борной кислоты является анион тетрагидроксибората ${\text{B(OH}})_{4}^{ - }$ [24, 25]. В растворе могут присутствовать анионы, содержащие в своем составе два (дибораты), три (трибораты), четыре (тетрабораты) атомов бора [26]. Значения констант равновесия для различных форм борной кислоты приведены ниже.
(1)
${\text{В(ОН}}{{)}_{3}} + {{{\text{Н}}}_{{\text{2}}}}{\text{О}} \rightleftarrows {\text{В(ОН)}}_{4}^{ - } + {{{\text{Н}}}^{ + }}\,\,\,\lg {{K}_{1}} = - 9.24,$(2)
${\text{2В(ОН}}{{{\text{)}}}_{3}} \rightleftarrows {{{\text{В}}}_{{\text{2}}}}{\text{О(ОН)}}_{5}^{ - } + {{{\text{Н}}}^{ + }}\,\,\,\lg {{K}_{2}} = - 9.61,$(3)
$\begin{gathered} 3{\text{В(ОН}}{{{\text{)}}}_{3}} \rightleftarrows {{{\text{В}}}_{{\text{3}}}}{{{\text{О}}}_{{\text{3}}}}{\text{(ОН}})_{4}^{ - } + {{{\text{Н}}}^{ + }} + 2{{{\text{Н}}}_{{\text{2}}}}{\text{О}}\, \\ {\text{lg}}{{K}_{3}} = - 7.34, \\ \end{gathered} $(4)
$\begin{gathered} 4{\text{В(ОН}}{{)}_{3}} \rightleftarrows {{{\text{В}}}_{{\text{4}}}}{{{\text{О}}}_{{\text{5}}}}{\text{(ОН}})_{4}^{{2 - }} + 2{{{\text{Н}}}^{ + }} + 3{{{\text{Н}}}_{{\text{2}}}}{\text{О}} \\ \lg {{K}_{4}} = - 16.25. \\ \end{gathered} $На рис. 1 представлена диаграмма состояния форм борной кислоты (в % в пересчете на атомы бора) в зависимости от рН в 0.05 М растворе. При значениях рН < 6 борная кислота находится практически полностью в молекулярной форме. При значениях рН 9.5 концентрации недиссоциированной борной кислоты и анионов тетрагидроксибората ${\text{B(OH}})_{4}^{ - }$ одинаковы. Суммарная концентрация остальных ионов полиборатов не превышает 5%.
Рис. 1.
Распределение форм борной кислоты при различных значениях рН. Суммарная концентрация всех форм борной кислоты $с_{В}^{0}$ = 0.05 М.
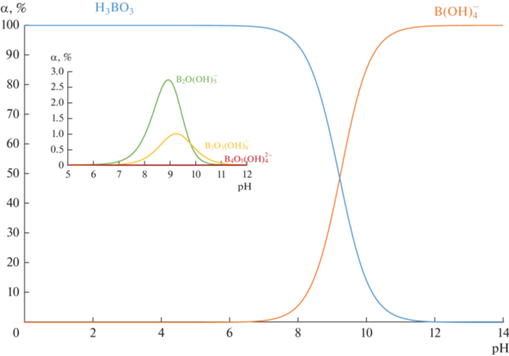
Вследствие того, что состояние борной кислоты в растворе зависит от кислотности, интенсивность и механизм переноса бора через ионообменные мембраны зависит от рН. Так как борная кислота в кислой среде находится в недиссоциированной форме многие исследователи [27–30] предлагают использовать электродиализ для разделения борной кислоты и ионов сильных электролитов при низких значениях рН. Но, несмотря на высокую степень разделения компонентов, часть борной кислоты переносится через ионообменные мембраны. Этот эффект объясняется диффузией молекулярной борной кислоты. В работах [31–33] был изучен процесс переноса Н3ВО3 отдельно через катионо- и анионообменные мембраны в электродиализном аппарате, при низком значении рН. Было установлено, что поток борной кислоты через анионообменные мембраны в 10 раз больше, чем поток через катионообменные мембраны. Независимо от типа катионообменных мембран поток Н3ВО3 зависит от потока и природы катионов. В присутствии ионов K+ перенос бора максимален и уменьшается в следующем ряду: K+ > Na+ > Ca2+ > Mg2+. Поток Н3ВО3 через анионообменную мембрану также зависит от природы аниона: Cl– > ${\text{NO}}_{3}^{ - }$ > ${\text{SO}}_{4}^{{2 - }}$ [31, 32]. Эти ионные ряды коррелирует с электроотрицательностью атомов: эффект объясняется взаимодействием борной кислоты с ионом и молекулами воды в составе гидратной оболочки [31, 32].
При повышении рН борная кислота переходит в ионную форму и преобладающим механизмом переноса бора становится электромиграция в виде борат-анионов [34]. Бораты конкурируют с анионами, находящимися в растворе, при этом чем выше подвижность конкурирующего иона, тем меньше поток борной кислоты [35].
Влияние рН на перенос борной кислоты Н3ВО3 через анионообменные мембраны исследовался в работах [36–38]. В работе [36] было установлено, что при повышении рН с 3 до 9 суммарный поток борной кислоты и боратов через анионообменные мембраны увеличился в 18 раз, вследствие образования в кислой среде борат-анионов. Однако дальнейшее увеличение рН приводит к уменьшению переноса бора. Этот эффект связывают с образованием при более высоких значениях рН тетраборатов, которые имеют малую подвижность, а также конкурирующим переносом ОН– ионов.
В [38] было исследовано влияние рН раствора в камере концентрирования (КК) электродиализатора на перенос борной кислоты. При повышении рН раствора в камере концентрирования диффузионный перенос ионов ОН– через анионообменные мембраны в камеры обессоливания (КО) сопровождается диссоциацией молекул Н3ВО3 в КО и переносом анионов ${\text{В}}\left( {{\text{ОН}}} \right)_{4}^{ - }$ через анионообменные мембраны в КК. При этом выход по току по бору превышал 100% [38]. Авторы установили, что образующиеся борат-анионы переносятся через анионообменные мембраны не только под действием электрического поля, но и в результате диффузии борат-анионов, вызванной потоком ОН– ионов из камеры концентрирования (диализ Доннана).
В данной работе методом вращающегося мембранного дискового электрода исследован механизм переноса ионов и борной кислоты через катионообменную Ralex СМН и анионообменную мембрану Ralex АМН при рН 5.5, когда в растворе основной формой является недисоциированная борная кислота, и рН 9.5, когда концентрации кислоты и тетработат-анионов – одинаковы. Полученные новые знания о механизме переноса ионов через катионо- и анионообменные мембраны использованы для повышения степени разделения нитратов и боратов электродиализом с ионообменными мембранами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В исследовании использовались катионообменные и анионообменные мембраны Ralex CMH и Ralex АMH. Мембраны Ralex CMH и Ralex АMH представляют собой композицию из мелкодисперсных полиэтилена и сополимера стирола с дивинилбензолом с фиксированными четвертичными амино- и сульфогруппами соответственно. Для придания мембранам механической жесткости их армируют полиэфирсульфоновой тканью. Основные физико-химические и транспортные характеристики мембран Ralex CMH и Ralex АMH представлены в табл. 1 [39, 40]. Производит мембраны “MEGA” a.s., Чешская республика.
Таблица 1.
Основные характеристики мембран Ralex CMH и Ralex АMH
Вольтамперные характеристики (ВАХ) и эффективные числа переноса ионов через мембраны исследовались методом вращающегося мембранного диска (ВМД) с равнодоступной в диффузионном и электрическом отношении поверхностью [41, 42] (рис. 2).
Рис. 2.
Схема установки с вращающимся мембранным диском: 1 – мембранный диск (S = 1.53 × 10–4 м2); 2 – вращающаяся стеклянная трубка; 3 – емкость с исследуемым раствором; 4 – подающий раствор капилляр; 5 – отбирающий раствор капилляр; 6 – поляризующие платиновые электроды; 7 – капилляры Луггина–Габера; 8 – источник постоянного тока; 9 – милливольтметр; 10 – хлорсеребряные электроды.
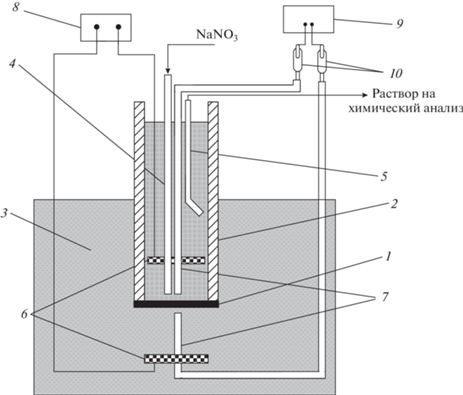
Толщина диффузионного слоя на границе исследуемая мембрана/раствор в установке ВМД задавалась путем изменения скорости вращения мембранного диска в соответствии с теорией Левича [43]:
(5)
$\delta = 1.61{{D}^{{\frac{1}{3}}}}{{\vartheta }^{{\frac{1}{6}}}}{{\omega }^{{ - \frac{1}{2}}}},$Скорость вращения мембранного диска варьировалась от 50 до 400 об./мин и измерялась с помощью оптико-механического преобразователя со встроенным цифровым блоком. Регистрация ВАХ проводилась в гальваностатическом режиме, с использованием потенциостата-гальваностата Elins P-250SM, разность потенциалов на мембране определяли с помощью хлорсеребряных электродов и иономера И-130, производства “Гомельский завод измерительных приборов”. Состав исходного раствора поддерживался постоянным.
Плотность предельного тока в такой системе рассчитывалась по уравнению Пирса:
(6)
${{i}_{{\lim }}} = \frac{{{{z}_{i}}DF{{C}_{0}}}}{{\delta \left( {\overline {{{t}_{i}}} - {{t}_{i}}} \right)}},$Эффективные числа переноса ионов Тj и ТB определялись по изменению концентрации компонентов в верхней полуячейке ВМД. Для катионообменной мембраны эта полуячейка являлась катодной камерой, для анионообменной мембраны – анодной камерой.
Расчет эффективных чисел переноса ионов Na+ и ${\text{NO}}_{3}^{ - }$ проводился по уравнению:
(7)
${{Т}_{j}} = \frac{{(c{}_{j} - c_{j}^{0})VF}}{I}\,\,\,(j = {\text{N}}{{{\text{a}}}^{ + }},{\text{NO}}_{3}^{ - }),$Эффективные числа переноса по бору ТВ определялись по значениям суммарной концентрации борной кислоты и боратов сВ.
где сВ – суммарная концентрация соединений бора на выходе из верхней полуячейки, моль/л; $с_{В}^{0}$ – концентрация соединений бора в исходном растворе моль/л.Уравнение (8) учитывает электродиффузионный перенос анионов бора и диффузионный перенос борной кислоты.
Концентрации ионов Na+ и ${\text{NO}}_{3}^{ - }$ в растворе контролировалась с помощью ионного хроматографа “Стайер” производства АО “Аквилон”. Нижний предел обнаружения для ионов натрия и нитрат-ионов составляет 0.10 мг/л. Суммарное содержание всех форм борной кислоты (сВ) определялось методом потенциометрического титрования с использованием автоматического титратора Mettler toledo EasyPlus. Пробу анализируемого раствора в зависимости от кислотности доводили до рН 7.0 0.1 М раствором гидроксида натрия или азотной кислоты, добавляли избыток сорбита для перевода борной кислоты в более сильную кислоту [44], и оттитровывали 0.1 М NaOH.
Исследование проводилось в смешанных растворах NaNO3 + H3BO3 при значениях рН 5.5 и рН 9.5. Как видно из рис. 1 при рН 5.5 борная кислота в растворе находится в молекулярной форме, при рН 9.5 доминирующей формой является тетрагидроксиборат ${\text{В}}\left( {{\text{ОН}}} \right)_{4}^{ - }.$ В соответствии с особенностями проведения измерений методом вращающегося мембранного диска была выбрана фиксированная концентрация нитрата натрия 0.01 М для обеспечения достаточной электропроводности в системе. Нижняя граница концентрации борной кислоты 0.005 М обусловлена пределом обнаружения борной кислоты методом титрования.
Исследование процесса электродиализного разделения 0.15 М нитрата натрия и 0.75 М борной кислоты проводилось на электродиализаторе с мембранами Ralex CMH и Ralex AMH. Раствор такого состава образуется при переработке отходов атомной промышленности методом биполярного электродиализа [45]. Электродиализатор состоял из 5 парных камер, образованных катионообменными и анионообменными мембранами 0.05 м × 0.2 м = 0.01 м2. Расстояние между мембранами задавалось сетчатой прокладкой толщиной 0.9 мм. Схема электродиализатора и направление потоков ионов показаны на рис. 3.
Рис. 3.
Схема электродиализной ячейки: А – анионообменная мембрана; К – катионообменная мембрана; КО – камера обессоливания; КК – камера концентрирования; ЭК – электродная камера.
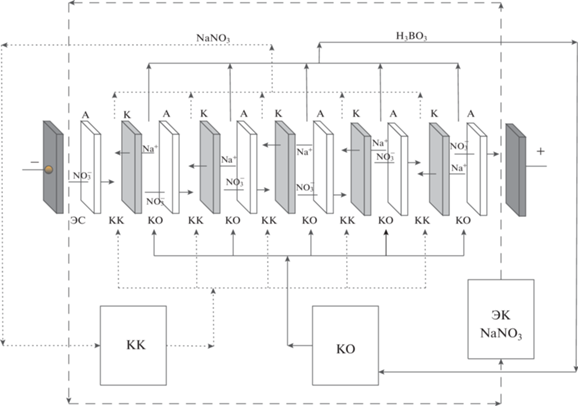
Процесс электродиализного разделения проводился в потенциометрическом режиме. Напряжение варьировали от 2 до 6 В на парную камеру электродиализного аппарата. Данный рабочий диапазон был выбран так как при напряжении меньше 2 В будет наблюдаться низкая интенсивность массопереноса, свыше 6 В наблюдается значительный омический нагрев. При этом использовался источник тока GPR-7510HD, производства GW Instek. Гидравлический режим процесса электродиализа – циркуляционный, обеспечивался перестальтическим многоканальным насосом Heidolph Pumpdrive 5101. Контроль за ходом процесса проводился путем химического анализа растворов рабочих камер электродиализатора.
Для оценки эффективности электродиализного разделения NaNO3 и борной кислоты рассчитывался коэффициент специфической селективности:
(9)
${{Р}_{{{{\text{B}} \mathord{\left/ {\vphantom {{\text{B}} {{\text{NaN}}{{{\text{O}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{NaN}}{{{\text{O}}}_{{\text{3}}}}}}}}} = P_{{{{\text{B}} \mathord{\left/ {\vphantom {{\text{B}} {{\text{N}}{{{\text{a}}}^{{\text{ + }}}}}}} \right. \kern-0em} {{\text{N}}{{{\text{a}}}^{{\text{ + }}}}}}}}^{{\text{K}}} + P_{{{{\text{B}} \mathord{\left/ {\vphantom {{\text{B}} {{\text{NO}}_{3}^{ - }}}} \right. \kern-0em} {{\text{NO}}_{3}^{ - }}}}}^{{\text{A}}} = \frac{{{{j}_{{\text{B}}}}{{C}_{{{\text{NaN}}{{{\text{O}}}_{{\text{3}}}}}}}}}{{{{j}_{{{\text{NaN}}{{{\text{O}}}_{{\text{3}}}}}}}{{C}_{{\text{B}}}}}},$Потери борной кислоты ω и степень обессоливания раствора по нитрату натрия α при электродиализной переработке раствора рассчитывали по соотношению:
(10)
$\omega = \frac{{С_{{{{{\text{Н}}}_{{\text{3}}}}{\text{В}}{{{\text{О}}}_{{\text{3}}}}}}^{{{\text{in}}}} - C_{{{{{\text{H}}}_{{\text{3}}}}{\text{B}}{{{\text{O}}}_{{\text{3}}}}}}^{{{\text{fin}}}}}}{{C_{{{{{\text{H}}}_{{\text{3}}}}{\text{B}}{{{\text{O}}}_{{\text{3}}}}}}^{{{\text{in}}}}}} \times 100\% ,$(11)
$\alpha = \frac{{С_{{{\text{NaN}}{{{\text{О}}}_{{\text{3}}}}}}^{{{\text{in}}}} - C_{{{\text{NaN}}{{{\text{O}}}_{{\text{3}}}}}}^{{{\text{fin}}}}}}{{C_{{{\text{NaN}}{{{\text{O}}}_{{\text{3}}}}}}^{{{\text{in}}}}}} \times 100\% ,$Удельные энергозатраты (W, Вт ч/моль) на проведение электродиализной переработки по переносу 1 моль нитрата натрия в процессе разделения рассчитывались по формуле (12):
где U – напряжение на аппарате, В; I – сила тока, А; t – время проведения электродиализа, ч.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Исследование электрохимических характеристик ионообменных мембран методом ВМД
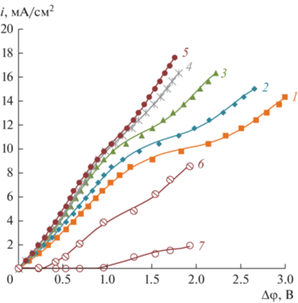
Вольтамперные характеристики (ВАХ) катионообменной мембраны Ralex CMH при скорости вращения ВМД 100 об./мин в 0.01 М растворе NaNO3 и в смешанных растворах NaNO3 + H3BO3 при значениях рН 5.5 показаны на рис. 4. Как видно из диаграммы распределения для борной кислоты (рис. 1), при этом значении рН борная кислота находится в молекулярной форме Н3ВО3. Концентрация NaNO3 поддерживалась постоянной (0.01 М), а концентрация борной кислоты варьировалась в диапазоне (0–0.05 М). На этом же рисунке показаны парциальные ВАХ по борной кислоте и боратам, рассчитанные по значениям эффективных чисел переноса (iB = TBi) при максимальном значении концентрации борной кислоты 0.05 М.
Рис. 4.
Общие (1–5), парциальные по ионам Н+ (6) и борной кислоте (7) ВАХ катионообменной мембраны Ralex CMH в растворах: 1 – 0.01 М NaNO3; 2 – 0.01 М NaNO3 + 0.005 М Н3ВО3; 3 – 0.01 М NaNO3 + 0.01 М Н3ВО3; 4 – 0.01 М NaNO3 + 0.02 М Н3ВО3; 5 – 0.01 М NaNO3 + 0.05 М Н3ВО3; Парциальные ВАХ по катионам водорода (кривая 6) и бору (кривая 7) для раствора 0.01 М NaNO3 + 0.05 М Н3ВО3 с максимальным содержанием борной кислоты. Скорость вращения ВМД ω = 100 об./мин, значения рН 5.5 растворов поддерживались постоянным.
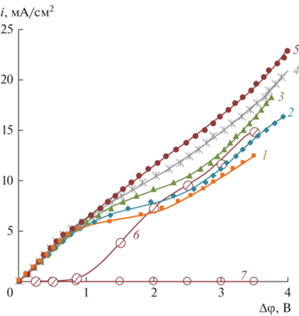
Анализ данных показывает, что предельная плотность тока (рис. 5) на катионообменной мембране, найденная методом касательных из ВАХ, не зависит от концентрации борной кислоты, а суммарный перенос борной кислоты и боратов во всем диапазоне плотностей тока, вследствие проявления эффекта доннановского исключения коинов, практически отсутствует. Однако, форма ВАХ зависит от содержания Н3ВО3 в растворе. Как и многие органические кислоты [46] борная кислота является каталитически активной в реакции диссоциации воды. С ростом ее концентрации в растворе в электромембранной системе увеличивается скорость диссоциации воды, и как следствие, образуются новые переносчики электрического тока. В результате развития этих сопряженных явлений концентрационной поляризации протяженность участков предельного тока сокращается.
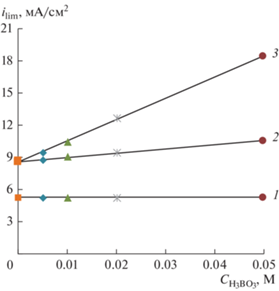
Рис. 5.
Зависимость плотности предельного тока мембран Ralex от концентрации борной кислоты в растворе 0.01 М NaNO3 при различных рН: 1 – мембрана Ralex СМН рН 5.5; 2 – мембрана Ralex АМН рН 5.5; 3 – мембрана Ralex АМН рН 9.5.
Общие и парциальные ВАХ анионообменных мембран Ralex AMH в смешанных растворах NaNO3 + H3BO3 при значении рН 5.5 представлены на рис 6. В силу доннановского исключения ионов Н+ показатель кислотности в анионообменной мембране выше, чем в растворе, что вызывает диссоциацию борной кислоты с образованием борат-анионов в фазе мембраны. С увеличением концентрации борат-анионов в мембране ее электропроводность растет, что приводит к увеличению наклона омического участка ВАХ.
Рис. 6.
Общие (1–5), парциальные по ионам ОН– (6) и ионам тетрабората (7) ВАХ анионообменной мембраны Ralex AMH в растворах: 1 – 0.01 М NaNO3; 2 – 0.01 М NaNO3 + 0.005 М Н3ВО3; 3 – 0.01 М NaNO3 + + 0.01 М Н3ВО3; 4 – 0.01 М NaNO3 + 0.02 М Н3ВО3; 5 – 0.01 М NaNO3 + 0.05 М Н3ВО3. Парциальные ВАХ по анионам гидроксила (кривая 6) и тетрабората (кривая 7) для раствора 0.01 М NaNO3 + 0.05 М Н3ВО3 с максимальным содержанием борной кислоты. Скорость вращения ВМД ω = 100 об./мин, значения рН 5.5 растворов поддерживались постоянным.
Предельный ток на анионообменной мембране практически не зависит от концентрации Н3ВО3 в смешанном растворе, рис. 5 (кривая 2). После достижения предельного тока на анионообменной мембране начинается перенос через нее ионов гидроксила (рис. 6). При этом рН в мембране смещается в щелочную область и начинается электродиффузионный перенос ионов гидроксила через мембрану (кривая 6). Сорбированная борная кислота при этом трансформируется в тетработат-анионы и начинается их электродиффузионный перенос (кривая 7) совместно с ионами гидроксила через анионообменную мембрану.
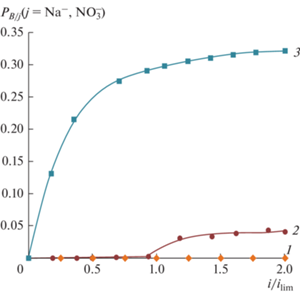
В слабощелочных растворах при рН 9.5, электромассоперенос анионов ${\text{В}}\left( {{\text{ОН}}} \right)_{4}^{ - }$ через анионообменную мембрану Ralex AMH начинается уже при низких плотностях тока рис. 7. Предельный ток в этой электромембранной системе прямопропорционально зависит от концентрации борной кислоты (рис. 5, кривая 3). На рис. 8 представлена зависимость коэффициента специфической селективности мембран от отношения тока к току предельному (i/ilim).
Рис. 7.
Общие (1–5), парциальные по ионам ОН– (6) и ионам тетрабората (7) ВАХ анионообменной мембраны Ralex AMH в растворах: 1 – 0.01 М NaNO3; 2 – 0.01 М NaNO3 + 0.005 М Н3ВО3; 3 – 0.01 М NaNO3 + + 0.01 М Н3ВО3; 4 – 0.01 М NaNO3 + 0.02 М Н3ВО3; 5 – 0.01 М NaNO3 + 0.05 М Н3ВО3. Парциальные ВАХ по анионам гидроксила (кривая 6) и тетрабората (кривая 7) для раствора 0.01 М NaNO3 + 0.05 М Н3ВО3 с максимальным содержанием борной кислоты. Скорость вращения ВМД ω = 100 об./мин, значения рН 9.5 растворов поддерживались постоянным.
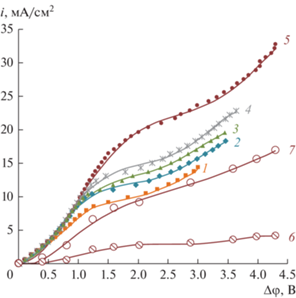
Рис. 8.
Зависимость коэффициента специфической селективности мембран, определенных методом вращающегося мембранного диска, от отношения плотности тока к плотности предельного тока мембран Ralex при различных значениях рН: 1 – мембрана Ralex СМН рН 5.5; 2 – мембрана Ralex АМН рН 5.5; 3 – мембрана Ralex АМН рН 9.5.
Зависимость предельного тока для мембраны Ralex АМН и от скорости вращения мембранного диска в исследованных растворах представлена на рис. 9.
Рис. 9.
Зависимость плотности предельного тока мембраны Ralex АМН от корня квадратного угловой скорости вращения ВМД в щелочных растворах (рН 9.5): 1 – 0.01 М NaNO3; 2 – для 0.01 М NaNO3 + + 0.01 М Н3ВО3; 3 – 0.01 М NaNO3 + 0.02 М Н3ВО3; 4 – 0.01 М NaNO3 + 0.035 М Н3ВО35 – 0.01 М NaNO3 + + 0.05 М Н3ВО3.
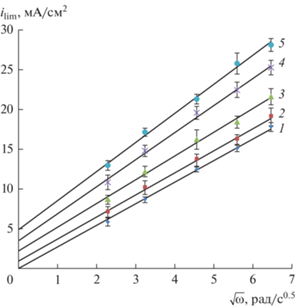
В растворах 0.01 М NaNO3 (прямая 1) зависимость ilim от $\sqrt \omega $ линейная и экстраполируется на значение ilim = 0 при скорости вращения мембранного диска ω = 0, что соответствует теории Левича. В растворах NaNO3 + NaB(OН)4 зависимость предельного тока на анионообменной мембране Ralex AMH от корня квадратного из скорости вращения ВМД не экстраполируется в начало координат. При $\sqrt \omega = 0,$ когда толщина диффузионного слоя становится бесконечно большой (без учета естественной конвекции), значение предельного тока не равно нулю. Это не нулевое значение предельного тока $i_{{{\text{lim}}}}^{0}$ в нитрат-боратных растворах увеличивается с ростом суммарной концентрации борной кислоты и тетрабората в растворе (табл. 2), и связанно с наличием кинетических ограничений в системе и существованием реакционного слоя. Ранее такая закономерность наблюдалась в растворах аминокислот [47, 48] и была объяснена замедленностью протекания в электромембраннной системе предшествующей химической реакции протонирования аминокислот.
Таблица 2.
Значение $i_{{{\text{lim}}}}^{0}$ в зависимости от суммарной концентрации борной кислоты
| ∑С(H3BO3), М | $i_{{{\text{lim}}}}^{0}$, мА/см2 |
|---|---|
| 0.01 | 0.97 ± 0.04 |
| 0.02 | 2.13 ± 0.26 |
| 0.035 | 3.45 ± 0.27 |
| 0.05 | 5.04 ± 0.91 |
Таким образом, перенос борной кислоты через анионообменную мембрану протекает по двум параллельным механизмам. Первый механизм является электродиффузионным и включает перенос через диффузионный слой и мембрану тетраборат-ионов, присутствующих в исходном равновесном растворе. Второй механизм – включает в себя замедленную химическую реакцию диссоциации борной кислоты (уравнение (1)) и последующий перенос образовавшихся тетрагидроксиборат анионов.
Исследование электродиализного разделения борной кислоты и нитрата натрия
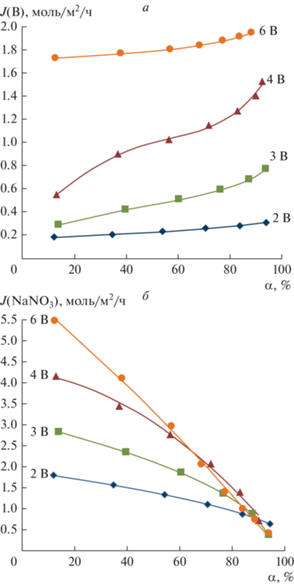
Зависимости суммарных потоков борной кислоты и боратов jB и потоков нитрата натрия ${{j}_{{{\text{NaN}}{{{\text{O}}}_{3}}}}}$ от степени обессоливания исходного раствора α в камерах электродиализного аппарата при различных значениях напряжения на электродиализаторе представлены рис. 10.
Рис. 10.
Зависимость плотности потоков бора (а) и нитрата натрия (б) от степени обессоливания нитрата натрия α. Состав исходного раствора 0.15 М нитрата натрия + 0.75 М борной кислоты при различном напряжении на электродиализаторе.
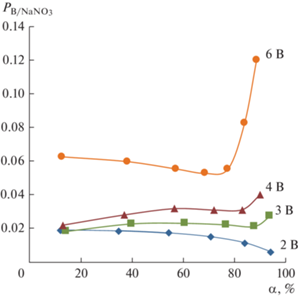
На рис. 11 показаны зависимости коэффициентов специфической селективности, рассчитанных по уравнению (9), от степени обессоливания растворов. ${{P}_{{{{\text{B}} \mathord{\left/ {\vphantom {{\text{B}} {{\text{NaN}}{{{\text{O}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{NaN}}{{{\text{O}}}_{{\text{3}}}}}}}}},$ полученные при электродиализе, близки по величине к сумме коэффициентов специфической селективности катионообменной и анионообменной мембраны, полученных методом вращающегося мембранного диска.
Рис. 11.
Зависимость коэффициента специфической селективности от степени обессоливания нитрата натрия α при различном напряжении на парной камере электродиализатора.
Из представленных данных видно, что потери борной кислоты при ее электродиализном обессоливании возрастают с увеличением напряжения на электродиализаторе и степени обессоливания α. При достижении предельного тока на анионообменной мембране Ralex AMH (рис. 10a, кривые 4 и 6 В) потери борной кислоты резко возрастают, в следствии наращивания массопереноса боратов через анионообменные мембраны и протекания химической реакции диссоциации борной кислоты, механизм которых исследован в предыдущем разделе методом ВМД.
Энергозатраты на проведение процесса электродиализной очистки борной кислоты W и потери борной кислоты ω от напряжения на парной камере при достижении α = 90% показаны на рис. 12.
Рис. 12.
Потери борной кислоты (а) и энергозатраты (б) в процессе электродиализной переработки, при α = 90%.
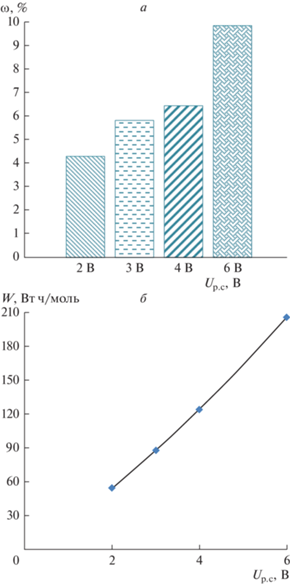
Анализ данных (рис. 11 и рис. 12) показывает, электродиализная переработка раствора 0.75 М борной кислоты и 0.15 М нитрата натрия является наиболее эффективной при низком напряжении на парную камеру (2 В). Так как этот режим соответствует наименьшим значениям коэффициента специфической селективности, потерям бора ω и энергозатратам.
ЗАКЛЮЧЕНИЕ
Методами вольтамперометрии и измерения гитторфовских чисел переноса на вращающемся мембранном диске исследованы электрохимические характеристики и специфическая селективность сильнокислотных Ralex CMH и сильноосновных Ralex АMH гетерогенных мембран в смешанных борат-нитратных растворах электролитов. Анализ общих и парциальных вольтамперных характеристик по ионам соли продуктам диссоциации воды и борат-анионам показал, что в слабокислых растворах (при рН 5.5), в которых борная кислота находится в молекулярной форме, и при плотностях электрического тока меньших предельного диффузионного тока перенос Н3ВО3 через катионообменную и анионообменную мембрану практически отсутствует. Проведение процесса электродиализа с мембранами Ralex CMH и Ralex АMH при этих условиях позволяет разделять борную кислоту и нитрат натрия с минимальными потерями борной кислоты. Потери борной кислоты при ее электродиализной очистке составляют около 4% (при степени очистки α = 90%).
При достижении предельного тока на анионообменной мембране Ralex АMH начинается диссоциация воды, перенос ионов гидроксила и трансформирующихся из борной кислоты анионов тетрагидроксибората ${\text{B(OH}})_{4}^{ - }.$ Коэффициенты специфической селективности анионообменных мембран ${{P}_{{{{\text{B}} \mathord{\left/ {\vphantom {{\text{B}} {{\text{NaN}}{{{\text{O}}}_{{\text{3}}}}}}} \right. \kern-0em} {{\text{NaN}}{{{\text{O}}}_{{\text{3}}}}}}}}}$ при этом возрастают почти на порядок, а потери борной кислоты при ее электродиализной очистке до 10%.
В слабощелочных растворах при рН 9.5 концентрации Н3ВО3 и тетрагидроксибората натрия одинаковы и конкурирующий электродиффузионный перенос тетрагидроксиборатов ${\text{B(OH)}}_{4}^{ - }$ и ${\text{NO}}_{3}^{ - }$ протекает во всем диапазоне исследованных плотностей тока. При этом в массопереносе через анионообменную мембрану участвуют анионы тетрагидроксибората, присутствующие в равновесном растворе и образующиеся в ходе протекания предшествующей реакции диссоциации борной кислоты.
Список литературы
Intharapat P., Nakason C., Kongnoo A. // Polymer Degradation and Stability. 2016. V. 128. P. 217.
Ullah S., Ahmad F., Shariff A.M. et al. // Progress in Organic Coatings. 2017. V. 109. P. 70.
Soltani M., Shetab-Boushehri S.F., Mohammadi H. et al. // J. Medical Hypotheses and Ideas. 2013. V. 7. P. 21.
Hsu C.F., Lin S.Y., Peir J.J. et al. // Applied Radiation and Isotopes. 2011. V. 69. P. 1782.
Hernandez-Patlan D., Solis-Cruz B., Adhikari B. et al. // Research in Veterinary Sci. 2019. V. 123. P. 7.
Lopalco A., Lopedota A.A., Laquintana V. et al. // J. Pharm. Sci. 2020. V. 109. P. 2375.
Wu Z., Liu Y., Deng C. et al. // J. Energy Storage. 2020. V. 27. № 101076.
Badawy W.A., El-Egamy S.S. // J. Power Sources. 1995. V. 55 P. 11.
Campari E.G., Bianchi M., Tomesani L. // Energy Procedia. 2017. V. 126. P. 541.
Myerscough P.B. Eds., Nuclear physics and basic technology, Nuclear Power Generation, Elsevier, 1992. 110 p.
Vaghetto R., Childs M., Kee E. et al. // Progress in Nuclear Energy. 2016. V. 91. P. 302.
Chen X., Chen T., Li J. et al. // J. Memb. Sci. 2019. V. 579. P. 294.
Дмитриев С.А., Лифанов Ф.А., Савкин А.Е., Лащенов С.М. // Атомная энергия. 2000. Т. 89. С. 365. (англоязычная версия: Dmitriev S.A., Lifanov F.A., Savkin A.E., Laschenov S.M. Rus. J. Atomic Energy. V. 9. P.365.).
Wolska J., Bryjak M. // Desalination. 2013. V. 310. P. 18–24.
Hussain A., Sharma R., Minier-Matar J. et al. // J. Wat. Proc. Engin. 2019. V. 32. № 100906.
Arias M.F.Ch., Bru L.V., Rico D.P., Galvañ P.V. // Desalination. 2011. V. 278. P. 244.
Kalaitzidou K., Tzika A.M., Simeonidis K., Mitrakas M. // Materials Today: Proceedings. 2018. V. 5. P. 27599.
Ryosuke A., Yoshihiro F., Shintaro K. et al. Пат. Republic of Korea. № KR20140031195A, заявл. 16.02.2013; опубл. 12.03.2014.
Guihua D. Пат. China. № CN101003375A, заявл. 19. 01.2007; опубл. 25.07.2005.
Valdez S., Orce A., Flores H., Mattenella L. // In. J.Mineral Processing. 2014. V. 133. P. 23.
Bártová Ŝ., Kůs P., Skala M., Vonková K. // Nuclear Engineering and Design. 2016. V. 300. P. 107.
Bornemissza E., Kis E., Kubo S. et al. Пат. German Democratic Republic. № DD 259274A1, заявл. 13.05.1985; опубл. 17.08.1988.
Иваненко В.И., Седнева Т.А., Локшин Э.П., Корнейков Р.И. Пат. РФ № 2652978, заявл. 12.04.2017; опубл. 04.05.2018.
Emeléus H.J., Sharpe A.G. Eds., In Advances in Inorganic Chemistry and Radiochemistry. N.Y.: Academic Press, 1982. 372 p.
Edwards J.O., Morrison G.C., Ross V.F., Schultz J.W. // J. American Chemical Society. 1955. V. 77. P. 266.
Zhou Y., Fang C., Fang Y., Zhu F. // Spectrochimica Acta – Part A: Molecular and Biomolecular Spectroscopy. 2011. V. 83. P. 82–87.
Melnyk L., Goncharuk V., Butnyk I. et al. // Desalination. 2005. V. 185. P. 147.
Białek R., Mitko K., Dydo P., Turek, M. // Desalination. 2014. V. 342. P. 29.
Dydo P., Turek M. // Desalination. 2014. V. 342. P. 35.
Mel’nik L.A., Butnik I.A., Goncharuk V.V. // J. Water Chem. Technol. 2008. V. 30. P. 167.
Dydo P. // J. Memb. Sci. 2012. V. 407–408. P. 202.
Dydo P. // Desalination. 2013. V. 310. P. 43.
Goli E., Hiemstra T., Van Riemsdijk W.H. et al. // Anal. Chem. 2010. V. 82. P. 8438.
Melnik L., Vysotskaja O., Kornilovich B. // Desalination. 1999. V. 124. P. 125.
Kabay N., Arar O., Acar F. et al. // Desalination. 2008. V. 223. P. 63.
Yazicigil Z., Oztekin Y. // Desalination. 2006. V. 190. P. 71.
Ayyildiz H.F., Kara H. // Desalination. 2005. V. 180. P. 99.
Turek M., Bandura B., Dydo P. // Desalination. 2008. V. 223. P. 119.
Product data sheet Ralex® Membrane СMH PES: https://www.mega.cz/files/datasheet/MEGA-RALEX-CMH-PES-en.pdf. Дата обращения: 07.09.2022.
Product data sheet Ralex® Membrane AMH PES: https://www.mega.cz/files/datasheet/MEGA-RALEX-AMH-PES-en.pdf. Дата обращения: 07.09.2022.
Заболоцкий В.И., Шарафан М.В., Шельдешов Н.В., Ловцов Е.Г. // Электрохимия. 2008. Т. 44. С. 155. (англоязычная версия: Zabolotskii V.I., Sharafan M.V., Shel’deshov N.V., Lovtsov E.G. // Russ. J. Electrochem. 2008. V. 44. P. 141.)
Шарафан М.В., Заболоцкий В.И., Бугаков В.В. // Электрохимия. 2009. Т. 45. С. 1252. (англоязычная версия: Sharafan M.V., Zabolotskii V.I., Bugakov V.V. // Russ. J. Electrochem. 2009. V. 45. P. 1162.)
Левич В.Г. Физико-химическая гидродинамика. М.: Физматгиз, 1959. 700 с. (англоязычная версия: Levich V.G., Physico- chemical hydrodynamics. Moscow: Fizmatgiz, 1959. 700 p.)
ГОСТ 14021.1-78. Ферробор. Методы определения бора.
Ковалев Н.В., Карпенко Т.В., Шельдешов Н.В., Заболоцкий В.И. // Электрохимия. 2021. Т. 57. С. 96. (англоязычная версия: Kovalev N.V., Karpenko T.V., Sheldeshov N.V., Zabolotsky V.I. // Russ. J Electrochem. 2021. V. 57. P. 122.)
Simons R. // Electrochim. Acta. 1984. V. 29. P. 151.
Загородных Л.А., Бобрешова О.В., Кулинцов П.И., Аристов И.В. // Электрохимия. 2006. Т. 42. С. 68. (англоязычная версия: Zagorodnykh L.A., Bobreshova O.V., Kulintsov P.I., Aristov I.V. // Russ. J. Electrochem. 2006. V. 42. P. 59.)
Загородных Л.А., Бобрешова О.В., Кулинцов П.И., Аристов И.В. // Электрохимия. 2005. Т. 41. С. 310. (англоязычная версия: Zagorodnykh L.A., Bobreshova O.V., Kulintsov P.I., Aristov I.V. // Russ. J. Electrochem. 2005. V. 41. P. 275.)
Дополнительные материалы отсутствуют.
Инструменты
Мембраны и мембранные технологии


