Микробиология, 2019, T. 88, № 1, стр. 116-119
Новый штамм Ensifer adhaerens M1 способен к трансформации перфторкарбоновых кислот
С. П. Четвериков a, *, О. Н. Логинов a
a Уфимский Институт биологии Уфимского федерального исследовательского центра
Российской академии наук
Уфа, Россия
* E-mail: che-kov@mail.ru
Поступила в редакцию 24.04.2018
После доработки 05.06.2018
Принята к публикации 02.10.2018
Перфторкарбоновые кислоты внесены в Приложение В Стокгольмской конвенции по стойким органическим загрязняющим веществам, что предусматривает принятие мер по минимизации и, по возможности, прекращению их производства и использования, с последующим уничтожением (Report…, 2009). Основные значимые представители этого класса соединений – перфтороктановая кислота (ПФОК) и перфтороктансульфонат (ПФОС) ‒ это высокостабильные синтетические химические соединения, широко используемые в производстве фторполимеров, пестицидов и, вследствие их поверхностно-активных свойств, в качестве компонентов противопожарных пен. ПФОК и ПФОС крайне устойчивы к биоразложению и детектируются во многих объектах окружающей среды и живых организмах (Yamashita et al., 2005; Tao et al., 2006; Betts, 2007; Anderson et al., 2008). В настоящее время в литературе имеются лишь единичные сообщения об утилизации ПФОК и ПФОС бактериями рода Pseudomonas без раскрытия особенностей биодеструкции (Kwon et al., 2014; Yi et al., 2016), хотя представители других типов фторорганических соединений, такие как фторбензол, перфторбифенилы и пр. биодеградабельны (Carvalho et al., 2005; Hughes et al., 2011; Amorim et al., 2013).
В настоящей работе представлены результаты исследования физиолого-биохимических свойств и таксономического положения штамма Ensifer adhaerens M1, обладающего уникальной способностью к использованию ПФОК и ПФОС в качестве единственного источника углерода и энергии.
Штамм E. adhaerens M1 был выделен из почвы, отобранной с территории хранения и испытания средств тушения пожаров (Мальдивская Республика), методом накопительной культуры. При выделении бактерий в качестве единственного источника углерода и энергии использовали ПФОС (1.0 г/л). Чистую культуру культивировали с использованием минеральной среды Раймонда (Raymond, 1961) с ПФОК или ПФОС (1.0 г/л) при 26°С и 160 об./мин. Рост штамма оценивали по оптической плотности (ОП590) клеточной суспензии на спектрофотометре СФ-56 (Россия).
Характеристику чистой культуры проводили по культурально-морфологическим и физиолого-биохимическим признакам, используя общепринятые руководства (Методы …, 1984, Определитель …, 1997). Выделение и очистку ДНК, определение молярного % Г + Ц, амплификацию, секвенирование гена 16S рРНК, филогенетический анализ осуществляли общепринятыми методами. Определенная для штамма E. adhaerens M1 последовательность фрагмента гена длиной 1319 пар нуклеотидов депонирована в GenBank под номером MH141439.
Оценивали содержание ПФОК и ПФОС в среде и идентифицировали продукты их биотрансформации на жидкостном тандемном хромато-масс-спектрометре LCMS-IT-TOF (“Shimadzu”, Япония) в ЦКП “БиоАналит” УИБ УФИЦ РАН в ультрафильтратах (≤3 кДа) культуральных жидкостей (КЖ). Хроматографическое разделение проводили в изократическом режиме на колонке Shim-pak XR-ODS (75 × 2.0 мм) (“Shimadzu”, Япония) при соотношении растворителей 5 мM ацетат аммония в воде‒ацетонитрил = 56 : 44; скорость элюирования 0.2 мл/мин. Концентрацию фторид-иона в среде измеряли при помощи фторид-селективного электрода ЭЛИС-131F (Россия).
Клетки штамма M1 – грамотрицательные подвижные палочки размером 0.7‒1.0 × 1.0‒2.0 мкм; имеют пучок жгутиков, неспорообразующие. На МПА колонии бело-кремовые, круглые, выпуклые, прозрачные, слизистые, диаметром 2‒3 мм. Метаболизм дыхательный. Штамм M1 – каталазо- и оксидазоположительный, восстанавливал нитрат и нитрит, не гидролизовал казеин, крахмал. Культура росла при температуре 10‒37°С (оптимум 26‒28°С), рН 6.0‒8.0 и концентрации NaCl до 2%.
Культура использовала в качестве единственного источника углерода D-глюкозу, лактозу, мальтозу, сахарозу, маннит, сорбит, D-арабинозу, D-ксилозу, D-маннозу, D-галактозу, D-рамнозу, сукцинат, малат, цитрат, 2-кетоглюконат, L-аланин, L-аспарагин, L-глутамин, L-глутаминовую кислоту.
Филогенетически выявлена принадлежность штамма M1 к виду Ensifer adhaerens, уровень сходства гена 16S рРНК с типовым штаммом E. adhaerens LMG 20216 составил 99.85%. Содержание Г + Ц в ДНК 62.2 мол. % ‒ типичное для бактерий данного вида.
Штамм M1 активно рос на минеральных средах, содержащих в качестве единственного источника углерода перфторкарбоновые кислоты (рисунок 1), достигая максимального показателя оптической плотности КЖ через 4 сут при культивировании на ПФОС с его полной трансформацией за 6 сут и через 3 сут выращивания на ПФОК с его разложением за 4 сут. Конверсия перфторированных субстратов сопровождалась выходом в среду свободных ионов фтора, а начало высвобождения коррелировало с началом линейного снижения их концентрации в среде.
Рис. 1.
Динамика роста (1) штамма Ensifer adhaerens M1 и изменения концентрации перфторкарбоновой кислоты (2) со схемой ее бактериальной деструкции (3) при культивировании в жидкой минеральной среде: а – с ПФОС; б – с ПФОК.
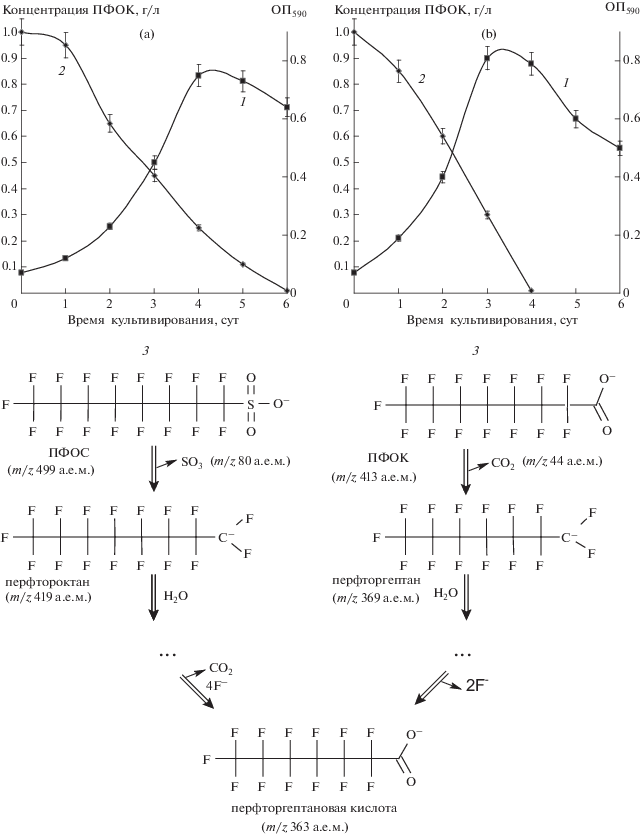
При хроматографическом анализе с масс-спектрометрией в исходной культуральной жидкости (КЖ) наблюдали диссоциированные кислотные ионы ПФОС и ПФОК (молекулярные ионы с отношением m/z 499 а.е.м. и 413 а.е.м. соответственно) характерные для анионных перфторсоединений. Через 1 сут в варианте с ПФОС детектировали наличие компонента, молекулярному иону которого соответствует m/z 419 а.е.м., что возможно в результате прохождения процесса монооксигеназного удаления из ПФОС сульфонатой группы (m/z 80 а.е.м.) в виде сульфита, который способен метаболизироваться в условиях голодания. Вероятно, с этим связана более низкая скорость роста на этом субстрате. Через 3 сут культивирования помимо компонентов с m/z 499 и 419 а.е.м. в ультрафильтрате обнаруживалось соединение, молекулярный ион которого имел соотношение m/z 363 а.е.м., отсутствовавшее первоначально в среде. В последующие сутки концентрация этого компонента в КЖ увеличивалась, а соединения с m/z 499 и 419 а.е.м. через 6 сут культивирования в среде не детектировались. Соединение с отношением m/z, равным 363 а.е.м., по масс-спектрам MS1 и MS2 идентифицировали как перфторгептановую кислоту с характерным прекурсор-ионом (m/z 363 а.е.м.) в масс-спектре MS1, фрагментирующемся с образованием продукт-иона с m/z 319 а.е.м. в масс-спектре MS2.
В варианте же с ПФОК через 1 сут обнаруживалось соединение, молекулярному иону которого соответствует m/z 369 а.е.м., что возможно в результате реакции элиминирования диоксида углерода (m/z 44 а.е.м.) из карбоксильной группы. В дальнейшем обнаруженное соединение полностью было трансформировано также в перфторгептановую кислоту.
Таким образом, в результате работы выделен и идентифицирован штамм Ensifer adhaerens M1, обладающий уникальной способностью использовать перфторкарбоновые кислоты, в частности, ПФОК и ПФОС, в качестве единственного источника углерода и энергии с образованием такого метаболита деградации, как перфторгептановая кислота, выделяя в среду свободные фторид-ионы, являющиеся индикатором частичной минерализации, и, возможно, оказывающие ингибирующий эффект на дальнейшую деструкцию промежуточных фторированных соединений.
Список литературы
Методы общей бактериологии. В 3 т. Под ред. Герхардт Ф.М.: Мир, 1984. Т. 1‒3.
Определитель бактерий Берджи. Под ред. Хоулт Дж., Криг Н., Снит П., Стейли Дж., Уильямс С. М.: Мир, 1997. Т. 1, 2.
Amorim C.L., Carvalho M.F., Afonso C.M.M., Castro P.M.L. Biodegradation of fluoroanilines by the wild strain Labrys portucalensis // Int. Biodeter. Biodegr. 2013. V. 80. P. 10‒15.
Anderson M.E., Butenhof J.L., Chang S. Perfluoroalkyl acids and related chemistries ‒ toxicokinetics and modes of action // Toxicol. Sci. 2008. V. 102. P. 3‒14.
Betts K. PFOS and PFOA in humans: new study links prenatal exposure to lower birth weight // Environ. Health Perspectives. 2007. V. 115. P. 550.
Carvalho M.F., Ferreira J.R., Pacheco C.C., De Marco P., Castro P.M.L. Isolation and properties of a pure bacterial stracapable of fluorobenzene degradation as sole carbon and energy source // Environ. Microbiol. 2005. V. 7. P. 294‒298.
Hughes D., Clark B.R., Murphy C.D. Biodegradation of polyfluorinated biphenyl in bacteria // Biodegradation. 2011. V. 22. P. 741‒749.
Kwon B.G., Lim H.J., Na S.H., Choi B.I., Shin D.S., Chung S.Y. Biodegradation of perfluorooctanesulfonate (PFOS) as an emerging contaminant // Chemosphere. 2014. V. 109. P. 221–225.
Raymond R.L. Microbial oxidation of n-paraffinic hydrocarbons // Develop. Industr. Microbiol. 1961. V. 2. P. 23–32.
Report of the Conference of the Parties of the Stockholm Convention on Persistent Organic Pollutants on the work of its fourth meeting, 4‒8 May 2009 // UNEP/POPS/ COP.4/38. Geneva: Stockholm Convention Secretariat, 2009. P. 66–69.
Tao L., Kannan K., Kajiwara N., Costa M., Fillmann G., Takahashi S., Tanabe S. Perfluorooctanesulfonate and related fluorochemicals in albatrosses, elephant seals, penguins, and polar skuas from the Southern Ocean // Environ. Science Technol. 2006. V. 40. P. 7642–7648.
Yamashita N., Kannan K., Taniyasu S., Horii Yu., Petrick G., Gamo T. A global survey of perfluorinated acids in oceans // Marine Pollut. Bull. 2005. V. 51. P. 658–668.
Yi L.B., Chai L.Y., Xie Y., Peng Q.J., Peng Q.Z. Isolation, identification, and degradation performance of a PFOA-degrading strain // Genet. Mol. Res. 2016. V. 15. doi 10.4238/gmr.15028043
Дополнительные материалы отсутствуют.


