Микробиология, 2019, T. 88, № 1, стр. 100-115
Сезонные изменения структуры сообщества аноксигенных фототрофных бактерий меромиктического озера Трехцветное (Кандалакшский залив Белого моря)
О. Н. Лунина a, *, А. С. Саввичев a, В. В. Бабенко b, Д. И. Болдырева b, Б. Б. Кузнецов c, Т. В. Колганова c, Е. Д. Краснова d, Н. М. Кокрятская e, Е. Ф. Веслополова a, Д. А. Воронов f, g, Н. А. Демиденко h, М. А. Летарова a, А. В. Летаров a, В. М. Горленко a
a Институт микробиологии им. С.Н. Виноградского, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
b Федеральный научно-клинический центр физико-химической медицины ФМБА России
119435 Москва, Россия
c Институт биоинженерии, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
d Беломорская биологическая станция им. Н.А. Перцова
Биологического факультета МГУ имени М.В. Ломоносова
Москва, Россия
e едеральный исследовательский центр комплексного изучения
Арктики имени академика Н.П. Лаверова РАН
163000 Архангельск, Россия
f Институт проблем передачи информации им. А.А. Харкевича РАН
127994 Москва, Россия
g Институт физико-химической биологии им. А.Н. Белозерского МГУ им. М.В. Ломоносова
119992 Москва, Россия
h Государственный океанографический институт им. Н.Н. Зубова
119034 Москва, Россия
* E-mail: onlun@yandex.ru
Поступила в редакцию 27.06.2018
После доработки 27.08.2018
Принята к публикации 02.10.2018
Аннотация
В марте 2012 и 2013 гг. и в сентябре 2013 и 2014 гг. были проведены исследования сообщества аноксигенных фототрофных бактерий (АФБ) водной толщи меромиктического оз. Трехцветное (Кандалакшский залив Белого моря). Показано восстановление структуры сообщества АФБ под хемоклином, происходившее в течение трех лет после частичного перемешивания, связанного с заплеском морской воды в озеро осенью 2011 г., и формирование высокоплотного слоя зеленоокрашенных (з/о) зеленых серобактерий (ЗСБ), c общей численностью не менее 108 кл. мл–1. В зимние сезоны в верхнем слое зеленой воды отмечено незначительное развитие коричневоокрашенных (к/о) ЗСБ. Показано, что в летние сезоны к/о ЗСБ занимают необычное для них положение над слоем зеленой воды в кислородной зоне. В сообществе АФБ отмечено присутствие пурпурных бактерий. Из проб воды верхней части сероводородной зоны озера были выделены 4 штамма АФБ. К/о и з/о штаммы ЗСБ оказались филогенетически близкими между собой и с типовым видом Chlorobium phaeovibrioides DSM 265, имея 99% сходства по данным сиквенса гена 16S рРНК. Один штамм пурпурных бактерий оказался филогенетически близким к соленоводным серным бактериям Thiocapsa marina, другой – к пресноводным несерным бактериям Rhodopseudomonas palustris. Выделенные штаммы серобактерий оказались филогенетически близки к бактериям зоны хемоклина стратифицированного оз. Кисло-Сладкое, также находящегося в прибрежной зоне Кандалакшского залива Белого моря.
Меромиктические водоемы являются классическими объектами исследований лимнологов, микробиологов и биогеохимиков (Горленко и соавт., 1977; Van Gemerden, Mas, 1995; Overmann et al., 1996; Thiel et al., 2010; Ecology of Meromictic Lakes, 2017).
В водной толще меромиктических озер формируется многослойное микробное сообщество, состоящее из фототрофных, хемотрофных и гетеротрофных микроорганизмов, достигающее высокой плотности в зоне хемоклина. В составе микробного сообщества хемоклина особый интерес представляют аноксигенные фототрофные бактерии (АФБ), являющиеся естественным фильтром, сдерживающим распространение сероводорода из нижних слоев озера.
Видовой состав и структура сообществ АФБ разных озер сильно различаются и зависят от гидрохимических условий, резкости градиентов в хемоклине и условий освещения верхней части сероводородной зоны озер. Известно, что пурпурные серобактерии (ПСБ) не выдерживают большой концентрации сероводорода, они менее чувствительны к кислороду, чем ЗСБ, и поэтому часто встречаются в верхней части хемоклина. ЗСБ, наоборот, являются строгими анаэробами, выдерживают бóльшие концентрации сероводорода, чем ПСБ, и поэтому образуют слой под хемоклином, часто под слоем ПСБ. К/о ЗСБ, приспособленные к жизни в условиях низкого освещения, обычно развиваются на нижней границе фотического слоя: на большой глубине (Черное море, оз. Гек-Гёль) (Manske et al., 2005; Лунина и соавт., 2008) или в условиях сильного затенения (оз. Вейсово, оз. Могильное) (Горленко и соавт., 1977; Лунина и соавт., 2005).
Классическим примером трехслойного пространственного расположения АФБ является карстовое оз. Конан-Ер (Горленко и соавт., 1977; Лунина и соавт., 2009). В соленоводных меромиктических озерах, как правило, присутствуют не все слои АФБ или некоторые из слоев могут объединяться. В оз. Репное (Донецкая обл., Украина) над слоем к/о ЗСБ (5.75 м) расположен слой преимущественно ПСБ (5.5 м) с небольшим количеством з/о ЗСБ (Горленко и соавт., 1977). В оз. Шунет описано двуслойное сообщество АФБ, где над слоем зеленой воды присутствует тонкий слой розовой воды, содержащей ПСБ (Лунина и соавт., 2007).
В большинстве озер формируется один слой, в котором доминирует лишь один вид АФБ, остальные же могут присутствовать в виде минорных компонентов. Примерами могут служить озера Могильное (Gorlenko et al., 1978), Махони (Overmann et al., 1991), Чипрана (Vila et al., 2002), Цизо (Casamayor et al., 2000).
Начиная с 2012 г. нами были проведены исследования микробного сообщества хемоклина водной толщи меромиктического высокосульфидного оз. Трехцветное, которое относится к группе озер, сохранивших связь с Кандалакшским заливом Белого моря. Ранее нами было показано, что в зоне хемоклина озера в составе сообщества АФБ доминировали з/о ЗСБ Chlorobium phaeovibrioides (Savvichev et al., 2018), также были получены данные о скоростях ключевых микробных процессов (в зимний и летний периоды). Однако структура фототрофного сообщества в этом уникальном водоеме и его видовой состав исследованы не были.
Целью настоящей работы было выяснить состав и структуру сообщества АФБ в оз. Трехцветное и проследить их изменения в связи с резкими сезонными изменениями освещенности и некоторых других физико-химических условий в водной толще водоема.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования на озере Трехцветное проводили в марте 2012 и 2013 гг. и в сентябре 2013 и 2014 гг.
Отбор проб воды осуществляли в точке с наибольшей глубиной 5–7.5 м. Пробы воды отбирали через 1 м, а в зоне хемоклина через 10 см, с помощью силиконовой трубки, закрепленной на калиброванном тросе, и портативного насоса Whale Premium Submersible Pump GP1352 (США). Отобранную воду разливали в 30-мл стеклянные флаконы, закрывали без пузырька воздуха резиновой пробкой и обжимали алюминиевой крышкой.
Общую соленость воды определяли в свежих образцах, используя кондуктометр WTW Condi 3110 (Германия).
Концентрацию кислорода и сероводорода измеряли непосредственно после отбора проб с использованием тест-наборов Aquamerck (“Merck”, Германия), а в сентябре 2013 г. – in situ кислородомером “Марк 302 E” (Россия) с погружным зондом, с поправкой на температуру и соленость. Сероводород определяли с использованием N,N-диметил-п-фенилендиамина (РД 52.24.450-2010) фотометром Эксперт-003 (Россия). Пробы воды с высоким содержанием сероводорода до окрашивания растворов предварительно разбавляли деионизированной водой (Дубинин и соавт., 2012).
Освещенность измеряли люксметром AR813A (Китай), модифицированным для погружения регистрирующего элемента под воду, с калиброванным тросом.
Для учета общей численности микроорганизмов (ОЧМ) пробы воды фиксировали раствором глутаральдегида, конечная концентрация – 2%. Затем 0.05–1 мл фиксированной пробы фильтровали через черные поликарбонатные фильтры (Миллипор) с диаметром пор 0.2 мкм. Фильтры окрашивали раствором акридинового оранжевого (Hobbie et al., 1977). Препараты просматривали с помощью люминесцентного микроскопа Olympus BX-41 с системой визуализации Image Scope Color (M) при увеличении ×1000. Учет клеток проводили на электронных изображениях 20 полей зрения.
Для получения накопительных культур АФБ в полевых условиях свежеотобранную озерную воду с различных глубин наливали в стерильные 30-мл флаконы, добавляли 100 мкл 10% дрожжевого экстракта для инициации синтрофного развития ЗСБ (Горленко и соавт., 2005). Для подавления оксигенного фотосинтеза добавляли диурон в концентрации 50 мг л–1. Флаконы герметично закрывали резиновой пробкой, оставляя пузырек воздуха диаметром не более 0.5 см.
Также, для получения накопительных культур АФБ в герметично закрытые стеклянные флаконы с питательной средой объемом 30 мл стерильными шприцами вводили пробы озерной воды объемом 5 мл. Использовали среду следующего состава (г л–1 дистиллированной воды): КН2РО4 – 0.7; NaCl – 15; MgSO4 · 7Н2О – 0.5; NH4Cl – 0.7; KCl – 0.33; NaHCO3 – 0.15; CaCl2 – 0.1; Na2S2O3 · · 5H2O – 1; Na2S · 9Н2О – 0.5; Na-ацетат – 0.5; Na-пируват – 0.5; дрожжевой экстракт – 0.1; раствор микроэлементов – 1 мл (Pfennig, Lippert, 1966); витамин В12 – 20 мкг, диурон – 50 мг; рН среды 7.0.
Для определения относительной численности АФБ в лабораторных условиях производили посев проб воды методом предельных серийных разведений природного материала на агаризованную (0.5%) питательную среду с 15 г л–1 NaCl. Культивирование проводили анаэробно в течение 1 мес. в люминостате при освещенности 2000 лк и температуре 20–25°С. Выделение и очистку культур проводили методом предельных разведений посевного материала с использованием жидких и агаризованных сред с разной соленостью.
Первичная идентификация микроорганизмов была выполнена по фенотипическим признакам с учетом формы, размера, цвета клеток и микроколоний, наличия газовых вакуолей, капель серы, спектров поглощения пигментов.
Пигментный состав полученных культур АФБ исследовали в препаратах целых клеток в 50% глицерине, а также в ацетоновых и ацетон-метанольных (7 : 2) экстрактах. Спектры поглощения снимали на спектрофотометре Cary 100 (“Varian”, Австралия) в диапазоне длин волн 350–900 нм. По нашим оценкам, в ацетоне происходило смещение пиков в среднем на 3–5 единиц в коротковолновую область, по сравнению с теми же пиками в ацетон-метанольном экстракте.
Для получения спектров поглощения света озерной воды пробы концентрировали на фильтрах GF/F, далее часть фильтра замачивали в 50% глицерине и снимали его спектр (март 2012 г.) или часть фильтра обрабатывали ультразвуком в дистиллированной воде и снимали спектр полученного водного раствора пигментов против дистиллированной воды (сентябрь 2014 г.). Пигменты другой части фильтра GF/F экстрагировали ацетоном и снимали спектр полученного экстракта пигментов против ацетона.
Для определения содержания бактериохлорофиллов (Бхл) использовали формулы (Overmann, Tilzer, 1989):
Присутствие каротиноида изорениератина, характерного для к/о ЗСБ, определяли по появлению в ацетоновых экстрактах пика в области 470 нм.
Микрофотографии клеток получали с помощью светового микроскопа Olympus при увеличении 1200 (объектив 90×) с иммерсионной системой и фазовым контрастом.
Электронно-микроскопические исследования проводили описанными ранее стандартными методами (Лунина и соавт., 2014).
Филогенетический анализ выделенных штаммов АФБ проводили, определяя последовательности генов 16S рРНК зеленых серобактерий, которые были получены из аннотации геномных сборок двух штаммов ранее описанным способом (Nikitina et al., 2015).
Выделенные пурпурные бактерии идентифицировали по гену 16S рРНК ранее описанным методом (Лунина и соавт., 2014).
РЕЗУЛЬТАТЫ
Описание оз. Трехцветное. Меромиктическое оз. Трехцветное (66°35.53′ N, 32°59.97′ E) расположено в Пеккелинской губе, входящей в состав Ругозерской губы Кандалакшского залива Белого моря, в 12 км от Беломорской биологической станции МГУ. Его размеры: площадь – 3.2 га, средняя глубина 1–1.5 м, максимальная глубина 7.5 м (Krasnova et al., 2014, 2015; Краснова и соавт., 2016).
Озеро названо Трехцветным из-за различных по цвету слоев воды: пресный поверхностный слой – бурый за счет гуминовых веществ, средний солоноватый слой – изумрудно-зеленый в результате развития ЗСБ, нижний еще более соленый слой – желтый вследствие присутствия полисульфидов. Озеро образовалось на месте древнего морского залива, отгороженного от моря островом, который в процессе поднятия берега присоединился к материку. Площадь водосборного бассейна в 20 раз превышает площадь самого озера, сток с водосбора собирается вблизи поверхности озера и формирует пресный слой глубиной 1.5–1.7 м. Озеро изолировано от моря; в летнее время уровень воды в нем на 1.20–1.26 м выше уровня моря, зимой абсолютная отметка поверхности льда – 1.25 м (Краснова и соавт., 2016). С учетом скорости регрессии моря, которую оценивают в 3.25–4.00 мм в год (Романенко, Шилова, 2012), порог, отделяющий водоем от моря, в результате подъема берега полностью преградил путь приливам 3–4 столетия назад. Однако при сильных нагонных ветрах на максимуме сизигийного прилива уровень воды может подниматься настолько, что вода из моря затекает в озеро, вызывая перемешивание верхних слоев озерной воды. Это случается крайне редко, с перерывом в несколько десятилетий. Один такой эпизод был зарегистрирован осенью 2011 г. (Краснова и соавт., 2013).
Последствия заплеска морской воды и последующее восстановление стратификации. В марте следующего, 2012 г., что на широте Северного полярного круга соответствует концу зимы, соленость поверхностного слоя озера возросла на несколько единиц, а сероводород поднялся к самой поверхности льда (Краснова и соавт., 2013) (рис. 1а). Кислород в воде не обнаруживался, галоклин и термоклин совпадали и находились между 1.0 и 3.5 м. В этот сезон вся водная толща озера была окрашена в зеленый цвет из-за присутствия в ней з/о ЗСБ, содержащих бактериохлорофилл d (Бхл d). Концентрация Бхл d уменьшалась с глубиной и на глубине 1 м составляла 782 мг м–3, на глубине 2 м – 272 мг м–3. У дна на глубине 5 м наблюдалось скопление осевших клеток, и содержание Бхл d возрастало до 419 мг м–3, что свидетельствовало о том, что перемешивание воды не затронуло нижние слои воды озера. Наибольшие значения аноксигенного фотосинтеза (АФ) были зарегистрированы в подледном слое (рис. 2а), оксигенный фотосинтез (ОФ) был сильно подавлен присутствием сероводорода и ледовым затемнением. Небольшое количество Хл а регистрировалось на глубине 1–2 м. Общая численность микроорганизмов на глубине 1 м составляла 33 × 106 кл. мл–1, в толще она снижалась, а у дна возрастала до 36 × × 106 кл. мл–1.
Рис. 1.
Гидрохимические показатели воды оз. Трехцветное: а – март 2012; б – март 2013; в – сентябрь 2013; г – сентябрь 2014.
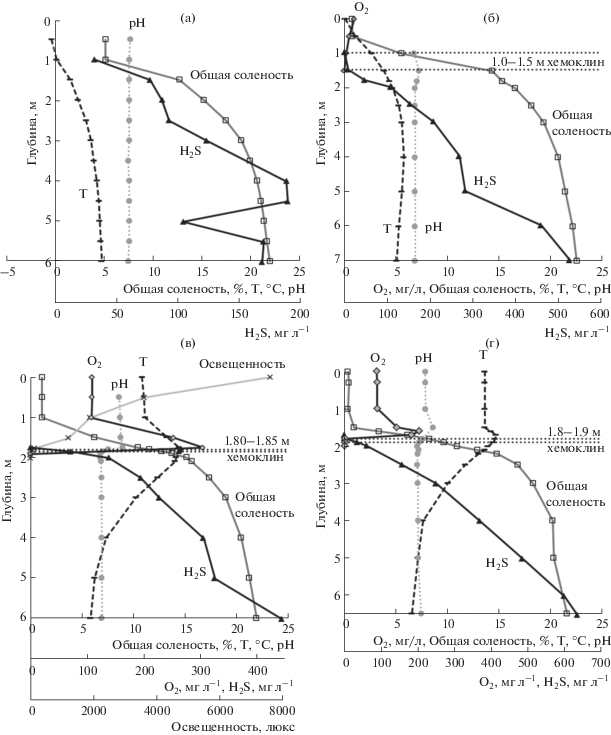
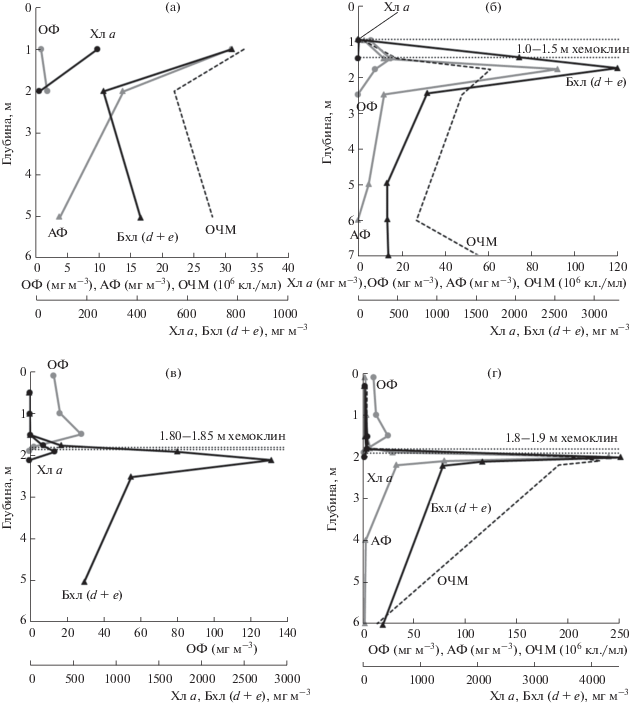
Рис. 2.
Профили фотосинтеза, содержания пигментов и общего счета клеток бактерий в воде оз. Трехцветное: (a) – март 2012, (б) – март 2013, (в) – сентябрь 2013, (г) – сентябрь 2014. Обозначения: ОФ – оксигенный фотосинтез; АФ – аноксигенный фотосинтез; Хл а – хлорофилл а; Бхл (d + e) – суммарно бактериохлорофиллы d и е зеленых серобактерий; ОЧМ – общая численность микроорганизмов.
В последующие годы мы наблюдали постепенное восстановление стратификации (Васильчук и соавт., 2016) (рис. 1б–1г). Вода поверхностного слоя опреснялась в марте 2013 г. до глубины 1 м и опресненный слой воды постепенно расширялся, достигая в сентябре 2014 г. глубины 1.7 м. Таким образом, в каждом последующем сезоне, согласно нашим исследованиям, галоклин становился все более резким и залегал все ниже. Появилась и все глубже распространялась кислородная зона: в марте 2013 г. она достигала 1 м, в сентябре 2013 г. – 1.8 м. Ниже зоны ветрового перемешивания на глубине 1.5–1.8 м, где пресная вода сменяется солоноватой, летом за счет активного оксигенного фотосинтеза иногда наблюдалось кислородное пересыщение: в сентябре 2013 г. оно составляло 300% на глубине 1.75 м, в сентябре 2014 г. – 204%. Одновременно в воде наблюдался хемоклин – весной 2013 г. он находился между 1–1.5 м, затем постепенно сужался и опускался вниз, занимая к сентябрю 2013 г. свое обычное в этом озере положение на глубине 1.8–1.9 м (Krasnova et al., 2015; Краснова и соавт., 2016). Содержание сероводорода у дна возрастало с 170 мг л–1 в марте 2012 г., до 640 мг л–1 в сентябре 2014 г.
Профиль pH, выровненный перемешиванием до 7.5 по всей глубине в марте 2012 г., к сентябрю 2013 г. полностью восстановился: значения рН уменьшались от поверхности (8.6–8.9) ко дну (6.7–6.9), но в верхней части галоклина немного повышались, что вместе с высоким содержанием кислорода указывало на активный ОФ в этой зоне.
Температура у дна в течение всего года не поднималась выше 5–7°С. В летне-осенние сезоны в эпилимнионе наблюдалась обратная температурная стратификация.
По мере восстановления стратификации зеленая окраска воды оказывалась все больше приуроченной к зоне хемоклина. В максимуме зеленой окраски воды, расположенном сразу под хемоклином, постепенно увеличивалось содержание пигментов ЗСБ (Бхл d + e). Широкий, толщиной до 1.5 м, в марте 2013 г. пик пигментов с каждым сезоном становился все уже и к сентябрю 2014 г. имел толщину не более 40 см (рис. 2б–2г). Постепенно возрастала интенсивность АФ, значения АФ в сентябре 2014 г. на порядок превышали значения ОФ (238 и 23.5 мкг С л–1 сут–1 соответственно). В сентябре 2014 г. пик ОФ в кислородной зоне приходился на глубину 1.5 м, содержание Хл а на этой глубине составило 50 мг/м3. Наибольшие значения АФ наблюдались на глубине 2 м, где регистрировалось содержание Бхл (d + е) в клетках бактерий более 4500 мг м–3.
С каждым сезоном увеличивалась численность бактериальных клеток в верхней части сероводородной зоны. Чрезвычайно большая общая численность микроорганизмов 2.0–2.3 × 108 кл. мл–1, была зафиксирована в сентябре 2014 г. в 10-см слое на глубине 2–2.1 м (сразу под хемолином), что свидетельствовало о присутствии в оз. Трехцветное высокоплотного сообщества микроорганизмов, ранее не встречавшегося нам ни в одном из исследованных водоемов (рис. 2г).
Сукцессионные и сезонные изменения в сообществе АФБ. Малая глубина расположения хемоклина (1.8–1.9 м) в оз. Трехцветное и достаточное освещение хемоклина – освещенность на верхней границе зеленого слоя составляет 20–150 лк, создают благоприятные условия для развития АФБ в верхней части сероводородной зоны. Во все сезоны исследований в озере доминировали ЗСБ, однако в зависимости от сезона встречались как зеленые, содержащие Бхл d и каротиноид хлоробактин, так и коричневые формы, содержащие Бхл е и каротиноид изорениератин. В марте 2012 г., когда вследствие осеннего перемешивания воды сероводород присутствовал даже подо льдом, пики Бхл d (450 нм и 730 нм в воде; 429 нм и 656 нм в ацетоновом экстракте) наблюдались, начиная с поверхности и до дна озера (рис. 3). На спектрах озерной воды в этот сезон нет признаков развития к/о ЗСБ (отсутствует пик изорениератина в области 470 нм). В посевах проб воды на агаризованную среду наблюдался рост колоний только зеленого цвета. По данным количественного учета на глубине 2 м число жизнеспособных клеток ЗСБ составляло 2.1 × 103 кл. мл–1, на глубине 5 м – 1 × 103 кл. мл–1, в придонной воде на глубине 6 м – 4.7 × 103 кл. мл–1 (табл. 1). О присутствии жизнеспособных клеток к/о ЗСБ в воде озера свидетельствует также тот факт, что спустя 3.5 года в одном из накопительных флаконов, хранившихся без специального освещения в холодильнике, был отмечен заметный рост к/о ЗСБ.
Рис. 3.
Спектры поглощения пигментов из взвеси воды оз. Трехцветное, март 2012. Сплошная линия – спектр стекловолокнистого фильтра GF/F (через который была профильтрована озерная вода) в 50% глицерине, пунктирная линия – спектр экстракта пигментов в ацетоне. Глубина (м): а –1; б – 2.
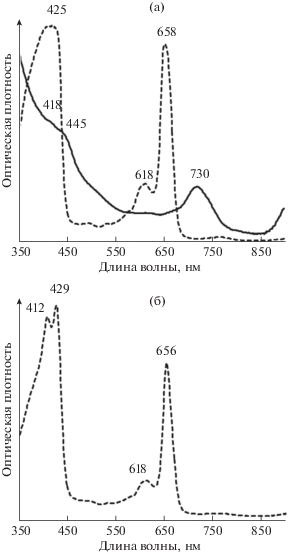
Таблица 1.
Данные количественного учета выросших на агаризованной среде колоний АФБ при посеве проб воды с различных горизонтов оз. Трехцветное, март 2013 г.
| Глубина, м | Численность клеток АФБ в воде озера, кл. мл–1 | |
|---|---|---|
| зеленоокрашенные ЗСБ | пурпурные серобактерии | |
| 1.5 | 0.45 × 103 | 0.23 × 103 |
| 1.6 | 5.9 × 103 | 3.4 × 103 |
| 2 | 7–8.1 × 103 | 0.2 × 103 |
| 3 | 0.8–3 × 104 | 0.14 × 103 |
| 4 | 2.1–2.8 × 104 | – |
| 5 | 3.5 × 103–2.5 × 104 | – |
В марте 2013 г. в озере наблюдалась сформированная кислородная зона, а сероводород начинал появляться с глубины 1 м. С этой глубины и до дна озера в озерной воде наряду с пиком Бхл d (430 нм) присутствовал пик 470 нм, характерный для к/о ЗСБ, содержащих Бхл е и каротиноид изорениератин (рис. 4). На глубине 1 и 1.5 м (верхняя часть сероводородной зоны) пик 470 нм (к/о ЗСБ) превышал пик 430 нм (з/о ЗСБ). Однако в посевах, предназначенных для количественного учета АФБ, вырастали преимущественно зеленые и пурпурные колонии. В верхних горизонтах сероводородной зоны (1.5–3 м) в незначительном количестве развивались ПСБ с газовыми вакуолями, максимальная численность которых (3.4 × 103 кл./мл) была зафиксирована на глубине 1.6 м. Из-за такого малого количества клеток на спектрах озерной воды ни в один из сезонов исследований нами не отмечалось присутствие пурпурных бактерий. Количество колоний зеленого цвета в пробах увеличивалось с глубиной, достигая максимума на 4 м (2.1–2.8 × × 104 кл. мл–1) и 5 м (3.5 × 103–2.5 × 104 кл. мл–1). К/о ЗСБ вырастали в толще агаризованной среды в виде очень мелких, едва заметных, размытых и быстро исчезающих колоний, количественно учесть которые не представлялось возможным. В жидких накопительных культурах к/о ЗСБ конкурентно вытеснялись з/о формами.
В последующий вегетационный сезон (сентябрь 2013 г.) развитие к/о ЗСБ в озере оказалось полностью подавленным зелеными формами ЗСБ. Однако о присутствии клеток к/о ЗСБ в озерной воде свидетельствовало еле заметное плечо 470 нм на спектре воды (экстракт) с глубины 1.5 м (зона кислородного пересыщения) (рис. 5). Аналогичная картина наблюдалась в сентябре 2014 г.: небольшой пик к/о ЗСБ и слабое плечо при 470 нм видны на спектрах воды с глубин 1.5–1.8 м (рис. 6).
Рис. 4.
Спектры поглощения ацетон-метанольных (7 : 2) экстрактов пигментов из взвеси воды оз. Трехцветное, март 2013. Глубина: а – 1 м; б – 1.5 м; в – 2 м; г – 2.5 м; д – 4 м.
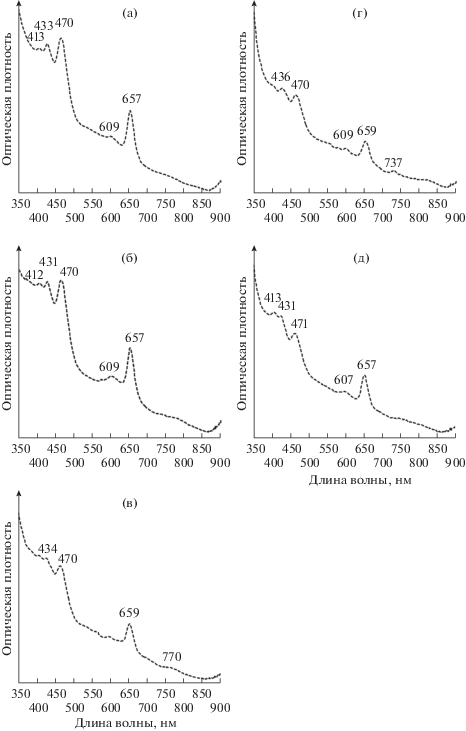
Рис. 5.
Спектры поглощения ацетоновых экстрактов пигментов из взвеси воды оз. Трехцветное, сентябрь 2013. Глубина (м): а – 0.5; б – 1; в – 1.5; г – 1.75; д – 1.9; е – 2.1; ж – 2.5; з – 5.
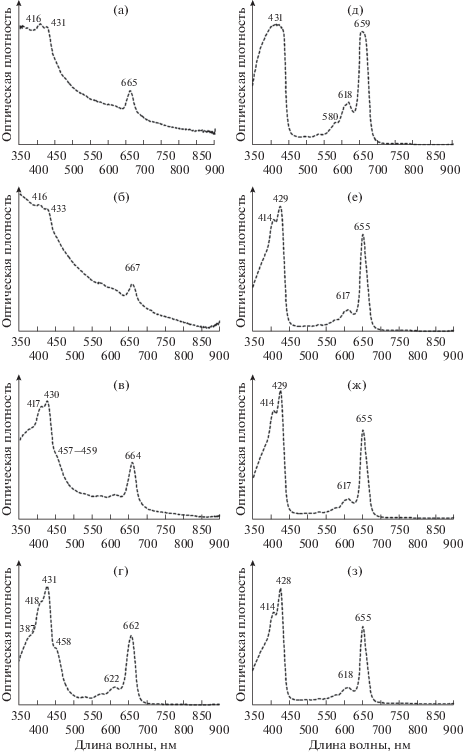
Рис. 6.
Спектры поглощения пигментов из взвеси воды оз. Трехцветное, сентябрь 2014. Глубина (м): а – 0.3; б – 1.5; в – 1.8; г – 2; д – 2.1; е – 2.2; ж – 6. Сплошная линия – пигменты озерной взвеси, сконцентрированной на фильтре GF/F, далее разбиты ультразвуком в дистилляте и снят спектр против дистиллята. Пунктирная линия – ацетоновый экстракт пигментов.
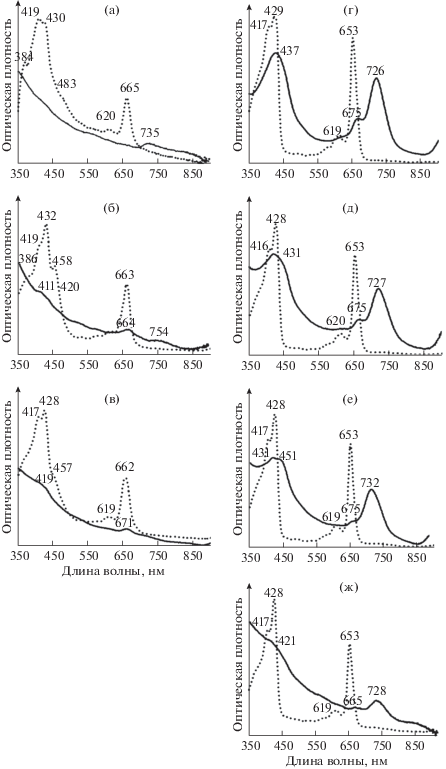
В теплое время года среди АФБ подавляюще доминировали з/о ЗСБ. В сентябре 2013 г. на глубине 1.9 м было не менее 105 кл. мл–1 з/о ЗСБ, в то время как количество ПСБ не превышало 0.1 × 103 кл. мл–1, а количество пурпурных несерных бактерий (ПНБ) было не более 0.6 × 103 кл. мл–1. В сентябре 2014 г. на глубине 2–2.1 м сформировался высокоплотный слой микроорганизмов, основной составляющей которого явились з/о ЗСБ. Интересно, что в посевах проб воды сентября 2014 г. пурпурные бактерии встречались ниже высокоплотного зеленого слоя, при этом количество ПНБ снизилось до 0.4 × 103 кл. мл–1 (на 2.2 м), в то время как ПСБ практически отсутствовали. К/о ЗСБ в летние сезоны высевались из проб воды верхней части сероводородной зоны (в том числе и из высокоплотного слоя), в виде единичных, обычно прозрачных и быстро исчезающих колоний.
Характеристика выделенных аноксигенных фототрофных бактерий. В разные сезоны исследований из воды озера были выделены 4 штамма АФБ: зеленоокрашенные зеленые серобактерии GrTcv12, коричневоокрашенные зеленые серобактерии PhvTcv-s14, пурпурные серобактерии AmTсv13 и пурпурные несерные бактерии RpmpTcv12.
В марте 2012 г. зеленоокрашенные ЗСБ GrTcv12 были выделены из пробы озерной воды с глубины 1 м. Клетки культуры были мелкие, неподвижные, округлые или овальные, размером 0.3–0.5 × × 0.6–0.8 мкм, содержали газовые вакуоли и могли быть одиночными или образовывали короткие (несколько клеток) и длинные (более 20 клеток) изогнутые нити. Некоторые отдельные клетки были крупнее и достигали размеров 0.3–0.8 × 1–1.5 мкм (рис. 7а–7в). Культура оказалась солоноватоводной, оптимальная соленость для роста штамма GrTcv12 составляла 5–10 г л–1 NaCl. Фотосинтетическими пигментами были Бхл d и каротиноид хлоробактин. Спектры штамма ЗСБ GrTcv12 полностью совпали со спектрами озерной воды, а также были близки к спектрам з/о ЗСБ, выделенных нами ранее из оз. Кисло-Сладкое (рис. 8а) (Лунина и соавт., 2014). По данным сиквенса гена 16S рДНК штамм з/о ЗСБ GrTcv13 (GenBank MH509940) имел 99% сходства с з/о тиосульфат-зависимым штаммом Chlorobium phaeovibrioides DSM 265 (номер Генбанка CP000607.1), а также с з/о штаммами Chlorobium spp. ChlvPS10 (номер Генбанка KC702852.1), PrPS10 (номер Генбанка KC702854.1), к/о штаммом PhvPS10 (номер Генбанка KC702853.1), выделенными нами из оз. Кисло-Сладкое (Кандалакшский залив Белого моря).
Рис. 7.
Морфология и ультратонкое строение клеток аноксигенных фототрофных бактерий из оз. Трехцветное: GrTc-v12 (а–в), BrTcv-s14 (г, д), AmTcv13 (е, ж), RpmpTcv12 (з–к). Световой микроскоп, фазовый контраст (а, б, г, е, з); электронные микрофотографии тотального препарата (и) и ультратонких срезов клеток бактерий (в, д, ж, к). Обозначения: Г.в. – газовые вакуоли; Хс – хлоросомы; Хф – хроматофоры; S – капли серы; Лт – ламеллярные тилакоиды.
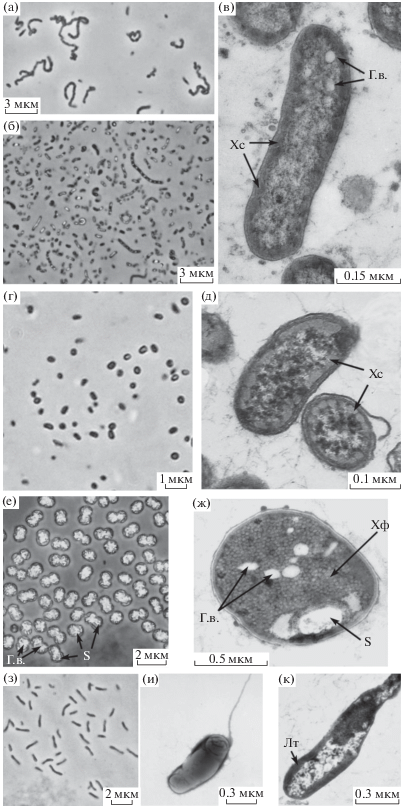
Рис. 8.
Спектры аноксигенных фототрофных бактерий из оз. Трехцветное: а – зеленоокрашенные ЗСБ GrTcv12; б – коричневоокрашенные ЗСБ BrTcv-s14; в – пурпурные серобактерии AmTcv13; г – несерные пурпурные бактерии RpmpTcv-12. Сплошная линия – спектр живой культуры в глицерине, пунктирная линия – спектр ацетон-метанольного экстракта пигментов (7 : 2).
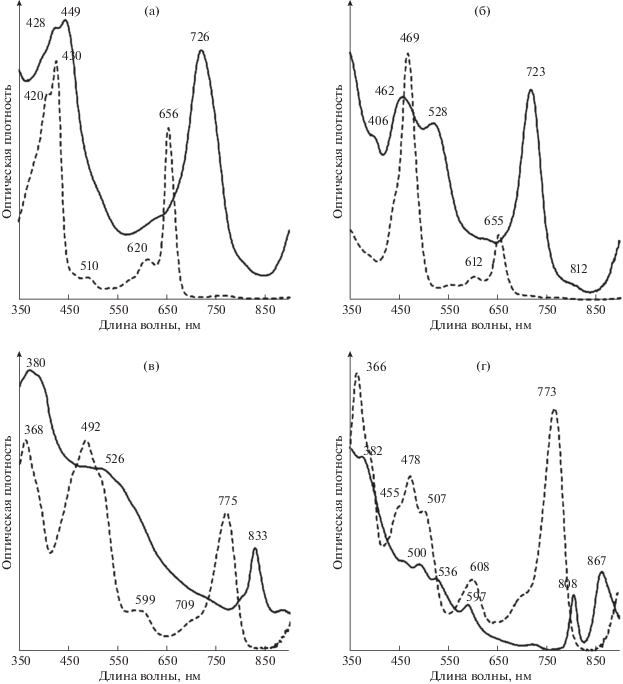
Коричневоокрашенные ЗСБ PhvTcv-s14, были выделены из колонии, выросшей на агаризованной среде при посеве озерной воде с глубины 2.2 м (сентябрь 2014 г.). В накопительных флаконах роста к/о ЗСБ не наблюдалось. Клетки культуры обычно были округлые или слабоизогнутые, неподвижные, размером 0.3–0.5 мкм, газовых вакуолей не содержали (рис. 7г, 7д). Культура хорошо вырастала при солености 5–20 г л–1 NaCl, оптимальная соленость для роста штамма PhvTcv-s14 составляла 10 г л–1 NaCl. Фотосинтетическими пигментами были Бхл е и каротиноид изорениератин. Спектры живой культуры и ацетон-метанольных экстрактов пигментов штамма PhvTcv-s14 совпадали со спектрами к/о ЗСБ штамма PhvPS10, выделенного из оз. Кисло-Сладкое в 2010 г. (рис. 8б). Штамм к/о ЗСБ PhvTcv-s14 (GenBank MH509941) имел 99% сходства с з/о штаммом GrTcv13, а также по 99% сходства с к/о Chlorobium phaeovibrioides DSM 265 и ЗСБ из оз. Кисло-Сладкое: з/о ChlvPS10, з/о PrPS10, к/о PhvPS10. Таким образом, наши данные показали, что как з/о ЗСБ, так и к/о ЗСБ из оз. Трехцветное относятся к двум морфотипам известного вида Chlorobium phaeovibrioides, причем зеленый морфотип содержит газовые везикулы, что ранее не отмечалось для бактерий данного вида.
В оз. Трехцветное обнаружены как соленоводные, так и пресноводные пурпурные бактерии. Галофильные пурпурные серобактерии AmTсv13 были выделены из пробы воды с глубины 1.5 м (март 2013 г.). Это были неподвижные округлые клетки 1–1.7 мкм в диаметре, содержащие газовые вакуоли и капли серы (рис. 7е, 7ж). Фотосинтетическими пигментами были Бхл а и каротиноиды океноновой серии. Культура хорошо вырастала при солености 10–35 г л–1 NaCl, оптимальная соленость составляла 10 г л–1. Спектры живой культуры и ацетон-метанольных экстрактов пигментов штамма AmTсv13 были близки спектрам окенонсодержащих штаммов AmPS10 и TcyrPS10, выделенных из оз. Кисло-Сладкое в сентябре 2010 г. (рис. 8в). Штамм пурпурных серобактерий AmTсv13 (GenBank MG193753), содержащий каротиноиды океноновой серии, имел по 99% сходства с типовыми штаммами: спириллоксантин-содержащим штаммом Thiocapsa rosea DSM 235T (GenBank AJ006062), окенон-содержащим штаммом Thiocapsa marina DSM 5653T (GenBank FM178270.1), а также с окенон-содержащим штаммом Thiocapsa sp. AmPS10 (GenBank КС702856) из оз. Кисло-Садкое.
Пурпурные несерные бактерии штамм RpmpTcv12- были выделены из единичных колоний, выросших на агаре при выделении ЗСБ (март 2012 г.). Клетки культуры – подвижные палочки (0.4–0.6 × 1.5–2 мкм), содержали Бхл а и каротиноиды спириллоксантиновой серии (рис. 7з–7к, 8г). Культура не росла при концентрации NaCl выше 15 г л–1. Присутствие пресноводного вида пурпурных несерных бактерий в воде хемоклина можно объяснить поступлением пресных вод с заболоченных берегов водоема. Штамм пурпурных несерных бактерий RpmpTcv12- (GenBank MG193752) имел по 99% сходства со штаммами Rhodopseudomonas palustris HaA2 и BisB5 (номер Генбанка CP000250.1 и CP000283.1).
ОБСУЖДЕНИЕ
Озеро Трехцветное является вторым стратифицированным водоемом на берегу Кандалакшского залива Белого моря, подробно исследованным нами (после оз. Кисло-Сладкое) с точки зрения видового разнообразия АФБ. Озеро Трехцветное является меромиктическим, хотя в экстраординарных случаях меромиксия этого водоема частично нарушается, что наблюдалось последний раз осенью 2011 г. Галоклин и термоклин озера практически совпадают, что гарантирует стабильное положение границы, разделяющей соленоводную сероводородную и сильно распресненную кислородную зоны водоема. Граница сероводородной зоны находится на глубине 1.8–1.9 м и хорошо освещена. При максимальной глубине всего 7.5 м, глубинные воды озера содержат рекордные концентрации сульфида (более 600 мг л–1), что обеспечивает формирование сверхплотного слоя з/о ЗСБ сразу под редокс-зоной.
Все выделенные нами бактерии из оз. Трехцветное оказались филогенетически очень близки бактериям, ранее выделенным из оз. Кисло-Сладкое, и были определены как зеленые и коричневые морфотипы известного вида Chlorobium phaeovibrioides, имея между собой 99% сходства по данным сиквенса гена 16S рРНК. Коричневый морфотип этого же вида ЗСБ доминировал в известном заполярном меромиктическом оз. Могильное (Лунина и соавт., 2005). Этот факт говорит о возможной зависимости видовой идентичности ЗСБ от географической близости водоемов, имеющих связь с морем, в приполярных и заполярных районах.
Тем не менее, оз. Трехцветное отличается от оз. Кисло-Сладкого и других ранее исследованных водоемов сразу двумя уникальными чертами: образованием высокоплотного слоя зеленых серобактерий и необычным положением коричневоокрашенных ЗСБ в верхней части сообщества АФБ, что было отмечено также М.Ю. Горбуновым (устное сообщение).
Мы полагаем, что причины этих особенностей кроются в чрезвычайно резких градиентах гидрохимических параметров зоны хемо- и галоклина, вследствие чего сразу под хемоклином формируется бактериальное сообщество высокой плотности. В сентябре 2014 г. в 10-см слое зеленой воды на границе кислородной и сероводородной зон зарегистрированная плотность бактериальных клеток была не менее 108 кл. мл–1. Небольшая толщина такого плотного зеленого слоя может зависеть от подпирающего снизу мощного потока сероводорода. Мы полагаем, что наибольшая плотность клеток ЗСБ сосредоточена в верхней части зеленого слоя может быть даже несколько выше полученных нами значений, что связано с неизбежным захватом при пробоотборе воды из соседних горизонтов с меньшей плотностью ЗСБ.
Следствием высокой плотности слоя, состоящего, в основном, из зеленоокрашенных клеток, является необычное положение в летние сезоны слоя коричневоокрашенных ЗСБ. Практически полное отсутствие жизнеспособных клеток к/о ЗСБ в посевах свидетельствует о неприспособленности этих бактерий к росту в условиях интенсивного освещения. Однако отмеченное нами в сентябре 2013 г. полное поглощение света плотным слоем з/о ЗСБ свидетельствует также и о невозможности развития к/о форм ЗСБ в обычной для них экологической нише под слоем з/о ЗСБ. Таким образом, развитие к/о серобактерий в озере в летние сезоны оказывается сильно подавленным избытком освещения в верхней части хемоклина, конкурентным вытеснением со стороны быстро растущих з/о клеток внутри плотного слоя, полным отсутствием света под высокоплотным слоем бактериальной пластинки.
Интересно, что в зимний сезон 2012 г., когда из-за заброса морской воды произошло нарушение хемоклина, и сероводородная зона поднялась под самый лед, проникающего поверхностного освещения хватило для поддержания развития з/о форм ЗСБ, тогда как развития к/о форм не происходило. Зимой 2013 г. в связи с отдалением зоны хемоклина от поверхности льда, недостаток поверхностного освещения начинал сдерживать развитие з/о форм ЗСБ, и в верхней части сероводородной зоны создавались благоприятные условия для развития к/о ЗСБ. В этот сезон ниже глубины 1.5 м, где при отсутствии света клетки ЗСБ представлены, в основном, отмирающей и оседающей биомассой, пик з/о ЗСБ (430 нм) превалировал над пиком к/о ЗСБ (470 нм). Это говорит о том, что, несмотря на глубокую адаптацию к чрезвычайно низкому освещению, развитие к/о ЗСБ в зимние сезоны в озере не достигает такого размаха, как развитие з/о ЗСБ в летние сезоны, что, вероятно, связано с низкой скоростью роста к/о ЗСБ при слабом освещении.
После таяния льда, з/о клетки с присущей им r-стратегией развития (для которой свойственны высокая плодовитость, небольшие размеры, относительно короткое время жизни поколения и способность быстрого и широкого распространения) очень быстро достигали высокой плотности, и слой к/о ЗСБ оказывался запертым между плотным слоем з/о ЗСБ и кислородным слоем, с последующим вытеснением к/о клеток в кислородную зону, где к/о ЗСБ, будучи строгими анаэробами, быстро теряли жизнеспособность. Тот факт, что из высокоплотного слоя происходило высевание единичных колоний к/о ЗСБ, свидетельствует о сохранении единичных жизнеспособных клеток к/о ЗСБ в сообществе.
Примечательно, что развитие пурпурных серобактерий, содержащих газовые вакуоли, также оказалось сильно подавленным. Об этом свидетельствует отсутствие пурпурных бактерий в посевах проб воды марта 2012 г. и сентября 2014 г. Развитие сколько-нибудь заметного количества ПСБ (3.4 × 103 кл. мл–1) происходило в течение 2012–2013 гг. в условиях широкого и разреженного слоя зеленой воды. В этот период становления сообщества АФБ хемоклина вполне ожидаемым казалось бы формирование двух разноокрашенных слоев по примеру двуслойного сообщества оз. Шунет, в котором глубина, профиль сероводорода в водной толще и концентрация сероводорода у дна практически совпадают с таковыми в оз. Трехцветное (Лунина и соавт., 2007). Однако в оз. Трехцветное такого не происходит, что, по-видимому, связано с высокой скоростью роста клеток з/о ЗСБ, по сравнению со скоростью роста клеток ПСБ и с установлением резких градиентов кислорода и сероводорода в очень узкой (10 см), в отличие от оз. Шунет (25 см), зоне хемоклина.
Первый автор от всей души благодарит замечательную актрису Ксению Лаврову-Глинку, вдохновляющие кинематографические работы которой служили настоящим двигателем при осознании и изложении непростого материала настоящей статьи. Авторы выражают искреннюю благодарность директору Беломорской биологической станции МГУ им. Н.А. Перцова А.Б. Цетлину, заведующему А.В. Савченко, водителям катеров и снегоходов В.В. Сивонену, В.Т. Колбыко, коллегам по летним и зимним экспедициям А.Н. Пантюлину, С.В. Пацаевой, Г.Н. Лосюк за помощь в проведении полевых исследований. Работа выполнена по теме госзадания (№ госрегистрации 01201350937), а также с использованием финансовых средств проектов РФФИ № 16-05-00548 и 17-04-01263. Идентификация бактерий выполнена в рамках выполнения государственного задания № 0104-2014-0203 с использованием научного оборудования ЦКП “Биоинженерия.
Список литературы
Васильчук Ю.К., Фролова Н.Л., Краснова Е.Д., Буданцева Н.А., Васильчук А.К., Добрыднева Л.В., Ефимова Л.Е., Терская Е.В., Чижова Ю.Н. Изотопно-геохимический состав воды в меромиктическом озере Трехцветном на Беломорском побережье // Водные ресурсы. 2016. Т. 43. С. 555–566. Vasil’chuk, Yu.K., Frolova, N.L., Krasnova, E.D., Budantseva, N.A., Vasil’chuk, A.C., Dobrydneva, L.V., Efimova, L.E., Terskaya, E.V., and Chizhova, Ju.N., Water isotopic-geochemical composition in the Trekhtsvetnoe meromictic lake on the White Sea coast, Water Res., 2016, vol. 43, pp. 828–838.
Горленко В.М., Дубинина Г.А., Кузнецов С.И. Экология водных микроорганизмов. М.: Наука, 1977. С. 181–192.
Горленко В.М., Михеев П.В., Русанов И.И., Пименов Н.В., Иванов М.В. Эко-физиологические свойства фотосинтезирующих бактерий из зоны хемоклина Черного моря // Микробиология. 2005. Т. 74. С. 239–247.
Gorlenko V.M., Mikheev P.V., Rusanov I.I., Pimenov N.V., Ivanov M.V. Ecophysiologocal properties of photosynthetic bacteria from the Black Sea chemocline zone // Microbiology (Moscow). 2005. V. 74. P. 201–209.
Дубинин А.В., Демидова Т.П., Кременецкий В.В., Кокрятская Н.М., Римская-Корсакова М.Н., Якушев Е.В. Определение восстановленных форм серы в анаэробной зоне Черного моря: сравнение методов спектрофотометрии и иодометрии // Океанология. 2012. Т. 52. С. 200–209.
Dubinin A.V., Demidova T.P., Kremenetskii V.V., Rimskaya-Korsakova M.N., Kokryatskaya N.M., Yakushev E.V. Determination of the reduced sulfur species in the anoxic zone of the Black Sea: A comparison of the spectrophotometry and iodometry techniques // Oceanology. 2012. V. 52. P. 181–190.
Краснова Е.Д., Пантюлин А.Н., Белевич Т.А., Воронов Д.А., Демиденко Н.А., Житина Л.С., Ильяш Л.В., Кокрятская Н.М., Лунина О.Н., Мардашова М.В., Прудковский А.А., Саввичев А.С., Филиппов А.С., Шевченко В.П. Комплексные исследования отделяющихся водоемов на разных стадиях изоляции от Белого моря в марте 2012 г. // Океанология. 2013. Т. 53. С. 714–717.
Krasnova E.D., Belevich T.A., Zhitina L.S., Ilyash L.V., Mardashova M.V., Prudkovsky A.A., Pantyulin A.N., Voronov D.A., Demidenko N.A., Kokryatskaya N.M., Lunina O.N., Savvichev A.S., Filippov A.S., Shevchenko V.P. Multidisciplinary studies of the separating lakes at different stage of isolation from the White Sea performed in March 2012 // Oceanology. 2013. V. 53. P. 639–642.
Краснова Е.Д., Воронов Д.А., Демиденко Н.А., Кокрятская Н.М., Пантюлин А.Н., Рогатых Т.А., Самсонов Т.Е., Фролова Н.Л. К инвентаризации реликтовых водоемов, отделяющихся от Белого моря // Комплексные исследования Бабьего моря, полу-изолированной беломорской лагуны: геология, гидрология, биота – изменения на фоне трансгрессии берегов / Труды Беломорской биостанции МГУ. М.: Товарищество научных изданий КМК, 2016. Т. 12. С. 211–241.
Краснова Е.Д., Демиденко Н.А., Пантюлин А.Н., Фролова Н.Л., Ефимова Л.Е., Широкова В.А. Термический и ледовый режимы реликтовых водоемов, отделяющихся от Белого моря // Динамика и термика рек, водохранилищ и прибрежной зоны морей / Труды VIII Межд. научно-практической конф.: в 2 томах. М.: Российский университет дружбы народов, 2014. С. 430–443.
Лунина O.Н., Горленко В.М., Попова О.А., Акимов В.Н., Русанов И.И., Пименов Н.В. Сезонные изменения структуры сообщества аноксигенных фототрофных бактерий реликтового озера Могильное (о. Кильдин, Баренцево море) // Микробиология. 2005. Т. 74. С. 677–686.
Lunina O.N., Gorlenko V.M., Solov’eva O.A., Akimov V.N., Rusanov I.I., Pimenov N.V. Seasonal changes in the structure of the anoxygenic phototrophic bacterial community in Lake Mogilnoe, a relict lake on Kil’din Island in the Barents Sea // Microbiology (Moscow). 2005. V. 74. P. 588–596.
Лунина О.Н., Брянцева И.А., Акимов В.Н., Русанов И.И., Рогозин Д.Ю., Баринова Е.С., Лысенко А.М., Пименов Н.В. Сезонные изменения структуры сообщества аноксигенных фототрофных бактерий озера Шунет (Хакасия) // Микробиология. 2007. Т. 76. С. 416–428.
Lunina O.N., Bryantseva I.A., Akimov V.N., Rusanov I.I., Rogozin D.Yu., Barinova E.S., Lysenko A.M., Pimenov N.V. Seasonal changes in the structure of the anoxygenic photosynthetic bacterial community in Lake Shunet, Khakassia // Microbiology (Moscow). 2007. V. 76. P. 368–379.
Лунина О.Н., Кевбрина М.В., Акимов В.Н., Пименов Н.В. Сообщество аноксигенных фототрофных бактерий горного меромиктического озера Гек-Гёль (Азербайджан) // Микробиология. 2008. Т. 77. С. 675–682.
Lunina O.N., Kevbrina M.V., Akimov V.N., Pimenov N.V. Anoxygenic phototrophic bacteria of the high-altitude meromictic lake Gek-Gel, Azerbaijan // Microbiology (Moscow). 2008. V. 77. P. 602–609.
Лунина О.Н. Пименов Н.В. Аноксигенные фототрофные бактерии в карстовых меромиктических озерах Среднего Поволжья // Биоразнообразие и типология карстовых озер Среднего Поволжья / Под ред.Мингазовой Н.М. Казанский гос. ун-т, 2009. С. 121–135.
Лунина О.Н., Саввичев А.С., Кузнецов Б.Б., Пименов Н.В., Горленко В.М. Аноксигенные фототрофные бактерии стратифицированного озера Кисло-Сладкое, (Кандалакшский залив Белого моря) // Микробиология. 2014. Т. 83. С. 90–108.
Lunina O.N., Savvichev A.S., Kuznetsov B.B., Pimenov N.V., Gorlenko V.M. Anoxygenic phototrophic bacteria of the Kislo-Sladkoe stratified lake (White Sea, Kandalaksha Bay) // Microbiology (Moscow). 2013. V. 82. P. 815–832.
Романенко Ф.А., Шилова О.С. Послеледниковое поднятие Карельского берега Белого моря по данным радиоуглеродного и диатомового анализов озерно-болотных отложений п-ова Киндо // Докл. РАН. 2012. Т. 442. С. 544–548.
Romanenko F.A., Shilova O.S. The postglacial uplift of the Karelian Coast of the White Sea according to radiocarbon and diatom analyses of Lacustrine-Boggy deposits of Kindo Peninsula // Doklady Earth Sciences. 2012. V. 442. P. 242–246.
Casamayor E.O., Schafer H., Baneras L., Pedros-Alio C., Muyzer G. Identification of and spatio-temporal differences between microbial assemblages from two neighboring sulfurous lakes: comparison by microscopy and denaturing gradient gel electrophoresis // Appl. Environ. Microbiol. 2000. V. 66. P. 499–508.
Ecology of Meromictic Lakes / Eds. Gulati R.D., Zadereev E.S., Degermendzhi A.G. Cham: Springer Int. Publ., 2017. V. 228. 405 p.
Hobbie J.T., Daley R.J., Jasper S. Use of Nucleopore filters for counting bacteria by fluorescence microscopy // Appl. Environ. Microbiol. 1977. V. 33. P. 1225–1228.
Gorlenko V.M., Vainshtein M.B., Kachalkin V.I. Microbiological characteristic of lake Mogilnoye // Arch. Hydrobiol. 1978. V. 81. P. 475–492.
Krasnova E., Voronov D., Frolova N., Pantyulin A., Samsonov T. Salt lakes separated from the White Sea // EARSeL eProceedings. 2015. V. 14. P. 8–22.
Manske A.K., Glaeser J., Kuypers M.M.M., Overmann J. Physiology and phylogeny of green sulfur bacteria forming a monospecific phototrophic assemblage at a depth of 100 meters in the Black Sea // Appl. Environ. Microbiol. 2005. V. 71. P. 8049–8060.
Montesinos E., Guerrero R., Abella C., Esteve I. Ecology and physiology of the competition for light between Chlorobium limicola and Chlorobium paeobacteroides in natural habitans // Appl. Environ. Microbiol. 1983. V. 46. P. 1008.
Nikitina A.S., Kharlampieva D.D., Babenko V.V., Shirokov D.A., Vakhitova M.T., Manolov A.I., Shkoporov A.N., Taraskina A.E., Manuvera V.A., Lazarev V.N., Kostryukova E.S. Complete genome sequence of an enterotoxigenic Bacteroides fragilis clinical isolate // Genome Announc. 2015. V. 3. doi 10.1128/ genomeA.00450-15
Overmann J., Tilzer M.M. Control of primary productivity and the significance of photosynthetic bacteria in a meromictic kettle lake Mittlerer Buchensee, West-Germany // Aquatic Sci. 1989. V. 51. P. 4.
Overmann J., Beatty J.T., Hall K.J. Pfennig N., Northcote T.G. Characterization of a dense, purple sulfur bacterial layer in a meromictic salt lake // Limnol. Oceanogr. 1991. V. 36. P. 846–859.
Overmann J., Beatty J.T., Hall K.J. Purple sulfur bacteria control the growth of aerobic heterotrophic bacterioplancton in a meromictic salt lake // Appl. Environ. Microbiol. 1996. V. 62. P. 3251–3258.
Pfennig N., Lippert K.D. Über das Vitamin B12-Bedürfnis phototropher Schwefelbakterien // Arch. Mikrobiol. 1966. V. 55. P. 245–256.
Savvichev A., Babenko V., Lunina O., Letarova M., Boldyreva D., Weslopolova E., Demidenko N., Kokryatskaya N., Krasnova E., Gaysin V., Kostryukova E., Gorlenko V., Letarov A. Sharp water column stratification with an extremely dense microbial population in a small meromictic lake Trekhtzvetnoe // Environmental Microbiology and Environmental Microbiology Reports. 2018. In press.
Smith J.H.C., Benitez A. Chlorophylls: analysis in plant materials // Moderne Methoden der Pflanzenanalyse / Ed. Peach K., Tracey M.V. Berlin–Gottingen–Heidelberg: Springer, 1955. V. 4. P. 142–196.
Thiel V., Tank M., Neulinger S.C., Gehrmann L., Dorador C., Imhoff J.F. Unique communities of anoxygenic phototrophic bacteria in saline lakes of Salar de Atacama (Chile) // FEMS Microbiol. Ecol. 2010. V. 74. P. 510–522.
Van Gemerden H., Mas J. Ecology of phototrophic sulfur bacteria // Anoxygenic Photosynthetic Bacteria / Eds. Blankenship R.E., Madigan M.T., Bauer C.E. New York: Kluwer Academic, 1995. P. 49–85.
Vila X., Guyoneaud R., Cristina X.P., Figueras J.B., Abella C.A. Green sulfur bacteria from hypersaline Chiprana Lake (Monegros, Spain): habitat description and phylogenetic relationship of isolated strains // Photosynth. Res. 2002. V. 71. P. 165–172.
Дополнительные материалы отсутствуют.


