Микробиология, 2019, T. 88, № 4, стр. 497-500
Роль внеклеточного полимерного матрикса в защитном эффекте при действии антибиотика азитромицина на Chromobacterium violaceum
М. В. Журина a, Ю. А. Николаев a, В. К. Плакунов a, *
a Федеральный исследовательский центр “Фундаментальные основы биотехнологии” Российской академии наук, Институт микробиологии им. С.Н. Виноградского
119071 Москва, Россия
* E-mail: plakunov@inmi.ru
Поступила в редакцию 28.02.2019
После доработки 25.03.2019
Принята к публикации 01.04.2019
В предыдущей работе мы показали, что грамотрицательная бактерия Escherichia coli ET12567 pRAG56, содержащая плазмиду, которая кодирует фермент аминогликозидфосфотрансферазу, инактивирующий канамицин, оказывает защитный эффект при действии антибиотика канамицина на грамположительную бактерию Micrococcus thailandicus НВ в бинарных биопленках этих двух культур. Аналогичное защитное действие в отношении антибиотика оксациллина проявляет штамм дикого типа E. coli K-12 (не содержащий ферментов инактивирующих антибиотики) в бинарных биопленках с грамположительной бактерией Kocuria rhizophila 4А-2Ж. В последнем случае нами высказано предположение, что защитный эффект обусловлен барьерной ролью внеклеточного полимерного матрикса (ВПМ) бинарных биопленок, ограничивающего поступление антибиотика внутрь биопленки (Плакунов и соавт., 2019).
Работы, посвященные роли ВПМ как барьера для проникновения антибиотиков в микробные биопленки, не дают однозначного ответа на вопрос о возможности такого защитного эффекта. С одной стороны, в ранних работах постулирована диффузионно-барьерная и сорбционная роль ВПМ в отношении органических веществ, в том числе биоцидов (Flemming, Wingender, 2010), но, с другой стороны, при проведении более глубоких исследований показано, что ВПМ проявляет выраженную специфичность во взаимодействии с органическими и неорганическими веществами в зависимости от своего химического состава и условий окружающей среды и не обязательно ограничивает проникновение биоцидов в биопленку (Flemming, 2016; Tallawi et al., 2016; Singh et al., 2017). Возможно, что противоречивые данные о роли ВПМ обусловлены недооценкой особенностей его состава и строения даже у близких в таксономическом и физиологическом отношении микроорганизмов. Для корректного выявления защитной роли ВПМ требуется сопоставление микроорганизмов, сходных во всех отношениях, кроме особенностей архитектуры ВПМ.
Целью данной работы было изучение защитного эффекта в отношении антибиотика азитромицина, оказываемого штаммом WT Chromobacterium violaceum ATCC 31532 на мутантный биосенсорный штамм C. violaceum CV026.
Эти штаммы идентичны по биохимическим и ростовым характеристикам, но мутантный штамм неспособен синтезировать N-ацилгомосеринлактоны (С6-АГЛ) – сигнальные компоненты глобальной регуляторной системы quorum sensing, поскольку у него в результате инсерции транспозона мини Tn5 инактивирован ген cvil, кодирующий синтетазу С6-АГЛ, вследствие чего его биопленки содержат дефектный ВПМ, значительно меньшей толщины и упрощенной архитектуры, чем у штамма дикого типа (Журина и соавт., 2013; Kamaeva et al., 2014). Поскольку моновидовые биопленки мутанта примерно на порядок чувствительнее к антибиотику азитромицину, чем моновидовые биопленки штамма WT, данные объекты позволяют проверить возможность проявления защитной реакции, связанной с барьерной ролью ВПМ. Статистическую обработку результатов проводили как в предыдущей статье (Плакунов и соавт., 2019).
Для выявления защитного эффекта C. violaceum WT в отношении мутанта CV026 использовали ранее описанные подходы (Плакунов и соавт., 2019) с некоторыми изменениями. Культуры хранили на столбиках полужидкой (0.3% агара) среды LA (среда LB с добавлением 0.3% агара) под вазелиновым маслом при комнатной температуре. Культуры перед опытом рассевали методом “истощающего штриха” на чашки Петри с плотной средой LA (среда LB с 2% агара). Выбирали типичную колонию и засевали в 50 мл жидкой среды LB. Культуры выращивали 24 ч при 30°С на качалке (150 об./мин), разбавляли стерильной средой LB до условной оптической плотности (светоплоглощение + светорассеяние), равной 1, и наносили по 50 мкл для получения биопленок-колоний на фильтры из стекловолокна размером 2.5 × 2.5 см (Whatman GF/F, диаметр пор 0.6–0.8 мкм). Фильтры размещали на поверхности плотной среды LA и инкубировали 24 ч при комнатной температуре для предформирования биопленок. После этого фильтры стерильно переносили на чашки Петри с плотной средой LA, содержащей 2 или 5 мкг/мл антибиотика азитромицина. Часть фильтров использовали для определения исходного содержания метаболически активных бактерий. Контрольные фильтры накладывали на чашки без антибиотика. Использованные концентрации азитромицина являются бактериостатическими для планктонных культур обоих штаммов и подавляют рост моновидовых биопленок мутанта на 70–80%, практически не влияя на рост моновидовых биопленок штамма WT (Мартьянов и соавт., 2015). Чашки с фильтрами инкубировали 48 ч при 30°C и окрашивали МТТ, как описано в предыдущей статье (Плакунов и соавт., 2019). Данные определения количества метаболически активных бактерий показаны на рис. 1.
Рис. 1.
Количество метаболически активных бактерий в моновидовых и бинарной предформированных биопленках в отсутствие и в присутствии азитромицина (Аз), измеряемое по восстановлению МТТ: 1 – моновидовая биопленка C. violaceum WT; 2 – моновидовая биопленка мутанта C. violaceum CV026; 3 – бинарная биопленка (CV026 + WT).
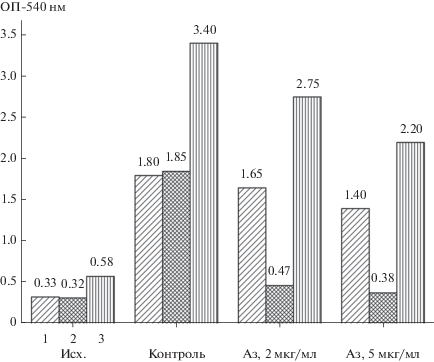
Как можно судить по результататам, представленным на рис. 1, C. violaceum WT проявляет достоверный защитный эффект в отношении мутанта CV026, поскольку количество метаболически активных бактерий в бинарной биопленке превышает их суммарное количество в моновидовых биопленках на 30% (при 2 мкг/мл азитромицина) и на 24% (при 5 мкг/мл азитромицина), что соответствует уровню значимости р < 0.05. Поскольку ранее нами было показано, что присутствие азитромицина не влияет на скорость восстановления МТТ C. violaceum, а использованные концентрации азитромицина практически не влияют на рост биопленок C. violaceum WT, это превышение можно объяснить только увеличением роста мутанта CV026 в составе бинарной биопленки.
К сожалению, в данных экспериментах нам не удалось применить ранее разработанный кинетический метод выявления защитного эффекта, основанный на различиях скоростей восстановления МТТ изучаемыми микроорганизмами (Плакунов и соавт., 2019), поскольку у обоих изученных штаммов скорость восстановления МТТ практически одинакова. Поэтому в качестве альтернативного доказательства защитного эффекта использовали подсчет числа КОЕ. Сложность задачи заключалась в том, что колонии изучаемых штаммов морфологически практически не различаются, поскольку молодые колонии штамма WT не окрашены и синтезируют пигмент виолацеин только на поздних стадиях роста. А мутант CV026 вообще неспособен синтезировать этот пигмент в отсутствие С6-АГЛ в среде, и его колонии также не окрашены. Как нам удалось установить, добавление в среду небольших количеств (не более 1 мкг/мл) С6-АГЛ вызывает синтез виолацеина и окрашивание колоний мутанта CV0267, но не влияет на окраску колоний штамма WT (Мартьянов и соавт., 2018). Более того, как показали предварительные опыты, вносить С6-АГЛ в бинарную биопленку нет необходимости, поскольку его количество, образуемое и выделяемое в среду штаммом WT, достаточно для синтеза виолацеина и окрашивания колоний мутанта CV026. Это позволяет легко выявить колонии мутанта в бинарной биопленке в присутствии штамма WT (рис. 2 и рисунок S ).
Рис. 2.
Число КОЕ: в моновидовой (А) и бинарной (Б) предформированных биопленках C. violaceum CV026; а также в моновидовой (В) и бинарной (Г) предформированных биопленках C. violaceum WT. 1 – исходная биопленка; 2 – контроль без азитромицина; 3–4 – в присутствии азитромицина (3 – 2 мкг/мл; 4 – 5 мкг/мл).
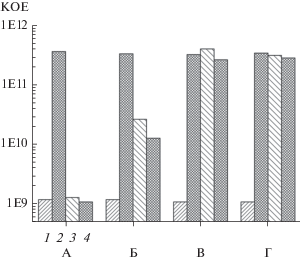
Подсчет числа КОЕ проводили по использованной ранее методике (Плакунов и соавт., 2019). Количественные данные подсчета числа КОЕ в бинарных биопленках для каждого из данных штаммов представлены на рис. 2.
Очевидно, что число жизнеспособных бактерий мутанта C. violaceum CV026 в бинарной биопленке (2.7 × 1010) многократно превышает их число в моновидовой биопленке при той же концентрации (2 мкг/мл) азитромицина (1.3 × 109). Аналогичная ситуация при концентрации азитромицина 5 мкг/мл: в моновидовой биопленке КОЕ для C. violaceum CV026 составляет 1.1 × 109, а в бинарной биопленке – 1.3 × 1010. Таким образом, C. violaceum WT с нормальным ВПМ оказывает защитное действие на мутант с дефектным ВПМ.
Наиболее вероятной причиной этого эффекта является связывание антибиотика компонентами матрикса C. violaceum WT. Средняя толщина матрикса биопленок C. violaceum WT (284 нм), измеренная методом лазерной интерференционной микроскопии, почти на порядок превышает среднюю толщину матрикса биопленок мутанта C. violaceum CV026 (30 нм) (Журина и соавт., 2013). Методом окрашивания матрикса с помощью специфичного к полисахаридам красителя диметилметиленового синего нами было показано значительное (почти на порядок) снижение содержания отрицательно заряженных полисахаридов в матриксе биопленок мутанта C. violaceum CV026 по сравнению с исходным штаммом C. violaceum WT (Мартьянов и соавт., 2015). Поскольку молекула азитромицина обладает основными свойствами, он активно связывается с кислыми полисахаридами, что и может служить основной причиной барьерной функции матрикса биопленок C. violaceum WT в отношении этого антибиотика.
Как мы предполагаем, защитный эффект в бинарной биопленке проходит два этапа (об этом можно судить по появлению окраски колоний, вызваннoй синтезом виолацеина, образование которого, как известно, является индикатором синтеза ВПМ). На первом этапе формирующийся ВПМ штамма C. violaceum WT защищает клетки мутанта от действия антибиотика. В стадии предформирования биопленки концентрация С6-АГЛ, по-видимому, не достигает величины, необходимой для восстановления синтеза матрикса мутантом, поскольку биосинтез виолацеина у мутанта C. violaceum CV026 индуцируется при более низких концентрациях С6-АГЛ, чем синтез ВПМ (Журина и соавт., 2013), а предформированные бинарные биопленки не окрашены. На втором этапе роста уже предформированной бинарной биопленки мутант может приобретать некоторую способность к нормальному синтезу ВПМ (индикатором чего является окрашивание его клеток, вызванное синтезом виолацеина), а, следовательно, к защитному действию ВПМ штамма C. violaceum WT теоретически может частично добавиться собственный защитный эффект ВПМ мутанта C. violaceum CV026.
Таким образом, показано, что ВПМ может играть важную роль в устойчивости микробных биопленок к антибиотикам.
Список литературы
Журина М.В., Кострикина Н.А., Паршина Е.А., Стрелкова Е.А., Юсипович А.И., Максимов Г.В., Плакунов В.К. Визуализация внеклеточного полимерного матрикcа биопленок Chromobacterium violaceum с помощью микроскопических методов // Микробиология. 2013. T. 82. № 4. C. 502–509.
Zhurina M.V., Kostrikina N.A., Parshina E.Yu., Strelkova E.A., Yusipovich A.I., Maksimov G.V., Plakunov V.K. Visualization of the extracellular polymeric matrix of Chromobacterium violaceum biofilms by microscopic methods // Microbiology (Moscow). 2013. V. 82. P. 517–524.
Мартьянов С.В., Журина М.В., Эль-Регистан Г.И., Плакунов В.К. Активирующее действие азитромицина на формирование бактериальных биопленок и борьба с этим явлением // Микробиология. 2015. Т. 84. № 1. С. 27–36.
Mart’yanov S.V., Zhurina M.V., El’Registan G.I., Plakunov V.K. Activation of formation of bacterial biofilms by azithromycin and prevention of this effect // Microbiology (Moscow). 2014. V. 83. P. 723–731.
Мартьянов С.В., Летаров А.В., Иванов П.А., Плакунов В.К. Стимуляция биосинтеза виолацеина в биопленках Chromobacterium violaceum под воздействием диметилсульфоксида // Микробиология. 2018. Т. 87. № 3. С. 325–329.
Mart’yanov S.V., Letarov A.V., Ivanov P.A., Plakunov V.K. Stimulation of violacein biosynthesis in Chromobacterium violaceum biofilms in the presence of dimethyl sulfoxide // Microbiology (Moscow). 2018. V. 87. P. 437–440.
Плакунов В.К., Николаев Ю.А., Ганнесен А.В., Чемаева Д.С., Журина М.В. Новый подход к выявлению защитной роли Escherichia coli в отношении грамположительных бактерий при действии антибиотиков на бинарные биопленки // Микробиология. 2019 . Т. 88. № 3. С. 288–296.
Flemming H.C., Wingender J. The biofilm matrix // Nat. Rev. Microbiol. 2010. V. 8. P. 623–633.https://doi.org/10.1038/nrmicro2415
Flemming H.C. EPS-Then and Now // Microorganisms. 2016. V. 4. Pii. E41.https://doi.org/10.3390/microorganisms4040041
Kamaeva A.A., Vasilchenko A.S., Deryabin D.G. Atomic force microscopy reveals a morphological differentiation of Chromobacterium violaceum cells associated with biofilm development and directed by N-hexanoyl-L-homoserine lactone // PLoS One. 2014. V. 9. e103741.https://doi.org/10.1371/journal.pone.0103741
Singh S., Singh S.K., Chowdhury I., Singh R. Understanding the mechanism of bacterial biofilms resistance to antimicrobial agents // Open Microbiol. J. 2017. V. 11. P. 53–62.https://doi.org/10.2174/1874285801711010053
Tallawi M., Opitz M., Lieleg O. Modulation of the mechanical properties of bacterial biofilms in response to environmental challenges // Biomater. Sci. 2017. V. 2. P. 887–900.https://doi.org/10.1039/c6bm00832a
Дополнительные материалы отсутствуют.
Инструменты
Микробиология


