Микробиология, 2020, T. 89, № 1, стр. 121-128
Изменение структуры прокариотного сообщества в ризосфере рапса ярового (Brassica napus L.) в зависимости от внесения бактерий, утилизирующих 1-аминоциклопропан-1-карбоксилат
С. Н. Петрова a, *, Е. Е. Андронов b, А. А. Белимов b, Ю. В. Береговая a, В. А. Денщиков a, Д. Л. Минаков a
a ФГБОУ ВО Орловский государственный аграрный университет им. Н.В. Парахина
302019 Орел, Россия
b ФГБНУ ВНИИ сельскохозяйственной микробиологии
196608 Санкт-Петербург, Пушкин, Россия
* E-mail: svet-orl@yandex.ru
Поступила в редакцию 25.01.2019
После доработки 21.05.2019
Принята к публикации 29.06.2019
Аннотация
Для определения характеристик таксономической структуры микробиомов, колонизирующих ризосферную почву масличного рапса, использовали высокопроизводительное секвенирование полученных ампликонных библиотек гена 16S рРНК. Изучено влияние интродукции бактерий, обладающих АЦК-дезаминазной активностью, в ризосферное сообщество рапса на повышение его урожайности. Доминантами прокариотного комплекса являлись Proteobacteria, Actinobacteria, Gemmatimonadetes и Acidobacteria. Обнаружена обратная зависимость между таксонами Crenarchaeota и Proteobacteria (r = ‒0.71, P < 0.01). Все детектируемые археотные последовательности принадлежали представителям семейства Nitrososphaeraceae, непосредственно участвующим в интенсификации азотного питания растений. Внесение в почву АЦК-утилизирующих штаммов, независимо от уровня минерального питания, существенно снижало доли Crenarchaeota (63‒72%), Verrucomicrobia (42‒53%) и Bacteroidetes (50‒56%) за счет увеличения доли Proteobacteria (38%). Показано положительное влияние интродуцируемых бактерий на относительную численность метаболически значимых классов протеобактерий в ризосфере рапса ярового за счет улучшения физиологического состояния растений. Установлена достоверная связь между относительной численностью протеобактерий и продуктивностью растительно-микробной системы (r = 0.85, P < 0.01) при внесении штаммов Pseudomonas oryzihabitans Ep4 и Variovorax paradoxus 3-P4, содержащих АЦК-дезаминазный комплекс. Выявленные различия в структуре микробных популяций в большей степени связаны с влиянием штаммов-интродуцентов, чем с внесением минеральных удобрений.
Использование минеральных удобрений под сельскохозяйственные культуры оказывает существенное влияние на прирост их продуктивности. Это в полной мере относится и к яровому рапсу, имеющему стратегическое значение для сельского хозяйства. Однако практическое применение минеральных (особенно азотных) удобрений в агроценозах связано с высоким уровнем затрат и может создавать различные проблемы экологического характера в биосфере. Поэтому поиск альтернативных менее энергозатратных и экологически безопасных источников минерального питания растений представляет большой научный и практический интерес.
Более 80% питательных веществ, используемых растением из почвы, становятся доступными благодаря деятельности почвенной микрофлоры, которая является трофическим фундаментом биосферы и представлена тысячами видов (Звягинцев и соавт., 2005). В этой связи становится чрезвычайно актуальным вопрос об использовании полезных свойств микроорганизмов почвы в сельскохозяйственной практике.
Большое значение для агроценозов небобовых культур имеют ассоциативные бактерии, обитающие в ризосфере и представляющие собой потенциальный ресурс симбионтов растений, обладающих пробиотической функцией, способствующих как повышению урожайности сельскохозяйственных культур, так и обеспечивающих устойчивое управление агроэкосистемами (van Elsas et al., 2012; van der Heijden et al., 2016). С этой точки зрения для агроценозов рапса особое значение имеют ризобактерии, продуцирующие ауксины и содержащие 1-аминоциклопропан-1-карбоксилат (АЦК) дезаминазу. АЦК-утилизирующие бактерии снижают ингибирование роста растений фитогормоном этиленом при биотических и абиотических стрессах, обладают стимулирующей рост функцией, повышают доступность элементов минерального питания для растений и являются важным элементом растительно-микробных систем (Белимов, Сафронова, 2011; Pеrez-Montaсo et al., 2014; Gamalero, Glick, 2015).
Однако ограниченное знание механизмов взаимодействия микроорганизмов в ризосфере затрудняет разработку и использование полезных растительно-микробных систем в сельском хозяйстве. Для успешного применения в агроценозах сельскохозяйственных культур бактериальных штаммов, содержащих АЦК-дезаминазу, необходимо понимание взаимодействий компонентов аборигенного ризосферного сообщества со штаммами-интродуцентами.
Показано, что применение штаммов полезной ризосферной микрофлоры при посевах различных сельскохозяйственных культур способствует активизации микробиологических процессов в почве агроценозов, положительно влияет на ее ферментативную активность (Пусенкова и соавт., 2012; Петрова, Денщиков, 2013; Пищик и соавт., 2015; Гамзаева, 2016). Однако большинство работ выполнены с использованием методов аппликаций или высева почвенной суспензии на элективные питательные среды, что позволяет определить численность лишь определенных эколого-трофических групп ризосферных микробных сообществ.
Цель работы ‒ изучить влияние интродукции АЦК-утилизирующих бактерий в ризосферное сообщество масличного рапса на повышение его урожайности.
В этом сообщении мы впервые с помощью методов молекулярной генетики описываем влияние АЦК-утилизирующих бактерий на изменение таксономической структуры микробного сообщества в ризосфере рапса ярового в условиях его различной обеспеченности минеральным питанием.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты исследования. В работе использовали семена суперэлиты раннеспелых районированных сортов рапса ярового Brassica napus (L.) Ратник и Рубеж, полученные во Всероссийском НИИПТИ рапса, (г. Липецк), а также штаммы ассоциативных бактерий, содержащие АЦК-дезаминазу и продуцирующие ауксины: Pseudomonas oryzihabitans Ep4 и Variovorax paradoxus 3-P4. Штаммы получены во Всероссийском НИИ сельскохозяйственной микробиологии (г. Санкт-Петербург) и депонированы в Ведомственной коллекции полезных микроорганизмов сельскохозяйственного назначения.
Для приготовления инокулюма ассоциативные бактерии культивировали, как описано ранее, в жидкой питательной среде (Лактионов и соавт., 2011) в течение 4 сут при 28°С на роторной качалке (180 об./мин). Полученные культуры разбавляли стерильной водопроводной водой до конечной концентрации 107 кл./мл. Микробиологическую чистоту инокулюмов проверяли методом посева разведений бактериальных суспензий на агаризованную питательную среду.
Полевые опыты. Почва участков, на которых проводили полевые опыты (ВНИИЗБК, п. Стрелецкий, Орловский р-н, 2012‒2014 гг.), темно-серая лесная среднесуглинистая, содержание гумуса 5.1 ± 0.1%, подвижного фосфора – 233 ± 8 мг/кг, подвижного калия – 97 ± 9 мг/кг; рН 5.2 ± 0.06 (средние данные за 3 года). Почвенные характеристики определяли стандартными методами (Аринушкина, 1970).
Растения рапса ярового выращивали в селекционном севообороте зернового типа с полной рендомизацией делянок (площадь делянки 10 м2) в 4-кратной повторности для каждого варианта, предшественник – зерновые. Минеральное удобрение (диаммофоска) вносили за 7 сут до посева в различных дозах N70P63K80 и N100P90K110 соответственно, 70 и 100% из расчета на планируемый урожай 3 т/га.
Инокулюм P. oryzihabitans Ep4 и V. paradoxus 3-P4 (200 мл/м2) вносили прикорневой обработкой на 10-е и 27-е сут после посева (соответственно, в фазы проростков и розетки листьев). Контролем служили варианты без инокуляции.
Семена рапса собирали объединителем TE-RRION-SAMPO SR2010 (“Агротехмаш”, Россия). В фазу цветения оценивали площадь ассимиляционной поверхности листьев с помощью фотопланиметра Li-3000c (США). Урожайность определяли путем взвешивания семян, убранных с каждой делянки прямым комбайнированием. Масличность семян определяли на анализаторе зерна Infratec™ 1241 по оригинальной методике Foss.
Методы высокопроизводительного секвенирования ДНК были использованы для изучения влияния интродуцируемых ризосферных бактерий и минеральных удобрений на таксономическую структуру бактериального сообщества ризосферы рапса ярового сорта Рубеж. Для этого в фазу цветения были отобраны образцы ризосферной почвы рапса и сохранены при ‒80°С до проведения дальнейших анализов.
Выделение ДНК проводили из 0.2 г почвенного образца с использованием набора Power Soil DNA Isolation Kit (“MoBio”, США).
Амплификацию генов 16S рРНК осуществляли с использованием универсальных праймеров (комплементарных последовательностям как бактерий, так и архей) к вариабельным участкам V4 – F515 GTGCCAGCMGCCGCGGTAA и R806 GGAC-TACVSGGGTATCTAAT (Bates, 2010). Праймеры содержали мультиплексные идентификаторы, позволяющие проводить одновременный анализ нескольких проб. На втором этапе проводили пиросеквенирование полученных амплификатов с использованием прибора Illumina MiSeq (“Roche”, США) согласно рекомендациям производителя.
Анализ ампликонных библиотек гена 16S рРНК проводили в программе QIIME версии 1.5.0. Из нуклеотидных последовательностей были удалены служебные последовательности и праймеры, проведена фильтрация последовательностей по качеству, выравнивание последовательностей с использованием алгоритма PyNast и построение матрицы генетических дистанций; в качестве матрицы для выравнивания использовали специально сконструированный набор последовательностей “Greengenes coreset”, доступный на сайте: http://greengenes.lbl.gov. Последовательности, обладающие сходством 97%, объединяли в OТЕ. Таксономическую идентификацию последовательностей проводили с использованием базы данных RDPII (Wang et al., 2007).
Статистическую обработку данных проводили в программе STATISTICA 10 (“StatSoft, Inc.”, США). Использовали дисперсионный и корреляционный анализ.
РЕЗУЛЬТАТЫ
Анализ таксономической структуры прокариотного сообщества ризосферы рапса показал, что абсолютное большинство составляют бактерии.
Во всех почвенных образцах были выявлены представители 15 бактериальных фил: Armatimonadetes, Acidobacteria, Actinobacteria, AD3, Bacteroidetes, Chloroflexi, Cyanobacteria, Elusimicrobia, Firmicutes, Gemmatimonadetes, Nitrospirae, Planctomycetes, Proteobacteria, Verrucomicrobia, WS3 и двух археотных фил: Crenarchaeota и Euryarchaeota (рис. 1). Наибольшую долю в микробном сообществе ризосферы рапса имел класс Proteobacteria, представляющий собой наиболее обширную группу грамотрицательных бактерий. Сопоставимым по численности был класс Actinobacteria, играющий важную роль в круговороте органических веществ и в углеродном цикле. Таксономически значимую долю в ризосферной почве составляли археи (7.7‒10.7%) и представители групп Gemmatimonadetes и Acidobacteria (5.2‒7.2%). Последние преимущественно представлены в местах с кислой и слабокислой реакцией среды, что соответствует фактическому уровню рН почвы опытного участка.
Рис. 1.
Таксономическая структура микробных сообществ (на уровне филы) в ризосфере рапса ярового в зависимости от условий минерального питания и инокуляции растений АЦК-утилизирующими бактериями.
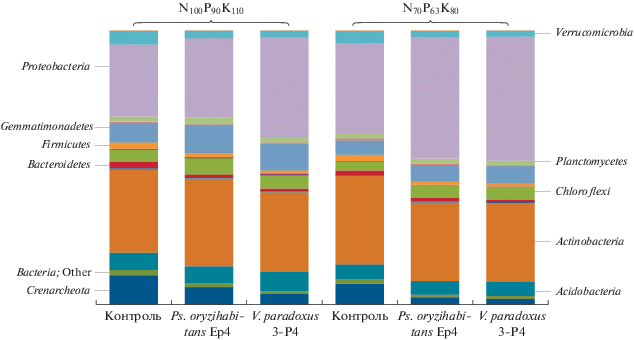
Изучение влияния минеральных удобрений на структуру ризосферного сообщества выявило, что сокращение их дозы внесения в почву примерно в равной степени приводило к снижению доли архей и бактерий класса Gemmatimonadetes (‒28%), а также к увеличению в ценозе относительной численности протеобактерий (+24%). На остальные филы микроорганизмов данный агроприем не оказал существенного влияния.
Изменения в составе сообщества проявились и в смене соотношения пула основных прокариотных фил при использовании биопрепаратов на основе АЦК-утилизирующих бактерий на обоих фонах минеральных удобрений. Так, в опытах с сокращенной дозой минеральных удобрений отмечено существенное снижение доли Crenarchaeota, Verrucomicrobia и Bacteroidetes, значения которых были сдвинуты, соответственно, с 7.7 до 2.1%, с 4.7 до 2.2% и с 1.8 до 0.9% (P < 0.01). Внесение на этом фоне биопрепаратов, напротив, стимулировало относительную распространенность Proteobacteria с 32.5 до 45.0% (P < 0.01). Аналогичный диапазон и характер изменений в составе прокариотного сообщества ризосферы рапса прослеживался и на фоне внесения полной дозы минеральных удобрений. Отличия заключались лишь в том, что в вариантах с применением штаммов P. oryzihabitans Ep4 и V. paradoxus 3-P4, увеличивалась доля бактерий класса Gemmatimonadetes с 7.2 до 10.6% (+46%) и с 7.2 до 9.8% (+36%) соответственно. При этом отмеченные изменения произошли за счет увеличения количества и относительной доли бактерий, не идентифицируемых на уровне семейства.
Как показали исследования микробиома на уровне семейства (рис. 2), состав (разнообразие) семейств доминантных фил в исследуемых вариантах практически не различался. В филе Actinobacteria большую долю занимали микроорганизмы семейств Gaiellaceae (>7.5%) и Micrococcaceae (>4.5%), соответственно, из порядков Gaiellales и Actinomycetales. Среди протеобактерий максимально распространены были семейства Alcaligenaceae, Comamonadaceae, Oxalobacteraceae, относящиеся к порядку Burkholderiales (7.9‒13.3%), Bradyrhizobiaceae и Hyphomicrobiaceae из порядка Rhizobiales (3.4‒4.5%), а также Enterobacteriaceae и Pseudomonadaceae (1.0‒2.4%).
Рис. 2.
Таксономическая структура протеобактерий в ризосфере рапса ярового в зависимости от условий минерального питания и инокуляции растений АЦК-утилизирующими бактериями. Наиболее многочисленные бактериальные филы: А – Alphaproteobacteria, B ‒ Betaproteobacteria, D – Deltaproteobacteria, Г – Gammaproteobacteria. NА – non-attributed sequences (неидентифицированные последовательности).
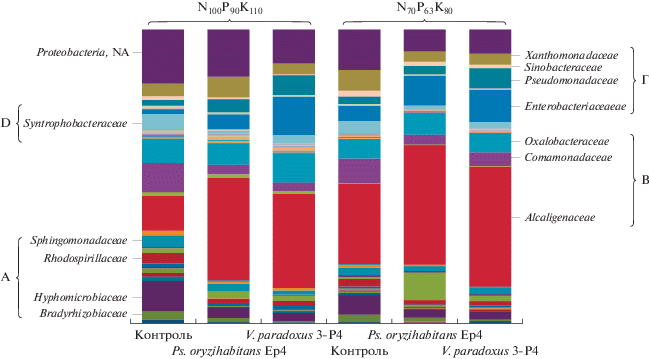
Существенные изменения структуры протеобактерий в ответ на сокращение дозы минеральных удобрений проявились в изменении соотношения представителей альфа-, бета- и гамма-подклассов. Доля двух последних увеличилась и составила более 80% за счет снижения относительной численности Alphaproteobacteria (с 30 до 13%). Показано, что семейства Alcaligenaceae, Enterobacteriaceae и Pseudomonadaceae занимают более 50% в структуре протеобактерий. Отмечено, что на фоне сниженной дозы вносимых удобрений N70P63K80 доля семейств Alcaligenaceae и Enterobacteriaceae возросла в 2.8 и 4.0 раза соответственно. Резкий рост относительной численности представителей данных семейств был обнаружен и при интродукции в ризосферу рапса АЦК-утилизирующих штаммов. Доля бактерий семейства Alcaligenaceae возросла в 2.0‒3.0 раза, а Enterobacteriaceae ‒ в 2.9‒11.2 раза. Широкую степень экологической пластичности продемонстрировали также Pseudomonadaceae, пул которых в ответ на внесение биопрепаратов увеличился в 4.6 раза. При этом установлена высокая положительная корреляция между показателями относительной численности протеобактерий и продуктивностью растительно-микробной системы рапса (r = = 0.85, P < 0.01).
Отзывчивость макросимбионта как на обеспеченность макроэлементами, так и на внесение P. oryzihabitans Ep4 и V. paradoxus 3-P4 проявлялась в изменении интегральных показателей продукционного процесса растения (табл. 1). Интродукция ассоциативных почвенных бактерий в ризосферу рапса вызывала рост площади ассимиляционной поверхности листьев: на фоне NPK100% на 18.2, а на фоне NPK70% ‒ на 25%. На обоих фонах минерального питания штаммы АЦК-утилизирующих бактерий повышали семенную продуктивность растений рапса на 18 и 14% соответственно. Существенное улучшение синтеза жира в семенах макросимбионта было получено при использовании АЦК-утилизирующих бактерий P. oryzihabitans Ep4 в условиях полной обеспеченности растений минеральным питанием.
Таблица 1.
Эффективность растительно-микробной системы рапса ярового в зависимости от внесения штаммов-интродуцентов на различных фонах минерального питания
| Варианты | Площадь ассимиляционной поверхности листьев, см2/раст. | Продуктивность 1 растения, г | Содержание жира в семенах, % | |||
|---|---|---|---|---|---|---|
| NPK 100% | NPK 70% | NPK 100% | NPK 70% | NPK 100% | NPK 70% | |
| Контроль | 540 | 402 | 6.0 | 4.5 | 43.2 | 41.0 |
| P. oryzihabitans 3P-4 | 641 | 506 | 6.9 | 4.9 | 45.2 | 41.6 |
| V. paradoxus Ep4 | 643 | 508 | 6.8 | 5.0 | 41.3 | 42.0 |
| НСР05 | 46 | 0.3 | 1.1 | |||
ОБСУЖДЕНИЕ
Исследования состава микробных сообществ, ассоциированных с корнями рапса (Brassica napus), выполнены с использованием высокопроизводительного секвенирования и выявили преобладание в микробиоме ризосферной почвы представителей Proteobacteria, Actinobacteria, Gemmatimonadetes и Crenarchaeota. Микроорганизмы этих таксономических групп являются обычными обитателями ризосферы культурных растений (Inceoğlu et al., 2011; Gkarmiri et al., 2017). В ряде исследований показано, что внесение высоких доз минеральных удобрений оказывало существенное влияние на изменение структуры микробного сообщества ризосферы рапса, увеличивая на 1/3 долю архей и Gemmatimonadetes при снижении Proteobacteria (Zhang et al., 2003; Jiang et al., 2007; Canfora et al., 2014). Наши результаты согласуются с этими данными. В цитируемых работах отмечено, что интенсивная сельскохозяйственная практика (особенно повышенная агрохимическая нагрузка) увеличивает содержание солей в почвах и изменяет структуру микробного сообщества в пользу представителей экстремальной микрофлоры, в частности, архей и Gemmatimonadetes. Эти изменения наглядно демонстрируют концепцию стабилизации микробного пула, согласно которой любой сдвиг в системе (например, внесение удобрений) сопровождается активизацией тех микроорганизмов, которые способны вернуть ее к состоянию гомеостаза.
Все детектируемые археотные последовательности в наших опытах принадлежали представителям семейства Nitrososphaeraceae филума Thaumarchaeota, что указывало на повышенное содержание солей аммония в почве. Известно, что Nitrososphaeraceae являются аммоний окисляющими археями (Treusch et al., 2005; Pester et al., 2012), способствующими интенсификации процессов, связанных с азотным питанием растения. В наших экспериментах сокращение дозы минеральных удобрений под рапс положительно коррелировало с относительной численностью данного археона в ризосферной почве (r = 0.63, Р < 0.01), что также согласуется с данными работы Wessen et al. (2011).
Увеличение доли некультивируемых бактерий Gemmatimonadetes в условиях высокого агрофона агроценозов рапса возможно связано с тем, что Gemmatimonadetes являются типичными представителями местообитаний с повышенной соленостью, низкой влажностью и обеспеченностью органическими веществами (Zhang et al., 2003; Ahmed et al.. 2018).
Структура таксона Actinobacteria, широко представленная порядком Actinomycetes, в зависимости от используемых в опыте агроприемов, существенно не изменилась. Хемоорганотрофные актинобактерии обладают различными стратегиями выживания и хорошо адаптируются к изменяющимся условиям среды (Singh et al., 2012), что объясняет их относительную устойчивость при внесении различных доз минеральных удобрений.
Напротив, снижение концентрации минеральных удобрений и интродукция штаммов, обладающих рост-стимулирующим действием на растения, положительно повлияли на изменение относительной численности протеобактерий. Как правило, Proteobacteria охватывают огромный уровень морфологического, физиологического и метаболического разнообразия и имеют большое значение для глобального цикла углерода. Считается, что большинство протеобактерий быстро растут, предпочитая среду, богатую питательными веществами, а их численность положительно коррелирует с продуктивностью CO2 почвы (Yergeau, 2011). Действительно, наблюдаемое увеличение данной таксономической группы происходило за счет бета- и гамма-подклассов, представители которых, в основном, являются гетеротрофами, живущими за счет корневых выделений, а образующийся в процессе их дыхания СО2 играет важную роль в мобилизации неорганических соединений. Относительное обилие бета-протеобактерий при снижении концентрации удобрений показано и в других исследованиях (Wu et al., 2006). Идентифицированные в наших экспериментах Betaproteobacteria и Gammaproteobacteria являются “газотрофами” и бродильщиками, использующими увеличившийся пул растительных экссудатов в процессе своего метаболизма.
Поскольку штаммы P. oryzihabitans Ep4 и V. paradoxus 3-P4 вносили в прикорневую зону рапса в высокой концентрации (107 кл./мл), увеличение доли Gammaproteobacteria, особенно относящихся к семейству Рseudomonadaceae, является вполне ожидаемым эффектом. Учитывая, что механизм действия АЦК-утилизирующих бактерий на растения состоит в стимуляции их роста посредством снижения концентрации АЦК в растении за счет АЦК-дезаминазной активности и продукции индолилуксусной кислоты (ИУК), логично предположить также увеличение численности представителей порядка Burkholderiales (например, Alcaligenaceae). Сообщается (Белимов, Сафронова, 2011), что около 8 видов данной группы микроорганизмов способны использовать АЦК как источник азотного и углеродного питания.
Получившие наибольшее распространение среди протеобактерий представители семейства Alcaligenaceae относятся к группе карбоксидобактерий, которые участвуют в окислении окиси углерода (Звягинцев и соавт., 2005). Эти гетеротрофные микроорганизмы осуществляют процесс биовыщелачивания и используют азот, фосфор, а также ацетат, лактат или глюконат натрия в качестве источника энергии и углерода (Никовская, Калиниченко, 2012). При этом лактат и ацетат являются продуктами формиатного брожения, осуществляемого Enterobacteriaceae, численность которых в наших исследованиях также существенно возросла в вариантах с инокуляцией растений штаммами P. oryzihabitans Ep4 и V. paradoxus 3-P4. Необходимо отметить, что кроме выше обозначенных продуктов, энтеробактерии в процессе своего метаболизма образуют формиат, ацетоин, а также 2,3-бутандиол (Пиневич, 2007). Эти летучие соединения, в свою очередь, могут оказывать дополнительное стимулирующее действие на рост растения, тем самым обеспечивая себе источник питания в виде растительных метаболитов (Шапошников, 2011).
Описанные выше механизмы возможного взаимодействия интродуцируемой микрофлоры с растением и аборигенным микробным сообществом в целом указывают на формирование растительно-микробной системы (РМС), в которой главную роль играет растительный компонент. Отмеченный нами рост продуктивности и увеличение содержания высокомолекулярных соединений (жир) в генеративных органах растительного компонента свидетельствуют об эффективности симбиотрофных отношений внутри созданной нами РМС. Следовательно, повышенная синтетическая деятельность рапса, обусловленная интродукцией штаммов АЦК-утилизирующих бактерий в условиях различной обеспеченности растений минеральными элементами, способствует изменению корневой экссудации (Belimov et al., 2009; Береговая и соавт., 2018) и модулирует структуру аборигенного микробного сообщества.
Таким образом, полученные результаты свидетельствуют о способности изучаемых ризобактерий оказывать воздействие на изменение таксономической структуры микробиома ризосферы рапса при разной обеспеченности макросимбионта минеральными элементами. Установлено сильное влияние внесения инокулятов АЦК-утилизирующих бактерий на сокращение относительной численности Crenarchaeota, Verrucomicrobia и Bacteroidetes при увеличении Proteobacteria. Показано положительное влияние интродуцируемых бактерий на относительную численность метаболически значимых классов протеобактерий в ризосфере рапса ярового за счет улучшения физиологического состояния растений. При этом различия в структуре микробных популяций в большей степени связаны со штаммами-интродуцентами (>73%), чем минеральными удобрениями (>24%). Установлена достоверная связь между относительной численностью протеобактерий и продуктивностью растительно-микробной системы (r = 0.85, P < 0.01) при внесении штаммов Pseudomonas oryzihabitans Ep4 и Variovorax paradoxus 3-P4, содержащих АЦК-дезаминазный комплекс.
Список литературы
Аринушкина Е.В. Руководство по химическому анализу почв. 2 изд. М.: Изд-во МГУ, 1979. 488 с. Arinushkina E.V. Guidelines for the Chemical Analysis of Soils. Moscow: Moscow State University Press, 1970.
Белимов А.А., Сафронова В.И. АЦК-диаминаза и растительно-микробные взаимодействия // Сельскохозяйственная биология. 2011. № 3. С. 23‒27.
Береговая Ю.В., Тычинская И.Л., Петрова С.Н., Парахин Н.В., Пухальский Ю.В., Макарова Н.М., Шапошников А.И., Белимов А.А. Сортовая специфичность эффектов ризобактерий в отношении азотфиксирующего симбиоза и минерального питания сои в условиях агроценоза // Сельскохозяйственная биология. 2018. Т. 53. № 5. С. 977‒993.
Гамзаева Р.С. Влияние биопрепаратов и минеральных удобрений на общую биологическую активность почвы и урожайность ячменя // Известия СПбГАУ. 2016. С. 86‒90.
Звягинцев Д.Г., Бабьева И.П., Зенова Г.М. Биология почв. М.: Изд-во МГУ, 2005. 445 с.
Лактионов Ю.В., Попова Т.А., Андреев О.А., Ибатуллина Р.П., Кожемяков А.П. Создание стабильной формы рост стимулирующих микробиологических препаратов и их эффективность // Сельскохозяйственная биология. 2011. Т. 3. С. 116‒118.
Никовская Г.Н., Калиниченко К.В. Биовыщелачивание тяжелых металлов из иловых осадков после биологической очистки муниципальных сточных вод // Химия и технология воды. 2013. Т. 35. № 2. С. 140‒150.
Петрова С.Н., Денщиков В.А. Изменение численности микроорганизмов в ризосфере сортов гороха посевного при формировании азотфиксирующего симбиоза // Земледелие. 2013. № 5. С. 17‒19.
Пиневич А.В. Микробиология. Биология прокариотов. СПб.: Изд-во С.-Петерб. ун-та, 2007. 331 с.
Пищик В.Н., Воробьев Н.И., Моисеев К.Г., Свиридова О.В., Сурин В.Г. Влияние бактерий Bacillus subtilis на физиологическое состояние растений пшеницы и микробоценоз почвы при использовании различных доз азотных удобрений // Почвоведение. 2015. Т. 48. С. 87–94. Pishchik V.N., Vorobyev N.I., Moiseev K.G., Sviridova O.V., Surin V.G. Influence of Bacillus subtilis on the physiological state of wheat and the microbial community of the soil under different rates of nitrogen fertilizers // Euras. Soil Sci. 2015. V. 48. Р. 77‒84.
Пусенкова Л.И., Ильясова Е.Ю., Киреева Н.А. Влияние биопрепаратов на продуктивность сахарной свеклы // Агрохимия. 2012. № 10. С. 20–26.
Шапошников А.И., Белимов А.А., Кравченко Л.В., Виванко Д.М. Взаимодействие ризосферных бактерий с растениями: механизмы образования и факторы эффективности ассоциативных симбиозов // Сельскохозяйственная биология. 2011. № 3. С. 16‒22.
Ahmed V., Verma M.K., Gupta S., Mandhan V., Chauhan N.S. Metagenomic profiling of soil microbes to mine salt stress tolerance genes // Front. Microbiol. 2018. V. 9. P. 159.
Bates S.T., Berg-Lyons D., Caporaso J.G., Walters W.A., Knight R., Fierer N. Examining the global distribution of dominant archaeal populations in soil // ISME J. 2010. V. 5. P. 908–917.
Belimov A.A., Dodd I.C., Safronova V.I. ACC deaminase-containing rhizobacteria improve vegetative development and yield of potato plants grown under water-limited conditions // Aspects Appl. Biol. 2009. V. 98. P. 163‒169.
Canfora L., Bacci G., Pinzari F., Lo Papa G., Dazzi C., Benedetti A. Salinity and bacterial diversity: to what extent does the concentration of salt affect the bacterial community in a saline soil? // PLoS One. 2014. V. 9. e106662.
Gamalero E., Glick B.R. Bacterial modulation of plant ethylene levels // Plant Physiol. 2015. V. 169. P. 13‒22.
Gkarmiri K., Mahmood S., Ekblad A., Alström S., Högberg N., Finlay R. Identifying the active microbiome associated with roots and rhizosphere soil of oilseed rape // Appl. Environ. Microbiol. 2017. V. 83. pii: e01938-17.
Inceoğlu O., Abu Al-Soud W., Salles J.F., Semenov A.V., van Elsas J.D. Comparative analysis of bacterial communities in a potato field as determined by pyrosequencing // PLoS One. 2011. V. 6. e23321.
Jiang H., Dong H., Yu B., Liu X., Li Y., Ji S. Microbial response to salinity change in Lake Chaka, a hypersaline lake on Tibetan plateau // Environ. Microbiol. 2007. V. 9. P. 2603–2621.
Pérez-Montaco F., Alías-Villegas C., Bellogín R.A., del Cerro P., Espuny M.R., Jiménez-Guerrero I., López-Baena F.J., Ollero F.J., Cubo T. Plant growth promotion in cereal and leguminous agricultural important plants: from microorganism capacities to crop production // Microbiol. Res. 2014. V. 169. P. 325‒336.
Pester M., Rattei T., Flench S., Gröngröft A., Richter A., Overmann J. amoA-based consensus phylogeny of ammonia-oxidizing archaea and deep sequencing of amoA genes from soils of four different geographic regions // Environ. Microbiol. 2012. V. 14. P. 525–539.
Singh S.P., Raval V.H., Purohit M.K., Thumar J.T., Gohel S.D., Pandey S., Akbari V.G., Rawal C.M. Haloalkaliphilic bacteria and actinobacteria from the saline habitats: new opportunities for biocatalysis and bioremediation // Microorganisms in Environmental Management: Microbes and Environment / Eds. Satyanarayana T., Johri B.N. Dordrecht: Springer Netherlands, 2012. P. 415–429.
Treusch A.H., Leininger S., Kletzin A., Schuster S.C., Klenk H.P., Schleper C. Novel genes for nitrite reductase and Amo-related proteins indicate a role of uncultivated mesophilic crenarchaeota in nitrogen cycling // Environ. Microbiol. 2005. V. 7. P. 1985–1995.
van der Heijden M.G.A., de Bruin S., Luckerhoff L., van Logtestijn R.S.P., Schlaeppi K. A widespread plant-fungal-bacterial symbiosis promotes plant biodiversity, plant nutrition and seedling recruitment // ISME J. 2016. V. 10. P. 389–399.
van Elsas J.D., Chiurazzi M., Mallon C.A., Elhottova D., Kristufek V., Salles J.F. Microbial diversity determines the invasion of soil by a bacterial pathogen // Proc. Natl. Acad. Sci. USA. 2012. V. 109. P. 1159–1164.
Wang Q., Garrity G.M., Tiedje J.M., Cole J.R. Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy // Appl. Environ. Microbiol. 2007. V. 73. P. 5261–5267.
Wu Q.L., Zwart G., Schauer M., Agterveld M.P.K., Bahn M.W. Bacterioplankton community composition along a salinity gradient of sixteen high-mountain lakes located on the Tibetan Plateau, China // Appl. Environ. Microbiol. 2006. V. 72. P. 5478–5485.
Yergeau E. Shifts in soil microorganisms in response to warming are consistent across a range of Antarctic environments // ISME J. 2011. V. 6. P. 692–702.
Zhang H., Sekiguchi Y., Hanada S., Hugenholtz P., Kim H., Kamagata Y. Gemmatimonas aurantiaca gen. nov., sp. nov., a gram-negative, aerobic, polyphosphate-accumulating micro-organism, the first cultured representative of the new bacterial phylum Gemmatimonadetes phyl. nov. // Int. J. Syst. Evol. Microbiol. 2003. V. 53. P. 1155–1163.
Дополнительные материалы отсутствуют.
Инструменты
Микробиология


