Микробиология, 2020, T. 89, № 1, стр. 111-120
Структура и функции бактериальных сообществ регрессивных пятен верхового торфяника
Т. Г. Добровольская a, *, А. В. Головченко a, Е. Н. Юрченко a, А. В. Якушев a, Н. А. Манучарова a, Л. В. Лысак a, Н. В. Костина a
a Московский государственный университет им. М.В. Ломоносова
119991 Москва, Россия
* E-mail: dobrtata@mail.ru
Поступила в редакцию 21.02.2019
После доработки 24.05.2019
Принята к публикации 29.05.2019
Аннотация
Проведено исследование бактериальных комплексов регрессивных пятен, являющихся наглядным проявлением дистрофной стадии развития верховых торфяников. Установлено, что в структуре биомассы регрессивных пятен преобладает биомасса водорослей, а в верховом торфе – биомасса грибного мицелия. В регрессивных пятнах численность бактерий, определенная методом прямого счета, в 3‒7 раз выше, чем в верховом торфе. Несмотря на преобладание в обоих исследуемых субстратах протеобактерий и ацидобактерий, их доля ниже в регрессивных пятнах. В регрессивных пятнах доминируют бактерии филума Verrucomicrobia, которые являются минорными компонентами в верховом торфе. Показано, что в сапротрофном бактериальном комплексе регрессивных пятен в сухие периоды доминируют бациллы, во влажные – протеобактерии. По результатам секвенирования 16S рРНК выделенные из регрессивных пятен культуры бактерий отнесены к родам Chryseobacterium, Stenotrophomonas, Pseudomonas и Chromobacterium. Физиологическое состояние бактериальных сообществ регрессивных пятен близко к состоянию сообществ низинного торфа за счет обилия бактерий, использующих легкодоступные полимеры. Азотфиксирующая активность бактериальных сообществ значительно выше в пятнах, чем в верховом торфе.
Широкое распространение регрессивных процессов на болотах северного полушария, проявляющееся в локальном прекращении торфонакопления (в связи с замещением растений-торфообразователей видами, не образующими торф, в первую очередь печеночниками и лишайниками) дало основание Е.М. Брадис (1972) выделить, наряду с общепринятыми низинным, переходным и верховым типами, регрессивный тип болот. Регрессивные процессы приводят к деструкции сфагнового покрова и образованию черных (регрессивных) пятен на поверхности торфяников. Анализ научных работ по этой тематике позволил заключить, что появление пятен связано: с ухудшением водного режима и усилением обводненности поверхности болот; с появлением растений, аккумулирующих азот, избыток которого является причиной исчезновения мохового покрова; с истощением минеральных солей в торфе; с выделением газов, разрушающих участки торфяной залежи (Бахнов, 1986; Foster, Fritz, 1987; Лопатин, 1997; Belyea, Lancaster, 2002).
Бактериальные сообщества верховых торфов изучены хорошо (Dedysh et al., 2006; Щербаков и соавт., 2013; Serkebaeva et al., 2013; Добровольская и соавт., 2014), чего нельзя сказать о бактериальных сообществах регрессивных пятен.
Целью нашей работы было выявление структурно-функциональной организации бактериальных сообществ регрессивных пятен.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектом исследования было грядово-мочажинное сфагновое безлесное болото “Большой Роговской Мох” (56°08′20′′ с.ш., 32°06′06′′ в.д.). Это болото является одной из пробных площадей Западнодвинского лесоболотного стационара Института лесоведения РАН в Тверской области (Вомперский и соавт., 1988). Отложения болота представлены торфом, возраст которого 8590 ± ± 179 тыс. лет; подстилаются органо-минеральным сапропелем. Залежь сложена до 2 м верховым торфом слаборазложившимся (степень разложения 3‒15%), от 2 до 3 м – среднеразложившимся (25‒35%). Значения рН варьируют сверху вниз по профилю от 2.7 до 4.3. Регрессивныe пятна на исследуемом торфяном массиве овальной формы и имеют размер в среднем 50 × 100 см. Образцы отбирали в августе 2015 г., который характеризовался как сухой период, так как за месяц количество выпавших осадков составило 6.9 мм, и в августе 2017 г. – во влажный период, когда количество выпавших осадков за месяц составило 87.9 мм.
Методика отбора образцов. Образцы пленок (0‒2 см) отбирали из 5 регрессивных пятен, удаленных друг от друга на расстоянии 3–7 м, в 10 кратной повторности. Для сравнительного анализа дополнительно проводили отбор образцов мха Sphagnum magellanicum Bird и верхового торфа (глубина 0‒10 см) с участков болота, не затронутых регрессией. Образцы извлекали из торфяного массива вручную с помощью cтерильных перчаток, затем помещали в стерильные пластиковые пакеты, которые в тот же день в охлажденном виде доставляли в лабораторию для дальнейших исследований.
Численность бактерий определяли методом прямого счета с использованием люминесцентной микроскопии (Методы почвенной микробиологии и биохимии, 1991). Предварительно десорбировали клетки с помощью ультразвукового диспергатора Bandelin Sonopuls HD 2070 (Германия) в течение 2 мин при мощности 50%. Для одного образца готовили 6 препаратов, которые окрашивали раствором акридина оранжевого (1 : 10 000). Окрашенные препараты просматривали в 20 полях зрения на люминесцентном микроскопе ЛЮМАМ-ИЗ (Россия) (светофильтры ЖС-19, ЖС-18, объектив ×90 Л, окуляры ×4 или ×5).
Количество клеток бактерий, содержащихся в 1 г свежего образца, вычисляли по формуле: N = = S1a n/vS2c, где N – число клеток бактерий в 1 г свежего образца; S1 – площадь препарата (мкм2); а – среднее число бактерий в поле зрения; n – показатель разведения суспензии (мл); v – объем капли, наносимой на стекло (мл); S2 – площадь поля зрения микроскопа (мкм2); с – навеска образца (г).
Биомассу бактерий (Б) рассчитывали по формуле: Б = N × 2 × 10–14 (г), где N – численность бактерий в 1 г образца, а биомасса сухого вещества для 1 бактериальной клетки объемом 0.1 мкм3 составляет 2 × 10–14 г (Кожевин и соавт., 1979). Удельную массу микроорганизмов принимали равной 1 г/см3; содержание воды в клетках – 80%.
Численность и таксономический состав бактерий сапротрофного блока определяли методом посева на агаризованную глюкозо-пептонно-дрожжевую среду (ГПД) (Добровольская и соавт., 2010). Для ингибирования роста грибов в среду добавляли 50 мг нистатина на 0.5 л среды. Для посева использовали суспензию, оставшуюся после приготовления препаратов для люминесцентной микроскопии. Посев проводили в 5-кратной повторности из экспериментально подбираемых 10-кратных разведений. Посевы инкубировали при комнатной температуре в течение 2–3 нед. Общую численность бактерий выражали в колониеобразующих единицах (КОЕ) на 1 г образца. Проводили дифференцированный учет колоний бактерий разных таксономических групп. Основных представителей бактерий выделяли в чистую культуру. Идентификацию выделенных штаммов до рода осуществляли на основании морфологических, культуральных и хемотаксономических признаков (Определитель бактерий Берджи, 1997; Добровольская и соавт., 2010). Доминирующими считали те таксоны бактерий, колонии которых составляли более 30% от общего числа колоний на чашке (Добровольская и соавт., 2010). Идентификацию доминирующих таксонов бактерий проводили по результатам секвенирования нуклеотидных последовательностей гена 16S рРНК с использованием программы BLAST (Manucharova et al., 2008).
Биоразнообразие прокариотного комплекса почвенных образцов определяли методом высокопроизводительного секвенирования консервативного участка гена 16S рРНК. Для экстракции тотальной ДНК применяли стандартные методы PowerSoil DNA Isolation Kit (“MO BIO”, США), руководствуясь инструкциями производителя. Амплификацию фрагментов гена 16S рРНК осуществляли с помощью вырожденных праймеров, комплементарных последовательностям как бактерий, так и архей: PRK341F (CCTACGGGRBGCASCAG) и PRK806R (GGACTACYVGGGTATCTAAT). Полученные ПЦР-фрагменты очищали на колонках QIAquick согласно протоколу производителя. Каждый ПЦР-фрагмент растворяли в 50 мкл ТЕ-буфера, полученного материала было достаточно для дальнейшего анализа. Нуклеотидные последовательности вариабельных фрагментов генов 16S рибосомальных РНК из образцов метагеномной ДНК определяли с помощью высокопроизводительного секвенирования. Секвенирование проводили на полигеномном секвенаторе Illumina Miseq, время прочтения ‒ 39 ч, количество pair-end reads (парных прочтений) – 8 млн. После проведенных прочтений с обоих концов ДНК формировали файл с прямыми и обратными прочтениями, которые представляли собой текстовое описание первичной структуры линейных макромолекул в виде последовательности мономеров. Обработку данных секвенирования осуществляли с использованием автоматизированного алгоритма QIIME 1.9.1, включающего объединение прямых и обратных прочтений, удаление технических последовательностей, фильтрацию последовательностей с низкими показателями достоверности прочтения отдельных нуклеотидов (качество менее Q20), фильтрацию химерных последовательностей, выравнивание прочтений на референсную последовательность 16S рРНК, распределение последовательностей по таксономическим единицам с использованием базы данных Silva версии 132. Использовали алгоритм классификации операционных таксономических единиц (ОТЕ) с открытым референсом (Open-reference OTU), порог классификации 97%.
Физиологическое разнообразие и трофическую специализацию гидролитического бактериального блока определяли комплексным структурно-функциональным методом (Якушев, 2015). Гидролитический бактериальный блок рассматривали как совокупность бактерий, способных расти на полимерах, в том числе легкодоступных. Изучали ассоциации микроорганизмов, возникающие после внесения суспензий исследуемых субстратов в набор жидких питательных сред с биополимерами. В инициированных сообществах анализировали кинетические параметры сукцессионных изменений. Поскольку сукцессия происходит в контролируемых условиях, то ее можно представить, как рост и отмирание периодической культуры, описываемой классическими кинетическими параметрами: максимальная удельная скорость роста, метаболический коэффициент и т.д. В данной работе анализировали только экономический коэффициент (Y) инициированных сообществ. Исследовали поддающиеся культивированию аэробные и факультативно-анаэробные бактерии. Для ингибирования роста грибов в среду вносили нистатин (конечная концентрация в среде 200 мг/л) и циклогексимид (60 мг/л). В качестве единственного источника углерода использовали полимеры, представленные очищенными коммерческими препаратами: кератин молотый “Sigma-Aldrich”, хитин ракообразных для приготовления коллоидного хитина “OligoTech”, целлюлоза порошковая 0.1‒0.25 мкм “Союзреактив”, пектин лимонный “ICN Biomedicals Inc.”, крахмал растворимый “ЛенРеактив”, ксилан берeзовый “Sigma-Aldrich”, инулин из цикория “Sigma-Aldrich”, декстран T-500 хроматографический “Loba Chemie”, агароза легкоплавкая “SERVA” (пример очень трудно разлагаемого биополимера), твин 20 “Ferak Berlin” (водорастворимый аналог жиров), казеин по Гамерстену “Merck” (аналог легко разлагаемого белка), ДНК “Sigma-Aldrich”.
Физиологическое разнообразие гидролитического бактериального блока оценивали по эмпирически выведенному методом главных компонент параметру – среднеарифметическому экономическому коэффициенту $\left( {\bar {Y}} \right)$ инициированных сообществ, сформировавшихся на 12 средах с полимерами. Экономический коэффициент конкретного инициированного сообщества $Y = \frac{{{{x}_{m}} - {{x}_{0}}}}{{{{s}_{0}}}},$ где s0 – исходная концентрация полимера (2.5 г/л); xm – максимальная концентрация клеток, достигаемая на питательной среде, x0 – исходная концентрация микроорганизмов в инокулированной суспензии. Высокие значения Y свидетельствуют о высокой продуктивности сообщества и эффективном усваивании того или иного полимера, низкие значения Y – о неподходящих условиях культивирования.
Методом главных компонент эмпирически выведен параметр разн ${{\bar {Y}}_{{{\text{разн}}}}}$– разность средних Y на средах с труднодоступными для потребления бактериями (хитин, целлюлоза, агароза, кератин) и легкодоступными (декстран, инулин, пектин, ксилан, крахмал, твин 20, казеин) полимерами (Y при использовании в качестве субстрата ДНК в этой формуле не использовали). Поскольку в трофической классификации почвенных микроорганизмов “гидролитики” – деструкторы труднодоступных полимеров, а “копиотрофы” – деструкторы легкодоступных, то ${{\bar {Y}}_{{{\text{разн}}}}}$ отражает трофическую специализацию гидролитического блока.
Азотфиксацию определяли методом газовой хроматографии (Методы почвенной микробиологии и биохимии, 1991). Для определения актуальной азотфиксации навески анализируемых субстратов (2‒3 г) помещали в пенициллиновые флаконы объемом 15 мл. Флаконы герметично закрывали резиновыми пробками с металлическими зажимами, вводили 1 мл ацетилена и инкубировали 2 ч как в темноте (в термостате, при температуре 25°С), так и на свету (при комнатной температуре). Затем из флаконов шприцем отбирали 1 мл пробы и анализировали количество образовавшегося этилена на хроматографе Кристалл 2000 (Россия) с пламенно-ионизационным детектором (длина колонки – 1 м, диаметр – 3 мм, наполнитель – Porapak N 80/100); температура колонки – 60°C, температура детектора – 160°C, температура испарителя – 100°C; расход газа-носителя (N2) – 50 мл/мин, воздуха – 280 мл/мин, водорода – 28 мл/мин. Определение проводили в 3‒5 кратной повторности. Активность азотфиксации выражали в нг С2Н4/г ч.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В структуре биомассы регрессивных пятен преобладала биомасса водорослей, которая составляла 74–87%. Доля бактерий варьировала от 7 до 15%, максимальные значения которой приходились на сухой период (август 2015 г.) (табл. 1). Иной была структура биомассы в образцах верхового торфа. Ее отличительной чертой было доминирование грибного мицелия (75–81%), на долю бактерий приходилось не более 5%, на долю водорослей – только 2%. По абсолютным показателям бактериальная биомасса в регрессивных пятнах многократно превышала таковую в верховом торфе и составила 1–3.5 мг/г (табл. 1).
Таблица 1.
Диапазон значений численности, биомассы и доли бактерий в регрессивных пятнах и верховом торфе
| Субстрат | Численность, ×109 кл./г | Биомасса, мг/г | Доля в общей биомассе, % |
|---|---|---|---|
| Регрессивныe пятна | 50–144 | 1–3.5 | 7–15 |
| Верховой торф | 20–23 | 0.4–0.5 | 4–5 |
Регрессивныe пятна характеризовались высокой численностью бактерий. Она варьировала с учетом пространственного фактора от 50 × 109 до 144 × 109 кл./г и была в 2.5‒7 раз выше, чем в образцах верхового торфа (табл. 1).
Численность бактерий эпифитно-сапротрофного комплекса, установленная методом посева, варьировала в регрессивных пятнах от 4 × 104 до 90 × 104 КОЕ/г (табл. 2). В образцах, отобранных в сухой период, доминировали бациллы и протеобактерии. В период летней засухи в качестве доминанта были обнаружены также бактерии рода Azotobacter. Протеобактерии преобладали в образцах, отобранных в период высокой влажности (табл. 2). В образцах верхового торфа, отобранных с площадок без регрессии, наблюдали монодоминирование бацилл.
Таблица 2.
Численность бактерий (×104 КОЕ/г) эпифитно-сапротрофного комплекса и относительное обилие таксономических групп бактерий (%) в регрессивных пятнах в различные периоды исследования
| № пятна | Сухой период | Влажный период | |||
|---|---|---|---|---|---|
| численность | относительное обилие* | численность | относительное обилие | ||
| Bacillus | Proteobacreria | Proteobacreria | |||
| 1 | 92 ± 7 | 71 | 29 | 54 ± 5 | 100 |
| 2 | 13 ± 3 | 84 | 16 | 57 ± 6 | |
| 3 | 15 ± 2 | 47 | 53 | 38 ± 3 | |
| 4 | 15 ± 3 | 51 | 49 | 34 ± 1 | |
| 5 | 25 ± 3 | 64 | 36 | 45 ± 4 | |
На основании результатов секвенирования последовательностей гена 16S рРНК была установлена родовая и видовая принадлежность доминирующих в бактериальных сообществах регрессивных пятен представителей протеобактерий: Chryseobacterium gregarium, Chryseobacterium yeoncheonense, Stenotrophomonas rhizophila, Pseudomonas koreensis, Chromobacterium vacinii. Представители родов Chryseobacterium и Stenotrophomonas были обнаружены и в верховом торфе. В исследуемых субстратах род Stenotrophomonas был представлен одним видом, а род Chryseobacterium – разными видами (табл. 3).
Род Chryseobacterium – результат переклассифицирования 5 видов рода Flavobacterium (Vandamme et al., 1994). Представителей этого рода обнаруживали в самых разных местообитаниях – на корнях растений, в почве, воде, рыбах, клиническом материале. Бактерии вида Chryseobacterium gregarium были впервые выделены из разлагающегося растительного материала и компостов и описаны как новый вид (Behrendt et al., 2008). Штаммы этого вида обладали способностью разлагать крахмал, желатин, эскулин, твин 80, но не могли проводить деструкцию таких труднодоступных полимеров как хитин и целлюлоза. Бактерии другого вида, обнаруженного нами в регрессивных пятнах – Chryseobacterium yeoncheonense, были впервые изолированы корейскими исследователями из почв под плантациями женьшеня (Hoang et al., 2013). От других видов этого рода они отличались лишь составом жирных кислот и хинонов.
Бактерии вида Stenotrophomonas rhizophila были выделены из ризосферы картофеля и описаны как новый вид (Wolf et al., 2002). Установлено, что они способны стимулировать рост растений и подавлять рост фитопатогенных грибов. Известно также об использовании этих бактерий, как и представителей других видов рода Stenotrophomonas, для биоремедиации почв благодаря их способности деградировать ксенобиотики (Binks et al., 1995).
Бактерии вида Pseudomonas koreensis впервые были изолированы из сельскохозяйственных почв Кореи и описаны как новый вид (Kwon et al., 2003). Как и многие другие представители рода Pseudomonas, бактерии этого вида являются типичными копиотрофами, ассоциированными с растениями и почвами, участвующими в деструкции органического вещества, но не способными использовать трудногидролизуемые полисахариды.
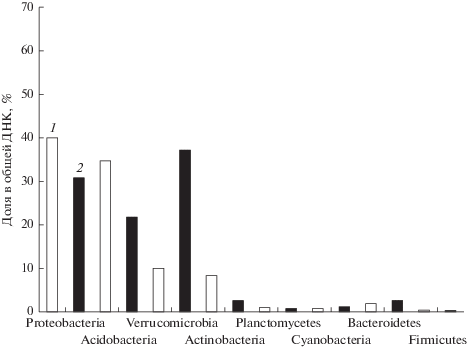
Сравнительный анализ прокариотной компоненты регрессивных пятен и верхового торфа с помощью метода высокопроизводительного секвенирования консервативного участка гена 16S рРНК позволил выявить их локализации: при общем доминировании протеобактерий и ацидобактерий, их доля была выше в верховом торфе. В регрессивных пятнах доминировали бактерии филума Verrucomicrobia (37%), в верховом торфе они составляли лишь 10%. Остальные филумы, обнаруженные в исследуемых субстратах, являются минорными компонентами (рис. 1).
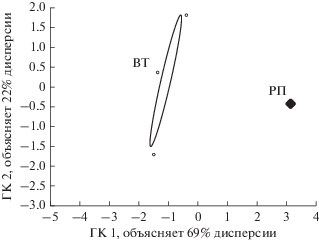
Обработка метагеномных данных методом главных компонент подтвердила выявленные закономерности (рис. 2). Из рисунка следует, что компонент ГК1, определяющий различия между регрессивными пятнами и верховым торфом, по вкладу дисперсии примерно в 3 раза более значим, чем фактор ГК2, обусловливающий различия между разными вариантами верхового торфа.
Рис. 2.
Анализ метагеномных данных методом главных компонент. Положение бактериальных комплексов в факторной плоскости ГК1 и ГК2: ВТ ‒ верховой торф; РП ‒ регрессивныe пятнa. Корреляционный эллипс ограничивает область с уровнем значимости p = 0.95.
Представители Verrucomicrobia изучены плохо, так как большинство бактерий являются некультивируемыми. Так, из веррукомикробий, обнаруженных в регрессивных пятнах, 95% относятся к некультивируемым формам. Веррукомикробии, определенные до рода Chtoniobacter (Sangwan et al., 2004), были выявлены как в пятнах, так и в верховом торфе.
Среди ацидобактерий, определенных до рода, преобладали Acidipila (в пятнax), Acidocella и Acidothermus (в верховом торфе). В исследуемых субстратах зарегистрировано два общих рода – Bryobacter и Granulicella (табл. 4). Бактерии рода Bryobacter были выделены впервые из кислых сфагновых болот Сибири и описаны как новый род и типовой вид Bryobacter aggregatus (Kulichevskaya et al., 2010). Культуры представляют собой ацидофильные, медленно растущие хемоорганотрофные бактерии, строгие аэробы, использующие только сахара и некоторые полисахариды, появляющиеся в процессе деструкции сфагнума. Бактерии рода Granulocella были впервые изолированы из верховых торфяников Сибири и Ярославской области и определены как новый род Granulocella с описанием 4-х видов (Pankratov, Dedysh, 2010). Культуры этого рода близки по большинству признаков к представителям рода Bryobacter. Различия определяются формированием внутриклеточных гранул (определяющих название рода), цветом колоний (розово-красный каротиноидный пигмент) и некоторыми физиолого-биохимическими и генетическими особенностями.
Таблица 4.
Спектр родов бактерий, обнаруженных в регрессивных пятнах и в верховом торфе с помощью метода высокопродуктивного секвенирования
| Таксоны | Регрессивныe пятна | Верховой торф |
|---|---|---|
| Альфа-протеобактерии | –* | Bradyrhizobium |
| – | Nitrobacter | |
| Roseiarcus | ||
| Филум Acidobacteria | Bryobacter | |
| Granulocella | ||
| – | Acidocella | |
| Acidipila | – | |
| – | Acidothermus | |
| Филум Verrucomicrobia | Chtoniobacter | |
В регрессивных пятнах и в верховом торфе внутри подкласса альфа-протеобактерий обнаружены представители рода Roseiarcus, принадлежащие к порядку Rhizobiales (табл. 4). Они являются метанотрофами, выделенными из кислых сфагновых болот. Описан и новый вид этого рода – Roseiarcus fermentans, относящийся к умеренно ацидофильным микроаэрофильным бродильщикам (Kulichevskaya et al., 2014). При росте на свету в этих бактериях обнаружили везикулярные мембраны (характерные для пурпурных бактерий) и бактериохлорофилл. Бактерии этого вида способны использовать широкий спектр субстратов, в том числе сахара и органические кислоты. Следует отметить большее разнообразие родов альфа-протеобактерий в верховом торфе, представленных родами Bradyrhizodium и Nitrobacter. Эти роды не были обнаружены в регрессивных пятнах (табл. 4).
Таким образом, несмотря на различия в составе крупных филумов и классов, в бактериальных сообществах регрессивных пятен и верхового торфа обнаружены общие представители родов. Это закономерно, так как регрессивные пятна образуются на поверхности олиготрофных болот в результате деструкции сфагнового покрова.
В регрессивных пятнах комплексным структурно-функциональным методом установлено высокое физиологическое разнообразие гидролитического бактериального блока $\left( {\bar {Y}} \right)$ за счет разложения легкодоступных полимеров растительного и водорослевого происхождения (ксилан, пектин, крахмал, инулин), при этом трофическая специализация снижается ${{\bar {Y}}_{{{\text{разн}}}}}$ (рис. 3). По сочетанию параметров $\bar {Y}$ и ${{\bar {Y}}_{{{\text{разн}}}}}$ регрессивныe пятна приближаются к низинным торфам, возможно, за счет формирования фрагментарной и эфемерной водорослевой биопленки на поверхности пятна. По данным Богдановской-Гиенэф (1956) образовавшаяся черная прослойка, улучшая условия азотно-минерального питания растений, способствует восстановлению сфагнового покрова, которое пойдет особенно успешно, если увлажнение уменьшится, благодаря ряду сухих лет или каким-нибудь другим обстоятельствам.
Рис. 3.
Физиологическое разнообразие $\left( {\bar {Y}} \right)$ и трофическая специализация $\left( {{{{\bar {Y}}}_{{{\text{разн}}}}}} \right)$ гидролитического бактериального блока регрессивной пленки (РП), верховых (T1 ВТ, T2 ВТ) и низинных торфов (Т1 НТ). Корреляционные эллипсы ограничивают область с уровнем значимости p = 0.95.
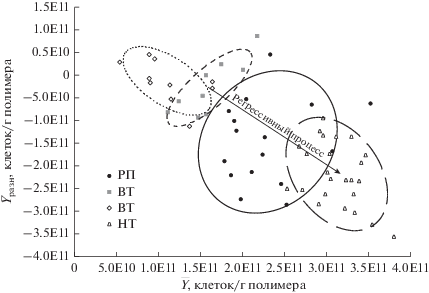
Таблица 5.
Азотфиксирующая активность в регрессивных пятнах и сфагнуме
| Субстрат | АФ на свету, нг C2H4/г суб. ч |
АФ в темноте, нг C2H4/г суб. ч |
|---|---|---|
| Регрессивнoe пятно 1 | 1.192 | 1.638 |
| Регрессивнoe пятно 2 | 6.167 | 3.379 |
| Регрессивнoe пятно 3 | 1.418 | 2.791 |
| Регрессивнoe пятно 4 | 0.744 | 19.928 |
| Регрессивнoe пятно 5 | 1.316 | 2.971 |
| Sphagnum magellanicum Bird., зеленая часть | 0.291 | –* |
| Sphagnum magellanicum Bird., очeс | 0.397 | – |
Таким образом, установлено, что в регрессивных пятнах значительно выше показатели обилия бактерий, а так же азотфиксирующая активность по сравнению с верховым торфом. Это объясняется, прежде всего, присутствием в регрессивных пятнах значительного количества водорослей, обеспечивающих дополнительный источник питания для бактерий. Сравнительный анализ прокариотной компоненты регрессивных пятен и верхового торфа с помощью метода высокопроизводительного секвенирования позволил выявить четкие различия в структуре бактериальных филумов. В регрессивных пятнах доминируют бактерии филума Verrucomicrobia, которые являются минорными компонентами в верховом торфе. Доля протеобактерий и ацидобактерий в регрессивных пятнах меньше, чем в верховом торфе. На основании молекулярных методов была установлена родовая и видовая принадлежность доминирующих в бактериальных сообществах регрессивных пятен протеобактерий. Представители всех этих родов и видов являются типичными копиотрофами. Использование структурно-функционального метода позволило подтвердить этот факт – высокое физиологическое разнообразие гидролитического бактериального блока $\left( {\bar {Y}} \right),$ обусловленное разложением легкодоступных полимеров растительного и водорослевого происхождения. Анализ функций бактерий, доминирующих в регрессивных пятнах, проведенный нами на основании литературных источников, позволяет сделать вывод об экологической значимости представителей, доминирующих в этих биотопах. Установлено, что многие из этих бактерий являются стимуляторами роста растений, антагонистами фитопатогенных микроорганизмов и используются для биоремедиации почв.
Список литературы
Бахнов В.К. Биогеохимические аспекты болотообразовательного процесса. Новосибирск: Наука, 1986. 192 с.
Богдановская-Гиенэф И.Д. О некоторых регрессивных явлениях на верховых болотах // Сборник работ к 75-летию со дня рождения академика В.Н. Сукачeва. М.‒Л.: Изд-во АН СССР, 1956. С. 90–107.
Брадис Е.М. Растительный покров болот как показатель их типа по условиям питания // Основные принципы изучения болотных биогеоценозов. Л.: Наука, 1972. С. 29–38.
Вомперский С.Э., Сирин А.А., Глухов А.И. Формирование и режим стока при гидролесомелиорации. М.: Наука, 1988. 168 с.
Добровольская Т.Г., Головченко А.В., Звягинцев Д.Г. Анализ экологических факторов, ограничивающих деструкцию верхового торфа // Почвоведение. 2014. Т. 47. № 3. С. 304–317.
Dobrovol’skaya T.G., Golovchenko A.V., Zvyagintsev D.G. Analysis of ecological factors limiting the destruction of high moor peat // Euras. Soil Sci. 2014. V. 47. P. 182–193.
Добровольская Т.Г., Головченко А.В., Лысак Л.В., Зенова Г.М. Физикохимия и биология торфа. Методы оценки численности и разнообразия бактериальных и актиномицетных комплексов торфяных почв: учебное пособие. Томск: Изд-во ТГПУ, 2010. 100 с.
Кожевин П.А., Полянская Л.М., Звягинцев Д.Г. Динамика развития различных микроорганизмов в почве // Микробиология. 1979. Т. 48. № 4. С. 490–494.
Лопатин В.Д. О наиболее существенных экологических особенностях болот // Экология. 1997. № 6. С. 419–422.
Мамай А.В., Степанов А.Л., Федорец Н.Г. Микробная трансформация соединений азота в почвах средней тайги // Вестн. Моск. ун-та. Сер. 17. Почвоведение. 2013. № 4. С. 32–38.
Методы почвенной биохимии и микробиологии. М.: Изд-во Московского ун-та, 1991. 304 с.
Определитель бактерий Берджи. М.: Мир, 1997. Т. 1, 2. 800 с.
Умаров М.М., Кураков А.В., Степанов А.Л. Микробиологическая трансформация азота в почве. М.: Геос, 2007. 138 с.
Щербаков А.В., Брагина А.В., Кузьмина В.Ю., Берг К., Мунтян А.Н., Макарова Н.М., Мальфанова Н.В., Кардинале М., Берг Г., Чеботарь В.К., Тихонович И.А. Эндофитные бактерии сфагновых мхов как перспективные объекты сельскохозяйственной микробиологии // Микробиология. 2013. Т. 82. № 3. С. 312–322.
Shcherbakov A.V., Bragina A.V., Kuzmina E.Yu., Berg Christian, Muntyan A.N., Makarova N.M., Malfanova N.V., Cardinale M., Berg G., Chebotar V.K., Tikhonovich I.A. Endophytic bacteria of sphagnum mosses as promising objects of agricultural microbiology // Microbiology (Moscow). 2013. V. 82. P. 306–315.
Якушев А.В. Комплексный структурно-функциональный метод характеристики микробных популяций // Почвоведение. 2015. Т. 48. № 4. С. 429–446.
Yakushev A.V. Integral structural-functional method for characterizing microbial populations // Euras. Soil Sci. (Moscow). V. 48. P. 378–394.
Behrendt U., Ulrich A., Schumann P. Chryseobacterium gregarium sp. nov., isolated from decaying plant material // Int. J. Syst. Evol. Microbiol. 2008. V. 58. P. 1069–1074.
Belyea L.R., Lancaster J. Inferring landscape dynamics of bog pools from scaling relationship and spatial patterns // J. Ecol. 2002. V. 90. P. 223–234.
Binks P.R., Nicklin S., Bruce N.C. Degradation of hexahydro-1,3,5-trinitro-1,3,5-triazine (RDX) by Stenotrophomonas maltophilia PB1 // Appl. Environ. Microbiol. 1995. V. 61. P. 1318–1322.
Dedysh S.N., Pankratov T.A., Belova S.E., Kulichevskaya I.S., Liesack W. Phylogenetic analysis and in situ identification of Bacteria community composition in an acidic Sphagnum peat bog // Appl. Environ.Microbiol. 2006. V. 72. P. 2110–2117.
Foster D.R., Fritz S.C. Mire development, pool formation and landscape processes on patterned fens in Dalarna, central Sweden // J. Ecol. 2002. V. 75. P. 409–437.
Hoang V.A., Kim Y.J., Nguyen N.L., Yang D.C. Chryseobacterium yeoncheonense sp. nov., with ginsenoside converting activity isolated from soil of a ginseng fie // Arch. Microbiol. 2013. V. 195. P. 463–471.
Kulichevskaya I.S., Danilova O.V., Tereshina V.M., Kevbrin V.V., Dedysh S.N. Descriptions of Roseiarcus fermentans gen. nov. sp. nov., a bacteriochlorophyll a-containing fermentative bacterium phylogenetically related to alphaproteobacterial methanotrophs, and of the family Roseiarcaceae fam. nov. // Int. J. Syst. Evol. Microbiol. 2014. V. 64. P. 2558–2565.
Kulichevskaya I.S., Suzina N.E., Liesack W., Dedysh S.N. Bryobacter aggregatus gen. nov., sp. nov., a peat-inhabiting, aerobic chemoorganotroph from subdivision 3 of the Acidobacteria // Int. J. Syst. Evol. Microbiol. 2010. V. 60. P. 301–306.
Kwon S.W., Kim J.S., Park I.C., Yoon S.H., Park D.H., Lim C.K., Go S.J. Pseudomonas koreensis sp. nov., Pseudomonas umsongensis sp. nov. and Pseudomonas jinjuensis sp. nov., novel species from farm soils in Korea // Int. J. Syst. Evol. Microbiol. 2003. V. 53. P. 21–27.
Manucharova N.A., Vlasenko A.N., Tourova T.P., Panteleeva A.N., Stepanov A.L., Zenova G.M. Thermophilic chitinolytic microorganisms of brown semidesert soil // Microbiology (Moscow). 2008. V. 77. P. 610–615.
Pankratov T.A., Dedysh S.N., Granulicella paludicola gen. nov., sp. nov., Granulicella pectinivorans sp. nov., Granulicella aggregans sp. nov. and Granulicella rosea sp. nov., acidophilic, polymer-degrading acidobacteria from Sphagnum peat bogs // Int. J. Syst. Evol. Microbiol. 2010. V. 60. P. 2951–2959.
Sangwan P., Chen X., Hugenholtz P., Janssen P.H. Chthoniobacter flavus gen. nov., sp. nov., the first pure-culture representative of subdivision two, Spartobacteria classis nov. of the phylum Verrucomicrobia // Appl. Environ. Microbiol. 2004. V. 70. P. 5875–5881.
Serkebaeva Y.M., Kim Y., Liesack I.V., Dedysh S.N. Pyrosequencing-based assessment of the bacteria diversity in surface and subsurface peat layers of a northern wetland, with focus on poorly studied phyla and candidate divisions // PLoS One. 2013. V. 8 № 5: e63994. https://doi.org/10.1371/journal.pone.0063994
Vandamme P., Bernardet J.F., Segers P., Kerssters K., Holmes B. New perspectives in the classification of the Flavobacteria: description of Chryseobacterium gen. nov., Bergeyella gen. nov. and Empedobacter norn. rev. // Int. J. Syst. Bacteriol. 1994. V. 44. P. 827–831.
Wolf A., Fritze A., Hagemann M., Berg G. Stenotrophomonas rhizophila sp. nov., a novel plant-associated bacterium with antifungal properties // Int. J. Syst. Evol. Microbiol. 2002. V. 52. P. 1937–1944.
Дополнительные материалы отсутствуют.