Микробиология, 2020, T. 89, № 2, стр. 200-205
Дифференциальная диагностика бактерий по спектрам гигантского комбинационного рассеяния
О. В. Борисова a, *, А. Г. Галстян a, А. Ю. Оленин b, Г. В. Лисичкин b, В. В. Зверев a
a ФГБНУ НИИ вакцин и сывороток им. И.И. Мечникова
105064 Москва, Россия
b Московский государственный университет им. М.В. Ломоносова, химический факультет
119991 Москва, Россия
* E-mail: olga.v.borisova@gmail.com
Поступила в редакцию 29.03.2019
После доработки 29.05.2019
Принята к публикации 29.09.2019
Аннотация
Эффект гигантского комбинационного рассеяния (ГКР) биоорганических соединений вблизи поверхности наночастиц серебра может быть использован для видовой идентификации колоний микроорганизмов. Препараты золя наночастиц серебра с предварительно выращенной единичной колонией микроорганизмов (штаммы Escherichia coli 376/2, Staphylococcus aureus 25923 Pseudomonas aeruginosa ATCC 27583 и Bacillus subtilis 534) обладают индивидуальными спектрами ГКР, наличие и интенсивность полос в которых коррелируют с видовым составом. Наиболее важные различия между спектрами исследованных 4 штаммов были ассоциированы с полосами при 649–652, 948–950, 1326–1340, 1468 см–1. Применение метода главных компонент в диапазоне 600–1600 см−1 дало сумму факторной нагрузки двух главных компонент, равную 83.53% суммарных различий между спектрами, и показало возможность дифференциальной диагностики четырех видов микроорганизмов.
Классическая идентификация микроорганизмов, основанная на выращивании их колоний в питательных средах, обладает двумя существенными ограничениями. Во-первых, продолжительность единичного анализа. Время, необходимое для формирования колонии, ее роста измеряется сутками. Во-вторых, не все микроорганизмы способны к формированию колоний, что затрудняет процесс получения достоверной информации об их присутствии. Это стимулирует развитие альтернативных методов идентификации микроорганизмов. Их основу, как правило, составляют либо специфические взаимодействия микроорганизмов между собой или с компонентами окружающей среды, либо определение продуктов жизнедеятельности, характерных только для них (Adler et al., 2008; Cheng et al., 2012; Havlicek et al., 2013; Bos et al., 2013; Попов и соавт., 2013; Мамонова и соавт., 2015).
Эффект гигантского комбинационного рассеяния (ГКР), возникающий в приповерхностной области наночастиц благородных металлов, может быть использован в анализе биологических объектов, в том числе и микроорганизмов (Stiles et al., 2008; Efrima, Zeiri, 2009; Оленин, Лисичкин, 2011; Singh et al.. 2015; Zhou et al., 2015; Zheng et al., 2018; Еремина и соавт., 2018). В качестве субстрата для получения спектров ГКР часто используются наночастицы золота и серебра, однако наночастицы серебра обычно обеспечивают более интенсивные и четкие полосы рассеяния (Cañamares et al., 2008; Sa et al., 2012).
Наиболее распространенным методом получения наночастиц серебра является химическое восстановление нитрата серебра боргидридом или цитратом натрия, гидрохлоридом гидроксиламина и другими восстанавливающими агентами, приводящее к образованию золей с разными размерами частиц в зависимости от условий эксперимента. Теоретически доказано и подтверждено экспериментально, что наличие двух или более агрегированных наночастиц может привести к усилению рамановского сигнала по сравнению с сигналом от индивидуальных частиц. Агрегация наночастиц, необходимая для повышения чувствительности, происходит, в частности, за счет добавления хлорида натрия, и ее степень зависит от концентрации соли (Petryayeva, Krull, 2011; Kruszewski, Cyrankiewicz, 2012).
Большинство исследователей сходятся во мнении, что спектры ГКР бактерий определяются компонентами клеточной стенки, такими как пептидогликан, липополисахариды, липиды, мембранные белки, нуклеиновые кислоты, тейхоевые кислоты (Walter et al., 2011; Sivanesan et al., 2014; Zhou et al., 2014). Также предполагается, что маленькие молекулы, такие как аденин, могут вносить вклад в спектры ГКР бактерий (Kahraman et al., 2011; Wu et al., 2015). Идентификация даже чистых культур микроорганизмов представляет особую проблему ввиду сложного, и в тоже время схожего, химического состава их поверхностных элементов, использование хемометрических подходов анализа первичной информации в ряде случаев позволяет получать дополнительную информацию, способствующую решению поставленных задач.
Исходя из изложенного выше, целью настоящего исследования является разработка экспресс-метода детектирования и идентификации бактерий на основе ГКР спектров анализируемых образцов, содержащих наночастицы серебра, включающая оптимизацию условий получения спектров, а также разработку алгоритма обработки первичной спектральной информации.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Культивирование штаммов Escherichia coli 376/2, Staphylococcus aureus 25923, Pseudomonas aeruginosa ATCC 27583, Bacillus subtilis 534 (ЦКП “Коллекция микроорганизмов III и IV групп патогенности НИИВС им И.И. Мечникова”) проводили с использованием мясо-пептонного агара в течение 18‒20 ч при 37°С.
Синтез водных золей наночастиц серебра осуществляли путем восстановления нитрата серебра боргидридом или цитратом натрия. В случае использования боргидрида натрия в исходную реакционную смесь вводили стабилизатор поверхности наночастиц – цитрат натрия. Условия проведения эксперимента и характеристики конечных продуктов приведены в табл. 1. и 2.
Таблица 1.
Условия получения и характеристики водных золей серебра. Продолжительность реакции 10 мин, концентрация наночастиц серебра 1 ммоль/л
| № | AgNO3, ммоль | NaBH4, ммоль | Na3Cit, ммоль | Температура реакции, °С | Объем конечного золя, мл | Концентрация золей серебра, ммоль/л |
|---|---|---|---|---|---|---|
| 1 | 0.12 | 0.12 | 0.24 | 20 | 120 | 1.0 |
| 2 | 0.03 | 0.015 | 0.06 | 4 | 30 | 1.0 |
| 3 | 0.03 | 0.015 | 0.06 | 20 | 30 | 1.0 |
| 4 | 0.03 | ‒ | 0.06 | 90 | 30 | 1.0 |
Предварительная подготовка образца перед регистрацией спектра ГКР включала смешивание единичной изолированной колонии микроорганизмов с аликвотой (0.115 мл) золя наночастиц, инкубацию в течение 10 мин, внесение аликвоты (0.01 мл) 1 моль/л раствора хлорида натрия до конечной концентрации 0.08 моль/л, тщательное перемешивание полученной массы в лунках 96-луночного планшета.
Регистрацию спектров ГКР проводили на спектрометре (ИнСпектр MIXSplitter, 532 нм) при экспозиции 5000 мс по три повтора в одной точке в разные временные промежутки (от 5 до 40 мин).
Обработку и анализ спектров осуществляли с помощью программного обеспечения OriginPro 9.0 (“OriginLab Corporation”).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Оптимизация условий получения ГКР спектров E. coli с целью получения стабильного соотношения основных пиков. Метод получения наночастиц серебра сказывается на спектральных характеристиках их конъюгатов с микроорганизмами. Регистрация спектров ГКР с устойчиво разрешенными основными полосами наблюдалась только при использовании наночастиц серебра, полученных путем восстановления нитрата серебра боргидридом натрия в присутствии цитрата натрия в качестве стабилизатора.
Основные полосы спектров ГКР конъюгатов Е. coli с наночастицами серебра наблюдались при 649‒651, 724‒725, 1326‒1340 см–1. При восстановлении нитрата серебра в водной среде на поверхности наночастиц могут сорбироваться компоненты реакционной массы (цитрат натрия или продукты его окисления), собственный спектр комбинационного рассеяния которых потенциально может сказываться на конечном результате. На рис. 1 представлены типичные ненормализованные спектры ГКР трехкомпонентных препаратов, содержащих единичную колонию Е. coli в присутствии наночастиц серебра и хлорида натрия, а также все двухкомпонентные варианты. Из представленных данных видно, что эффект ГКР возникает только при наличии в системе всех трех составляющих.
Рис. 1.
Типичные ненормализованные спектры ГКР суспензий, содержащих E. coli 376/2, наночастицы серебра, хлорид натрия.
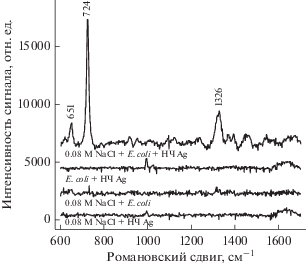
Характерные спектры ГКР для Е. coli регистрировались только в присутствии хлорида натрия. Связанное с этим увеличение интенсивности полос, наиболее вероятно объясняется агрегацией наночастиц серебра, что косвенно подтверждается изменением интенсивности и формы спектров поглощения в диапазоне 350–700 нм: пик поглощения наночастиц серебра при 420 нм в присутствии хлорида натрия уширяется, а его интенсивность снижается. Этот факт находится в соответствии с результатами ряда работ, в которых отмечается, что агрегация наночастиц, вызванная различными агентами, ‒ ключевой момент в получении спектров ГКР (Knauer et al., 2010; Kruszewski et al., 2012).
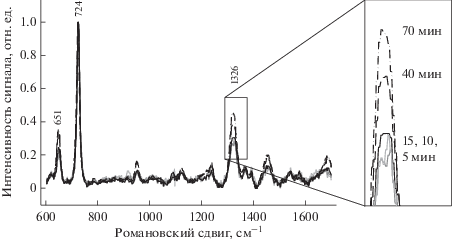
Спектры, фиксируемые для одного и того же образца, с течением времени изменяются и различаются интенсивностью и разрешением основных полос. Для установления оптимального времени регистрации после добавления раствора хлорида натрия в интервале 5‒70 мин была произведена последовательная съемка спектров. Результаты представлены на рис. 2. В интервале от 5 до 15 мин наблюдается только изменение интенсивности основных полос поглощения, нормализация спектров дает их практически полное совпадение. При дальнейшей инкубации даже для нормализованных спектров происходит относительное увеличение интенсивности линий в областях 900, 1260, а особенно – 1320 и 1460 см‒1.
Рис. 2.
Нормализованные спектры ГКР суспензий, содержащих E. coli 376/2, наночастицы серебра, хлорид натрия в интервале времен инкубации 5‒70 мин.
Результаты, полученные с тремя образцами золей наночастиц, отличающихся средним размером, были аналогичны; в дальнейшей работе использовали образец № 2 (табл. 1 и 2). Также было установлено, что оптимальные условия получения спектров ГКР всех 4-х видов микроорганизмов включают предварительную инкубацию единичной изолированной колонии микроорганизмов с аликвотой золя наночастиц в течение 10 мин и последующее внесение хлорида натрия.
Таблица 2.
Максимумы спектров поглощения и средние размеры наночастиц золей серебра
| № | Максимум спектра поглощения, нм | Средний размер частиц, нм |
|---|---|---|
| 1 | 392 | 21 |
| 2 | 391 | 3 |
| 3 | 389 | 1.5 |
| 4 | 421 | 15 |
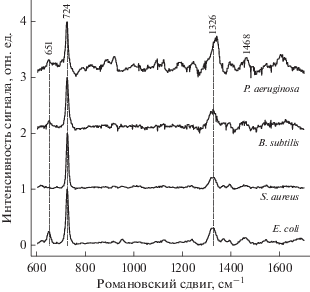
Оценка возможности дифференциального выявления бактерий. В оптимизированных условиях произведена регистрация спектров ГКР для 4 видов микроорганизмов: Е. coli, S. aureus, B. subtilis и P. aeruginosa. Типичные спектры образцов приведены на рис. 3. ГКР-спектры всех анализируемых микроорганизмов имели общий интенсивный пик около 724‒725 см‒1. Наиболее важные различия между спектрами исследованных патогенов были ассоциированы с полосами при 649‒652, 948‒950, 1326‒1340, 1468 см‒1.
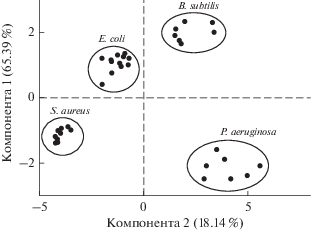
Для статистической классификации анализируемых микроорганизмов использовался мультивариантный статистический метод главных компонент. Этот метод позволяет уменьшить размерность набора спектроскопических данных до нескольких, обычно 2‒3-х, главных компонент, описывающих максимум изменчивости между анализируемыми объектами.
Главные компоненты представляют собой линейные комбинации исходных данных, в данном случае набора нормализированных интенсивностей рассеяния. Перед использованием метода главных компонент все ГКР спектры преобразовывали путем сглаживания, вычитания базового уровня и нормализации по максимальному сигналу. Анализировались данные, представленные максимальными нормализованными интенсивностями рассеяния в диапазоне 620‒622, 649‒652, 724‒725, 1128‒1130, 1187, 1245‒1246, 1326‒1340, 1458, 1468 и 1536 см‒1.
Применение метода главных компонент дало сумму факторной нагрузки двух главных компонент, равную 83.53% суммарных различий между спектрами. На рис. 4 приведены рассчитанные методом главных компонент результаты анализа 35 спектров для 4 видов бактерий, где выборки, относящиеся к различным типам микроорганизмов, апроксимированы не пересекающимися эллипсами, что показывает возможность дифференциальной диагностики этих микроорганизмов.
Рамановское рассеяние конъюгатов наночастиц серебра с бактериальными клеточными стенками. Специфика возникновения эффекта ГКР состоит в том, что интенсивные рамановские линии в спектрах могут возникать только для сорбатов, находящихся в непосредственной близости от металлической поверхности. С химической точки зрения эти сорбаты должны формировать поверхностные комплексы с атомами серебра. Такие комплексы возможны с функциональными группами биоорганических соединений, составляющих клеточную стенку, количественный состав которой, скорее всего, индивидуален для различных видов бактерий.
Авторами ряда работ (Zhou et al., 2014; Kamińska et al., 2016), исследовавшими взаимодействие наночастиц серебра с бактериями, приводится информация по отнесению линий спектров ГКР к вращательно-колебательным взаимодействиям, происходящих в молекулах, составляющих клеточные стенки бактерий. Эта информация представлена в табл. 3.
Таблица 3.
Соотнесение линий спектров ГКР с колебательно-вращательными взаимодействиями в биомолекулах, составляющих клеточную стенку бактерий
| Сдвиг линии КР, см‒1 | Отнесение | Сдвиг линии КР, см‒1 | Отнесение |
|---|---|---|---|
| 563 | Углеводы | 1268 | δ(CH2) амид III |
| 624 | Скелетные колебания ароматического кольца | 1330 | υ(NH2) аденин, полиаденин, ДНК |
| 652 | δ(COO‒) | 1360‒1440 | υ(COO‒) симметричные |
| 735 | Аденин, гликозидное кольцо | 1368 | υ(COO‒) и δ(C‒H) белков |
| 808 | υ(CN) тирозин, порин, валин | 1440‒1460 | δ(CH2) насыщенные жиры |
| 955 | υ(CN) | 1540‒1645 | Амид II, υ(CN), γ(NH) |
| 1128 | Амид III, аденин, полиаденин, ДНК | 1640‒1680 | Амид I |
| 1250‒1310 | Амид III |
С высокой степенью уверенности можно утверждать, что линии в спектрах ГКР при 649‒652 см‒1 могут быть отнесены к карбоксильным группам жирных кислот, линии при 725, 1326‒1340 см‒1 – к нуклеотидам (аденину) и ДНК, при 948‒950 см‒1 – υ(CN), 1468 ‒ δ(CH2) насыщенных жирных кислот.
Также в процессе работы проводили контроль стабильности золей серебра, осуществляемый путем периодической регистрации спектров малахитового зеленого оксалата в концентрации 10‒7 моль/л в присутствии 0.04 моль/л NaCl с использованием наночастиц серебра в концентрации 0.2 ммоль/л в качестве ГКР-субстрата в течение 6 мес. один раз в две недели. Изменения в интенсивности основных пиков при 1171, 1288, 1359 и 1614 см‒1 в пределах ±15% показывают, что в течение не менее чем 6 мес. ГКР-свойства наночастиц серебра не меняются.
Таким образом, разработан метод, позволяющий проводить идентификацию микроорганизмов путем сравнения спектра ГКР анализируемого образца с известными бактериальными спектрами. Реализация данного метода требует выбора метода получения изолированных колоний бактерий (Sanders, 2012) применительно к конкретному типу образцов, а также составление библиотеки Спектров ГКР.
Список литературы
Еремина О.Е., Семенова А.А., Сергеева Е.А., Браже Н.А., Максимов Г.В., Шеховцова Т.Н., Гудилин Е.А., Веселова И.А. Спектроскопия гигантского комбинационного рассеяния в современном химическом анализе: достижения и перспективы использования // Успехи химии. 2018. Т. 87. С. 741‒770.
Eremina O.E., Semenova A.A., Sergeeva E.A., Brazhe N.A., Maksimov G.V., Shekhovtsova T.N., Goodilin E.A., Veselova I.A. Surface-enhanced Raman spectroscopy in modern chemical analysis: advances and prospects // Rus. Chem. Rev. 2018. V. 87. P. 741–770.
Мамонова И.А., Бабушкина И.В., Норкин И.А., Гладкова Е.В., Матасов М.Д., Пучиньян Д.М. Биологическое действие наночастиц металлов и их оксидов на бактериальные клетки // Российские нанотехнологии. 2015. Т. 10. № 1‒2. С. 106‒110.
Mamonova I.A., Babushkina I.V., Norkin I.A., Gladkova E.V., Puchin’yan D.M., Matasov M.D. Biological activity of metal nanoparticles and their oxides and their effect on bacterial cells // Nanotechnologies in Russia. 2015. V. 10. № 1‒2. P. 128‒134.
Оленин А.Ю., Лисичкин Г.В. Получение, динамика структуры объема и поверхности металлических наночастиц в конденсированных средах // Успехи химии. 2011. Т. 80. С. 635‒662.
Olenin A.Yu., Lisichkin G.V. Metal nanoparticles in condensed media: preparation and the bulk and surface structural dynamics // Rus. Chem. Rev. 2011. V. 80. P. 605–630.
Попов Д.А., Овсеенко С.Т., Осипов Г.А., Вострикова Т.Ю. Ускоренный способ идентификации возбудителей бактериемий с применением метода газовой хромато-масс-спектрометрии // Клиническая лабораторная диагностика. 2013. № 5. С. 54‒58.
Adler M., Wacker R., Niemeyer C.M. Sensitivity by combination: immuno-PCR and related technologies // Analyst. 2008. V. 133. P. 702‒718.
Bos L.D.J., Sterk P.J., Schultz M.J. Volatile metabolites of pathogens: a systematic review // PLoS Pathog. 2013. V. 9. e1003311.
Cañamares M.V., Garcia-Ramos J.V., Sanchez-Cortes S., Castillejo M., Oujja M. Comparative SERS effectiveness of silver nanoparticles prepared by different methods: A study of the enhancement factor and the interfacial properties // J. Colloid Interface Sci. 2008. V. 326. P. 103–109.
Cheng H.-W., Huan S.-Y., Yu R.-Q. Nanoparticle-based substrates for surface-enhanced Raman scattering detection of bacterial spores // Analyst. 2012. V. 137. P. 3601‒3608.
Efrima S., Zeiri L. Understanding SERS of bacteria // J. Raman Spectrosc. 2009. V. 40. P. 277‒288.
Havlicek V., Lemr K., Schug K.A. Current trends in microbial diagnostics based on mass spectrometry // Anal. Chem. 2013. V. 85. P. 790‒797.
Kahraman M., Keseroglu K., Culha M. On sample preparation for surface-enhanced Raman scattering (SERS) of bacteria and the source of spectral features of the spectra // Appl. Spectrosc. 2011. V. 65. P. 500–506.
Kamińska A., Witkowska E., Kowalska A., Skoczyńska A., Ronkiewicz P., Szymborski T., Waluk J. Rapid detection and identification of bacterial meningitis pathogens in ex vivo clinical samples by SERS method and principal component analysis // Anal. Methods. 2016. № 8. 4521–4529.
Knauer M., Ivleva N.P., Niessne R., Haisch C. Optimized surface-enhanced Raman scattering (SERS) colloids for the characterization of microorganisms // Anal. Sci. 2010. V. 26. P. 761–766.
Kruszewski S., Cyrankiewicz M. Aggregated silver sols as SERS substrates // Acoust. Biomed. Eng. 2012. V. 121. № 1 A. P. 68–74.
Petryayeva E., Krull U.J. Localized surface plasmon resonance: Nanostructures, bioassays and biosensing ‒ A review // Anal. Chem. 2011. V. 706. P. 8–24.
Sa Y., Jung L., Jung Y.M. Avidin induced silver aggregation for SERS based Bioassay // Bull. Korean Chem. Soc. 2012. V. 33. P. 3681–3685.
Sanders E.R. Aseptic laboratory techniques: plating methods // J. Vis. Exp. 2012. № 63. e3064.
Singh H.P., Kaur A., Kaur I., Buttar H.S., Bhullar S.K. Gold nanoparticles: a promising therapeutic approach // Biomed. Rev. 2015. V. 26. P. 23‒36.
Sivanesan A.,Witkowska E., Adamkiewicz W., Dziewit L, Kaminska A., Waluk J. Nanostructured silver-gold bimetallic SERS substrates for selective identification of bacteria in human blood // Analyst. 2014. V. 139. P. 1037–1043.
Stiles P.L., Dieringer J.A., Shah N.C., Van Duyne R.P. Surface-enhanced Raman spectroscopy // Annu. Rev. Anal. Chem. 2008. V. 1. P. 601‒626.
Walter A., Marz A., Schumacher W., Rosch P., Popp J. Towards a fast, high specific and reliable discrimination of bacteria on strain level by means of SERS in a microfluidic device // Lab. Chip. 2011. V. 11. P. 1013–1021.
Wu X., Huang Y.-W., Park B., Tripp R.A., Zhao Y. Differentiation and classification of bacteria using vancomycin functionalized silver nanorods array based surface-enhanced Raman spectroscopy and chemometric analysis // Talanta. 2015. V. 139. P. 96–103.
Zheng X.-S., Jahn I.J., Weber K., Cialla-May D., Popp J. Label-free SERS in biological and biomedical applications: recent progress, current challenges and opportunities // Spectrochim. Acta. Part A: Molecular and Biomolecular Spectroscopy. 2018. V. 197. P. 56‒77.
Zhou H., Yang D., Ivleva N.P., Mircescu N.E., Niessner R., Haisch C. SERS detection of bacteria in water by in situ coating with Ag nanoparticles // Anal. Chem. 2014. V. 86. P. 1525‒1533.
Zhou W., Gao X., Liu D., Chen X. Gold nanoparticles for in vitro diagnostics // Chem. Rev. 2015. V. 115. P. 10575‒10636.
Дополнительные материалы отсутствуют.