Микробиология, 2020, T. 89, № 3, стр. 367-371
Разнообразие денитрифицирующих бактерий в биопленках, сформированных на каменистых субстратах в литоральной зоне озера Байкал
Г. В. Подлесная a, *, С. А. Потапов a, А. Ю. Краснопеев a, Ю. Р. Штыкова a, И. В. Томберг a, О. А. Тимошкин a, О. И. Белых a
a Лимнологический институт СО РАН
664033 Иркутск, Россия
* E-mail: podlesnaya@lin.irk.ru
Поступила в редакцию 24.07.2019
После доработки 29.10.2019
Принята к публикации 01.11.2019
Аннотация
Денитрификация – главный биологический процесс восстановления нитратов до молекулярного азота (N2). Впервые показано присутствие денитрифицирующих бактерий nirK-типа в эпилитических биопленках литоральной зоны озера Байкал. Выявлено, что наибольшее видовое богатство характерно для микробных сообществ биопленок, отобранных в районе пос. Большое Голоустное и вблизи г. Северобайкальск, наименьшее – в районе пос. Листвянка. Филогенетический анализ показал, что для всех клонированных последовательностей ближайшими родственниками являются некультивируемые денитрифицирующие бактерии из разных местообитаний. Близкородственные культивируемые гомологи представлены последовательностями, принадлежащими порядкам Rhizobiales и Rhodobacterales класса Alphaproteobacteria.
Денитрификация – процесс восстановления нитрата до газообразного азота через образование нитрита, оксида азота и закиси азота (Zumft, 1997). В водных экосистемах бактериальная денитрификация служит основным способом удаления соединений азота, что определяет ключевое значение этого процесса в поддержании стабильных гидрохимических показателей и, в целом, трофического статуса водоемов (Кузнецов, 1985). В последние годы на оз. Байкал наблюдается “экологический кризис”, характеризующийся крупномасштабными изменениями состава, численности и структуры сообществ гидробионтов, вызванный, очевидно, эвтрофированием водоема (Timoshkin et al., 2018). Микробные сообщества биопленок, сформированных на каменистых субстратах в прибрежной зоне озера, также реагируют на любые изменения среды обитания и служат индикаторами уровня антропогенной нагрузки на экосистему Байкала (Суслова и соавт., 2018).
Цель данной работы – изучить разнообразие денитрифицирующих бактерий в биопленках твердых субстратов в литоральной зоне оз. Байкал с помощью маркеров к гену nirK, кодирующему медьсодержащую нитритредуктазу.
Пробы биопленок отобраны с поверхности камней в прибрежной зоне оз. Байкал в 2017 году (табл. 1). Определение физико-химических характеристик воды в местах отбора проб биопленок проводили, как ранее описано (Galachyants et al., 2018). Суммарную ДНК образцов выделяли методом фенол-хлороформной экстракции. Фрагмент гена nirK амплифицировали с помощью праймеров F1aCu и R3Cu (Hallin, Lindgren, 1999). Полученные нуклеотидные последовательности фрагмента гена nirK депонированы в базу данных GenBank под номерами MK460600–MK460761. Поиск гомологичных последовательностей выполняли, используя BLASTX-анализ (http://blast.ncbi.nlm.nih.gov). Аминокислотные последовательности, сходные более чем на 95%, объединяли в группы (операционные таксономические единицы, OTЕ). Индексы биоразнообразия рассчитывали на основе ОТЕ в программе Mothur 1.39.5 (http://www.mothur.org). Древо аминокислотных последовательностей конструировали, применяя Байесовский анализ с помощью программы MrBayes (v. 3.2.6) (Huelsenbeck, Ronquist, 2001). На основе аминокислотных последовательностей получали матрицу дистанций метрикой UniFrac с последующим использованием иерархического кластерного анализа (hclust) (Murtagh, 1992) методом UPGMA, применяя пакеты phyloseq (v. 1.21.0) и phangorn (v. 2.2.0), реализованные в программе R (v. 3.2.4).
Таблица 1.
Физико-химические свойства придонной воды в местах отбора проб биопленок
| Проба | Станция, глубина |
Координаты | Дата | Т, °C | рН | ${\text{NH}}_{4}^{ + }$, мг/л | ${\text{NO}}_{2}^{ - }$, мг/л | ${\text{NO}}_{3}^{ - }$, мг/л | ${\text{PO}}_{4}^{{3 - }}$, мг/л | TN, мг/л | TOC, мг C/л |
|---|---|---|---|---|---|---|---|---|---|---|---|
| G5 | Б. Голоустное, 15 м |
52°1′36.5′′ N 105°24′11.8′′ E |
08.2017 | 8.0 | – | 0.008 | 0.003 | 0.37 | 0.038 | 0.44 | 1.6 |
| G6 | Б. Ая, 15 м |
52°49′49.86′′ N 106°42′13.38′′ E |
08.2017 | 7.1 | – | 0.006 | 0.005 | 0.05 | 0.043 | 0.47 | 1.5 |
| G7 | Листвянка, 1 м |
51°50′41.92′′ N 104°52′31.04′′ E |
06.2017 | 8.3 | 8.05 | 0.02 | 0.003 | 0.21 | 0.012 | – | – |
| G8 | 09.2017 | 8.1 | 8.09 | 0.005 | 0.004 | 0.08 | 0.028 | 0.42 | 2.1 | ||
| G9 | Северобайкальск, 1 м | 55°37′49.8′′ N 109°21′1.7′′ E |
06.2017 | 9.1 | 8.60 | 0.00 | 0.002 | 0.07 | 0.005 | – | – |
| G10 | 09.2017 | 7.5 | 8.40 | 0.005 | 0.004 | 0.14 | 0.035 | 0.33 | 2.0 |
Физико-химические показатели придонной воды, окружающей субстраты с биопленками, представлены в табл. 1. Всего проанализировано 170 аминокислотных последовательностей гена nirK (табл. 2). BLASTх-анализ показал, что для всех клонированных последовательностей ближайшими родственниками преимущественно были некультивируемые денитрифицирующие бактерии из разных местообитаний со сходством от 78 до 100%. Только две последовательности пробы G8 были идентичны с таковыми штамма Ochrobactrum sp. 3CB4. Наибольшим видовым богатством, согласно индексам разнообразия, отличались образцы G5 (пос. Большое Голоустное), G9 и G10 (г. Северобайкальск); наименьшим – проба G8 (пос. Листвянка) (табл. 2). Состав последовательностей гена nirK и их относительное обилие различались между пробами с разных станций. ОТЕ 1, включающая наибольшее количество последовательностей (90), доминировала во всех образцах биопленок, кроме G5, где преобладала ОТЕ 2. ОТЕ 2, содержащая 14 последовательностей, также найдена во всех образцах, за исключением G8. Кроме того, еще 7 OTЕ обнаружены более чем в одном образце, а 25 OTЕ только в одной пробе, 18 из которых были представлены единичной последовательностью гена nirК. Древо последовательностей всех проб биопленок, сгруппированных в 35 OTЕ, и родственных последовательностей из GenBank демонстрирует, что клонированные последовательности фрагмента гена nirK распределились в четыре кластера (рис. 1). Кластер I содержит ОТЕ с низким сходством с последовательностями из GenBank. Так, ОТЕ 7, 19, 23, 24, 27, 28 и 32 на 78, 93, 90, 82, 89, 87 и 93% соответственно сходны с последовательностями из устья Желтой реки, оз. Плюсзее и почвы. Большая же часть последовательностей (151) объединилась в кластер IV: 79% из образца G5, 98% – G6, 84% – G7, 97% – G8, 94% – G9 и 67% – G10.
Таблица 2.
Богатство и разнообразие последовательностей гена nirK в биопленках литорали оз. Байкал
| Образец | Количество последовательностей | Количество ОТЕ | Покрытие, % |
Индексы разнообразия | |||
|---|---|---|---|---|---|---|---|
| АСЕ | Chao1 | Шеннона | обратный Симпсона | ||||
| G5 | 19 | 10 | 63.2 | 24.2 | 31.0 | 2.06 | 6.33 |
| G6 | 42 | 7 | 90.5 | 19.5 | 10.0 | 1.12 | 2.16 |
| G7 | 25 | 8 | 84.0 | 14.3 | 10.0 | 1.59 | 3.45 |
| G8 | 31 | 6 | 90.3 | 9.7 | 7.5 | 0.96 | 1.76 |
| G9 | 32 | 11 | 75.0 | 31.0 | 20.3 | 1.51 | 2.46 |
| G10 | 21 | 10 | 85.7 | 11.7 | 10.6 | 2.20 | 8.32 |
Рис. 1.
Древо, построенное на основе аминокислотных последовательностей гена nirK, сгруппированных в OTЕ. Цифрами показана достоверность ветвления, установленная с помощью “bootstrap”-анализа 20 млн альтернативных деревьев. В качестве внешней группы использовали последовательность гена aniA из Moraxella catarrhalis (YP_003626300).
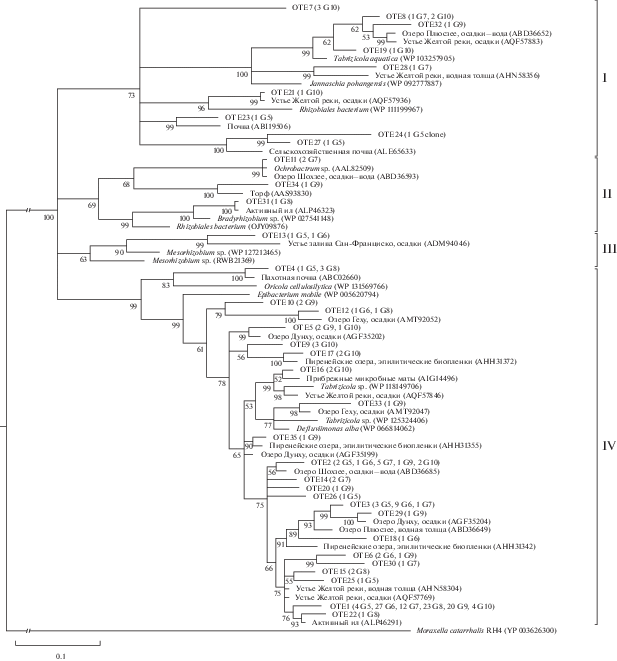
Ближайшими родственниками для данных последовательностей были штаммы порядков Rhodobacterales и Rhizobiales и некультивируемые бактерии из различных местообитаний: биопленки олиготрофных озер в Пиренеях (Vila-Costa et al., 2014), прибрежные микробные маты, вода–осадки мезотрофного оз. Шохзее и водная толща эвтрофного оз. Плюсзее (Kim et al., 2011), осадки эвтрофных озер Дунху (Hou et al., 2013) и Геху, водная толща (Li et al., 2014) и осадки устья Желтой реки, активный ил, почва. Очевидно, что столь широко распространенная группа бактерий играет весьма важную роль в осуществлении процесса денитрификации. Полученные нами результаты согласуются с данными исследования разнообразия денитрификаторов в других озерах. Так, большинство последовательностей гена nirK из эпилитических биопленок олиготрофных озер в Пиренеях принадлежали порядкам Rhizobiales и Rhodobacterales класса Alphaproteobacteria (Vila-Costa et al., 2014). Для осадков бореальных озер, расположенных в Финляндии, также показано, что основная доля последовательностей гена nirK принадлежит бактериям порядка Rhizobiales (Saarenheimo et al., 2015). Предположительно, в биопленках оз. Байкал гены nirK-типа содержат не только Alphaproteobacteria, но и представители других филумов и классов. В последние годы на основе анализа полных геномов бактерий установлено, что гены nirK присутствуют в филах Bacteroidetes, Firmicutes, Actinobacteria и т.д., при этом показано разделение последовательностей на две клады: первая, в основном, включает Alphaproteobacteria (и некоторые Gamma- и Betaproteobacteria), вторая содержит более разнообразные таксоны (Helen et al., 2016).
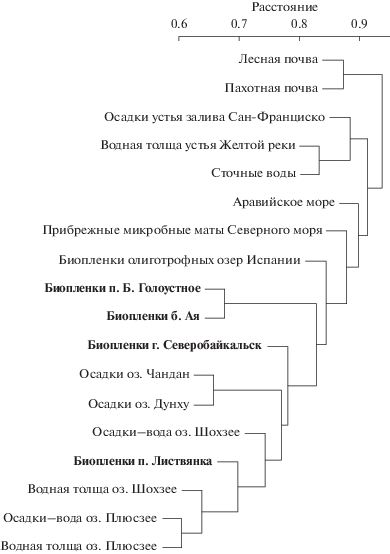
Иерархический кластерный анализ сообществ денитрификаторов из различных сред обитания демонстрирует формирование отдельных групп последовательностей в зависимости от физико-химических параметров окружающей среды (рис. 2). Байкальские последовательности группируются в отдельный кластер с последовательностями из воды, осадков и биопленок других озер. Стоит отметить, что последовательности из проб, отобранных с глубины 1 м в акваториях пос. Листвянка и г. Северобайкальск, объединились в один подкластер с последовательностями мезотрофных и эвтрофных озер. Выявленный факт может отражать последствия избыточного поступления биогенов в прибрежную зону озера, которые особенно ярко выражены на небольших глубинах вблизи населенных пунктов (Timoshkin et al., 2018).
Рис. 2.
Дендрограмма nirK-сообществ, построенная с использованием иерархического кластерного анализа (hclust) методом UPGMA. Сообщества денитрификаторов из оз. Байкал выделены жирным шрифтом.
Таким образом, в оз. Байкал впервые обнаружены денитрифицирующие бактерии, содержащие ген nirK, кодирующий медьсодержащую нитритредуктазу. Денитрифицирующие бактерии nirK-типа в биопленках на каменистых субстратах представлены классом Alphaproteobacteria. Благодаря наличию и разнообразию бактерий данной функциональной группы показана потенциальная способность бактериальных сообществ озера к удалению нитратной и нитритной форм азота, что подтверждается гидрохимическими данными, согласно которым трофический статус озера в настоящее время определяется как олиготрофный.
Список литературы
Кузнецов С.И., Саралов А.И., Назина Т.Н. Микробиологические процессы круговорота углерода и азота в озерах. М.: Наука, 1985. 213 с.
Суслова М.Ю., Пестунова О.С., Суханова Е.В., Штыкова Ю.Р., Косторнова Т.Я., Ханаев И.В., Сакирко М.В., Парфенова В.В. Роль культивируемых микроорганизмов биопленок каменистых субстратов в системе самоочищения озера Байкал // Микробиология. 2018. Т. 87. С. 718–726.
Suslova M.Yu., Pestunova O.S., Sukhanova E.V., Shtykova Yu.R., Kostornova T.Ya., Khanaev I.V., Sakirko M.V., Parfenova V.V. Role of cultured microorganisms from biofilms formed on rocky substrates in the lake Baikal self-purification system // Microbiology (Moscow). V. 87. P. 788–795.
Galachyants A.D., Tomberg I.V., Sukhanova E.V., Shtykova Yu.R., Suslova M.Yu., Zimens E.A., Blinov V.V., Sakirko M.V., Domysheva V.M., Belykh O.I. Bacterioneuston in Lake Baikal: abundance, spatial and temporal distribution // Int. J. Environ. Res. Publ. Health. 2018. V. 15. Article 2587.
Helen D., Kim H., Tytgat B., Anne W. Highly diverse nirK genes comprise two major clades that harbour ammonium-producing denitrifiers // BMC Genomics. 2016. V. 17. Article 155. https://doi.org/10.1186/s12864-016-2465-0
Hou J., Cao X.Y., Song C.L., Zhou Y.Y. Predominance of ammonia-oxidizing archaea and nirK-gene-bearing denitrifiers among ammonia-oxidizing and denitrifying populations in sediments of a large urban eutrophic lake (Lake Donghu) // Can. J. Microbiol. 2013. V. 59. P. 456–464.
Huelsenbeck J.P., Ronquist F. MRBAYES: Bayesian inference of phylogenetic trees // Bioinformatics. 2001. V. 17. P. 754–755.
Kim O.-S., Imhoff J.F., Witzel K-P., Junier P. Distribution of denitrifying bacterial communities in the stratified water column and sediment–water interface in two freshwater lakes and the Baltic Sea // Aquat. Ecol. 2011. V. 45. P. 99–112.
Li J., Wei G., Wang N., Gao Z. Diversity and distribution of nirK-harboring denitrifying bacteria in the water column in the Yellow River estuary // Microbes Environ. 2014. V. 29. P. 107–110.
Murtagh F. Comments on “Parallel algorithms for hierarchical clustering and cluster validity” // IEEE Trans. Pattern Anal. Mach. Intell. 1992. V. 14. P. 1056–1057.
Saarenheimo J., Tiirola M.A., Rissanen A.J. Functional gene pyrosequencing reveals core proteobacterial denitrifiers in boreal lakes // Front. Microbiol. 2015. V. 6. Article 674. https://doi.org/10.3389/fmicb.2015.00674
Timoshkin O.A. Coastal zone of the world’s great lakes as a target field for interdisciplinary research and ecosystem monitoring: Lake Baikal (East Siberia) // Limnology and Freshwater Biology. 2018. № 1. P. 81–97.
Vila-Costa M., Bartrons M., Catalan J., Casamayor E.O. Nitrogen-cycling genes in epilithic biofilms of oligotrophic high-altitude lakes (Central Pyrenees, Spain) // Microb. Ecol. 2014. V. 68. P. 60–69.
Zumft W.G. Cell biology and molecular basis of denitrification // Microbiol. Mol. Biol. Rev. 1997. V. 61. P. 533–616.
Дополнительные материалы отсутствуют.


