Микробиология, 2021, T. 90, № 3, стр. 367-371
Новая среда для культивирования “Desulforudis audaxviator”
А. П. Лукина a, О. В. Карначук a, *
a Кафедра физиологии растений, биотехнологии и биоинформатики,
Томский государственный университет
634050 Томск, Россия
* E-mail: olga.karnachuk@green.tsu.ru
Поступила в редакцию 30.11.2020
После доработки 20.01.2021
Принята к публикации 22.01.2021
Аннотация
Медленнорастущие трудно культивируемые прокариоты требуют специальных условий при выращивании в лаборатории. Часто трудности, связанные с культивированием, препятствуют депонированию новых изолятов в коллекции и приданию им таксономического статуса. Сульфатредуцирующий фирмикут, “Desulforudis audaxviator” BYF, был выделен из воды глубинной термальной скважины в Западной Сибири. В этом исследовании мы продемонстрировали, что снижение концентрации кальция и фосфатов, а также дополнительное внесение в среду полиамина спермидина увеличивает скорость роста и образование биомассы бактерией.
В последние годы растет количество сообщений об успешном выделении в культуру медленнорастущих трудно культивируемых прокариот (Sone et al., 2018; Pascual et al., 2018). Эти организмы удается выращивать в лаборатории, однако низкие концентрации клеток в культуре и медленный рост часто препятствуют выполнению условий, необходимых для валидации организма и описания новых таксонов. Ярким примером является недавнее сообщение о культивировании археи “Candidatus Prometheoarchaeum syntrophicum”, принадлежащей к “Asgard”-археям, предположительным предкам эукариот (Imachi et al., 2020). Выделение медленнорастущего организма (со временем удвоения 14–25 дней) заняло более десяти лет. Медленный рост, мониторинг которого осуществляется путем количественной ПЦР, не позволил исследователям депонировать архею в две международные коллекции и выполнить условие, необходимое для таксономического описания. Из данных литературы известны примеры, когда культивирование прокариот может быть усовершенствовано не путем нахождения более эффективных энергетических субстратов, а изменением содержания в среде азота и фосфора. Классическим примером является культивирование новых ацидофильных метанотрофов и Acidobacteria из сфагновых болот с использованием питательных сред с низкой ионной силой и снижением содержания фосфатов (Dedysh, 2011).
Это исследование посвящено оптимизации среды культивирования выделенного ранее “Desulforudis audaxviator” BYF (Karnachuk et al., 2019). Первоначально бактерия была обнаружена во фракционных водах глубокой золотодобывающей шахты Мпоненг в Южной Африке (Chivian et al., 2008). Авторами был получен композитный геном бактерии после концентрирования ДНК из 5600 л фракционной воды, что было необходимо вследствие низкой концентрации клеток. Метагеномная и геномная информация показала, что этот штамм фактически является единственным обитателем экосистемы, и метаболизм организма основан на гидрогенотрофной сульфатредукции. На основании геологических наблюдений было предположено, что источником водорода в экосистеме является радиолиз воды, что породило спекуляции о возможной космической роли десульфорудиса (Atri et al., 2016). Все попытки культивирования организма на протяжении более десяти лет оставались безуспешными, что породило гипотезу об исключительно медленных скоростях роста и делении один раз в тысячу лет (Labonté et al., 2015). “Desulforudis audaxviator” BYF был выделен из глубинных подземных вод, вскрываемых термальной скважиной в поселке Белый Яр Томской области (Karnachuk et al., 2019). Артезианская вода скважины с температурой 40–45°С поступает с глубины 2 км, а ее состав определяется присутствием древней морской воды, разбавляемой современными метеорными водами (Kadnikov et al., 2019). Общая минерализация воды составляет 1.8 г/л. Скорость роста штамма BYF в лабораторной культуре была значительно выше предполагаемых ранее и составляла 0.027 ч–1 (Karnachuk et al., 2019). Однако медленный рост при невысокой численности клеток препятствовал депонированию организма в международные коллекции и приданию валидного статуса роду и виду.
Целью этого исследования была оптимизация условий культивирования бактерии на основе геномной информации и полученных ранее данных об особенностях морфологии.
Наши эксперименты с чистой культурой “Desulforudis audaxviator” BYF показали, что, наряду с водородом, организм использует традиционные для сульфатредукторов органические доноры электронов – лактат, пируват, фумарат, сукцинат, пропионат, бутират, этанол, а также сахара – глюкозу и сахарозу. Однако все попытки замены энергетического субстрата не повышали выход биомассы и скорость роста. Электронная микроскопия выявила в клетках бактерии электронно-плотные структуры, напоминающие ацидокальцисомы (Karnachuk et al., 2019). Дополнительные исследования элементного состава образований по описанной ранее схеме подтвердили, что электронно-плотные структуры обогащены кальцием и фосфором (рис. 1). Ca и P накапливались непосредственно в области предполагаемой ацидокальцисомы, в то время как распределение S и Fe в клетке было случайным. Образование сульфидов железа, часто связанных с клетками, является характерной особенностью роста сульфатредукторов (Ikkert et al., 2013). Мы предположили, что при выращивании бактерии на используемой ранее модифицированной среде Видделя–Бака (Karnachuk et al., 2019) избыток фосфора и кальция депонируется в ацидокальцисомах, что может приводить к дополнительным энергетическим затратам и снижению скорости роста. Глубинные воды, в которых обитает десульфорудис, характеризуются повышенной ионной силой по сравнению с пресноводными экосистемами из-за смешения древней морской воды с пресноводными осадками, питающими подземные горизонты. Несмотря на тот факт, что общая минерализация глубинной воды, вскрываемой скважиной в поселке Белый Яр, составляет 1.8 г/л, эти биотопы дефицитны по кальцию и магнию (Kadnikov et al., 2019). Содержание Ca менее 10 мг/л и следовые количества фосфора были зафиксированы в воде (Frank et al., 2016). В силу специфики местообитания, простое разбавление основной среды, используемое исследователями при культивировании олиготрофов, не подходит для выращивания организмов из глубинных подземных горизонтов.
Рис. 1.
Трансмиссионная электронная микрофотография ультратонких срезов клеток “Desulforudis audaxviator” BYF с электронно-плотными структурами (a). Картирование элементов с применением рентгеновского микроанализа (б–д): б – распределение серы; в – распределение железа; г – распределение фосфора; д – распределение кальция. Длина масштабной линейки – 600 нм.

Для проверки гипотезы об ингибирующем действии высоких концентраций кальция и фосфора были поставлены эксперименты по определению кинетических параметров роста штамма BYF на среде со сниженным содержанием этих элементов. В экспериментах была использована пресноводная среда Видделя–Бака (Widdel, Bak, 1992), содержащая (в г/л): Na2SO4 – 4; KH2PO4 – 0.2; NH4Cl – 0.25; NaCl – 1; MgCl2 · 6H2O – 0.4; KCl – 0.5; CaCl2 – 0.113. Дополнительно к основной среде вносили 2 мл раствора витаминов, 1 мл раствора микроэлементов, по 1 мл раствора Na2SeO3 и Na2WO4. Формиат (7.5 мM) и ацетат (2.5 мM) использовали в качестве донора электронов и источника углерода. Ранее мы модифицировали среду Видделя–Бака для культивирования штамма BYF, внося удвоенное количество (48 г/л) восстановителя, Na2S · 9H2O, и элементное железо, присутствие которого является необходимым для роста бактерии (Karnachuk et al., 2019). В этом исследовании в опытных вариантах снижали концентрацию солей кальция и фосфата. В первом варианте опыта концентрация CaCl2 в модифицированной среде Видделя–Бака была снижена c 0.113 до 0.025 г/л без изменения других компонентов среды. Во втором варианте – концентрация KH2PO4 была снижена с 0.2 до 0.05 г/л основной среды. В контрольном варианте состав среды не изменяли. Для снижения концентрации фосфата и кальция в инокуляте для опытных вариантов проводили предварительные пересевы культуры на модифицированную среду с низкой концентрацией, так как культура не выдерживает отмывки путем центрифугирования. За ростом следили по количеству клеток в культуре, которое учитывали в трех повторностях, как описано ранее (Karnachuk et al., 2019).
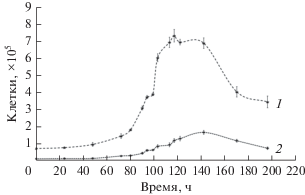
Культивирование штамма BYF в двух опытных вариантах на модифицированных средах приводило к увеличению количества клеток в культуре по сравнению с контролем (рис. 2). Максимальная численность клеток в конце логарифмической фазы роста составляла 1.2 × 106 на среде со сниженной концентрацией кальция, в то время как в контроле не превышала 1.5 × 105 клеток/мл. Снижение концентрации кальция и фосфатов приводило к сокращению лаг-фазы по сравнению с контролем. Однако удельная скорость роста возросла до 0.046 ч–1 (время удвоения 15.1 ч) против 0.026 ч–1 (время удвоения 26.7 ч) в контроле только на среде с пониженным содержанием кальция. Оба экспериментальных варианта характеризовал ранний лизис клеток в конце стационарной фазы.
Рис. 2.
Рост штамма “Desulforudis audaxviator” BYF на модифицированной среде Видделя с формиатом (представленный как количество клеток в мл среды): 1 – контроль; 2 – среда со сниженной концентрацией KH2PO4; 3 – среда со сниженной концентрацией Ca-Cl2. Вертикальные линии показывают стандартное отклонение.
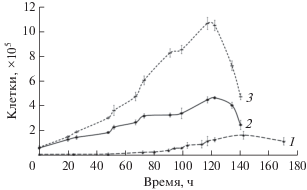
Геномная информация о метаболизме сложно культивируемой бактерии также может помочь в усовершенствовании условий культивирования (Karnachuk et al., 2020). Мы обратили внимание на присутствие белков, участвующих в синтезе полиаминов в геноме “Desulforudis audaxviator”. Спермидинсинтаза и агманитаза, необходимая для синтеза предшественника спермидина, находятся в одном опероне, что предполагает существование действующего пути синтеза спермидина у бактерии. Хотя существует доказанная связь синтеза полиаминов с термофилией у прокариот, роль спермидина в метаболизме бактерий до сих пор остается малоизученной (Michael, 2018). Существуют предположения о возможности связывания полиаминов с пептидогликаном клеточной стенки, что повышает ее ригидность (Hirao et al., 2000; Hamana et al., 2012). Наиболее вероятной гипотезой мы считаем участие спермидина в защите от окислительного стресса. Ранее участие полиаминов, спермидина и путресцина, в защите от токсичного действия О2, супероксида и перекиси водорода было продемонстрировано на мутантах E. coli с нарушенным синтезом полиаминов (Chattopadhyay et al., 2003). В наших экспериментах мы дополнительно вносили спермидин (“BioChemica PanReac AppliChem”) в модифицированную среду Видделя–Бака в концентрации 1.45 мг/л. В среде с добавлением спермидина наблюдали максимальную удельную скорость роста штамма BYF, которая составляла 0.086 ч–1 (время удвоения 8.05 ч) (рис. 3), а максимальная концентрация клеток в конце логарифмической фазы достигала значения 7 × 105 кл./мл. Добавление спермидина также снижало длительность лаг-фазы. Таким образом, снижение концентрации кальция и фосфора в основной среде Видделя–Бака и дополнительное внесение спермидина позволяет выращивать культуру штамма “Desulforudis audaxviator” BYF в лабораторных условиях со скоростями, сопоставимыми для традиционных анаэробов.
Список литературы
Atri D. On the possibility of galactic cosmic ray-induced radiolysis-powered life in subsurface environments in the Universe // J. R. Soc. Interface. 2016. V. 13(123). P. 20160459.
Chattopadhyay M.K., Tabor C.W., Tabor H. Polyamines protect Escherichia coli cells from the toxic effect of oxygen // Proc. Natl. Acad. Sci. USA. 2003. V. 100. P. 2261–2265.
Chivian D., Brodie E.L., Alm E.J., Culley D.E., Dehal P.S., DeSantis T.Z., Gihring T.M., Lapidus A., Lin L.H., Lowry S.R., Moser D.P., Richardson P.M., Southam G., Wanger G., Pratt L.M., Andersen G.L., Hazen T.C., Brockman F.J., Arkin A.P., Onstott T.C. Environmental genomics reveals a single-species ecosystem deep within Earth // Science. 2008. V. 10. P. 275–278.
Dedysh S.N. Cultivating uncultured bacteria from northern wetlands: knowledge gained and remaining gaps // Front. Microbiol. 2011. V. 2. Art. 184. https://doi.org/10.3389/fmicb.2011.00184
Frank Y.A., Kadnikov V.V., Lukina A P., Banks D., Beletsky A.V., Mardanov A.V., Sen’kina E.I., Avakyan M.R., Karnachuk O.V., Ravin N.V. Characterization and genome analysis of the first facultatively alkaliphilic Thermodesulfovibrio isolated from the deep terrestrial subsurface // Front. Microbiol. 2016. V. 7. Art. 2000. https://doi.org/10.3389/fmicb.2016.02000
Hamana K., Itoh T., Sakamoto M., Hayashi H. Covalently linked polyamines in the cell wall peptidoglycan of the anaerobes belonging to the order Selenomonadales // J. Gen. Appl. Microbiol. 2012. V. 58. P. 339–347.
Hirao T., Sato M., Shirahata A., Kamio Y. Covalent linkage of polyamines to peptidoglycan in Anaerovibrio lipolytica // J. Bacteriol. 2000. V. 182. P. 1154–1157.
Ikkert O.P., Gerasimchuk A.L., Bukhtiyarova P.A., Tuovinen O.H., Karnachuk O.V. Characterization of precipitates formed by H2S-producing, Cu-resistant Firmicute isolates of Tissierella from human gut and Desulfosporosinus from mine waste // Antonie Van Leeuwenhoek. 2013. V. 103. P. 1221–1234.
Imachi H., Nobu M. K., Nakahara N., Morono Y., Ogawara M., Takaki Y., Takano Y., Uematsu K., Ikuta T., Ito M., Matsui Y., Miyazaki M., Murata K., Saito Y., Sakai S., Song C., Tasumi E., Yamanaka Y., Yamaguchi T., Kamagata Y., Tamaki H., Takai K. Isolation of an archaeon at the prokaryote-eukaryote interface // Nature. 2020. V. 577. P. 519–525.
Kadnikov V.V., Mardanov A.V., Beletsky A.V., Karnachuk O.V., Ravin N.V. Genome of the candidate phylum Aminicenantes bacterium from a deep subsurface thermal aquifer revealed its fermentative saccharolytic lifestyle // Extremophiles. 2019. V. 23. P. 189–200.
Karnachuk O.V., Frank Y.A., Lukina A.P., Kadnikov V.V., Beletsky A.V., Mardanov A.V., Ravin N.V. Domestication of previously uncultivated ”Candidatus Desulforudis audaxviator” from a deep aquifer in Siberia sheds light on its physiology and evolution // ISME J. 2019. V. 13. P. 1947–1959.
Karnachuk O.V., Lukina A.P., Kadnikov V.V., Sherbakova V.A., Beletsky A.V., Mardanov A.V., Ravin N.V. Targeted isolation based on metagenome-assembled genomes reveals a phylogenetically distinct group of thermophilic spirochetes from deep biosphere // Environ. Microbiol. 2020. Epub ahead of print. PMID: 32869496. https://doi.org/10.1111/1462-2920.1521832869496
Kato S., Yamagishi A., Daimon S., Kawasaki K., Tamaki H., Kitagawa W., Abe A., Tanaka M., Sone T., Asano K., Kamagata Y. Isolation of previously uncultured slow-growing bacteria by using a simple modification in the preparation of agar media // Appl. Environ. Microbiol. 2018. V. 84. e00807-18.
Labonté J.M., Field E.K., Lau M., Chivian D., Van Heerden E., Wommack K.E., Kieft T.L., Onstott T.C., Stepanauskas R. Single cell genomics indicates horizontal gene transfer and viral infections in a deep subsurface Firmicutes population // Front. Microbiol. 2015. V. 6. Art. 349. https://doi.org/10.3389/fmicb.2015.00349
Michael A.J. Polyamine function in archaea and bacteria // J. Biol. Chem. 2018. V. 293. P. 18693–18701.
Pascual J., Foesel B.U., Geppert A., Huber K.J., Boedeker C., Luckner M., Wanner G., Overmann J. Roseisolibacter agri gen. nov., sp. nov., a novel slow-growing member of the under-represented phylum Gemmatimonadetes // Int. J. Syst. Evol. Microbiol. 2018. V. 68. P. 1028–1036.
Widdel F.F., Bak R. Gram negative mesophilic sulfate reducing bacteria // The Prokaryotes: A Handbook on the Biology of Bacteria: Ecophysiology, Isolation, Identification, Applications / Eds. Balows A. et al. Berlin: Springer, 1992. P. 3352–3378.
Дополнительные материалы отсутствуют.