Микробиология, 2021, T. 90, № 4, стр. 500-505
Микробное сообщество отходов птицефабрики и его роль в образовании сероводорода
Е. В. Груздев a, *, Е. А. Латыголец b, А. В. Белецкий a, М. А. Григорьев b, А. В. Марданов a, М. К. Кадырбаев b, О. П. Иккерт b, О. В. Карначук b, Н. В. Равин a
a Институт биоинженерии, ФИЦ Биотехнологии РАН
119071 Москва, Россия
b Лаборатория биохимии и молекулярной биологии, Томский государственный университет
634050 Томск, Россия
* E-mail: gruevg@yandex.ru
Поступила в редакцию 04.02.2021
После доработки 12.03.2021
Принята к публикации 15.03.2021
Аннотация
Микробиота отходов птицеводства остается практически неизученной, несмотря на ее ведущую роль в образовании летучих одорантов и неприятного запаха. Одним из основных компонентов запаха является сероводород, который может образовываться в результате микробной сульфатредукции. Исследован состав микробного сообщества отходов крупной птицефабрики “Межениновская”, расположенной на расстоянии 15 км от г. Томска. Методом профилирования 16S рРНК в микробном сообществе обнаружены представители сульфатредуцирующих Desulfovibrionaceae. Их доля в сообществе возрастала при инкубации отходов в среде с сульфатом и лактатом, при этом увеличивалась и продукция сероводорода. Источником сульфата в отходах может являться гипс, а также кормовые добавки, сформулированные в виде сульфатов, например, лизин сульфат.
Образование летучих соединений с резким запахом – известная проблема производства мяса птицы. Основным источником запаха являются одоранты, включающие летучие органические соединения и неорганические соединения – аммоний, сероводород и восстановленные соединения серы (Traube et al., 2010). Сероводород имеет низкий порог чувствительности, 0.007 мг/м3, и служит одним из основных компонентов неприятного запаха отходов сельскохозяйственных животных (Traube et al., 2011). В концентрации свыше 0.1% в воздухе сероводород быстро вызывает тяжелое отравление с летальным исходом. Продолжительное воздействие низких концентраций H2S может вызывать нейроповеденческие дисфункции (Fiedler et al., 2008).
В биотопах, содержащих сульфат, при дефиците кислорода диссимиляционная сульфатредукция является основным источником образования сероводорода. При производстве мяса птицы окисленные формы серы могут поступать с кормовыми добавками, часто формулируемыми в виде сульфатов. Нерастворимый сульфат кальция, гипс, используют как составной компонент подстилки для впитывания влаги. Нам не известно систематических исследований присутствия сульфатредуцирующих прокариот в отходах птицеферм. Недавнее исследование продемонстрировало, что диссимиляционное образование H2S является важным процессом в слепой кишке кур-несушек (Huang et al., 2019). Авторы сообщают, что содержание Desulfovibrio, Mailhella, Bilophila и Lawsonia в слепой кишке коррелировало с образованием H2S. Основываясь на этом факте, было сделано заключение, что именно диссимиляционная сульфатредукция, а не разложение серосодержащих аминокислот, вносят основной вклад в образование сероводорода в кишечнике кур.
Основным источником одорантов при производстве мяса птицы являются отходы, представляющие смесь помета птицы, подстилки, перьев, остатков корма и воды (Wadud et al., 2012). Наиболее распространенный способ утилизации отходов представляет их компостирование путем выдерживания в специальных хранилищах. При компостировании происходит частичное обеззараживание отходов от патогенов человека и животных, после чего полученный компост используют в качестве органического удобрения для выращивания растений (Dunlop et al., 2016). Места складирования отходов, так называемые пометохранилища, являются основным источником неприятного запаха. До сих пор микробиота отходов производства птицы и ее роль в производстве летучих соединений остается практически неизученной (Dunlop et al., 2016).
Целью настоящего исследования являлся анализ микробного сообщества отходов производства птицы, накапливаемого в пометохранилище птицефабрики “Межениновская”, расположенного в непосредственной близости (около 15 км) от областного центра, города Томска. В летнее время интенсивный запах, образуемый в районе птицефабрики, является предметом активных общественных дискуссий.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Отбор проб, полевые измерения, минералогический и элементный анализ. Пробы отходов в пометохранилище были отобраны 12 июля 2019 г. Концентрацию H2S в месте отбора пробы для анализа измеряли в разные сезоны года, с периодичностью около одного раза в месяц с использованием переносного газоанализатора OKA-T (“Информ-аналитика”, Россия) с электрохимическим сенсором (погрешность инструмента составляет ±25%). Измерения не проводили в период снежного покрова, который в Томске длится с начала ноября до конца марта. Минералогический состав отходов, высушенных на воздухе, определяли с использованием дифрактометра Shimadzu XRD-6000 как описано ранее (Ikkert et al., 2013). Для определения элементного состава использовали сканирующий электронный микроскоп, совмещенный с рентгеновской спектрометрией с использованием микроскопа PhilipsSEM 515 и спектрометр EDAXInc (“Mahwan”, США).
Эксперименты с микрокосмами. В сывороточные бутылки объемом 500 мл вносили 300 мл отходов пометохранилища и 200 мл искусственной среды. Среда имела следующий состав (в г/л): KH2PO4 – 0.2, NH4Cl – 0.25, NaCl – 1, MgCl2 · 6H2O – 0.4, KCl – 0.5, 0.113 – CaCl2. В экспериментальные микрокосмы вносили сульфат (28 мM в виде Na2SO4) и лактат (18 мM) вместе c сульфатом (28 мM). Микрокосмы инкубировали в темноте при температуре 20°С в течение 15 сут. Контрольный микрокосм инкубировали в тех же условиях, но без внесения добавок. Во время инкубации микрокосмов контролировали содержание сероводорода.
Характеристика состава микробных сообществ по генам 16S рРНК. В конце инкубации микрокосмов 1 мл осадка использовали для выделения ДНК с помощью DNeasy PowerMax SoilKit (“Qiagen”, Hilden, Германия). ПЦР-фрагменты были получены с использованием универсальных праймеров 341F (5'-CCTAYGGGDBGCWSCAG-3') и 806R (5'-GGACTACNVGGGTHTCTAAT-3'), баркодированы с помощью NexteraXT IndexKitv.2 (“Illumina”, США) и очищены с использованием AgencourtAM Purebeads (“Beckman Coulter”, Brea, CA, США). Затем ПЦР фрагменты были секвенированы на Illumina MiSeq (чтения 2 × 300 нт с обоих концов). Парные чтения были объединены с использованием FLASH v.1.2.11 (Magoc, Salzberg, 2011). Полученные последовательности (26 983 шт. для микрокосма без сульфата, 37 516 шт. для микрокосма с сульфатом без лактата и 25 911 шт. для микрокосма с сульфатом и лактатом) были кластеризованы в операционные таксономические единицы (ОТЕ) при 97% идентичности с помощью программы Usearch (Edgar, 2010); низкокачественные чтения, химерные и единичные последовательности были удалены при кластеризации с использованием алгоритма Usearch. Таксономическая идентификация была выполнена по базе SILVA v.132 с использованием алгоритма VSEARCH (Rognes et al., 2016).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
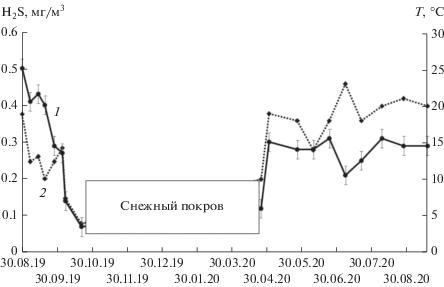
Содержание сероводорода в воздухе, минералогический и элементный анализ отходов. Концентрации сероводорода в воздухе возле пометохранилища в период измерений колебалась от 0.065 (в конце октября) до 0.5 (в конце августа) мг/м3 (рис. 1). Это содержание значительно превышает предельно допустимую концентрацию, 0.008 мг/м3, установленную в Российской Федерации для жилых районов. Содержание сероводорода в воздухе возле пометохранилища закономерно коррелировало с температурой воздуха, подтверждая биологическую природу H2S.
Рис. 1.
Изменение концентрации сероводорода (1) и температура воздуха (2) возле пометохранилища фабрики “Межениновская”. Стандартное отклонение рассчитано из трех измерений.
Минералогический состав отходов показал присутствие нерастворимого сульфата кальция, гипса, CaSO4 · 2H2O (рис. 2). Также была обнаружена кристаллическая сера и карбонаты – кальцит CaCO3 и анкерит Ca(Fe,Mg,Mn)(CO3)2. Элементный анализ подтвердил значительное присутствие кальция и серы. Таким образом, в отходах присутствовали возможные акцепторы электронов для сульфатредукци и сероредукции. Многие сульфатредуцирующие бактерии способны восстанавливать сульфат гипса фактически с такой же скоростью, как растворимый сульфат (Karnachuk et al., 2002).
Рис. 2.
Дифрактограмма, показывающая минералогический состав отходов пометохранилища (вверху). Обозначения: Ae анкерит, Ca(Fe,Mg,Mn)(CO3)2, (PDF-79-1347); Cc кальцит, CaCO3, (PDF-24-0027); Er эрионит, (Na2,K2,Ca)2Al4-Si14O36 · 15H2O, (PDF-12-0275); Gy гипс, CaSO4 · 2H2O, (PDF-03-0044); Qu кварц, SiO2, (PDF-01-0649); S сера, S6, (PDF-76-2242); St струвит, NH4MgPO4 · 6H2O, (PDF-15-0762); Td тридимит, SiO2, (PDF-29-1493). Микрофотография (сканирующий электронный микроскоп) отходов и элементный анализ (внизу).

Состав микробных сообществ микрокосмов. Предварительные исследования состава микробного сообщества профилированием гена 16S рРНК не выявили организмов с известной способностью к диссимиляционной сульфатредукции. Основываясь на том факте, что низкое содержание сульфата и доноров электронов могут лимитировать численность сульфатредукторов в отходах, были предприняты попытки обнаружить эту функциональную группу путем стимулирования процесса в микрокосмах с добавлением сульфата и лактата – модельных субстратов для диссимиляционных сульфатредукторов.
Микрокосмы инокулировали отходами из пометохранилища, в экспериментальные микрокосмы вносили лактат вместе с сульфатом или только сульфат, микрокосм без добавок использовали как контрольный. По окончании 15-сут инкубации микрокосмов концентрация H2S составляла 35 мг/л в микрокосме с сульфатом и лактатом, 26 мг/л в микрокосме с сульфатом и 16 мг/л в контроле без добавок.
Состав микробных сообществ микрокосмов определяли с помощью высокопроизводительного секвенирования фрагментов гена 16S рРНК. Во всех трех микрокосмах доминирующими группами были Bacteroidetes (34–44% последовательностей генов 16S рРНК), Firmicutes (29–36%) и Gammaproteobacteria (9–12%) (рис. 3). В основном это были типичные представители микробиома кишечника птиц: семейства Bacteroidaceae и Prevotellaceae среди Bacteroidetes, Acidaminococcaceae, Lactobacillaceae, Lachnospiraceae, Ruminococcaceae, Veillonellaceae среди Firmicutes.
Рис. 3.
Состав микробных сообществ микрокосмов по данным анализа генов 16S рРНК. S–/L–, микрокосм без лактата и сульфата; S+/L–, микрокосм с сульфатом без лактата; S+/L+, микрокосм с сульфатом и лактатом.
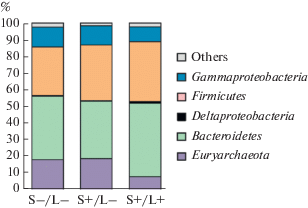
Археи, в основном метилотрофные метаногены порядка Methanomassiliicoccales, составляли 18–19% сообщества в контроле и в микрокосме с сульфатом. В микрокосме с сульфатом и лактатом их доля снижалась до 8%, что может быть обусловлено конкуренцией с сульфатредукторами за низкомолекулярные доноры электронов.
Из числа известных сульфатредукторов в микрокосмах были обнаружены дельтапротеобактерии семейства Desulfovibrionaceae. Их доли в контрольном микрокосме и в микрокосме с сульфатом составляли 0.43 и 0.37% соответственно, а в присутствии сульфата и лактата она возрастала до 1.0%. Desulfovibrionaceae были представлены двумя ОТЕ, относящимися к родам Bilophila и Desulfovibrio, причем последние составляли более 90%. Эти два рода были обнаружены ранее в кишечнике кур-несушек (Huang et al., 2019), увеличение их численности в присутствии сульфата и лактата согласуется с предположением об их роли в образовании сероводорода.
В составе микробного сообщества также присутствовали бактерии, близкие к роду Tissierella. Эта группа образует сероводород из аминокислот за счет ферментов цистеинсинтазы (CysK) и цистеиндесульфгидразы (CdsH) (Bukhtiyarova et al., 2019). Tissierella spp., выделенные из фекалий человека (Ikkert et al., 2013) и с поверхности медных монет, образовывали до 30 мг H2S на литр среды. Tissierellaceae составляли менее 1% сообщества, их доля не возрастала в микрокосмах с сульфатом.
Сульфат-редукция как вероятный источник сероводорода. Таким образом, предварительный анализ микробного сообщества указывает, что вероятным источником сероводорода, образуемого в отходах пометохранилища, является сульфатредукция, осуществляемая Desulfovibrionaceae – представителями кишечной микрофлоры кур. В присутствии гипса, а возможно и других источников сульфата (например, сульфата лизина, используемого в кормовых добавках), и низкомолекулярных органических соединений, образуемых ферментативными микроорганизмами филумов Bacteriodetes и Firmicutes, эти бактерии могут развиваться и образовывать значительные количества сероводорода, выделяющегося в пометохранилищах.
Список литературы
Bukhtiyarova P.A., Antsiferov D.V., Brasseur G., Avakyan M.R., Frank Y.A., Ikkert O.P., Pimenov N.V., Tuovinen O.H., Karnachuk O.V. Isolation, characterization, and genome insights into an anaerobic sulfidogenic Tissierella bacterium from Cu-bearing coins // Anaerobe. 2019. V. 56. P. 66–77.
Dunlop M.W., Blackall P.J., Stuetz R.M. Odour emissions from poultry litter – A review litter properties, odour formation and odorant emissions from porous materials // J. Environ. Manage. 2016. V. 177. P. 306–319.
Edgar R.C. Search and clustering orders of magnitude faster than BLAST // Bioinformatics. 2010. V. 26. P. 2460–2461.
Fiedler N., Kipen H., Ohman-Strickland P., Zhang J., Weisel C., Laumbach R., Kelly-McNeil K., Olejeme K., Lioy P. Sensory and cognitive effects of acute exposure to hydrogen sulfide // Environ. Health. Perspect. 2008. V. 116. P. 78–85.
Huang C.B., Xiao L., Xing S.C., Chen J.Y., Yang Y.W., Zhou Y., Chen W., Liang J.B., Mi J.D., Wang Y., Wu Y.B., Liao X.D. The microbiota structure in the cecum of laying hens contributes to dissimilar H2S production // BMC Genomics. 2019. V. 20. P. 770.
Ikkert O.P., Gerasimchuk A.L., Bukhtiyarova P.A., Tuovinen O.H., Karnachuk O.V. Characterization of precipitates formed by H2S-producing, Cu-resistant Firmicute isolates of Tissierella from human gut and Desulfosporosinus from mine waste // Antonie van Leeuwenhoek. 2013. V. 103. P. 1221–1234.
Karnachuk O., Kurochkina S., Tuovinen O. Growth of sulfate-reducing bacteria with solid-phase electron acceptors // Appl. Microbiol. Biotechnol. 2002. V. 58. P. 482–486.
Magoc T., Salzberg S.L. FLASH: fast length adjustment of short reads to improve genome assemblies // Bioinformatics. 2011. V. 27. P. 2957–2963.
Rognes T., Flouri T., Nichols B., Quince C., Mahé F. VSEARCH: a versatile open source tool for metagenomics // PeerJ Preprints. 2016. V. 4. e2409v1.
Trabue S., Kerr B., Bearson B., Ziemer C. Swine odor analyzed by odor panels and chemical techniques // J. Environ. Qual. 2011. V. 40. P. 1510–1520.
Trabue S., Scoggin K., Li H., Burns R., Xin H., Hatfield J. Speciation of volatile organic compounds from poultry production // Atmos. Environ. 2010. V. 44. P. 3538–3546.
Wadud S., Michaelsen A., Gallagher E., Parcsi G., Zemb O., Stuetz R., Manefield M. Bacterial and fungal community composition over time in chicken litter with high or low moisture content // Br. Poult. Sci. 2012. V. 53. P. 561–569.
Дополнительные материалы отсутствуют.


